Editor General
Virgilio Centurion – Brasil
Editores
CATARATA – Arnaldo Espaillat – Rep. Dominicana
REFRACTIVA Y CÓRNEA – María José Cosentino – Argentina
Coeditores de Cirugía Refractiva y Córnea
Arturo Chayet (México)
Cesar Carriazo (Colombia)
Daniel Scorsetti (Argentina)
David Flikier (Costa Rica)
Luis Izquierdo Jr. (Perú)
Mauro Campos (Brasil)
Miguel Srur (Chile)
Renato Ambrósio (Brasil)
Roberto Albertazzi (Argentina)
Sérgio Kwitko (Brasil)
Coeditores de Catarata
Armando Crema (Brasil)
Carlos Nicoli (Argentina)
Claudia Palacio Pastrana (México)
Claudio Orlich (Costa Rica)
Daniel Badoza (Argentina)
Edgardo Carreño (Chile)
Eduardo Chávez (México)
Enrique Suárez (Venezuela)
José Luis Rincón (Venezuela)
Luis Lu (USA)
Miguel Padilha (Brasil)
Editor de Vídeo
Editores
CATARATA – José Luis Rincón (Venezuela)
REFRACTIVA Y CÓRNEA – Heriberto Mario Marotta (Argentina)
Coeditores de Cirugía Refractiva y Córnea
Alberto Habert (México)
Arturo Kantor (Chile)
Carlos Ferroni (Argentina)
Carlos Palomino (España)
David Flikier (Costa Rica)
Edna Almodin (Brasil)
Luis A. Rodríguez Torres (Venezuela)
Luis Izquierdo (Perú)
Pablo Suarez (Ecuador)
Coeditores de Catarata
Claudio Orlich (Costa Rica)
Daniel Badoza (Argentina)
Eduardo Viteri (Ecuador)
Fernando Aguilera (México)
Jorge Jaramillo (Venezuela)
Juan Carlos Corbera (Perú)
Milton Yogi (Brasil)
Ramón Lorente (España)
Director Ejecutivo
Traducción cortesía de

Servicio Internet cortesía de

Editorial
Cirugía de catarata en pacientes con Enfermedades Inflamatorias Oculares
Dr. Manuel Alejandro Garza León – México
Artículo de revisión
Nuevas tendencias en el cálculo de lentes intraoculares tóricos
Dr. David Flikier – Costa Rica
Foro Catarata
Cirugía de catarata complicada con ruptura capsular y vítreo en cámara anterior:
¿vitrectomía anterior o vitrectomía vía pars plana?
Coordinador: Dr. Rodrigo Donoso – Chile
Panelistas: Dr. Ernesto Otero – Colombia, Dr. Roberto Von Hertwig – Brasil, Dr. Juan Carlos Corbera – Perú, Dr. Mauricio A. Perez – Chile, Dr. Virgilio Centurion – Brasil
Catarata: Ciencia – Arte – Experiencia
Noticiero ALACCSA-R pregunta (colaboración del Dr. José Miguel Varas-Prieto – Ecuador):
Catarata y uveítis: se trata de un paciente de 86 años con 4 días de evolución de congestión periquerática en 360 grados, dolor intenso y progresivo, acompañado de empeoramiento de la visión del ojo derecho.
Dr. Cristóbal Couto – Argentina
SBAO – Sociedade Brasileira de Administração em Oftalmologia
Técnicas y herramientas para organizar la administración de una clínica oftalmológica: finanzas e inversiones
Jeanete Herzberg – Brasil
Noticia
Desenlace del caso presentado en la edición de enero de 2013 – ATENCIÓN!
Dr. Cecilio F. Velasco Barona – México
Calendario 2013
ALACCSA-R / LASCRS in ASCRS – San Francisco, April 19 – 23, 2013
ALACCSA-R / LASCRS in Pan American & Brazilian Cong. of Ophthal., Rio de Janeiro, Aug. 07 – 10, 2013
Busque en www.alaccsa.com modelo de consentimiento informado para cirugía de catarata. Colaboración inestimable del Dr. Luis Escaf.
Avisos
- noticiero@alaccsa-r.info: Puede enviar sus comentario que en el próximo número iremos publicarlo.
- Las opiniones o manifestaciones aquí divulgadas son de exclusiva responsabilidad de los autores.
- Si no deseas recibir Noticiero ALACCSA-R, clique aquí.
Cirugía de catarata en pacientes con Enfermedades Inflamatorias Oculares
Dr. Manuel Alejandro Garza León – México
E-mail: manuel@drgarza.mx
Introducción
La incidencia de las enfermedades inflamatorias oculares (EIO) o también llamadas uveítis, en los países desarrollados, es de 45 casos por 100.000 habitantes/año, con una prevalencia de 70 por 100.000, siendo la causa del 10-15% de los nuevos casos de ceguera en EEUU. Aunque la causa más frecuente de pérdida visual en pacientes con EIO es la presencia de edema macular quístico, las cataratas son la complicación más frecuente (1) siendo su frecuencia variable de acuerdo a cada enfermedad, pero en términos generales casi el 50% de los pacientes con EIO la desarrollan.
Existen varios mecanismos para la formación de la catarata: la enfermedad per se (por ej. La asociada a infección perinatal por TORCH), la inflamación crónica del segmento anterior (por ej. La asociada a artritis idiopática juvenil) o secundaria al manejo anti inflamatorio con cortico esteroides por cualquier vía.
Indicaciones
A diferencia de los pacientes con catarata senil, la cirugía de catarata en pacientes con EIO no es una cirugía electiva, es importante siempre considerar de manera amplia los pros y contras de realizar la cirugía, ya que se ha demostrado que el realizar una cirugía de catarata es uno de los factores más importantes para mala evolución y desarrollo de hipotonía en pacientes con uveítis (2) .
Foster y colaboradores (3) sugieren 4 razones bien establecidas para operar a un paciente de catarata en pacientes con una enfermedad inflamatoria ocular: 1) Inflamación activa secundaria a proteínas cristalineanas (Uveítis facogénica), 2) Catarata significativa en pacientes con control inflamatorio adecuado y buen pronóstico visual, 3) Incapacidad de valorar el segmento posterior en pacientes con sospecha de alteración del polo posterior y 4) Catarata en pacientes que requieren cirugía de segmento posterior. En los pacientes pediátricos se debe también tener en cuenta el riesgo de desarrollo de ambliopía sobre todo cuando la catarata es unilateral en pacientes menores de 7 años.
Diagnóstico
El primer paso para un buen manejo preoperatorio es sospechar que nuestro paciente con catarata pudiera estar asociada a una EIO, reconociendo que las EIO son más frecuentes en personas en edad media. En todo paciente joven que presente una catarata debe de considerarse que es secundaria a una enfermedad inflamatoria ocular hasta demostrar otra etiología y, cuando se presenta en un paciente pediátrico, la presencia de queratopatía en banda o sinequias posteriores debe hacernos sospechar de una etiología inflamatoria. En personas de la tercera edad, es importante evaluar la presencia de alteraciones de la superficie ocular, fibrosis subconjuntival y simbléfaron, características del penfigoide de membranas mucosas.
Aunque los oftalmólogos somos privilegiados por la posibilidad de evaluar in vivo el órgano que estudiamos, no debemos de olvidar la importancia que tiene el interrogatorio. Entre las informaciones que debemos conocer están: las enfermedades sistémicas que pueden agravarse con el manejo de la uveítis como serían la diabetes mellitus, la hipertensión arterial y la osteoporosis por mencionar algunas. También debemos saber si están presentes las enfermedades sistémicas que pueden causar uveítis como la espondilitis anquilosante, artritis idiopática juvenil, sífilis o tuberculosis. Además, si el paciente refiere una historia previa de glaucoma, edema macular o uso de esteroides, así como un diagnóstico previo de infección ocular herpética o toxoplasmosis debe ser tomado en cuenta tanto para el diagnóstico de la enfermedad inflamatoria ocular así como para el manejo pre operatorio.
Siempre se debe realizar una exploración oftalmológica completa, poniendo énfasis en la presencia de las siguientes alteraciones:
- Esclera: áreas de escleromalasia o escleritis,
- Conjuntiva: la presencia de fibrosis subconjuntival y simbléfaron
- Córnea: la queratopatía en banda y la endoteliopatía autoinmune son características de pacientes pediátricos con uveítis anterior asociada a artritis idiopática juvenil (AIJ) o Pars Planitis, otro hallazgo frecuente son los depósitos retroqueráticos que generalmente se localizan en la parte inferior en forma de triángulo conocido como triángulo de Artl, finalmente, debe evaluarse de manera adecuada el conteo endotelial que puede estar disminuido en pacientes con uveítis herpéticas.
- Cámara anterior: Es de vital importancia evaluar si existe actividad inflamatoria o no, la presencia de células inflamatorias debe ser “gradificada”, además de las células inflamatorias, la presencia de proteínas en el humor acuoso (flare) aunque no es un indicador de inflamación activa (es de la ruptura de la barrera hemato-acuosa) ni exclusivo de EIO (se presenta frecuentemente en pacientes con desprendimiento de retina crónico) nos debe sugerir una catarata secundaria que requiere un diagnóstico etiológico antes de la cirugía.
- Iris: Además de las características sinequias posteriores, los pacientes con EIO pueden presentar nódulos en el borde (de koeppe) o en el estroma (de Bussaca) iridiano. Otro hallazgo frecuente en pacientes con síndrome Uveítico de Fuch´s es la atrofia del iris con heterocromía.
- Cristalino: NO existe un patrón patognomónico de cataratas secundaria a Uveítis, en la literatura se describe a la opacidad subcapsular posterior como el tipo de catarata más frecuente, sin embargo, las cataratas secundarias a esteroides también se presentan frecuentemente con el mismo tipo. En pacientes con uveítis anterior severas o crónicas, frecuentemente se desarrollan membranas o calcificaciones sobre la cápsula anterior, es importante reconocerlas ya que el plan quirúrgico se debe modificar en caso de presentarlas.
- Vítreo: Los hallazgos más importantes a este nivel además de la inflamación del vítreo son los copos y bancos de nieve típicos de la pars planitis, así como la presencia de una membrana ciclítica que puede confundirse con una opacidad subcapsular posterior generalmente de localización inferior.
- Retina: Siempre que sea posible, debe realizarse una evaluación bajo dilatación pupilar farmacológica en todo paciente con una catarata, esto es de mayor importancia si sospechamos una etiología inflamatoria ya que la presencia de cicatrices, hemorragias o cambios pigmentarios deben tomarse en cuenta tanto para el manejo pre operatorio, como para discutir con el paciente el pronóstico visual.
El llegar a un diagnóstico definitivo de la enfermedad inflamatoria ocular causante de la catarata es de vital importancia tanto para el manejo pre operatorio, la planeación quirúrgica, el manejo post operatorio (como se mencionará más adelante) y finalmente con fines pronósticos. Existe abundante información en la literatura sobre un buen pronóstico en pacientes con síndrome uveítico de fuchs (4)aunque también existen algunos reportes de complicaciones importantes en este grupo de pacientes (5,6) y sin duda la literatura reporta un pronóstico muy reservado en niños con artritis idiopática juvenil por ejemplificar algunos casos.
Manejo pre operatorio
Aunque no existen estudios aleatorizados que demuestren el tiempo adecuado de inactividad inflamatoria necesario para tener un mejor pronóstico y disminuir la inflamación post operatoria, algunos estudios (7,8) y el consenso de los especialistas sugieren que el tiempo mínimo de inactividad debe ser de 3 meses a excepción de los casos de uveítis facogénicas donde debe realizarse el procedimiento a la brevedad posible.
Como mencionamos previamente, el diagnóstico etiológico es muy importante, cuando la uveítis es secundaria a un proceso infeccioso local, existen reportes en la literatura de reactivación de infecciones herpéticas y toxoplasmosis (9) posterior a una cirugía de catarata, por lo que se sugiere iniciar tratamiento antibiótico o antiviral profiláctico (Trimetroprim/sulftametoxazol 800/160 mg cada 12 horas o Aciclovir 400 mg 5 veces al día respectivamente) una semana previa al procedimiento quirúrgico.
Sin duda el control inflamatorio postquirúrgico es el problema principal en este grupo de pacientes, por lo que generalmente se inicia un tratamiento anti inflamatorio esteroideo tópico de manera profiláctica 7 a 10 días antes de la cirugía (cada 2 a 4 horas). Además, cuando sospechamos que el paciente va a desencadenar una reacción inflamatoria postquirúrgica severa como en los casos de uveítis anterior asociada a AIJ, pacientes pediátricos con Pars Planitis, uveítis anterior aguda asociada a HLA B27, etc., se debe agregar esteroides sistémicos a dosis inmunosupresoras (1 a 1.5 mg/kg/día) ya que se ha demostrado una mejor respuesta que el sólo utilizar esteroides trans y post quirúrgicos (10), aunque se tenga un manejo inmunosupresor no esteroideo adecuado.
Aunque frecuentemente existen alteraciones en el iris que impiden una buena dilatación pupilar, es recomendable suspender los midriáticos/ciclopléjicos unos días antes ya que su uso continuo disminuye su efecto para la cirugía.
Existe poca información en la literatura sobre el beneficio de antibióticos profilácticos en este grupo especial de pacientes, por lo que se deben extrapolar los datos reportados en pacientes con otros tipos de catarata, y aunque en mi conocimiento no existe un estudio que evalúe el efecto de medicamentos anti inflamatorios no esteroideos tópicos en la profilaxis del edema macular de pacientes con uveítis, entre los especialistas en EIO existe un consenso del pobre o nulo efecto de estos medicamentos para la prevención y tratamiento del edema macular quístico en este grupo de pacientes.
Procedimiento quirúrgico
Los avances tecnológicos y de técnicas quirúrgicas han tenido un gran impacto en la cirugía de catarata de pacientes con Uveítis; los resultados quirúrgicos han mejorado de manera muy importante a partir de la introducción de la facoemulsificación (11,12). Sin embargo, estos casos requieren de habilidades y destrezas más especiales que las necesarias para realizar una cirugía de catarata de un paciente senil, por lo que es muy importante que sea realizada por cirujanos expertos y contar con todos los materiales y equipos necesarios, debe siempre de tenerse a la mano uno o dos viscoelásticos extras, tinciones vitales, anillos retractores de iris, y otros.
Brevemente discutiremos cada uno de los pasos del procedimiento quirúrgico:
- Antes de iniciar la cirugía es recomendable limpiarse los guantes del exceso de talco que pueden tener ya que la entrada de cualquier agente externo puede desencadenar una respuesta inflamatoria más severa.
- Tipo de anestesia: Debido a la mayor manipulación de las estructuras del segmento anterior y en especial del iris, no se recomienda realizar esta cirugía con anestesia tópica, además se debe de evitar en lo posible inyectar medicamentos que pudieran causar una reacción inflamatoria.
- Incisión: Salvo algunos casos especiales, el tipo de incisión debe decidirse de acuerdo a la experiencia del cirujano y su familiaridad, en casos en los que el paciente tiene un antecedente de escleritis o se requiere hacer una cirugía combinada de glaucoma o se planea realizar una, se debe de realizar una incisión en córnea clara. La incisión con túnel escleral esta indicada en pacientes con antecedentes de queratitis ulcerativa periférica o úlcera de Mooren y está contra indicada en pacientes con conjuntivitis cicatriciales.
- Manejo de las sinequias posteriores y pupila pequeña: La manipulación excesiva del iris es un factor muy importante de inflamación post quirúrgica, por lo que es muy importante evitar al máximo su manipulación, las maniobras de tracción-contratracción deben evitarse, con el advenimiento de nuevos y mejores viscoelásticos, la viscodisección es una técnica muy utilizada; siempre que no exista una membrana pupilar, puede realizarse un abordaje pupilar; en uveítis crónicas, frecuentemente existen membrana fibrosas muy densas que impiden el acceso directo a la cápsula anterior, cuando esto sucede, puede realizarse una iridectomía periférica y desde ahí entrar inyectando un poco de viscoelástico para desplazar el cristalino hacia atrás e intentar perforar la membrana con la punta de la cánula. Si esto no es posible, creamos un espacio de seguridad para incidir la membrana con la punta filosa de una tijera de Vannas sin el riesgo de cortar la cápsula anterior. Una vez disecadas las sinequias posterior es, pueden utilizarse ganchos retractores de iris o realizar unas pequeñas esfinterotomías y probar si la viscodilatación es suficiente para exponer adecuadamente la catarata.
- Manejo de la cápsula anterior: en casos de uveítis crónicas, frecuentemente nos encontramos con una cápsula anterior calcificada parcial o totalmente, si la calcificación es central podemos intentar incluirla dentro de la capsulorexis planeada, cuando esto no es posible, nos podemos ayudar de una tijera de Vannas para completar la capsulorexis, ya que si realizamos maniobras de tracción, el vector resultante puede ser inadecuado y llevarnos a que se corra la capsulorexis por detrás del ecuador. El uso de tinciones vitales como el azul de tripano puede ser de gran ayuda, tanto para la identificación adecuada de la cápsula anterior así como para un mejor manejo de la misma. La capsulorexis debe ser amplia ya que existe mayor riesgo de opacidad y contracción capsular.
- Implantación del lente intraocular (LIO): En los adultos con EIO es bien aceptada la implantación de LIOs, sin embargo, donde existe mayor controversia es en pacientes pediátricos sobre todo aquellos con AIJ, aunque estudios recientes apoyan su colocación en pacientes con un excelente control anti inflamatorio previo (13). Continúan reportes de complicaciones severas con su uso sobre todo si no existe un control previo de la uveítis (14). Si se decide colocar el LIO, es recomendable realizar una capsulorexis circular continua posterior y una vitrectomía anterior central. Los factores de riesgo más importantes para tener que retirar un LIO son: Uveítis intermedia, panuveítis, pacientes con AIJ y enfermedades crónicas de difícil control como la Sarcoidosis (15).
- Características del LIO: existe abundante información sobre la biocompatibilidad de varios materiales y diseños de LIO en pacientes sanos y con uveítis, siendo el acrílico el mejor tolerado; de los LIOs que contamos en América (16,17), la plataforma AcrySoft® (Laboratorios Alcon) han demostrado un bajo porcentaje de opacidad de la cápsula posterior, sin embargo, una alta presencia de células gigantes epitelioides en la superficie anterior del lente.
- Iridectomía profiláctica: Anteriormente, la iridectomía profiláctica era un procedimiento de rutina en todo paciente con uveítis operado de catarata, pero con el advenimiento de nuevas técnicas y mejores tecnologías, puede prescindirse de esta maniobra en algunos casos. Sin embargo, siempre que se opere a pacientes con alto riesgo de inflamación postquirúrgica, no debe de olvidarse realizar una iridectomía amplia tanto para evitar el desarrollo de un bloqueo pupilar, como para poder evaluar mejor el segmento posterior en caso de que la pupila se quede miótica y no responda a los midriáticos.
- Aplicación de corticoesteriodes: Aprovechando que el paciente se encuentra canalizado y con monitorización de los signos vitales, durante el procedimiento quirúrgico puede aplicarse un bolo de metilprednisolona (500 a 1000 mg), además, al finalizar el procedimiento se puede utilizar inyecciones subtenonianas, intravítreas o en cámara anterior de triamcinolona. (18,19) Con los nuevos implantes de acción prolongada se abre una nueva opción para estos pacientes, algunos reportes (20) del uso de implantes de Fluoccinolona (Retisert® Laboratorios Bausch & Lomb) han demostrado resultados prometedores.
- Manejo de enfermedades oculares asociadas: Aunque no existen estudios bien estructurados en la literatura sobre los beneficios y riesgos de cirugías secuenciales vs combinadas de catarata más vitrectomía o catarata más glaucoma, algunos colegas sugieren un mejor resultado cuando se hacen cirugías combinadas de catarata y vitrectomía (21).
Manejo post operatorio
Frecuentemente después de llegar a la catarata, en su remoción se utiliza muy poco ultrasonido y eso nos da la idea de que el postoperatorio va a ser más sencillo de lo que pensábamos, sin embargo, en este grupo de pacientes es mejor ser muy agresivos en el manejo ya que una vez instaurado un proceso inflamatorio severo es difícil de controlar.
Aún en la actualidad los corticoesteroides siguen siendo el medicamento más efectivo para controlar el proceso inflamatorio, sin embargo, es importante reconocer que no todos los esteroides funcionan igual o tienen la misma penetración intraocular. De las preparaciones comerciales tópicas con que contamos en México, el medicamento que tiene un mayor poder anti inflamatorio es el Acetato de Prednisolona al 1%, aunque en poder anti inflamatorio, la Dexametasona supera a la Prednisolona, las presentaciones comerciales (Dexafrin® Laboratorios Sophia, Maxidex Isopto® Laboratorios Alcon) vienen a una concentración menor (0.1%) y en formulación de fosfato, el cual tiene una menor penetración a la cámara anterior que el acetato. Además es importante revisar si la formulación viene en solución o suspensión (en México las 2 presentaciones son suspensión), ya que de ser suspensión es importante recordarle al paciente la necesidad de agitar el frasco antes de colocarse la gota.
La tasa de complicaciones postoperatorias en este grupo de pacientes es mucho más alta que en la población general, un estudio reciente en Alemania encontró un 59.4% de complicaciones a largo plazo (22), por lo que además de un tratamiento agresivo con esteroides, el seguimiento debe ser muy escrupuloso, debe haber una tolerancia cero a la inflamación; existen varios signos que nos deben alertar, además de la presencia de células inflamatorias, el acumulo de células pigmentarias en el lente intraocular es otro signo frecuente de pobre control de la inflamación.
Debido a la mayor frecuencia de edema macular quístico postquirúrgico en comparación con la población general (7), debe realizarse una exploración completa del segmento posterior en todas las visitas de control y realizar estudios para confirmar o descartar su presencia para instituir el tratamiento adecuado en caso de ser necesario.
Con un buen diagnóstico etiológico, adecuado manejo preoperatorio, una técnica quirúrgica impecable y un buen manejo postoperatorio, el pronóstico visual de los pacientes operados de catarata puede ser muy satisfactorio, con una mejoría visual de al menos 2 líneas en cerca del 75% de los casos (22-25).
Conclusiones
La cirugía de catarata en pacientes con enfermedades inflamatorias oculares presenta muchos retos para el cirujano; un correcto diagnóstico etiológico, el trabajo en equipo, una excelente relación médico-paciente y el seguimiento estrecho son imprescindibles para un mejor pronóstico final.
Referencias bibliográficas en www.alaccsa.com
Nuevas tendencias en el cálculo de lentes intraoculares tóricos
Dr. David Flikier – Costa Rica
E-mail: david@flikier.com
A pesar de que el utilizar las queratometrías del Lenstar (después de validar la desviación estándar de las medidas, < 0.3 D y eje < 3.5 grados), e introducirlas en el calculador para un lente intraocular (LIO) tórico, es considerado una práctica adecuada, existen casos que aún con una técnica quirúrgica ideal en cuanto a marcación y colocación del LIO, no se obtienen resultados óptimos.
Douglas Koch (Douglas D. Koch, MD, Shazia F. Ali, BS, Mitchell P. Weikert, MD, Mariko Shirayama, MD, Richard Jenkins, MD, Li Wang, MD, PhD, J Cataract Refract Surg 2012; 38:2080–2087), ha invertido los dos últimos años buscando la causa y, en sus últimos artículos, encuentra una serie de datos interesantes que debemos conocer para mejorar nuestros resultados.
A continuación enumero algunos de estos resultados,
- La cara posterior de la córnea induce un cierto grado de astigmatismo.
- Este astigmatismo en general es bajo +0.3 D.
- En un alto porcentaje es contra la regla (86.6%). En la cara posterior de la córnea existe una mayor curvatura vertical, que debido a la diferencias en índices de refracción entre la córnea y el humor acuoso, producen el efecto inverso al de la cara anterior de la córnea con el aire.
- Esta curvatura vertical posterior, induce un astigmatismo contra la regla de +0.22 D, en un 5%, mayor de 0.5 D .
- Con la edad disminuye este astigmatismo de cara posterior en forma mínima, (0.025 mm en radio por año), con un efecto clínico casi de 0 y aumenta el anterior (0.029 mm por año) contra la regla (efecto mayor de la cara anterior contra la regla con la edad).
- El cambio de curvatura de la cara anterior produce un cambio del poder de la córnea 8 veces mayor que el de la cara posterior.
- La correlación del astigmatismo de cara posterior contra la regla es muy alta en casos de astigmatismo con la regla de cara anterior. La correlación en astigmatismos oblícuos o contra la regla (de cara anterior) es muy baja.
- En astigmatismos con la regla, el astigmatismo de cara posterior es proporcional al de la cara anterior. El astigmatismo posterior es + = (Astig ant x 0.1)+0.3 (dato estadístico).
- Al programar la cirugía, si existe astigmatismo con la regla, dejar hipo corregido para no pasarse a contra la regla por el efecto de la cara posterior.
- Es por este motivo que la incisión corneal de < 2.2 mm no “induce astigmatismo” cuando se realiza en el meridiano de 180º e induce astigmatismos de 0.4 a 0.75 D, cuando se realiza a 90º.
- En altos astigmatismos existe un cambio del eje del astigmatismo mayor de 10 grados cuando se calcula el astigmatismo total de la córnea vs. el de la cara anterior. (Sabong Srivannaboon, MD, Soeharnila, MD, Chareenun Chirapapaisan, MD, Pratuangsri Chonpimai, BSJ Cataract Refract Surg 2012; 38:2088–2093)
Conclusiones y recomendaciones:
No tomar en cuenta el astigmatismo de la cara posterior, puede llevar a un error en el cálculo del LIO tórico a colocar, llevando a una hipercorrección en los casos de astigmatismo con la regla y una hipo corrección en los casos de astigmatismo contra la regla.
Una opción que puede facilitar el procedimiento a seguir es: si usted opera con incisión a 90 grados, debe introducir en el calculador de Lio tórico, una inducción de astigmatismo por incisión de 0.5 a 0.8 D. Si la incisión la realiza a 180, debe introducir una inducción de astigmatismo por incisión cercana a 0 D. Esto especialmente en los casos de astigmatismos con la regla, donde si existe mayor correlación con el astigmatismo de cara posterior.
El eje del astigmatismo total de la córnea puede variar hasta 10 grados, principalmente en astigmatismos altos, y en aquellos casos de astigmatismos oblicuos y contra la regla.
El Galilei puede ser un instrumento útil en la elección del poder del LIO tórico a colocar y en la programación del eje.
Cirugía de catarata complicada con ruptura capsular y vítreo en cámara anterior:
¿vitrectomía anterior o vitrectomía vía pars plana?
Coordinador: Dr. Rodrigo Donoso – Chile
Panelistas: Dr. Ernesto Otero – Colombia, Dr. Roberto Von Hertwig – Brasil, Dr. Juan Carlos Corbera – Perú, Dr. Mauricio A. Pérez – Chile, Dr. Virgilio Centurion – Brasil
Dr. Donoso: 1. ¿EN QUé SITUACIóN DECIDE HACER UNA VITRECTOMíA POR PARS PLANA?
Dr. Centurion:
Debido a que la frecuencia de esta complicación es bastante baja (1.2% EUREQUO, J Cataract Refract Surg 2012;38:1086-1093) y los resultados de su tratamiento resultan eficaces, no veo necesidad, desde el punto de vista práctico, de realización de la vitrectomía vía pars plana.
La técnica de vitrectomía por la vía anterior, con dos incisiones de un (1) mm cada una en la región límbica, con irrigación-aspiración separadas y con parámetros de baja infusión resuelven muy bien esta situación.
Mis parámetros para vitrectomía anterior son:
Irrigation: 60 cm DRT: 0 Cut Rate: 800 Vacuum: 300 Asp Rate: 12
El objetivo de esta vitrectomía es retirar el vítreo del segmento anterior, eliminar posible tracción vítrea y posibilitar el implante que podrá ser en la bolsa, en el sulcus ciliaris o con fijación escleral.
Al final de la cirugía, una pupila centrada que reacciona al miótico es señal de una buena vitrectomía.
Dr. Otero:
En ninguna
Dr. Von Hertwig:
En nuestro servicio se realiza vitrectomía vía pars plana en los casos donde hayan fragmentos de núcleo del cristalino desplazados hacia el humor vítreo, luego de una rotura capsular, que no sean accesibles por la vía anterior. Hoy día con los instrumentos de menor calibre (23G), hay una tendencia de que esta vía de acceso se haga más frecuente en estos casos por la facilidad de manejo y menor inflamación.
Dr. Corbera:
Aunque se ha propiciado que todo cirujano de segmento anterior deba manejar la posibilidad de realizar una vitrectomia vía pars plana eficiente, me siento más cómodo usando regularmente una vitrectomia anterior y utilizando las incisiones de faco (principal y “side port”) o creando nuevas incisiones corneales dependiendo donde está ubicada la ruptura capsular. Prefiero evitar usar la vía pars plana en la mayoría de los casos.
Dr. Pérez:
Muchas son las situaciones que requieren la realización de una vitrectomía por pars plana, desde una vitrectomía anterior programada en casos de reconstrucción del segmento anterior con prolapso vítreo, intercambio de lente intraocular sin soporte capsular adecuado previo a fijación escleral, o bien, en casos no programados de pérdida vítrea durante facoemulsificación, ya sea de catarata standard, en que pese a realizar una capsulorhexis posterior primaria luego del compromiso de la cápsula posterior, no se logró evitar el prolapso vítreo, o bien en catarata traumática con compromiso previo de la cápsula posterior. En resumen, mi aproximación al manejo del prolapso vítreo en cualquier circunstancia va a ser siempre a través de un puerto vía pars plana.
Para este efecto, utilizo un trocar 23G, ingresando entre 3 a 3.5 mm del limbo y un vitrector 23G conectado al facoemulsificador en modo cut/IA, que luego de modificaciones de hardware al modelo original me permite realizar 2500 cortes/min.
Sugiero evitar realizar vitrectomías a través del limbo, para así evitar aumentar el prolapso vítreo hacia cámara anterior producto de diferencia de presiones, recordando que el vítreo, al estar constituido casi en su totalidad por agua, se comporta como un fluido, y si aspiramos en cámara anterior generando una presión negativa en relación a la presión en la cámara vítrea, estaremos fomentando el prolapso de éste. Además, el hecho de utilizar un trocar, nos permite evitar al máximo el contacto con el vítreo de la base vítrea, que es el vítreo que al ser traccionado, presenta mayor riesgo de generar un desgarro retinal.
Dr. Donoso: 2. ¿CUáL ES SU MANEJO SECUENCIAL ANTE UNA RUPTURA CAPSULAR CON VíTREO EN CA SIN RESTOS DE NúCLEO?
Dr. Centurion:
1) Siempre que sea posible, mantener el instrumental que esté utilizando por la incisión principal (faco o I/A) en el momento del diagnóstico de una ruptura de la cápsula posterior (RCP), con flujo bajo, o sea, congelar los movimientos. A seguidas inyección de SVE (substancia viscoelástica) por la incisión auxiliar y cortar la irrigación. Así estamos evitando provocar tracción del vítreo en CA (cámara anterior).
2) Con la CA llena de SVE, hacemos la vitrectomía anterior, inicialmente a seco y luego con irrigación separada.
3) Después, la revisión de todo el segmento anterior para verificar si no hay restos corticonucleares, si no hay “vigas” vítreas y analizamos el complejo zónulo-capsular para decidir si es posible el implante programado en la bolsa capsular, o en el sulcus ciliaris con lente intraocular (LIO) de 3 piezas en la graduación correcta o en último caso, si necesario fijación escleral.
4) Tras el implante del LIO, pasamos el vitreófago buscando posibles restos de “vigas” vítreas. A seguir aspiración de la SVE e inyección de miótico. La pupila bien centrada es señal de que la complicación fue bien resuelta.
Dr. Otero:
Primero inyecto visco-elástico dispersivo antes de sacar la punta del faco. Esto evita que la cápsula se colapse y se aumente el tamaño de la ruptura. Generalmente lo introduzco por la paracentesis con la mano izquierda. Luego analizo si hay vítreo en la CA. Si no lo hay y la ruptura es pequeña, procedo a ampliar la incisión a 2.8 mm (de 2.2 mm) e introduzco el LIO en el saco capsular. Si hay vítreo, procedo a realizar una vitrectomía anterior inicialmente seca (sin irrigación) y luego con una irrigación muy lenta (bajando la botella) a través de la incisión principal. Una vez libre de vítreo decido si introduzco una lente de 3 piezas en el sulcus o una lente de una sola pieza en el saco. Siempre entro a cirugía con 2 lentes, el que voy a poner y uno de 3 piezas por si es necesario. En algunas ocasiones también, si veo que el lente está en el saco pero el agujero se aumentó durante la inserción, atrapo la óptica en la rhexis lo que le da estabilidad al lente de una sola pieza. Siempre antes de insertar el lente, amplío la incisión unos 2 a 4 mm para que pueda introducir toda la punta del inyector a la CA y así hacer una inserción más controlada. Al final, pongo un punto de sutura y un poco de acetil-colina en la CA para ver si hay aun bandas vítreas en las incisiones. Si las hay, con una espátula de ciclo-diálisis, las libero haciendo un movimiento de barrido sobre el iris. Siempre, la pupila debe terminar negra, central y redonda. Si logramos esto, el manejo de la complicación ha sido impecable.
Dr. Von Hertwig:
Al momento de una ruptura capsular hay que tener el cuidado de retirar la punta de la pieza de mano de facoemulsificación sin que haya encarcelamiento del vítreo en el instrumento. La presencia del vítreo en la punta puede traccionar el mismo y aumentar la posibilidad de complicaciones retinianas. Hay que realizar la vitrectomía en el segmento anterior, sin o con mínima infusión de líquido para no hiperhidratar el vítreo y así aumentar su extrusión. Luego, con los restos corticales libres del contacto con el vítreo se pone substancia viscoelástica en el segmento anterior con la finalidad de evitar la anteriorización del vítreo. Hay que sacar los restos corticales solamente con aspiración y concluir la cirugía.
Dr. Corbera:
Una vez detectada la ruptura capsular posterior, coloco viscoelástico en la cámara anterior retirando al mismo tiempo la punta de faco en modo irrigación. Si no hay restos nucleares me debo asegurar de retirar la mayor cantidad de corteza que pueda, sin agrandar la ruptura. Para tal efecto, me gusta utilizar la técnica de hidrojet que consiste en:
Una vez colocado el viscoelástico, utilizar la cánula de hidrodisección para acercarme a los restos corticales periféricos, aspirar levemente, sujetar el córtex y retirarlo suavemente o llevarlo hacia el centro. Repito la misma operación para retirar la mayor cantidad de córtex posible. Puedo aspirar esos restos corticales dejados al centro, utilizando la pieza de irrigación/aspiración pero ocluyendo manualmente la manguera de irrigación, controlando de esa manera el flujo y realizando una suave aspiración
Verifico que tenga la rexis intacta.
Luego realizo una vitrectomía anterior con altos cortes y baja aspiración, separando la irrigación del vitrector para usarla por otro puerto.
Puedo usar triamcinolona para tener una mejor visualización del vítreo.
Una vez que he retirado todo el vítreo de cámara anterior, coloco viscoelástico e inserto un LIO en el surco.
Dr. Pérez:
Una vez identificada la ruptura capsular, lo primero es evitar remover los instrumentos, ya sea el facoemulsificador o la cánula de irrigación/aspiración en forma instintiva desde el interior del globo ocular. Luego, como ya lo mencionamos, debemos presurizar la cámara anterior, en este caso con viscoelástico dispersivo a través de una paracentesis, logrando una presión de cámara superior a la presión de cámara vítrea, para así evitar fomentar el prolapso vítreo a través del defecto capsular.
Ya con la cámara anterior presurizada, es necesario intentar transformar el desgarro de la cápsula posterior, que presenta uno o más puntos de stress definidos y que en general van a apuntar hacia la periferia favoreciendo la extensión del desgarro, en un defecto sin puntos de alto stress definidos1; en otras palabras, transformar el desgarro capsular en una capsulorhexis circular continua posterior primaria.
Una vez estabilizado el desgarro capsular, debemos establecer la presencia o ausencia de vítreo protruyendo a través del desgarro. De estar presente, procedemos a realizar una vitrectomía anterior a través de un puerto 23G vía pars plana, utilizando 2500 cortes/min hasta eliminar por completo el prolapso vítreo. Ante la duda respecto a vítreo remanente, es posible utilizar triamcinolona diluida en cámara anterior, la que nos va a permitir teñir el vítreo, mejorando así su visualización. Cabe señalar que el viscoelástico, al igual que el vítreo también es teñido por la triamcinolona y puede prestarse a confusión.
Ya sin vítreo y con nuestra capsulorhexis posterior sin puntos únicos de stress, procedemos a insertar nuestro lente de elección al saco capsular, siendo el de mi preferencia un lente de una pieza, de acrílico hidrofóbico y bordes cuadrados. En el caso en que no se hubiese logrado estabilizar el desgarro, procedemos a insertar un lente de 3 piezas, inicialmente al surco capsular, y luego procedemos a realizar la captura de la óptica del lente en la capsulorhexis anterior hacia el saco capsular.
En mi opinión no se debe proceder a disminuir la altura de la botella de suero ante un desgarro capsular, considerando que nuestro principal enemigo en este momento es generar una presión en cámara anterior inferior a la de la cámara vítrea. Debemos considerar que nuestro peor escenario, ante las técnicas y buen pronóstico actuales de una vitrectomía programada con fragmentación de segmentos de núcleos en el vítreo por el equipo de retina, no es la pérdida de fragmentos nucleares hacia el vítreo, si no que al intentar rescatar esos fragmentos, muchas veces para evitar un golpe al ego del cirujano, creemos un desgarro retinal gigante por tracción inadecuada del vítreo.
Dr. Donoso: 3. ¿CUáL ES SU MANEJO SECUENCIAL ANTE UNA RUPTURA CAPSULAR CON VíTREO EN CA CON RESTOS NUCLEARES?
Dr. Centurion:
La secuencia es similar a la pregunta anterior, pero con la presencia de restos de núcleo y córtex yo haría:
- Congelar movimientos, retirada de instrumental (faco), inyección de SVE dispersiva, intentando bloqueo de la RCP.
- Vitrectomía “leve”, en el local de la RCP + inyección SVE.
- Retirada de los restos para la cámara anterior.
- Facoemulsificación con módulo slow motion faco, en CA o plano iris.
Con facoemulsificador INFINITI – Alcon los parámetros son:
– Irrigation: 50 cm – DRT: 0 – Torsional amplitude: 50 – Vacuum: 180 – Asp Rate: 18
- Aspiración bimanual de los restos corticales con los siguientes parámetros: – Irrigation: 50 cm – Vacuum: 180 – Asp Rate: 18
- Vitrectomía;
- Revisión del SA;
- Implante de LIO;
- Vitrectomía final;
- Inyección de miótico
Dr. Otero:
- Inyectar visco-elástico dispersivo por detrás de los restos nucleares y taponando la zona de ruptura. Idealmente sin retirar la punta del faco ya que al hacer esto, la cámara anterior se colapsa aumentando la ruptura capsular.
- Dependiendo de la cantidad de núcleo aún en el saco, intento emulsificarlos o traerlos a la cámara anterior. En este momento, y si he logrado desplazar los restos nucleares a la cámara anterior, decido implantar una lente de 3 piezas en el sulcus para crear una barrera y poder terminar la emulsificación (técnica de scafolding). Al final, se repiten los pasos como en la ruptura sin restos nucleares.
- Si algún fragmento se desplaza a la cavidad vítrea, lo dejo ahí y al finalizar el procedimiento paso el paciente al cirujano de retina y vítreo para una vitrectomía por pars plana 23 o 25 y que sea él quien retire los fragmentos luxados.
Dr. Von Hertwig:
Los procedimientos son los mismos de la cuestión anterior. Luego de la inyección de la substancia viscoelástica y de la liberación de los restos nucleares del vítreo, se retiran los mismos con la punta del facoemulsificador con parámetros bajos. Evidentemente existe una gran variedad de situaciones, distintas localizaciones y número de fragmentos nucleares, que pueden hacer que la conducta tenga variaciones, pero como regla general las recomendaciones son estas.
Dr. Corbera:
Si se presenta una ruptura capsular y aún tengo restos nucleares, procedo a colocar viscoelástico detrás de los restos para estabilizarlos, luego amplio la incisión corneal para manipular fácilmente la extracción de estos restos con una pinza dentada.
Una vez extraídos los restos nucleares, procedo a manipular el córtex para su extracción conforme el párrafo 2.
Dr. Pérez:
El manejo de una ruptura capsular con vítreo y restos nucleares es bastante similar a los manejos sin restos nucleares. La principal diferencia consiste en, una vez presurizada nuestra cámara anterior y conteniendo el prolapso vítreo con la ayuda de viscoelástico dispersivo, procedemos a utilizar el viscoelástico para luxar los restos nucleares desde el saco capsular hacia la cámara anterior. Una vez que hemos vaciado el saco capsular y todos los fragmentos nucleares están por delante del plano del iris, flotando en el viscoelástico, procedemos a insertar el lente intraocular, en este caso de 3 piezas en el surco capsular si es que no hemos logrado transformar el desgarro en una capsulorhexis posterior continua, y capturamos su óptica en el saco capsular utilizando la capsulorhexis anterior. El lente tendrá la función tanto de evitar que los restos nucleares se muevan por diferencia de presión hacia la cámara vítrea y por otro lado evitará que, también por fluctuaciones de presión, el prolapso vítreo se acentúe.
Con nuestro diafragma, en este caso cápsula anterior-lente intraocular, restablecido y separando ambos compartimentos, procedemos a realizar nuestra vitrectomía anterior por pars plana a través de un puerto 23G de forma standard y, una vez libres de vítreo, completamos la remoción de los fragmentos nucleares remanentes en cámara anterior, ya sea mediante el mismo vitrector, alimentándolo con un segundo instrumento, o bien con el facoemulsificador.
Dr. Donoso: 4. ¿CUANDO SOSPECHA QUE HAY VíTREO EN CA DURANTE LA FACOEMULSIFICACIóN?
Dr. Centurion:
El cuadro clásico: 1º) la cámara se profundiza; 2º) generalmente midriasis; 3º) el faco para de funcionar; 4º) inestabilidad del cristalino.
Dr. Otero:
Hay dos signos que son claves. Uno es la profundización de la cámara anterior. Cuando esto sucede lo debe sospechar uno inmediatamente. El otro, que no es tan “patognomónico”, es que oigamos el sonido de oclusión en la máquina, sin estarlo. Esto lo debe llevar a uno a sospechar o que hay un fragmento de núcleo atrapado adentro de la punta o que haya vítreo en la CA. Algunas veces uno puede visualizar que al aspirar, los fragmentos de núcleo tienen un movimiento anormal como si no pudiesen fluir normalmente o se desplazan alejándose de la punta.
Dr. Von Hertwig:
Durante la facoemulsificación hay la sospecha cuando se observa iridodonesis que puede ser acompañada de disminución de la fuerza de atracción de los fragmentos de catarata hacia la punta del facoemulsificador y aumento de la profundidad de la cámara. Sobre todo en cataratas muy duras o con mucha manipulación en la cámara anterior.
Dr. Corbera:
Básicamente, cuando el núcleo no rota con facilidad, cuando se profundiza súbitamente la cámara anterior, cuando se ladea el núcleo, cuando la punta de faco pierde fuerza de aspiración y cuando observo con facilidad el reflejo rojo ampliado.
Dr. Pérez:
En primera instancia es necesario sospechar la presencia de vítreo en CA cuando realizamos una facoemulsificación en casos predispuestos a, ya sea compromiso de la cápsula posterior preexistentes (cataratas traumáticas, cataratas polares posteriores, lenticono posterior) o bien a diálisis zonulares (trauma, Ectopia Lentis primaria, o Ectopia Lentis secundarias, tales como Sd. de Marfan, microesferofaquia, Weill-Marchesani, homocistinuria, etc.)
Signos de sospecha de presencia vítrea en el intraoperatorio serán la profundización inesperada de cámara anterior, pérdida de eficiencia del facoemulsificador, marcada facodonesis o bien, directa visualización ya sea de un desgarro de la cápsula posterior o de una diálisis zonular.
Ante la duda recordar la tinción con triamcinolona diluida para así teñir el vítreo y favorecer su visualización.
Dr. Donoso: 5. ¿CóMO PREVIENE LA RUPTURA CAPSULAR POSTERIOR Y VíTREO ANTE UN DESGARRO DE LA RHEXIS?
Dr. Centurion:
Sabemos que el 95% de los desgarros de la rhexis paran a nivel del ecuador, debido a la estructura anatómica de las zónulas en su inserción a la cápsula anterior. (Assia EI; Apple DJ; Tsai JC; Morgan RC. Mechanism of radial tear formation and extensión after anterior capsulectomy. Ophthalmology 1991;98:432-437).
Todas las maniobras como la emulsificación o la I/A deben hacerse con bajo flow rate. En casi la totalidad de los casos es posible terminar la cirugía sin posteriorización del rasgado de la cápsula.
Dr. Otero:
Es en mi opinión una de las situaciones más retadoras para el cirujano de segmento anterior ya que tiene el núcleo entero en el saco. Lo que generalmente hago es hidrodisecar con muy poco fluido inyectando en la zona a 180 grados del desgarro. En estos casos, hago una técnica de faco lenta (slow motion phaco) y siempre trabajando lejos de la zona del desgarro.
Dr. Von Hertwig:
Hay una maniobra que se utiliza cuando la rhexis se dirige hacia el ecuador, que consiste en traccionar la capsula en el mismo sitio en que se desgarro la rhexis, en dirección centrípeta para el lado diametralmente opuesto al desgarro, así evitando la migración para la capsula posterior. Esta maniobra recupera con grande eficiencia la continuidad de la capsulorhexis y el proseguimiento de la cirugía con seguridad.
Dr. Corbera:
Trato de trabajar lo menos posible por esa zona para no ejercer fuerzas traccionales en ese sentido, evito profundizar la cámara anterior, usualmente disminuyo los parámetros de faco.
Dr. Pérez:
Ante un desgarro de la capsulorhexis circular continua, debemos diferenciar 3 situaciones posibles:
1) La primera es un desgarro que no se extiende hasta el ecuador del cristalino ni las zónulas. En este caso, mi elección es realizar el rescate del desgarro, mediante la modificación de la dirección del vector de fuerza aplicado al punto máximo de stress, ubicado en el extremo del desgarro capsular, gracias a la maniobra publicada por Brian Little3, en la que previo a desdoblar el borde de la capsulorhexis, se realiza una tracción en el sentido opuesto con dirección al centro del saco capsular. Esto nos va a permitir redirigir el desgarro, alejarlo de la periferia y transformarlo en un defecto continuo, sin puntos de máximo stress.
2) El desgarro llega hasta el ecuador del cristalino y la inserción zonular, pero no se extiende hacia la cápsula posterior. Ante esta situación, cualquier intento por redirigir el desgarro, una vez que éste avanzó hasta las inserciones zonulares, tiene alto riesgo de extenderlo hacia la cápsula posterior. El manejo consiste en completar la capsulorhexis en la dirección horario opuesta, luego realizar la facoemulsificación utilizando una técnica de bajo stress zonular, siendo la de mi elección el quick chop, con chop horizontal y finalmente, considerar la realización de una capsulorhexis circular continua posterior primaria para utilizar como medio de fijación de la óptica al finalizar el caso, asegurando el centrado y la estabilidad del lente intraocular a largo plazo.
3) El desgarro se extiende más allá del ecuador comprometiendo la cápsula posterior. ésta es una situación de alto riesgo de generar pérdida de fragmentos nucleares hacia la cámara vítrea. Una vez identificado este defecto, lo ideal es intentar una vez más transformar un defecto con un solo alto punto de stress en un defecto continuo, utilizando el mismo principio de fuerzas vectoriales, esta vez creando un defecto de borde continuo en la cápsula posterior que finaliza de vuelta hacia el defecto original, una vez más sin ningún punto de alto stress, lo que evitará su extensión.
Dr. Donoso: 6. ¿CUáL ES SU MANEJO POSTOPERATORIO ANTE UNA VITRECTOMíA POR RUPTURA CAPSULAR?
Dr. Centurion:
Mantengo mi rutina que es moxifloxacin + dexametasona por 15 días, nepafenaco por 30 días.
En casos especiales, donde hubo mayor trauma del segmento anterior indicamos esteroides VO.
Dr. Otero:
Siempre dejo lo de rutina fluoroquinolona de 4 generación (cada 3 horas por 8 días) y Prednisolona (cada 8 horas por 15 días) y adiciono al régimen un AINES tópico (me gusta mucho el Ketorolaco) 3 veces al día por 2 meses.
Dr. Von Hertwig:
Recomendamos en nuestro servicio corticoterapia sistémica (prednisona 40mg) asociada a gotas de antibiótico, corticoides y antiinflamatorio no esteroidal. Se aconseja más reposo en los primeros días del postoperatorio, además de riguroso examen del polo posterior, en especial la región macular. Hay que tener atención especial a la presión intraocular porque puede estar más alta en los primeros días, incluso el uso de inhibidores de la anhidrasa carbónica o betabloqueadores pueden ser necesarios.
Dr. Corbera:
Inmediatamente colocado el LIO en el surco y retirado el viscoelástico, coloco moxifloxacina y dexametasona (Vigadexa) 0.2 ml en la cámara anterior. Uso 60 mg de prednisona vía oral por dos días. Uso prednisolona 1% en gotas cada 4 horas por 5 días. Utilizo un hipotensor ocular que no tenga inhibidores de anhidrasa carbónica (para no forzar trabajo del endotelio).
Luego el manejo habitual de un pos operado de catarata.
Dr. Pérez:
Mi manejo postoperatorio ante una cirugía de facoemulsificación standard consiste en una quinolona de cuarta generación y acetato de prednisolona al 1%, ambos tres veces al día asociado a Bromfenaco una vez al día (u otro antiinflamatorio no esteroidal a elección), controlando al paciente al día, semana y mes post-operatorios, realizando examen de fondo de ojo dilatado en el último control. En el caso de realizar una vitrectomía por pars plana, es más, ante cualquier manipulación vítrea, ya sea programada o no programada, es imperativo realizar examen de fondo de ojo dilatado en cada visita post-operatoria, para descartar cualquier desgarro retinal que se pudiese haber producido ante alguna tracción inadvertida. Es importante además hacer hincapié al paciente en detectar los síntomas de alerta de un desgarro o desprendimiento retinal, tales como fotopsias, aparición de nuevas entopsias, o velos o cortinas en el campo visual.
* El autor no presenta intereses financieros en relación al contenido de este artículo.
Datos de Contacto de los Doctores
Dr. Rodrigo Donoso, e-mail: rdonoso@pasteur.cl
Dr. Ernesto Otero, e-mail: otero.ernesto@gmail.com
Dr. Juan Carlos Corbera, e-mail: jccorbera@speedy.com.pe
Dr. Virgilio Centurion, e-mail: centurion@imo.com.br
Dr. Roberto Von Hertwig, e-mail: rvhertwig@gmail.com
Dr. Mauricio A. Perez, e-mail: mperez@gmx.us
Catarata: Ciencia – Arte – Experiencia
Noticiero ALACCSA-R pregunta (colaboración del Dr. José Miguel Varas-Prieto – Ecuador, e-mail: jm@varas.com):
Catarata y uveítis: se trata de un paciente de 86 años con 4 días de evolución de congestión periquerática en 360 grados, dolor intenso y progresivo, acompañado de empeoramiento de la visión del ojo derecho.
Antecedentes: Se desconoce antecedentes familiares de enfermedad oftalmológica. No tiene antecedentes médicos personales (no hay antecedentes clínicos, farmacológicos ni quirúrgicos relevantes). No tiene antecedentes oftalmológicos quirúrgicos ni médicos. Vive en un hogar geriátrico desde hace 1 año.
Negativos relevantes: no historia de artralgias ni alteraciones articulares. No hay antecedentes de ingesta de alimentos de dudosa cocción o pescado crudo. No hay antecedentes de episodios similares. No hay certeza de traumatismo ocular reciente.
Examen físico: paciente orientado, colaborador con la entrevista, inteligencia y raciocinio promedio. El ojo derecho tiene AVsc PL (percepción luminosa) dudosa, congestión periquerática en 360º, edema corneal, hipopion, cámara anterior turbia, PIO 22 mm Hg, no se puede ver el plano iridiano por la turbidez de la cámara anterior. El ojo izquierdo tiene AVsc CD (cuenta dedos), reflejo pupilar directo presente, córneas transparentes sin signos de inflamación antigua, catarata madura, presión 18 AG.


Conducta inicial hasta este momento: ¿Cuál es su sospecha clínica? ¿Qué prueba diagnóstica le parece esencial para el diagnóstico e inicio del tratamiento? ¿Qué exámenes pediría? ¿Iniciaría tratamiento médico empírico?
Dr. Cristóbal Couto – Argentina
E-mail: cristobalcouto@hotmail.com
Dudas:
1. Si el paciente está en un geriátrico: tenemos certeza que todos los antecedentes son negativos.
2. El paciente con 86 años tiene más edad de tumor o infección que de uveítis.
El examen biomicroscópico revela cosas interesantes:
1. Parece una uveítis anterior pero con esa córnea no se ve el fondo de ojo para descartar una uveítis difusa.
2. La córnea está descompensada en un ojo con la presión ocular normal, lo que puede hacer pensar en una endotelitis por herpes o una descompensación por una uveítis facoanafilactica.
3. El hipopion es demasiado oscuro y parece estar teñido de sangre, lo que podría hablar de un herpes.
Posibles diagnósticos:
1. Endoftalmitis endogena
2. Linfoma, Leucemia (maquerade syndrome)
3. Uveítis facoanafiláctica (catarata completa en el ojo contralateral) que habrá pasado con este ojo
4. Queratouveitis herpética, tiene descompensación de la córnea o endotelitis?
5. Candidiasis (también es una endoftalmitis endógena)
6. Enfermedad de Behcet (raro en esta edad)
7. Uveítis anterior HLA B 27 (rarísimo)
8. 6 y 7 son las uveítis que cursan con hipopion
Que haría:
1. Ecografía: descarto engrosamiento coroideo lo que me hablaría de un compromiso posterior y endoftalmitis endógena por bacterias u hongos (Candidiasis). Si la ecografía me da normal descarto la endoftalmitis endógena.
2. Punción cámara anterior: a) Citología (células tumorales, inflamatorias)
b) PCR para bacterias, virus y hongos
c) Cultivo humor acuoso para bacterias y hongos. Pensar también en una mico bacteria atípica (común en pacientes añosos (Elderly patients)). Pedir cultivo para mico bacterias atípicas.
3. Examen de sangre, PPD, VDRL, FTA abs, estudios reumatológicos.
Tratamiento sintomático hasta obtener los resultados
DESENLACE DEL CASO
Diagnósticos diferenciales: endoftalmitis bacteriana; endoftalmitis micótica; uveítis anterior idiopática; uveítis facoantigénica.
Diagnóstico de trabajo: la sospecha clínica inicial fue de una uveítis facoantigénica debido a ausencia de antecedentes, madurez de la catarata del otro ojo, inicio rápido y marcada intensidad inflamatoria.
Manejo inicial: tratamiento inicial con prednisolona acetato al 1% cada hora; atropina sulfato al 1% cada 12 horas; Acetaminofen 500 mg c/6 horas; se pidió cuadro hemático y velocidad de eritrosedimentación inicialmente.
Aspecto a los 3 días de tratamiento


Seguimiento: tras 3 semanas de tratamiento con disminución progresiva de la prednisolona y manejo con antihipertensivos.

Diagnóstico definitivo: se confirma clínicamente el diagnóstico de uveítis facoanafiláctica; catarata morganiana; se programa EECC sin suspender corticoides antes de la operación.
Resultado al control del mes: pseudofaquia correcta con AV c/c 20/30.
SBAO – Sociedade Brasileira de Administração em Oftalmologia
Técnicas y herramientas para organizar la administración de una clínica oftalmológica: finanzas e inversiones
Jeanete Herzberg – Brasil
Administradora de empresas y socia fundadora de Interact Gestão de Negócios Ltda., empresa de consultoría en gestión de clínicas médicas.
E-mail: jeanete@interact-consult.com.br
¿Qué son “técnicas y herramientas para organizar la administración de una clínica oftalmológica”? ¿En qué difieren de la administración de cualquier otro negocio? En mi opinión, no hay diferencia en las técnicas y herramientas de administración, sino en la forma en que se aplican, de acuerdo con las necesidades del negocio y de sus emprendedores.
Inicialmente, es importantísimo aclarar la diferencia conceptual entre las funciones que el médico, dueño de la clínica, tiene: el médico tiene su remuneración resultante de su trabajo, sus honorarios. El emprendedor, a su vez, invierte capital en su negocio y espera un retorno de esta inversión. Para eso, él es remunerado por beneficios y dividendos del negocio. Así, las técnicas de administración que discutiremos aquí serán siempre dirigidas a la gestión de las clínicas y, por lo tanto, para el emprendedor que busca excelencia en su negocio.
En cualquier actividad las principales preguntas de los emprendedores, dueños de los negocios, son: ¿dónde quiero llegar, cuándo, cómo, con quién y a qué costo? Del mismo modo, los médicos dueños de clínicas deben definir lo que quieren para su negocio. ¡Las técnicas y herramientas son justamente utilizadas para hacer que las clínicas puedan organizarse para lograr sus objetivos!.
Las principales herramientas en el área financiera y contable son el balanceo y balances mensuales, informes gerenciales y el flujo de caja. El balanceo y los balances son fotografías instantáneas de la situación de la clínica en el último día del año (balanceo) o de cada mes (mensual). Ellos permiten la visualización de la situación económica de la clínica indicando si existe ganancia o pérdida a lo largo del tiempo. También se pueden calcular diversos indicadores de resultados, entre ellos: liquidez – cuánto $ existe en caja para cada $ a pagar, ganancia realizada en el periodo, grado de endeudamiento (cuánto es financiado por los emprendedores y cuánto por terceros), margen de ganancia, tendencias del negocio y otros tantos indicadores.
Los informes gerenciales deben cumplir con la demanda de informaciones más específicas de control del negocio. Como por ejemplo: productividad de los médicos, utilización racional de las salas de consultas, rentabilidad de los seguros médicos privados, líneas de productos y servicios, número de consultas y sus respectivos valores y adquisición de equipos.
Flujo de caja es la herramienta que indica la situación financiera de la clínica. Su acompañamiento es fundamental para saber el estado actual y las proyecciones de entradas y salidas de dinero y, por lo tanto, falta o sobra de numerario. El conocimiento de la situación de la caja permite la toma temprana de medidas para evitar saldos negativos o aún dar destino para eventuales sobras.
Organización y métodos también tienen un papel importante en la gestión de una clínica. Crear diagrama de flujo de actividades rutinarias de control es fundamental para que la clínica mantenga su conocimiento acerca de los procesos internos burocráticos. Deben ser hechos controles básicos de actividades quirúrgicas, de registro de los médicos y otros profesionales que de ellas participaron, de la emisión de cheques y depósitos. Estos controles deben respetar las necesidades de la clínica y no deben, en oposición, burocratizar excesivamente los procesos.
Sistemas de gestión podrán ser utilizados, pero siempre respetando los objetivos mayores de la clínica. Hay que sistematizar informaciones relevantes, consistentes y de real importancia para la gestión.
Estos son algunos ejemplos de técnicas y herramientas que se utilizan en la gestión de clínicas oftalmológicas. Por supuesto, así como en la oftalmología en la cual el médico utiliza todas las herramientas disponibles para mejorar la visión del paciente, el administrador también tiene las suyas para ayudarlo en una gestión de éxito de la clínica. ¡Sean bienvenidos al mundo de la administración!
Desenlace del caso presentado en la edición de enero de 2013 – ATENCIÓN!
Dr. Cecilio F. Velasco Barona – México
E-mail: ceciliovelascobarona@gmail.com
Paciente femenina de 50 años de edad, operada hace 27 años de Queratomileusis in situ en ambos ojos. La paciente ha usado lentes de contacto desde hace 27 años, está desesperada y no tolera más los lentes de contacto. Exploración oftalmológica: A.V. O.D. cuenta dedos, O.I. cuenta dedos; Refracción de hace 2 años: O.D. -11.00 = -0.50 x 104, O.I. -10.25 = – 0.25 x 115. Refracción actual: O.D -11.50 = -1.75 x 176 con C.V. de 20/50, O.I. -10.25 = – 4.00 x 45, con C.V. de 20/50. Las K’s (autorrefractor): O.D. 42.75 x 174 / 44.25 x 84; cil -1.50 x 174; K prom 43.50. O.I. 43.25 x 37 / 45.75 x 127; cil -2.50 x 37; K prom 44.50. Pentacam: imágenes en documento adjunto. Eje antero-posterior por US: O.D. 29.17 mm, O.I. 27.96 mm. Segmento anterior: Córnea transparente, con leucoma poco denso, de forma circular, con diámetro de 6mm aprox. en A.O. Cámara anterior: Formada, amplia, con opacidades en caballero y EN + A.O. Fondo de ojo A.O: Papila con excavación de 30%, fondo coroideo, mácula normal. La paciente desea cirugía para corrección de su defecto refractivo.
Preguntas: 1) ¿Qué cirugía realizarían? 2) En caso de optar por faco, ¿cómo calcularían el poder del LIO? 3) ¿Qué queratometrías? ¿Autorrefractor, Pentacam, IOL Master, Lenstar? 4) ¿Utilizan compensación de queratometrías? ¿Cuál? 5) ¿Qué fórmula utilizarían? ¿Holladay 1, II, Haigis, SRK/T, Hoffer Q, SRK II, Olsen? 6) ¿Utilizaría un LIO tórico? 7) ¿Otro tipo de LIO? ¿Asférico, esférico?
Forma de cálculo y resultado final
Cálculo:
1.- El promedio de las K’s del autorrefractor son muy semejantes a las K’s que se obtienen por la topografía con Pentacam (incluyendo el promedio de las K´s dentro de los 3mm) en A.O. por lo que, decido tomar el promedio de las K’s del autorrefractor.
2.- El eje A/P fue tomado por ultrasonido con técnica de inmersión.
3.- Fórmulas:
OJO DERECHO: SRK/T + 4.50
HOLLADAY 1 + 4.00
HAIGIS + 4.50
HOFFER Q + 4.00
SRK II + 6.00
Implante: + 6.00 SN60WF
RM (2 meses) + 0.50 = – 0.50 x 175 20/20
KM 42.00/ 43.25 x 149 prom K 42.75
OJO IZQUIERDO:
SRK/T + 6.50
HOLLADAY 1 + 5.50
HAIGIS + 6.50
HOFFER Q + 5.50
SRK II + 8.00
Implante + 8.50 SN60WF
RM (1 mes) + 0.25 = – 2.50 x 50
KM 43.50/46.00 x 42 prom K 44.75
El resultado es que la fórmula de SRK II, que ha sido satanizada por muchos años, nos demuestra que en casos con las K’s que corresponden a ojos emétropes, pero con ejes grandes (arriba de 26 mm) tiene un buen resultado.
- ASCRS/ASOA Symposium & Congress
April 19 – 23, San Francisco, CA – USA
Informaciones: www.ascrs.org
- Jornadas Nacionales de Oftalmología
Mayo 16 – 18, Buenos Aires – Argentina
Informaciones: www.oftalmologos.org.ar/index.php/formacion-presencial/jornadas
- 28 Congreso de la SECOIR
Mayo 22 – 25, Barcelona – España
Informaciones: www.oftalmo.com/secoir
- VII Congreso Internacional de Oftalmología – XV Congreso Cubano de Oftalmología
Mayo 29 – 31, La Habana – Cuba
Informaciones: Dr. Marcelino Río Torres – E-mail: oftalmologia2013@horpf.sld.cu – Tel.: (537) 265-4800
- VII Congresso Brasileiro de Catarata e Cir. Refrativa
Mayo 29 – Junio 01, Praia do Forte, Bahía – Brasil
Informaciones: www.catarata-refrativa.com.br
- XXVIII Congresso Pan-Americano de Oftalmologia;
XXXVII Congresso Brasileiro de Oftalmologia
Agosto 07 – 10, Rio de Janeiro – Brasil
Informaciones: www.cbo.com.br | www.paao.org
- XXXI Congress of the ESCRS
Octubre 05 – 09, Netherlands – Amsterdam
Informaciones: www.escrs.org
- AAO Annual Meeting
Noviembre 16 – 19, New Orleans, LA – USA
Informaciones: www.aao.org
- Joint Meeting Bascom Palmer Eye Institute
& Fundación Oftalmológica los Andes
Diciembre 05 – 07, Santiago de Chile
Informaciones: www.oftalandes.cl



ALACCSA-R / LASCRS in ASCRS – San Francisco, April 19 – 23, 2013
Aviso: informaciones retiradas del sitio de ASCRS http://13am.ascrs.org/program, podrá tener modificaciones.
¡Marque en su agenda!
SATURDAY, APRIL 20, 2013
20-306. ASCRS Course 20-306: Lens Surgery After Refractive Surgery (Presented in Spanish)
1:00 PM – 2:30 PM; Room 306 (Moscone)
Virgilio Centurión; Eduardo Chávez Mondragón; Harold Freydell; Cecilio F. Velasco; Luis Escaf; Claudia Palacio; Marcelo V. Netto
S-5. ASCRS Symposium S-5: Management of Complicated Cases in Cataract and Refractive Surgery (Presented in Spanish)
3:00 PM – 5:00 PM; Room 134 (Moscone)
William C. De La Peña; Miguel A. Padilha; José A. Cristóbal; José A. Claros Bernal ; Virgilio Centurión; Luis W. Lu; Carlos L. Nicoli; Claudia Palacio; Marcelo C. Ventura; Leticia Arroyo-Muñoz; Alfonso Arias-Puente; Eduardo Chavez Mondragon; Carlos Palomino; Luis Escaf; Néstor Gullo; Enrique Súarez; Cesar C. Carriazo; Miguel Srur; Roberto Zaldivar; María José Cosentino; José L. Güell; Sergio Kwitko; Raúl S. Súarez; Enrique Graue-Wiechers; Angela M. Gutierrez; Luis Izquierdo; Arturo L. Kantor; Tito Ramirez-Luquin; Félix Pérez; Marcelo Sterzovsky
5:00 PM; Room 134 (Moscone)
Recepción y Coctel de Bienvenida – ALACCSA-R
SUNDAY, APRIL 21, 2013
S-6. ASCRS Symposium S-6: Combined Symposia of Cataract and Refractive Societies – Presbyopia Correction: Where? When? How?
8:00 AM – 9:30 AM; Room 134 (Moscone)
Roger F. Steinert; Edward J. Holland; Graham D. Barrett; Peter J. Barry; William C. De La Peña
21-204. ASCRS Course 21-204: Newest Concepts on Diagnosis and Treatment of Corneal Ectasia
(Sponsored by ALACCSA-R; Presented in Spanish)
10:00 AM – 11:30 AM; Room 304 (Moscone)
Mauro Campos; Marcelo Sterzovsky; Rene Moreno; Angela M. Gutierrez; Renato Ambrósio; Tito Ramirez-Luquin
Program:
New diagnostic tools – Renato Ambrosio, MD
Crosslinking: when, how and why – Marcelo Sterzovsky, MD
Crosslinking: results – Mauro Campos, MD
Crosslinking: Complications – Tito Ramírez Luquin, MD
Lamelar Transplant, when, how and why – Felix Pérez, MD
Penetrating Graft, when, how and why – Angela María Gutierrez, MD
Intracorneal Rings, when how and why – René Moreno, MD
21-206. ASCRS Course 21-206: Actual Surgical and Refractive Management of Congenital Cataract
(Presented in Spanish)
10:00 AM – 11:30 AM; Room 306 (Moscone)
Leticia Arroyo-Muñoz; Marcelo C. Ventura; Liana O. Ventura; Claudia Palacio; Santiago Garcia Arroyo; Sergio Ruiz-Esmenjaud; Carlos Palomino; José A. Cristóbal; Adan Tapia
21-406. ASCRS Course 21-406: Learning From Our Mistakes 2013: International Video Symposium of Complication Management in Cataract and Anterior Segment Surgery (Presented in Spanish)
3:00 PM – 4:30 PM; Room 306 (Moscone)
Guadalupe Cervantes-Coste; Abhay R. Vasavada; Virgilio Centurión; Arturo S. Chayet; Everardo Barojas; Claudio Orlich; Renato Ambrósio; Erick Mendoza Schuster; Miguel Srur; Robert H. Osher; Fernando Aguilera-Zarate; Fernando L. Soler
MONDAY, APRIL 22, 2013
22-207. ASCRS Course 22-207: Astigmatism Correction in 2013 (Sponsored by ALACCSA-R; Presented in Spanish)
10:00 AM – 11:30 AM; Room 307 (Moscone)
Miguel Srur; Luis Izquierdo; Guadalupe Cervantes-Coste; María José Cosentino; Fernando L. Soler; Virgilio Centurión; Mauro Campos; Cesar C. Carriazo
The Astigmatic correction with:
Femptosecond Laser – Luis Izquierdo, MD
Lasik – PRK – María José Cosentino, MD
Toric Monofocals IOLs – Fernando Soler, MD
Multifocal Toric IOLs – Virgilio Centurion, MD
Phakic Toric IOLas – Miguel Srur, MD
Corneal Rings – Mauro Campos, MD
Bioptic – Cesar Carriazo, MD
22-306. ASCRS Course 22-306: Presbyopia: Options of Surgical Treatment (Sponsored by ALACCSA-R; Presented in Spanish)
1:00 PM – 2:30 PM; Room 306 (Moscone)
María José Cosentino; Tito Ramirez-Luquin; Angela M. Gutierrez; Jose M. Vargas; Enrique Suarez; Mauro Campos; Ivan L. Ossma
Program:
Femptosecond Laser – Angela Maria Gutierrez, MD
Presbymax – Tito Ramirez Luquin, MD
Monovision – María José Cosentino, MD
SupraCOR – Virgilio Centurion, MD
KAMRA – Jose Manuel Vargas, MD
Intracorneal Lens Flexivue-Presbia – Waldir Portelinha, MD
Accommodative IOL Crystalens – Mauro Campos, MD
Accommodative IOL Synchrony – Ivan Ossma, MD
Multifocal diffractive IOL – Enrique Suárez, MD
Final Remarks – María José Cosentino, MD – Tito Ramirez Luquin, MD
TUESDAY, APRIL 23, 2013 23-107. ASCRS Course 23-107: Laser-Assisted Cataract Surgery – Where Are We Today?
(Sponsored by ALACCSA-R; Presented in Spanish)
8:00 AM – 9:30 AM; Room 307 (Moscone)
Jose L. Rincon; Carlos Palomino; Claudio Orlich; Edgardo Carreño; Arnaldo Espaillat
23-206. ASCRS Course 23-206: Surgical Management of Challenging Cases (Presented in Spanish)
10:00 AM – 11:30 AM; Room 306 (Moscone)
Claudia Palacio; Oscar Guerrero-Berger; Virgilio Centurión; Luis Escaf; Leticia Arroyo-Muñoz; Ana Beatriz Medina Pérez; Arnaldo Espaillat; Santiago Garcia Arroyo; Evangelia Stangogiannis-Druya
S-21. ASCRS Symposium S-21: The Best of the ASCRS (Presented in Spanish)
1:00 PM – 2:30 PM; Room 132-133 (Moscone)
Carlos L. Nicoli; Virgilio Centurión; Jaime Macías Martínez; Rafael Castañeda; Arturo Maldonado-Junyent; Santiago Garcia Arroyo; Oscar Guerrero-Berger; Edgardo Carreño; Narlly Ruiz-Quintero; Sábastian Onnis; Crisanti Stagogiannis; Enrique O. Graue-Hernandez; Valeria Sánchez-Huerta; Bruna V. Ventura; Evangelia Stangogiannis-Druya; Fernando L. Soler; Oscar V. Asís
ALACCSA-R / LASCRS in Pan American & Brazilian Congress of Ophthalmology, Rio de Janeiro, August 07 – 10, 2013
ALACCSA-R Program
“The Best of Cataract and Refractive Surgery in 2013” ALACCSA-R (120 min)
OS
Moderadores: William De La Peña, Virgilio Centurión, Armando Crema
Panel de Discusión: Paulo Cesar Fontes, Nestor Gullo, José Luís Rincon, Marcos Rey, José Antonio Claros
Faco Tip – Chop – Cesar Carriazo
Cirugía de catarata asistida con Láser de Femtosegundo – Edgardo Carreño
Iris suture fixation, my experience – Newton Andrade Jr.
Cirurgia da catarata em nanoftalmia – Fernando Trindade
Facoemulsificación en córneas patológicas – Miguel Angelo Padilha
Lentes Rayner M-flex near y far: experiencia personal – Marcelo Ventura
Utilidad de la Vitrectomía Anterior por Pars Plana en cirugía de catarata – Arnaldo Espaillat
II – Refractive Surgery
Moderadores: María José Cosentino, Mauro Campos, Miguel Srur
Panel de Discusión: Sergio Kwitko, Luís Izquierdo, Carmen Barraquer
The role of epithelial thickness in refractive surgery – Marcelo Netto
Complicaciones limbicas del cross linking corneal – Ramon Naranjo
LASIK for Presbyopia in emmetropic patients – María José Cosentino.
Corneal Inlay for presbyopia: is it safe? – Marcony Santhiago
Lasik em casos especiais – Waldir Portelinha
Lamellar endothelium transplant and multifocal IOL – Walton Nosé
“Casos Dificiles en Cirugía de Catarata y Refractiva” (90 min)
Moderadores: Luís Escaf, Enrique Suarez, César Carriazo
Panel de Discusión: Ronaldo Cavalcanti, Werner Zacharias, Ana Luisa Hoffing Lima
Caso 1 Leticia Arroyo
Caso 2 Leonardo Akaishi
Caso 3 José Manuel Vargas
Caso 4 Eduardo Chávez M
Caso 5 Edna Almodin
Caso 6 Pablo Suarez
Caso 7 Crisanti Stangogiannis
Caso 8 Arnaldo Espaillat
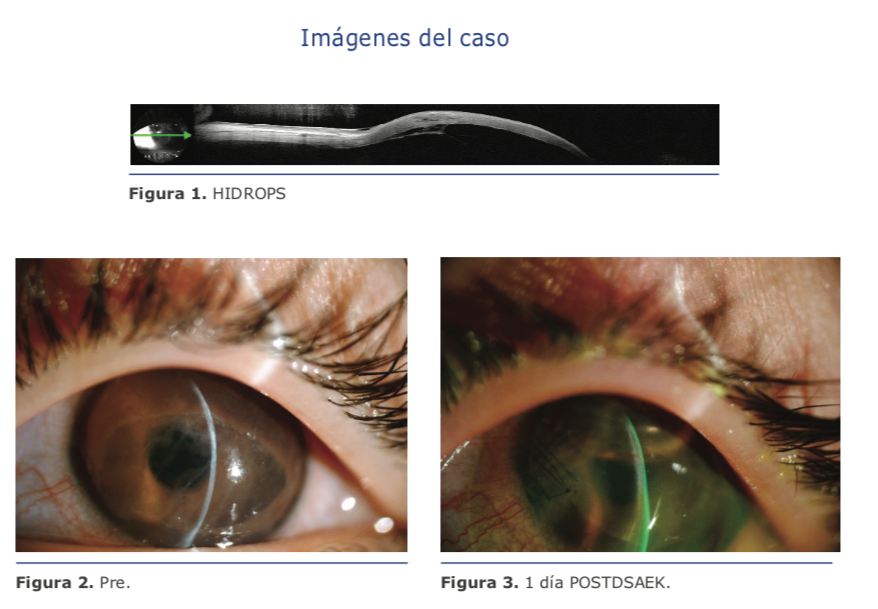



 Además del dispositivo de ultrasonido digital Insight 100 VHF (ArcScan Inc, Golden, CO), ahora también puede medirse el espesor epitelial mediante sistemas de OCT, especialmente el RTVue − Avanti (Opto-vue, Fremont, CA) y el MS-39. Es de amplio conocimiento que en el queratocono ocurren cambios del espesor epitelial, puesto que curvaturas extremas conducen a la ruptura del epitelio, como se observa a menudo del punto de visto clínico. El adelgazamiento epitelial sobre el cono se ha demostrado mediante análisis histopatológico de córneas con queratocono (Scroggs et al.33) y, posteriormente (Haque et al.34), mediante software personalizado y un sistema de OCT HumphreyZeiss (Humphrey Systems, Dublín, California).
Además del dispositivo de ultrasonido digital Insight 100 VHF (ArcScan Inc, Golden, CO), ahora también puede medirse el espesor epitelial mediante sistemas de OCT, especialmente el RTVue − Avanti (Opto-vue, Fremont, CA) y el MS-39. Es de amplio conocimiento que en el queratocono ocurren cambios del espesor epitelial, puesto que curvaturas extremas conducen a la ruptura del epitelio, como se observa a menudo del punto de visto clínico. El adelgazamiento epitelial sobre el cono se ha demostrado mediante análisis histopatológico de córneas con queratocono (Scroggs et al.33) y, posteriormente (Haque et al.34), mediante software personalizado y un sistema de OCT HumphreyZeiss (Humphrey Systems, Dublín, California).
























































