Dr. Antonio Méndez Noble
Es importante remarcar los avances que ha tenido la cirugía refractiva. Por lo pronto no es tiempo de hablar de miopía, hipermetropía y/o astigmatismo. Nuestra nueva frontera la hemos alcanzado con temas de presbicia.
Como lo hemos visto en otros tiempos es importante tener en cuenta las características de nuestro paciente a tratar. Donde se abren una serie de opciones de tratamiento. Conocer y saber aplicar cada una de ellas es importante, ya que nuestro paciente, como siempre es el caso en cirugía refractiva, no está enfermo y solo requiere de gafas.
De esta manera se aborda el tema con dos expertos en cirugía refractiva en una zona en el noroeste de
México, Tijuana B. C. caracterizada entre otras cosas por su gran turismo médico en cirugía refractiva.
Dr. Edgar A. González
¿Cuándo escoge un lente multifocal para el manejo de la presbicia?
- Paciente con catarata
- Paciente hipermétrope
- Mayor de 50 años
- Sin patología ocular agregada
Todas las anteriores
Comentario:
En el tratamiento de presbicia con implante de lente intraocular una de las principales indicaciones es la edad del paciente mayor a 60 años, ya que diversos estudios reportan una mayor incidencia de desprendimiento de retina regmatógeno (DRR) en personas menores a 60 años (0.50%), comparado con pacientes mayores a 75 años, donde la incidencia disminuye significativamente (0.04%)1,2. Considerando otros factores de riesgo para DRR posterior a cirugía de catarata hay que mencionar la longitud axial (LA) mayor a 25 mm, en donde se reporta aumento de la incidencia de esta complicación en comparación con LA < 23.73 mm (p <0.001)2, por lo que pacientes hipermétropes presentan menor riesgo de esta complicación. En éste sentido vale la pena mencionar la necesidad de una revisión adecuada de la retina periférica para descartar la presencia de lesiones predisponentes que puedan aumentar el riesgo de DRR antes y posterior a la cirugía3,4,5.
Otro criterio a cumplir es la ausencia comorbilidades sistémicas y oculares, que pueden ser contraindicación relativa o absoluta de implante de lente intraocular multifocal, principalmente aquellas que tienen el potencial de afectar de manera negativa la sensibilidad al contraste, como diabetes mellitus, glaucoma, o alteraciones de superficie ocular como son síndrome de ojo seco y blefaritis que deben ser evaluados y tratados previamente al procedimiento quirúrgico1.
Dra. Ned Davila Avila
¿Cuándo escoge un lente multifocal para el manejo de la presbicia?
- Paciente con catarata
- Paciente hipermétrope
- Mayor de 50 años
- Sin patología ocular agregada
Todas las anteriores
Comentario:
Mi paciente candidato ideal es un paciente hipermétrope con catarata sintomática, mayor de 50 años, ¿por qué? Está descrito que la incidencia de desprendimientos de retina es mayor en los sujetos menores de 50 años operados de cirugía de catarata que en pacientes mayores, cabe destacar que el riesgo es acumulativo con el tiempo, aproximadamente 2,3 veces mayor comparado con el riesgo basal1.
Las personas con defectos refractivos hipermetrópicos tienen alto porcentaje de satisfacción con lentes multifocales (algunos reportes entre 84.3 y 93.56) 2-3, esto puede estar relacionado con la dependencia de anteojos prequirúrgicos tanto para visión lejana y cercana.
Por otro lado, es importante considerar que “los lentes premium son para pacientes con ojos premium”. Como parte de la valoración general recomiendo tratar ojo seco (en caso de que el paciente tenga), medir aberraciones corneales de alto orden, tamaño pupilar, ya que pueden tener impacto negativo en la sensibilidad al contraste y disfotopsias3,4,5. También descartar padecimientos en la retina como retinopatía diabética, degeneración macular relacionada con la edad y las membranas epirretinianas, que aunque se consideran contraindicaciones relativas podrían tener un impacto negativo en el desempeño del lente multifocal4.
Dr. Edgar A. González
¿Cuándo está indicada la cirugía corneal para presbicia?
- Entre los 40 y 50 años de edad
- Pacientes hipermétropes mejores de 3 Dioptrías
- Toleran monovisión
- Pacientes con cristalino transparente
Todas las anteriores
Comentario:
Existen hoy en día diversas técnicas quirúrgicas para la corrección de presbicia a través de la aplicación de láser excimer y en general las podemos dividir en tres grupos:
-Monovisión: Un ojo se trata para enfocar de lejos (ojo dominante) y el otro ojo enfoca para cerca (ojo no dominante), las cuáles se reportan con una tasa de éxito de entre el 50 y 75% según la serie revisada1,2.
-Cirugías que a través de un perfil de ablación específico incrementan la profundidad de foco, un ejemplo de éstas técnicas es el Presbyond, la cuál induce un cambio controlado en la asfericidad corneal y en la aberración esférica, dejando el ojo dominante emétrope, y el ojo no dominante con una refracción de -1.50 D. Ésta es la cirugía que personalmente ofrezco para tratamiento de presbicia, puesto que en la literatura han reportado buenos resultados: AV binocular de 20/25 o mejor en el 99 – 100% de los casos y visión cercana > J3 en el 95 a 99% de los casos3, estadística que he podido comprobar con los casos que he tratado.
-Cirugías de ablación multifocal. Se ablaciona un área corneal central corregida para lejos y un área en periferia media corneal corregida para cerca (asfericidad negativa)3,4.
Es necesario mencionar qué en cualquier caso, los criterios de cirugía no difieren en cuánto a las características a cumplir como cualquier otra cirugía láser, entiéndase una topografía corneal normal, refracción estable, y ausencia de enfermedades oculares, como ojo seco, presencia de catarata, infecciones actuales o previas, como herpes5; y sistémicas; así como el uso de medicamentos, que contraindiquen el procedimiento. Una vez cumplidos estos criterios el paciente ideal es aquel que presente presbicia manifiesta, acompañando de un error refractivo para la visión lejana por lo que la edad idónea para estos procedimientos es en pacientes menores a 50 años y mayores de 40. El rango de error refractivo tratable en estos procedimientos se ha descrito de miopía de -8.00 D hasta hipermetropía de +3.00 D3; pacientes con refracciones fuera de este rango pudieran no tener una buena satisfacción.
Además de la valoración antes mencionada es sumamente importante valorar las necesidades del paciente y su personalidad, determinar el ojo preferente, así como la tolerancia a la monovisión, esto nos ayudará a estimar la capacidad de neuroadaptación y detectar pacientes que sean visualmente demandantes con expectativas poco realistas6.
Dra. Ned Davila Avila
¿Cuándo está indicada la cirugía corneal para presbicia?
- Entre los 40 y 50 años de edad
- Pacientes hipermétropes mejores de 3 Dioptrías
- Toleran monovisión
- Pacientes con cristalino transparente
Todas las anteriores
Comentario:
La cirugía corneal para tratar presbicia tiene lugar en aquellos pacientes con cristalino transparente considerados jóvenes para realizar una cirugía de catarata.
Existen varias estrategias para lograr mejorar la visión cercana, hablando de la monovisión realizada con Lasik o PRK, el ojo dominante se corrige a la emetropía y el ojo no dominante con un target variable, usualmente entre -1.50 y -2.0 con previa prueba de tolerancia. Actualmente se sabe que cuando el desenfoque monocular del ojo no dominante alcanza 2.5 dioptrías o más, existe una disminución significativa de la sensibilidad al contraste y se inhibe la binocularidad, seguido de supresión que vuelve al sistema óptico monofocal (más complicado de tolerar). Sin embargo, disminuir la cantidad de anisometropía disminuye la visión cercana 1,2.
Por otro lado, en mi práctica clínica utilizo la cirugía Presbyond ® que combina el efecto de micro-monovisión (ojo no dominante con target -1.5 D, ojo derecho calculado a emetropía) y modifica la aberración esférica corneal para aumentar la profundidad de foco. Con este tratamiento los pacientes hipermétropes adquieren una visión sin corrección lejana de 20/20 o mejor en el 98.5% y una agudeza visual cercana sin corrección de J2 o mejor en el 95.6% de los casos, aunque también ha demostrado buen desempeño en pacientes emétropes y con astigmatismo miópico 1,2,3.
Un paciente administrador en compañía transnacional, que llega a consulta por no ver bien de cerca, tiene 45 a. de edad, AV binocular de 20/25 mejora a 20/20 con +1.00 esférico en cada ojo. Con esa corrección mejora visión cercana a J2, requiere de +1.00 para ver cómodamente J1. Sin lentes ve J3 y no quiere usar gafas. ¿Qué hacen en esta situación?
Dr. Edgar A. González
Se le indican gafasMedicamento mióticoLentes de contactoLasik- Lente multifocal / EDOF
- Implante corneal.
Comentario:
A mi criterio considero que éste paciente no es un buen candidato a una corrección quirúrgica, debido a varios factores. Como primer punto podría considerarse que el paciente es emétrope y su único problema es la presbicia, aunque deberíamos evaluar la refracción bajo cicloplejia debido a que es probable que presente hipermetropía latente, caso en el cuál podríamos platicar con el paciente sobre la posibilidad de un tratamiento en otro momento, cuando presente aumento de la hipermetropía manifiesta con consecuente disminución de la AV lejana y dependiendo de la edad en la que ésto se presente podríamos considerar en su momento cirugía láser o implante de lente multifocal /EDOF, pero en este momento no consideraría ninguno de éstos tratamientos. Por el contrario, podríamos iniciar con tratamientos menos invasivos que podrían ir desde el uso de gafas, que además nos ayudarían a lograr que se manifieste su hipermetropía, uso de lente de contacto, que en caso de tolerar monovisión, se podría hacer con lente de contacto, o en su caso lente de contacto multifocal. Otra opción viable y que ha demostrado tener cierta tasa de éxito es el tratamiento de pilocarpina a dosis bajas (1.25%, una aplicación al día), en donde se ha observado mejoría de 3 líneas de visión cercana en el 30.7% de los pacientes, comparado con placebo (8.1%)3.
Independientemente de las opciones, es importante explorar las necesidades y expectativas del paciente, que es lo que espera de la cirugía, y en nuestro caso exponerle los probables resultados que podemos obtener, así de ésta manera llegar con él a una decisión que sea benéfica y viable.
Un paciente administrador en compañía transnacional, que llega a consulta por no ver bien de cerca, tiene 45 a. de edad, AV binocular de 20/25 mejora a 20/20 con +1.00 esférico en cada ojo. Con esa corrección mejora visión cercana a J2, requiere de +1.00 para ver cómodamente J1. Sin lentes ve J3 y no quiere usar gafas. ¿Qué hacen en esta situación?
Dra. Ned Davila Avila
- Se le indican gafas
- Medicamento miótico
- Lentes de contacto
Lasik- Lente multifocal / EDOF
- Implante corneal.
Comentario:
Los pacientes más desafiantes para el tratamiento de presbicia son el grupo de emétropes (Agudeza visual 20/25 o mejor), esto se debe a que suelen tener grandes expectativas visuales por tener una buena visión lejana y no acostumbran a utilizar lentes, por lo tanto la exigencia visual en el postoperatorio es alta.
Parte de la valoración preoperatoria incluye explicar de manera detallada a los pacientes un panorama real de lo que pueden ofrecer estas cirugías y sus posibles efectos no deseados como disminución de la calidad visual lejana.
En el caso de los tratamientos no quirúrgicos, una de las opciones es el tratamiento con pilocarpina, que puede inducir miosis y contracción del cuerpo ciliar que también ayudaría en la acomodación del cristalino. El uso diario de clorhidrato de pilocarpina solución oftálmica al 1,25% en monoterapia es el régimen que ha sido aprobado por la FDA de EE. UU. Su uso ha sido controvertido, ya que se han reportado algunas asociaciones entre el inicio del tratamiento con pilocarpina al 1,25% con casos de desprendimiento de retina (3 ojos de 2 pacientes) 1,2.
Respecto al tratamiento de lasik presbyond ® en pacientes emétropes, es complicada la inducción de aberración esférica por la cantidad de refracción a tratar, pero se realiza un protocolo de micro-monovisión asférica, sin embargo, se le atribuye a la micro-monovisión la mejoría de la visión cercana. Esto es respaldado con los resultados de Reinstein, et al, 2012, donde encontraron que los ojos dominantes tratados para visión lejana, solo 34% tuvo visión cercana de J7 o mejor, comparada con los ojos no dominantes, donde el 94% vió J2 o mejor 3.
Mi manejo en este contexto sería un lasik para presbicia. Sugiero en este grupo en especifico, realizar prueba de tolerancia ambulatoria con lentes de contacto con el target -1.5 D en el ojo no dominante, ya que se ha reportado un porcentaje de retratamientos en este grupo del 11.8% y post quirúrgicamente hasta 3.4% de los pacientes no toleraron la micro-monovisión 3.
1 Referencias
Jorge L. Alio, Ana B. Plaza-Puche, Roberto Férnandez-Buenaga, Joseph Pikkel, Miguel Maldonado, Multifocal intraocular lenses: An overview, Surv Ophthal, 2017, Volume 62, 611-34.
Thylefors, J., Jakobsson, G., Zetterberg, M. and Sheikh, R. (2022), Retinal detachment after cataract surgery: a population-based study. Acta Ophthalmol, 100: e1595-e1599.
Haug SJ & Bhisitkul RB (2012): Risk factors for retinal detachment following cataract surgery. Curr Opin Ophthalmol 23: 7–11.
Behndig A, Montan P, Stenevi U, Kugelberg M & Lundstrom M: One million cataract surgeries: Swedish National Cataract Register 1992-2009. 2011, J Cataract Refract Surg 37: 1539–1545.
Clark A, Morlet N, Ng JQ, Preen DB & Semmens JB (2012): Risk for retinal detachment after phacoemulsification: a whole-population study of cataract surgery outcomes. Arch Ophthalmol 130: 882–888
2 Referencias
Olsen T, Jeppesen P. The incidence of retinal detachment after cataract surgery. Open Ophthalmol J. 2012;6:79-82. doi: 10.2174/1874364101206010079. Epub 2012 Sep 7. PMID: 23002414; PMCID: PMC3447164.
Galvis V, Escaf LC, Escaf LJ, et al. Visual and satisfaction results with implantation of the trifocal Panoptix® intraocular lens in cataract surgery. J Optom. 2022;15(3):219-227. doi:10.1016/j.optom.2021.05.002
Nicula CA, Popescu R, Rednik AM, Nicula D, Bulboaca AE, Stanescu I. Refractive Lens Exchange in Hyperopic Presbyopes with the Acrysof IQ Panoptix Intraocular Lens: One-Year Results and Analysis of the Literature. Ther Clin Risk Manag. 2020;16:1125-1137. Published 2020 Nov 19. doi:10.2147/TCRM.S279065
Grzybowski A, Kanclerz P, Tuuminen R. Multifocal intraocular lenses and retinal diseases. Graefes Arch Clin Exp Ophthalmol. 2020 Apr;258(4):805-813. doi: 10.1007/s00417-020-04603-0. Epub 2020 Jan 18. PMID: 31955239; PMCID: PMC7575463.
Fernández J, Alfonso Sánchez JF, Nieradzik M, Valcárcel B, Burguera N, Kapp A. Visual performance, safety and patient satisfaction after bilateral implantation of a trifocal intraocular lens in presbyopic patients without cataract. BMC Ophthalmol. 2022;22(1):341. Published 2022 Aug 10. doi:10.1186/s12886-022-02556-y
3 Referencias:
Jain S et al. Success of monovision in presbyopes: review of the literature and potential applications to refractive surgery. Surv Ophthalmol 1996; 40:491-499
Garcia-Gonzalez M et al. Visual outcomes of LASIK-induced monovision in myopic patients with presbyopia. Am J Ophthalmol 2010; 150 (3):381-6.
Stival LR et al. Presbyopic Laser Excimer Ablation: A Review. J Refract Surg 2018; 34(10):698-710.
Ryan A, O’Keefe M. Corneal approach to hyperopic presbyopia treatment: six-month outcomes of a new multifocal excimer laser in situ keratomileusis procedure. J Cataract Refract Surg. 2013;39:1226-1233.
René Moreno, A. Miguel Srur, B. Carlos Nieme, Cirugía refractiva: indicaciones, técnicas y resultados, Revista Médica Clínica Las Condes, Volume 21, Issue 6, 2010. Pages 901-910,
Jorge L. Alio, Ana B. Plaza-Puche, Roberto Férnandez-Buenaga, Joseph Pikkel, Miguel Maldonado, Multifocal intraocular lenses: An overview, Surv Ophthal, 2017, Volume 62, 611-34
4 Referencias:
Reinstein DZ, Couch DG, Archer TJ. LASIK for hyperopic astigmatism and presbyopia using micro-monovision with the Carl Zeiss Meditec MEL80 platform. J Refract Surg. 2009 Jan;25(1):37-58. doi: 10.3928/1081597X-20090101-07. PMID: 19244952.
Reinstein DZ, Archer TJ, Gobbe M. LASIK for Myopic Astigmatism and Presbyopia Using Non-Linear Aspheric Micro-Monovision with the Carl Zeiss Meditec MEL 80 Platform. J Refract Surg. 2011 Jan;27(1):23-37. doi: 10.3928/1081597X-20100212-04. Epub 2010 Mar 1. PMID: 20205360.
Reinstein DZ, Carp GI, Archer TJ, Gobbe M. LASIK for presbyopia correction in emmetropic patients using aspheric ablation profiles and a micro-monovision protocol with the Carl Zeiss Meditec MEL 80 and VisuMax. J Refract Surg. 2012 Aug;28(8):531-41. doi: 10.3928/1081597X-20120723-01. PMID: 22869232.
5 Bibliografía:
Ryan A, O’Keefe M. Corneal approach to hyperopic presbyopia treatment: six-month outcomes of a new multifocal excimer laser in situ keratomileusis procedure. J Cataract Refract Surg. 2013;39:1226-1233.
Jorge L. Alio, Ana B. Plaza-Puche, Roberto Férnandez-Buenaga, Joseph Pikkel, Miguel Maldonado, Multifocal intraocular lenses: An overview, Surv Ophthal, 2017, Volume 62, 611-34
Waring GO 4th, Price FW Jr, Wirta D, McCabe C, Moshirfar M, Guo Q, Gore A, Liu H, Safyan E, Robinson MR. Safety and Efficacy of AGN-190584 in Individuals With Presbyopia: The GEMINI 1 Phase 3 Randomized Clinical Trial. JAMA Ophthalmol. 2022 Apr 1;140(4):363-371.
6 Referencias:
Grzybowski, A.; Ruamviboonsuk, V. Pharmacological Treatment in Presbyopia. J. Clin. Med. 2022, 11, 1385. https://doi.org/ 10.3390/jcm11051385
Al-Khersan H, Flynn HW Jr, Townsend JH. Retinal Detachments Associated With Topical Pilocarpine Use for Presbyopia. Am J Ophthalmol. 2022;242:52-55. doi:10.1016/j.ajo.2022.05.011
Reinstein DZ, Carp GI, Archer TJ, Gobbe M. LASIK for presbyopia correction in emmetropic patients using aspheric ablation profiles and a micro-monovision protocol with the Carl Zeiss Meditec MEL 80 and VisuMax. J Refract Surg. 2012 Aug;28(8):531-41. doi: 10.3928/1081597X-20120723-01. PMID: 22869232
 Dra. Alexandra Abdala Figuerola
Dra. Alexandra Abdala Figuerola  Dra. Angela María Gutierrez
Dra. Angela María Gutierrez  Dr. Luis Fernando Mejía
Dr. Luis Fernando Mejía 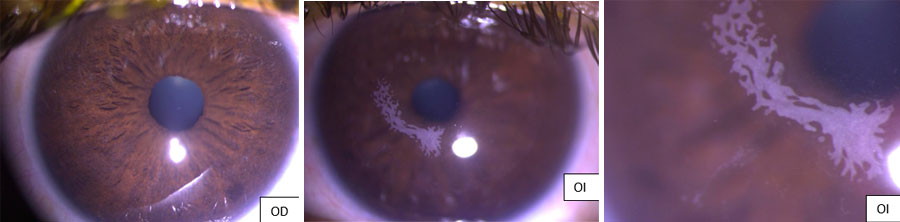 Foto Clínica
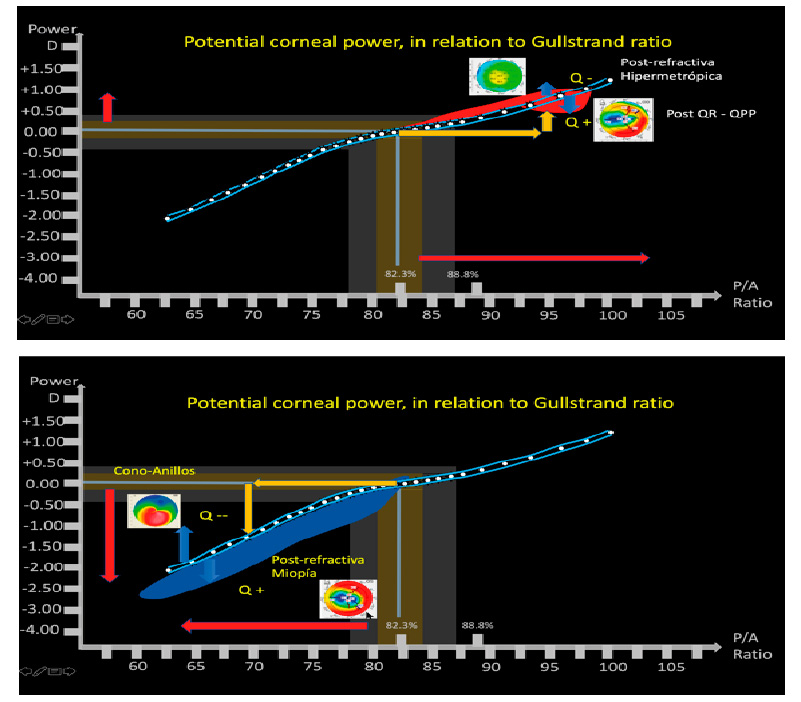
Foto Clínica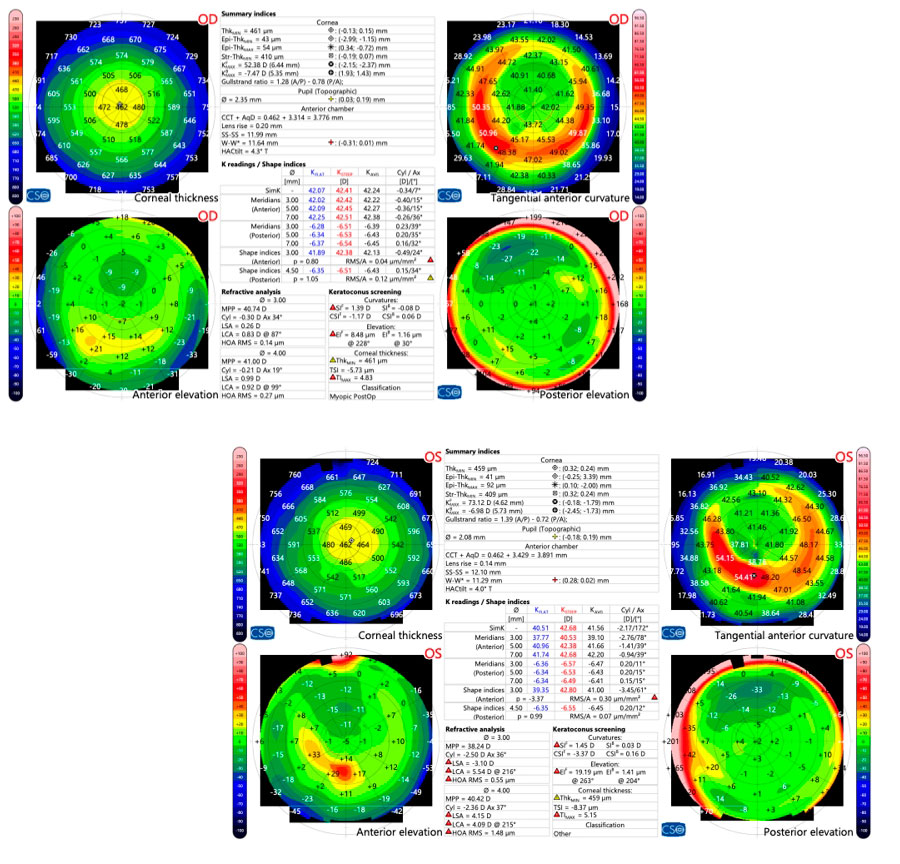 Topografía corneal
Topografía corneal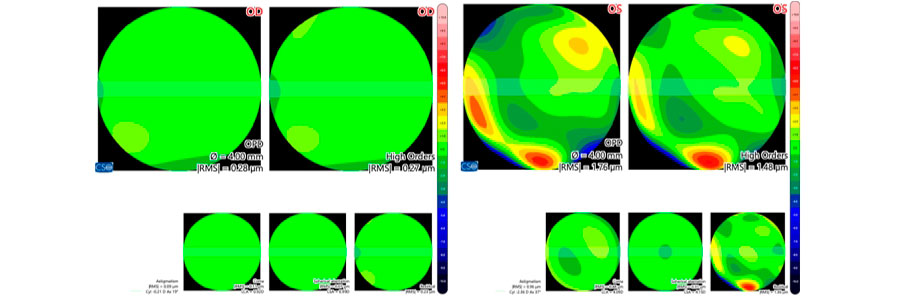 Aberrometría
Aberrometría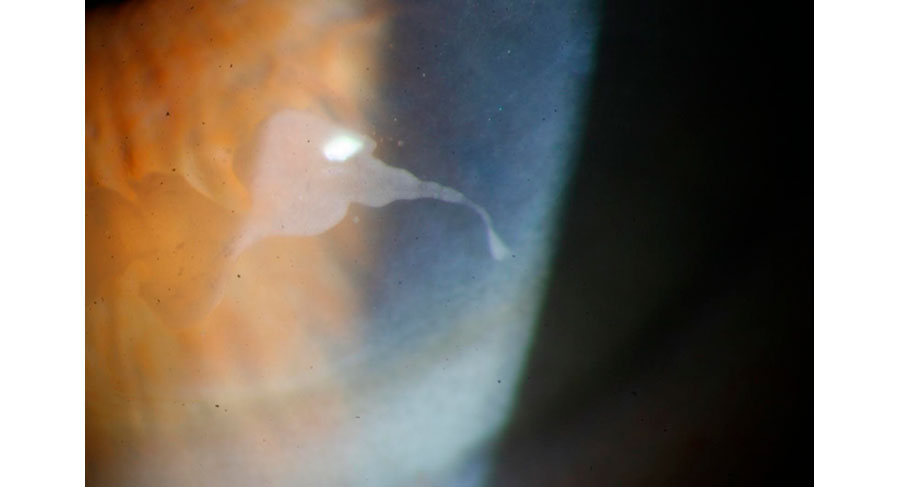 Foto A
Foto A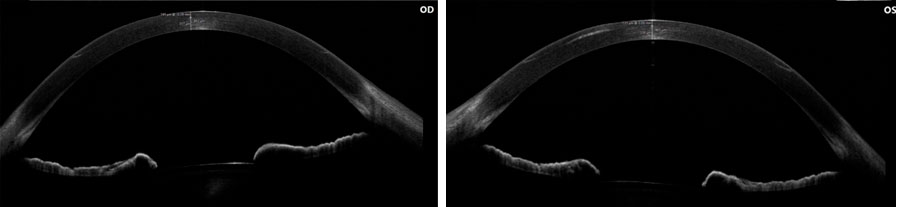



 Dr. Antonio Méndez Noble
Dr. Antonio Méndez Noble Dr. Edgar A. González
Dr. Edgar A. González Dra. Ned Davila Avila
Dra. Ned Davila Avila


 Dr. Gustavo Espinoza
Dr. Gustavo Espinoza

 Dr. Manuel Alejandro Garza León – México
Dr. Manuel Alejandro Garza León – México 


 Dr. Virgilio Centurión, MD – Brasil
Dr. Virgilio Centurión, MD – Brasil Dra. Bruna Ventura, MD PhD – Brasil
Dra. Bruna Ventura, MD PhD – Brasil Personal
Personal



 Zapata María Florencia, Córdoba, Argentina
Zapata María Florencia, Córdoba, Argentina









 José Miguel Varas, MD – Ecuador
José Miguel Varas, MD – Ecuador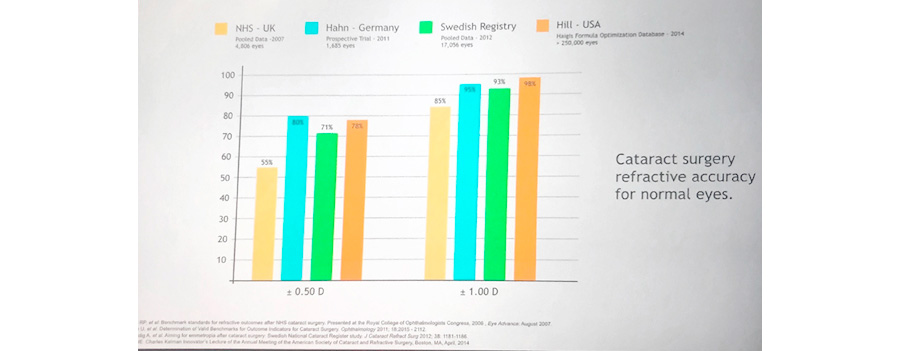 Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)
Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)