Resumen
El cálculo del tamaño de ICL a implantar en la cirugía refractiva intraocular continúa siendo desafiante para los cirujanos. Múltiples fórmulas y nomogramas se han propuesto para predecir el tamaño de lente ideal minimizando así el error del vault postoperatorio.
La posibilidad de ver y conocer la anatomía intraocular in vivo mediante distintos avances tecnológicos permite hoy en día conocer las variables que determinan la inserción final del lente y por ende predecir el vault esperado. La fórmula más precisa en predicción del vault está basada en el diámetro interno del cuerpo ciliar.
Equipos de ultrabiomicroscopía de alta resolución y operador independiente logran identificar la inserción del ICL y sus variaciones, simétrica sobre el cuerpo ciliar o sobre el sulcus, o asimétrica sobre el cuerpo ciliar y el sulcus. Esto tendrá una fuerte repercusión en el diseño futuro del ICL así como en la técnica quirúrgica a implementar.
Conflicto de intereses
FLG y FA no presentan conflicto de intereses.

Dr. Dan Reinstein
El Dr. Reinstein es consultor de Carl Zeiss Meditec (Carl Zeiss Meditec AG) y tiene un interés financiero en la tecnología Artemis Insight 100 (ArcScan, Inc.) a través de patentes administradas por el Cornell Center for Technology Enterprise and Commercialization (CCTEC), Ithaca, Nueva York.

Dr. Fernando Arasanz
Introducción
La utilización de lentes fáquicos de colámero implantables (ICL Staar Visian Implantable Collamer Lens, Staar Surgical) ha demostrado ser una técnica refractiva segura, efectiva y predictiva frente a un gran rango de errores refractivos.1 2 Su rápida recuperación, excelente calidad visual, la preservación de la acomodación, su reversibilidad, su menor incidencia de ojo seco, y su costo hacen que el ICL gane indicación frente el excimer láser en muchos casos.3 Asimismo, por las mínimas aberraciones de alto orden y al no requerir de ablaciones corneales, la colocación de ICL es siempre la primera opción frente a miopías elevadas. 4 5
El ICL es una lente intraocular diseñada en distintos diámetros (12,1, 12,6, 13,2 y 13,7mm) para quedar posicionada en la cámara posterior por debajo del iris y por delante del cristalino. El tamaño del ICL seleccionado y la posición final del mismo generará el vault, término utilizado para nombrar la distancia entre el lente y la superficie anterior del cristalino. Staar recomienda un vault entre 250 y 750 µm, siendo el vault ideal de 500 µm.6 7 8 Es por lo tanto indispensable conocer esta anatomía para evitar complicaciones.
Importancia de la predicción del vaulting
La importancia en la selección del tamaño del ICL y evitar un vault inapropiado se basa en minimizar las posibles complicaciones postoperatorias asociadas. Un bajo vault (≤50-230 µm) puede llevar al contacto mecánico entre el lente y el cristalino, así como a una inadecuada circulación del humor acuoso, generando la posibilidad de opacidad capsular anterior y formación de cataratas.9 10 Un vault elevado (>1000 µm) puede causar excesivo contacto mecánico entre el ICL y el iris, generando inflamación y aumento de la presión intraocular, síndrome de dispersión pigmentaria, atrofia de iris, y/o glaucoma agudo de ángulo cerrado.
Inicialmente se propusieron distintas fórmulas y nomogramas para determinar el diámetro del sulcus (STS) donde se colocaría el ICL. 15 16 17 18 19 Si bien la tradicional medición blanco a blanco (WTW) y la profundidad de la cámara anterior recomendada por STAAR surgical continúa siendo el método de cálculo más usado hoy en día para estimar el STS, es éste un pobre predictor del tamaño del vault,20 generando un 20% de casos fuera de lo aceptable.21
Indicaciones de explante de ICL
Dada la gran variedad de criterios y recomendaciones sobre un vault aceptable en la literatura, la decisión de seguir de cerca al paciente versus explantar el lente por un vault indebido en ausencia de complicaciones sigue siendo una decisión médica personal. Zeng y colaboradores definen como criterios de explante aquellos vaults inferiores a 100 µm o superiores a 1000 µm con una cámara estrecha con cierre angular en algún cuadrante o vaults mayores de 1000 µm sin ángulo estrecho pero con pupilas mayores a las prequirúrgicas con disfotopsias.22 23
Evolución de la customización del vaulting
En el 2000 Lovisolo y colaboradores sugieren que se use el sulcus-a-sulcus (STS) para calcular el tamaño de ICL que se implante.24 25 Luego Dan Reinstein y colaboradores, en el 2009, ponen de manifiesto la baja correlación existente entre las mediciones del WTW, el ángulo a ángulo (ATA) y el STS.20 Al estimar el valor del STS desde del WTW, se observó un error de +/- 0,5 mm en el 38% de los casos, mientras que al estimarlo desde el ATA el mismo error se redujo a un 32,7%. Esta diferencia de 0,5mm implica un diámetro de ICL diferente.
Dougherty en el 2011 introdujo una fórmula de cálculo incorporando la medición del STS con ultra biomicroscopía (UBM).26 Reinstein y Lovisolo publicaron sus resultados del uso del STS, mostrando que en la mitad de casos, se escogería un tamaño diferente por uso del STS que por uso del WTW con el nomograma de STAAR, y logrando mucho menos de dispersión en las medidas del vault postoperatorio.27 En el 2012 Kojima suma, al cálculo del ICL, la distancia que existe entre el STS y el cristalino (STSL) también logrando mejores resultados; y obteniendo 11% de vaults excesivos.16 Estas mediciones fueron realizadas con equipos UBM con sondas sostenidas a mano alzada, lo que conlleva a que el centrado y el foco sean totalmente operador dependiente. Son útiles para estudiar la anatomía pero sus mediciones tienen muy baja reproducibilidad intraoperador.
Muchos factores pueden influir en el vault final luego del implante del ICL. Lee y colaboradores encuentran que la compresión horizontal del sulcus ciliar es un factor fundamental en la formación del vault pero que no logra predecir el vault de manera efectiva. 28 Trancon et al29 y Zeng et al30 demuestran que la anatomía del cristalino y sus cambios de curvatura afectan indirectamente el vaulting luego de la cirugía.
Desarrollo de nuevo equipamiento
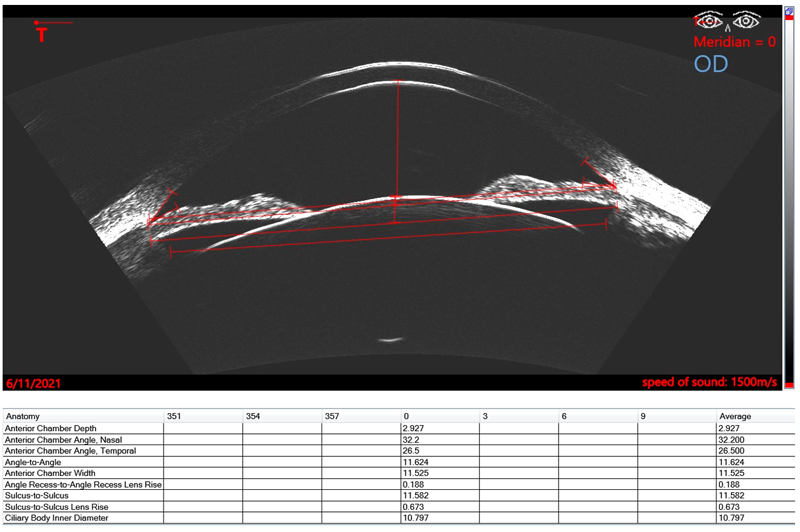
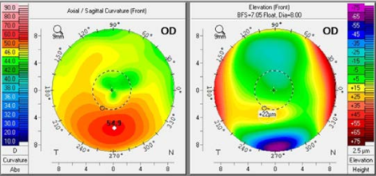
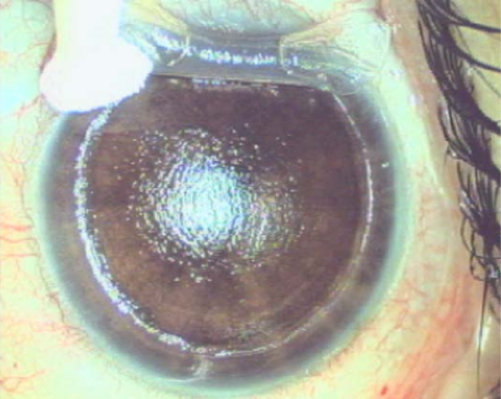
Figura 1. Insight 100 nuevo soft
Basado sobre el trabajo de Reinstein desde los años 90, cuando desarrollo la tecnología de ultrasonido de muy alta frecuencia digitalizado (VHF – very high frequency – digital ultrasound) para lograr el escaneo en arco dirigido para aumentar la precisión de medidas en la cornea y el segmento anterior, la compañía Arcscan comercializó esta tecnología Artemis para dar la posibilidad de medir los múltiples y distintos diámetros intraoculares propuestos en la cámara posterior. El Insight 100® de ArcScan Inc junto con el trabajo de Reinstein y colaboradores generó un cambio radical en la cirugía de ICL. En contraste a las maquinas UBM manejadas a mano alzada y trabajando en frecuencias más de 30-40MHz, el Insight 100 es un escáner robótico, con sonda VHF de 60MHz que produce una resolución de 1 µm y que permite realizar mapas epiteliales corneales y biometrías precisas del segmento anterior de forma rápida y confortable para el paciente. El foco del scan, centrado y seguimiento de la pupila es automático, así como el desplazamiento robotizado de la sonda, logrando obtener imágenes de los distintos meridianos. En el 2020 Reinstein propone una nueva fórmula basada sobre un parámetro nunca antes descrito para calcular el vault postoperatorio: el diámetro interno del cuerpo ciliar.31 El equipo Insight 100 permite que se pueda determinar los diámetros del sulcus (STS), de la cámara anterior (ATA), del cuerpo ciliar (CIBD – ciliary body iner diameter), y la elevación del cristalino a nivel del ATA y del STS. (Figura 1). En el website www.iclsizing.com, accesible de manera gratuita, el cirujano puede volcar estas mediciones y predecir el vault resultante con los distintos diámetros de lentes.
Confirmación de la posición final del ICL
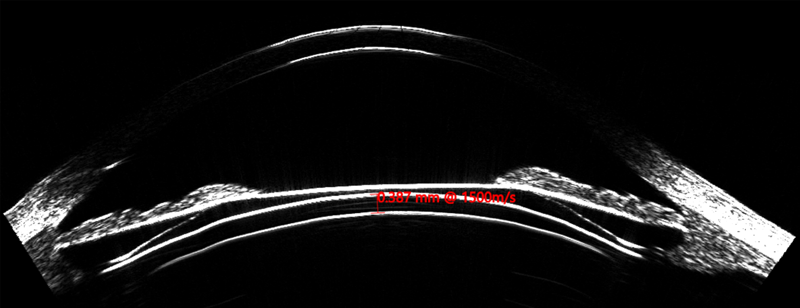
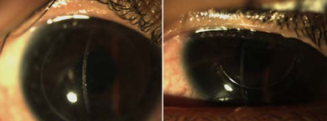
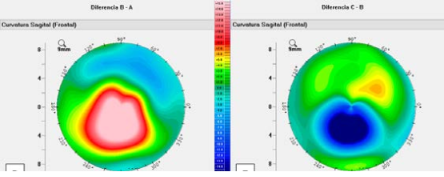
Figura 2. ICL inserción simetrica ciliar_Page_1
Asimismo, el ArcScan Insight 100 permite corroborar, en el postoperatorio, como se comportan los ICL por debajo del iris, visualizando si los implantes quedan simétricos con ambas hápticas en el sulcus o sobre el cuerpo ciliar (CB) (Figura 2); o son implantes asimétricos con una de las hápticas en el sulcus y la otra sobre el cuerpo ciliar. (Figura 3)
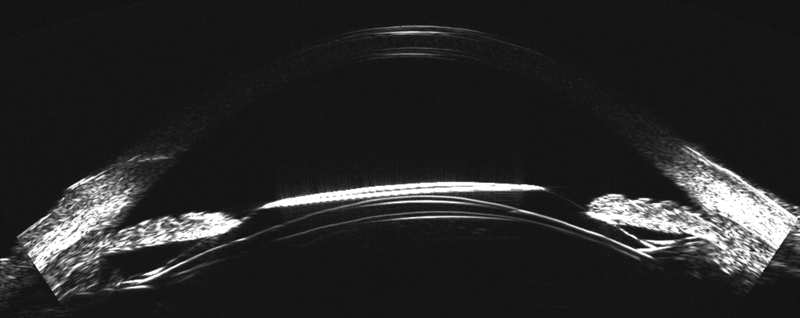
Figura 3. ICL Insercion asimetrica_Page_1
Casos Clínicos
Se evalúan los primeros 16 casos de ICL implantados por FA según el cálculo de iclsizing.com y utilizando el ArcScan Insight 100 para el cálculo biométrico realizados por FLG y FA.
Vault PostOperatorio
Al evaluar el vault a los 30 días postoperatorios en 16 casos de cirugías de ICL calculados mediante el ArcScan y realizados por el mismo cirujano (FA), se observó un vault +/- 100 µm del calculado en el 62,62% (n=10) de los casos; y un vault +/- 300 µm en el 87,50% (n=14) de los casos. (Figura 4)
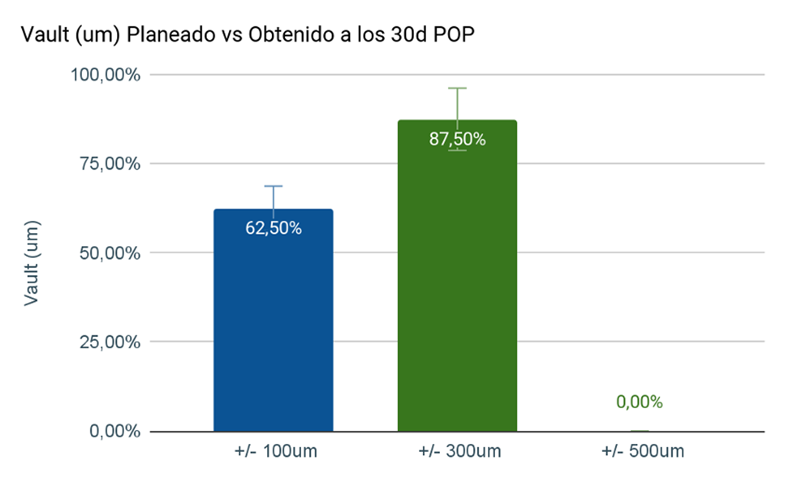
Figura 4. Vault
Posición final del lente
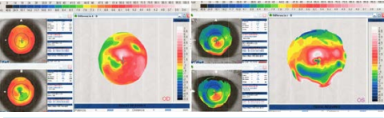
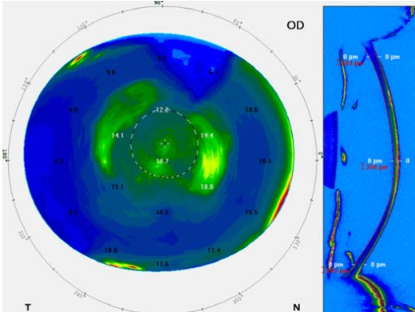
La posición final del ICL a los 30 días postoperatorios fue simétrica y sobre el CB en el 80% de los pacientes. El diámetro interno del CB es más pequeño que el diámetro del STS. Es por esto que la medición del CBID cumple un rol fundamental en el cálculo predictivo del vault. La compresión horizontal del ICL al implantarse en un diámetro más pequeño es mayor que si se situara en el sulcus. (Figura 5).
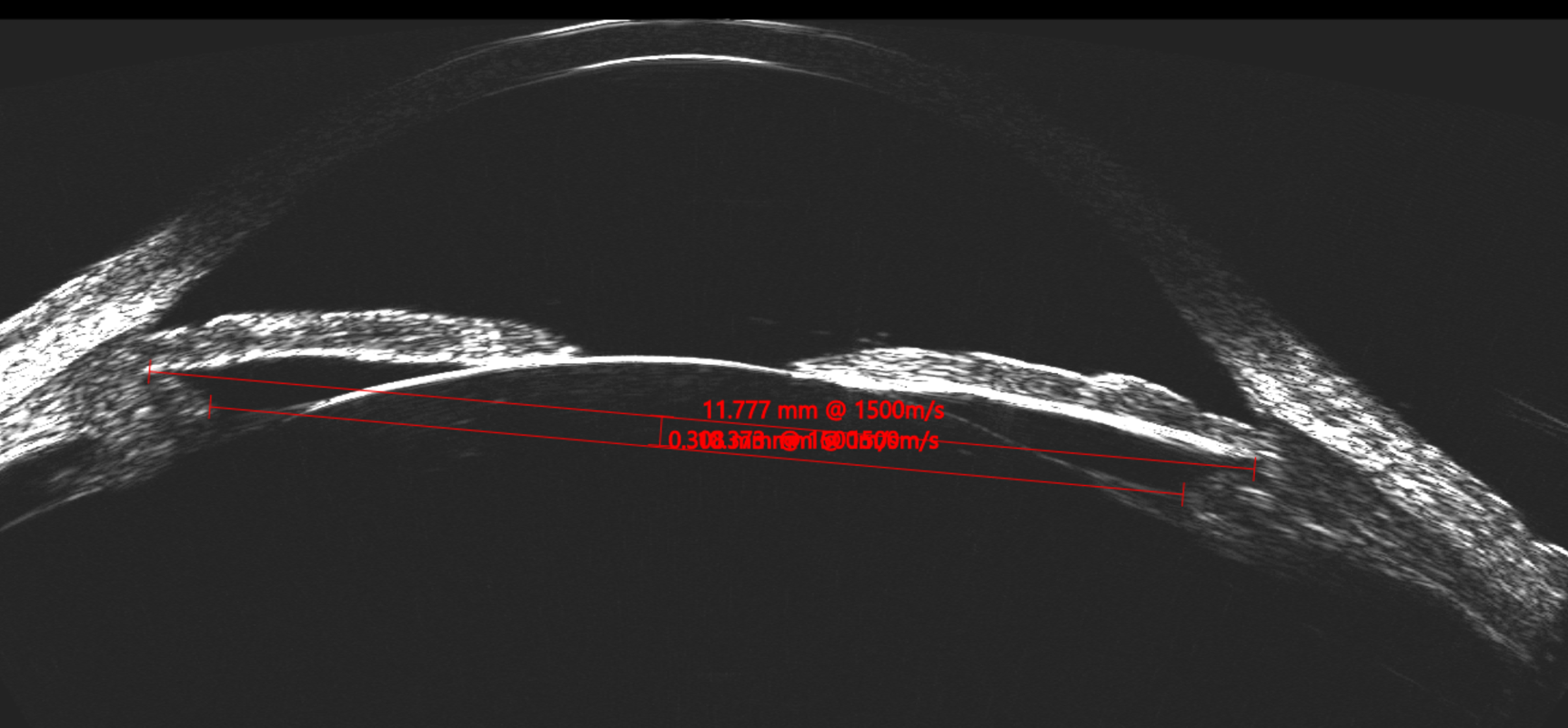
Figura 5. Insght 100 dif STS vs CB-CB_Page_1
Diámetros de ICL sugeridos por Staar vs Iclsizing.com
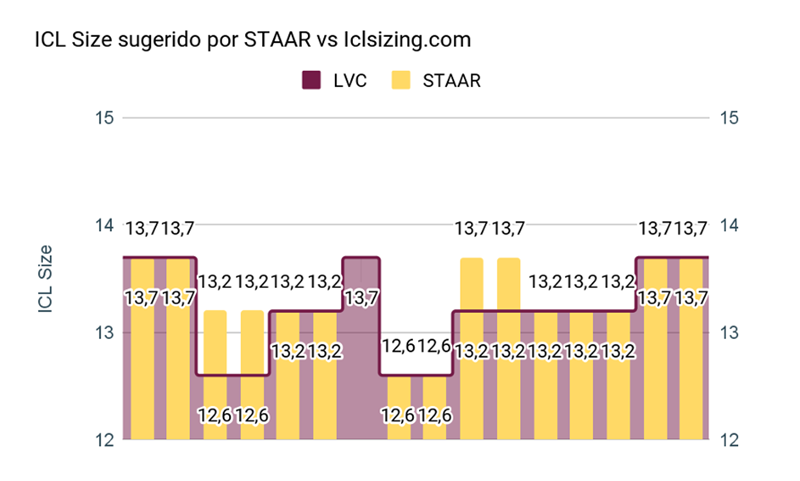
Figura 6. Size
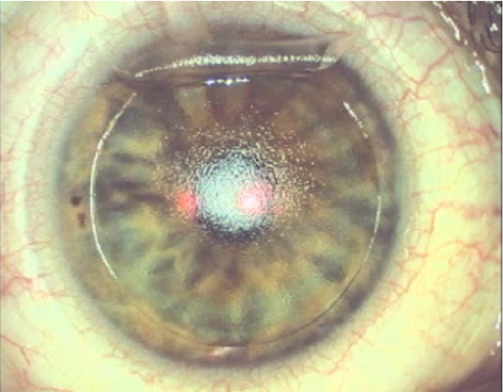
Al comparar el diámetro sugerido por STAAR vs. Iclsizing.com se pudo observar que el 31,25% (n=5) no coinciden, siendo Iclsizing.com quien propone un lente 0,5mm menor. (Figura 6). Un caso emblemático fue un paciente que consulta por ectasia bilateral post LASIK. Luego de un DALK en uno de los ojos y para corregir la ametropía residual decidimos implantar un ICL. Con un WTW de 13,00 mm STAAR no recomendaba el implante por encontrarse fuera de rango. A través del ArcSan Insight 100 y iclsizing.com los autores pudieron calcular un ICL tórico de 13,7 mm con un vault estimado de 669 µm. A los 30 días POP el paciente presentaba un vault de 690 µm. (Figura 7)
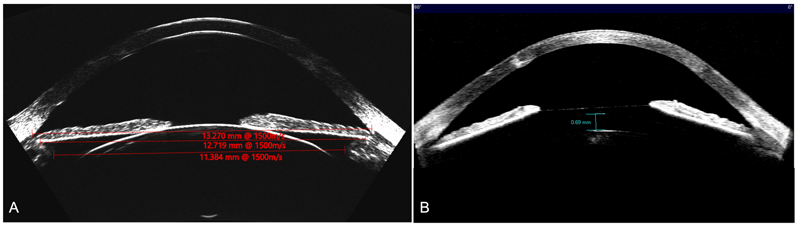
Figura 7. A_B
Conclusión
El uso del ICL ha demostrado ser seguro y efectivo a través del tiempo a partir de múltiples estudios científicos. Establecida la técnica quirúrgica, el desafío pasó a ser el poder predecir el tamaño correcto del ICL. Si bien la tasa de complicaciones asociadas al vaulting generalmente es baja, genera un impacto negativo en la aceptación del cirujano hacia esta cirugía.
Con el fin de aumentar la seguridad del procedimiento es crucial conocer y medir dónde y cómo va a quedar posicionado el ICL. Actualmente, la única forma de lograrlo es con ultrasonido de muy alta frecuencia y robotizado. Interpretando que gran cantidad de ICLs quedan alojados en el cuerpo ciliar y no en el sulcus, y entendiendo que el diámetro CBID es mas poderoso que el sulcus-a-sulcus y mucho más poderoso que el blanco-a-blanco o el angulo-a-angulo (por OCT) en evitar la incidencia de vaults fuera de lo recomendado.
La predicción del tamaño del ICL a implantar y poder lograr un vault óptimo ha generado un gran interés clínico que determinó desarrollar el equipamiento necesario para poder realizar las distintas mediciones preoperatorias propuestas. Asimismo la importancia de ver, conocer y medir la anatomía intraocular es fundamental ante la presencia de quistes o la antero posición del cuerpo ciliar que puede generar un vaulting fuera de lo calculado. El ArcScan logra medir y conocer la anatomía precisa con una alta eficiencia y repetitividad; permitiéndole al cirujano customizar el vault deseado y conocer la posición final y simétrica o no del ICL.
Esta nueva posibilidad de observación nos llevará a replantear posiblemente el diseño del lente como también la técnica quirúrgica tratando de predecir la posición de las hápticas y evitar las inserciones asimétricas.
Referencias
Sanders DR, Doney K, Poco M, ICL in Treatment of Myopia Study Group United States food and drug administration clinical trial of the implantable collamer lens (ICL) for moderate to high myopia: 3-year follow-up. Ophthalmology 2004;111(9):1683–92.
Niu L, Miao H, Han T, Ding L, Wang X, Zhou X. Visual outcomes of visian ICL implantation for high myopia in patients with shallow anterior chamber depth. BMC Ophthalmol. 2019;19:121.
Moya T, Javaloy J, Montés-Micó R, Beltrán J, Muñoz G, Montalbán R. Implantable Collamer lens for myopia: assessment 12 years after implantation. J Refract Surg. 2015;31(8):548–56
Alfonso JF, Fernandez-Vega-Cueto L, Alfonso-Bartolozzi B, Montes-Mico R, Fernandez-Vega L. Five-year follow-up of correction of myopia: posterior chamber phakic intraocular lens with a central port design. J Refract Surg. 2019;35:169–76.
Vasavada V, Srivastava S, Vasavada SA, Sudhalkar A, Vasavada AR, Vasavada VA. Safety and efficacy of a new phakic posterior chamber IOL for correction of myopia: 3 years of follow-up. J Refract Surg. 2018;34:817–23.
Alfonso JF, Lisa C, Palacios A, Fernandes P, González-Méijome JM, Montés-Micó R. Objective vs subjective vault measurement after myopic implantable Collamer lens implantation. Am J Ophthalmol. 2009;147(6):978–83
Fernandes P, Gonzalez-Meijome JM, Madrid-Costa D, Ferrer-Blasco T, Jorge J, Montes-Mico R. Implantable collamer posterior chamber intraocular lenses: a review of potential complications. J Refract Surg. 2011;27:765–76.
Matarazzo F, Day AC, Fernandez-Vega Cueto L, Maurino V. Vertical implantable collamer lens (ICL) rotation for the management of high vault due to lens oversizing. Int Ophthalmol. 2018;38:2689–92.
Guber I, Mouvet V, Bergin C, Perritaz S, Othenin-Girard P, Majo F. Clinical outcomes and cataract formation rates in eyes 10 years after posterior phakic lens implantation for myopia. JAMA Ophthalmol. 2016;134:487–94
Gimbel HV, LeClair BM, Jabo B, Marzouk H. Incidence of implantable collamer lens-induced cataract. Can J Ophthalmol. 2018;53:518–22.
Repplinger B, Kohnen T. Intraocular pressure after implantation of an ICL with aquaport. Development of intraocular pressure after implantation of an ICL (model V4c) with aquaport without iridotomy. Ophthalmologe. 2018; 115:29–33.
Ye C, Patel CK, Momont AC, Liu Y. Advanced pigment dispersion glaucoma secondary to phakic intraocular collamer lens implant. Am J Ophthalmol. 2018;10:65–7.
Chun YS, Park IK, Lee HI, Lee JH, Kim JC. Iris and trabecular meshwork pigment changes after posterior chamber phakic intraocular lens implantation. J Cataract Refract Surg. 2006;32:1452–8.
Shipper I. Surgical management of acute angle-closure glaucoma after implantation of a toric ICL. J Cataract Refract Surg. 2007;33:563–4.
Dougherty PJ, Rivera RP, Schneider D, Lane SS, Brown D, Vukich J. Improving accuracy of phakic intraocular lens sizing using high-frequency ultrasound biomicroscopy. J Cataract Refract Surg 2011;37:13–8.
Kojima T, Yokoyama S, Ito M, Horai R, Hara S, Nakamura T, Ichikawa K. Optimization of an implantable Collamer lens sizing method using high-frequency ultrasound biomicroscopy. Am J Ophthalmol 2012;153:632–7.
Reinstein DZ, Lovisolo CF, Archer TJ, Gobbe M. Comparison of post-operative vault height predictability using white-to-white or sulcus diameter-based sizing for the Visian implantable collamer lens. J Refract Surg 2013; 29:30–5.
Malyugin BE, Shpak AA, Pokrovskiy DF. Posterior chamber phakic in-traocular lens sizing based on iris pigment layer measurements by anterior segment optical coherence tomography. J Cataract Refract Surg 2015;41: 1616–22.
Nakamura T, Isogai N, Kojima T, Yoshida Y, Sugiyama Y. Implantable collamer lens sizing method based on swept-source anterior seg-ment optical coherence tomography. Am J Ophthalmol 2018;187: 99–107
Reinstein DZ, Archer TJ, Silverman RH, Rondeau MJ, Coleman DJ. Correlation of anterior chamber angle and ciliary sulcus diameters with white-to-white corneal diameter in high myopes using artemis VHF digital ultrasound. J Refract Surg. 2009;25(2):185-94.
Nam SW, Lim DH, Hyun J, Chung ES, Chung TY. Buffering zone of implantable Collamer lens sizing in V4c. BMC Ophthalmol. 2017;17(1):260.
AlSabaani NA, Behrens A, Jastanieah S, Al Malki S, Al Jindan M, Al Motowa S. Causes of phakic implantable collamer lens explantation/exchange at king Khaled eye specialist hospital. Middle East Afr J Ophthalmol 2016;23(4):293–5.
Packer M. Meta-analysis and review: effectiveness, safety, and central port design of the intraocular collamer lens. Clin Ophthalmol 2016;9(10):1059–77.
Lovisolo CF, Pesando PM. The Implantable Contact Lens (ICL) and Other Phakic IOLs. Canelli, Italy: Fabiano; 2000
Lovisolo CF, Reinstein DZ. Phakic intraocular lenses. Surv Ophthalmol. 2005;50(6):549-87.
Dougherty PJ, Rivera RP, Schneider D, Lane SS, Brown D, Vukich J. Improving accuracy of phakic intraocular lens sizing using high-frequency ultrasound biomicroscopy. J Cataract Refract Surg 2011;37:13–8.
Reinstein DZ, Lovisolo CF, Archer TJ, Gobbe M. Comparison of postoperative vault height predictability using white-to-white or sulcus diameter-based sizing for the visian implantable collamer lens. J Refract Surg. 2013;29(1):30-5.
Lee DH, Choi SH, Chung ES, Chung TY. Correlation between preoperative biometry and posterior chamber phakic visian implantable collamer lens vaulting. Ophthalmology. 2012;119:272–7.
Trancon AS, Manito SC, Sierra OT, Baptista AM, Serra PM. Determining vault size in implantable collamer lenses (ICL): preoperative anatomy and lens parameters. J Cataract Refract Surg. 2020;46:728–36.
Zeng QY, Xie XL, Chen Q. Prevention and management of collagen copolymer phakic intraocular lens exchange: causes and surgical techniques. J Cataract Refract Surg. 2015;41:576–84.
A new formula for ICL sizing’, Keynote Speaker, MRSSS Military Refractive Surgery Safety and Standards Symposium, January 9, 2020, San Diego, USA.

 Dr. Gerardo Valvecchia
Dr. Gerardo Valvecchia Dr. Daniel Badoza
Dr. Daniel Badoza



















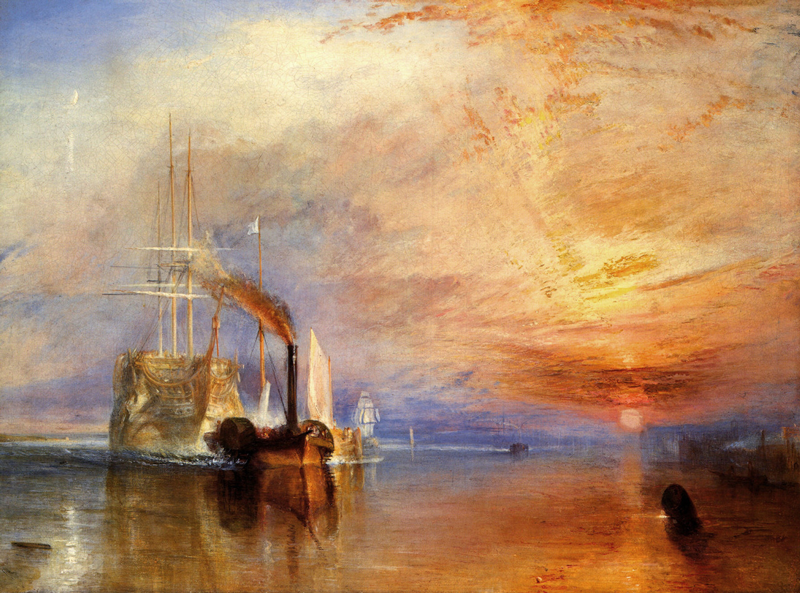








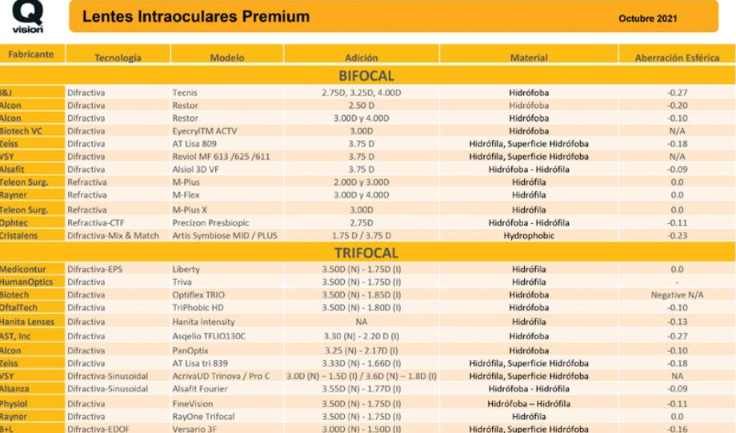
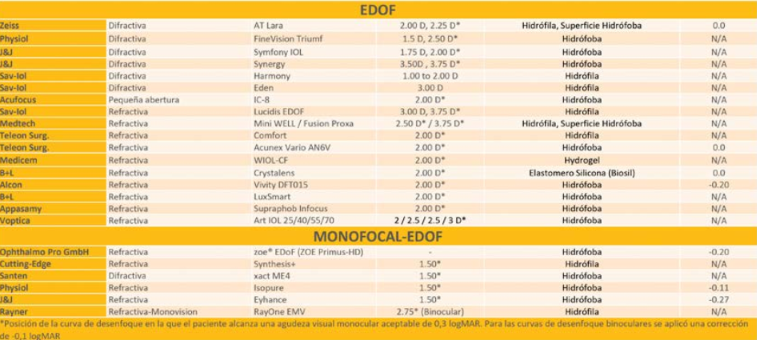 Figura 1.
Figura 1.