La distribución en la población de lo que llamamos alta miopía o miopía extrema es muy difícil de cuantificar, pues no existe una delimitación absolutamente precisa entre las diferentes magnitudes.
Las delimitaciones no son claras a la hora de clasificarlas, ni existe consenso si debemos diferenciarlas por el largo axial o por la refracción, o por el poder del lente intraocular a implantar. Tampoco se han dilucidado los umbrales que dividen las distintas categorías.
En este sentido se puede observar que, arbitrariamente, en algunos trabajos, se dividen solamente entre miopía leve, hasta –3 D por un lado, y por el otro, se ubica la moderada junto con la elevada, por encima de –3 D. Otros estudios hablan de elevada a partir de –8 D y extrema por encima de –10 D 2.
El ojo miope extremo, particularmente, constituye un verdadero desafío para el cirujano de segmento anterior por varios motivos, que analizaremos a continuación.
Estos pacientes nos ofrecen una problemática muy peculiar, que debe ser considerada como tal, analizada en toda su complejidad y enfrentada en cada caso como una situación individual y no como si se tratara de una catarata en un ojo de dimensiones normales.
Pueden aparecer escollos en los 2000, es un método con un error de todos los pasos del proceso: durante el estudio preoperatorio, en la etapa intraoperatoria y también en el posoperatorio. En cada momento es necesario advertir sobre los posibles inconvenientes a los que nos enfrentaremos, evitar minimizarlos, para no transformarlos en un caso de difícil manejo.
Los avances tecnológicos en la evaluación preoperatoria, el cálculo del LIO mucho más exacto, la incorporación de lentes intraoculares multifocales, trifocales y de rango extendido han transformado la cirugía sobre el cristalino en una cirugía refractiva.
Es en este contexto en el que la cirugía de catarata en el ojo miope extremo debe ser analizada a la hora de realizar el implante del lente intraocular.
Evaluación preoperatoria:
Como en todo paciente que se somete a una cirugía de catarata, debe realizarse un examen oftalmológico completo, pesquisando primero si existen trastornos de la superficie ocular, y tratándolos con firmeza antes de realizar la biometría.
El cálculo del lente es fundamental a la hora de implantar cualquier lente intraocular, pero en estos casos es capital. La biometría ultrasónica, única utilizada hasta principios de medida inaceptable para los requerimientos actuales. Esos errores de medida del largo axial pueden llegar a ser tan grandes, en los casos de los ojos extremos, que las variaciones queratométricas debido a la superficie ocular pueden tener poca influencia en el resultado final. En la era actual del cálculo, con la biometría óptica, los errores que generan córneas irregulares pueden ser muy significativos debido a que el error de cálculo tolerado es mínimo.
Los ojos con largos axiales mayores que 30 mm son los que más frecuentemente consideramos cuando nos referimos a ojos miopes extremos.
Estos largos muy extremos pueden combinarse con córneas normales, pero también con córneas muy planas o con córneas muy curvas. Sin embargo, debemos tener en cuenta que, largos no tan extremos, entre 26 y 30 mm, pueden combinarse con córneas muy curvas y resultar en la necesidad de implantar lentes intraoculares en un rango entre –10 D y +3 D.
Cada una de estas combinaciones puede generar un error diferente a la hora del cálculo del lente intraocular.
A estos tipos de ojo miope extremo se deben sumar algunos pocos pacientes que fueron operados en la época inicial de la cirugía con excimer, cuando se operaban miopías de –15 D, que son muy difíciles de calcular, debido a que tienen áreas tratadas con diámetro muy pequeño, extremadamente planas en el centro, y que nos generan problemas por lo exagerado del aplanamiento corneal y la dificultad en las mediciones queratométricas por las irregularidades topográficas que acompañan a este tipo de ablación.
También debemos considerar los miopes extremos operados previamente con lentes intraoculares fáquicos, de cámara anterior con soporte angular, tipo Kelman, o de soporte iridiano de tipo iris claw, o los de cámara posterior. En estos casos, se agrega la dificultad quirúrgica que significa la extracción del lente fáquico y el astigmatismo que puede generar la incisión dependiendo del modelo que deba ser explantado: de 6 o 6.5 mm en los que son de PMMA (cámara anterior de soporte angular e iridiano) y de 3.25 o 3.5 mm en los plegables (Artiflex, ICL), que son de polisiloxano y Collamer, respectivamente. El cálculo en estos ojos requiere corregir el largo axial en el IOLMaster o Lenstar con la opción de ojo con lente fáquico, agregando el tipo de material del lente utilizado y calcularlo como un ojo miope elevado, como si no estuviera operado.
La introducción de la Interferometría de Coherencia Parcial en 1998 ha mejorado la medida del largo axial dramáticamente. En la actualidad es imprescindible efectuarla siempre en la miopía extrema.
Ante la imposibilidad de realizarla, por ejemplo, en cataratas completas, subcapsulares posteriores u otras circunstancias con opacidad de medios muy importante, deberemos hacer la biometría ultrasónica solamente cuando no se pueda hacer la biometría óptica.
Con la biometría ultrasónica sabemos que estamos cometiendo un error de medida que puede ser muy importante, y que, aunque tomemos todos los recaudos en la medición y en el resto de los parámetros, es altamente probable que el cálculo del lente a implantar nos conduzca a un error refractivo frecuentemente significativo.
La principal ventaja de la biometría óptica es su mayor precisión, 10 veces, comparada con la biometría ultrasónica. Ha mejorado el cálculo en general, utilizando cualquiera de las fórmulas disponibles.
La utilización de los MIOL nos obliga a obtener resultados refractivos entre +0.50 D y –0.50 D idealmente en todos los casos. Esta exactitud no la podemos prometer en los miopes extremos todavía, aunque ha habido avances prometedores en el cálculo en los últimos años, ese nivel de exactitud no puede ser alcanzado en este tipo de ojos.
La evaluación de la retina periférica con oftalmoscopía binocular indirecta debe ser realizada siempre para detectar desgarros o lesiones retinales que predispongan al desprendimiento de retina. Además, se debe evaluar la mácula con tomografía de coherencia óptica (OCT), para detectar alteraciones maculares, que se debe realizar como en todos los casos, aunque en los miopes elevados no siempre se puede obtener una buena imagen macular en el OCT.
Chair Time
• En el interrogatorio, el primer tema a considerar es analizar con el paciente cuáles son sus expectativas y cuáles son sus posibilidades reales. En este contexto, es frecuente que los pacientes estén informados sobre los tipos de lentes intraoculares disponibles en el mercado, pero no saben que no todos son aplicables a su caso en particular. En este sentido, es importante anticiparle que, luego de los estudios, veremos cuál o cuáles se adaptan mejor a las características de su ojo.
• Esto incluye el tema de la corrección de astigmatismos corneales, que se debe tener en cuenta, pero creo que es inútil conversar, previamente, de alternativas muy especiales sin sustento y después, frente a los resultados, comenzar a explicar por qué en su caso no puede implantarse un tipo u otro de lente de los que ya hemos hablado anteriormente de manera un tanto superficial.
• Una pregunta que no puede faltar debe ir orientada a saber cómo se ha manejado habitualmente durante la vida. (En los que tienen solo catarata monocular hay que plantear el tema en función de ambos ojos)
◊ Aquellos que han usado anteojos aéreos solamente, deben comprender que, una vez operados, pueden llegar a ver muy bien de lejos, pero eso implicaría ver muy mal de cerca. En este sentido, si prefieren ver
de lejos sin anteojos, usarán anteojos de cerca. Otra alternativa, en los pacientes que prefieren seguir manteniendo buena visión cercana sin corrección y no les molestaría usar anteojos aéreos para la visión lejana, con una corrección de alrededor de–3D.
◊ Por otro lado, están los pacientes con miopía extrema, que vienen utilizando solamente lentes de contacto y no utilizaron nunca corrección de cerca. En este punto es necesario tratar de preguntar si han utilizado en monovisión, aunque puede ser que hayan estado hipocorregidos ambos, y con diferencia entre ambos ojos. Estos pacientes se beneficiarán seguramente con un resultado refractivo de –1.00 D a –2.50 D.
◊ Aquellos que previamente utilizaron lentes de contacto para ver bien a distancia, pero usaron siempre corrección de cerca, y eso es lo que prefieren, es mejor apuntar a la emetropía o a una miopía de –0.50 D.
◊ También es muy diferente en los casos operados con lentes fáquicos, en los cuales es fundamental saber cómo han estado previamente, de la misma manera que con los usuarios de LC.
◊ Si se trata de pacientes pre présbitas que han utilizado siempre LC y nunca anteojos, la situación exige una conversación mayor que consiste en explicar la presbicia a alguien que no la ha padecido todavía y que está acostumbrado a ver bien de lejos y cerca con LC. Existen muchos pacientes jóvenes con cataratas en miopías elevadas.
• Desde el punto de vista del compromiso de la retina, es importante tener en cuenta que el riesgo del desprendimiento de retina es mayor en este grupo de pacientes. Hay que advertirlo, anticiparlo, como explicamos el riesgo de endoftalmitis en lo relativo a la frecuencia con la que puede aparecer y sus consecuencias.
En este sentido, se ha propuesto clasificar la miopía elevada en: aislada, que no presenta patología retinal, y ocurre en aproximadamente el 50 % (IHM); patológica anterior, el 22 % (APM), cuando está afectada la retina anterior; patológica posterior, el 10 % (PPM), cuando está afectada la mácula; y combinada, el 17 % (CPM), que incluye anterior y posterior. El equivalente esférico promedio de cada grupo aumenta desde la aislada (–8 D) a la combinada (–10 D)1. Este estudio nos indica que, de cada dos miopes extremos, uno puede tener lesión patológica retinal, y el otro puede no tenerla.
Evaluación preoperatoria
• Sedebecitarpararealizarlosestudios preoperatorios con tiempo suficiente de descanso de los LC. El examen debe incluir biometría de coherencia óptica y topografía corneal con aberrometría. En este sentido, existen diversos equipos como Pentacam, Galilei, OPD Sense III, que aportan muchos datos sobre la córnea, la superficie ocular y el sistema óptico que hoy constituyen herramientas indispensables para la selección del lente intraocular.
• Como dije anteriormente, un tema en absoluto no menor, es que la gran mayoría de los pacientes miopes extremos son usuarios habituales de lentes de contacto y muy reacios a suspenderlos por tiempos prolongados. Esto genera dos problemas: las mediciones corneales pueden ser de muy mala calidad, debido a la alteración de la superficie ocular por el sobreuso, y el fenómeno de moldeado de la córnea (síndrome de warpage), que puede dar lugar a errores en las medidas queratométricas. En general se aconseja discontinuar los lentes por lo menos una a dos semanas en el caso de los blandos y 4 a 6 semanas en los rígidos.
• Uno de los factores que conspira contra el éxito en la exactitud de la medida del largo axial es que, si bien la precisión de la biometría basada en la interferometría de coherencia óptica ha mejorado mucho, la ubicación geográfica de la fóvea en estos ojos no siempre es posible, por lo que no se puede medir correctamente el largo axial.
◊ En el caso de los ojos miopes extremos, en primer lugar, se trata de un ojo con diversas anomalías en cuantoasuformaynosolo a sus dimensiones. Estas anomalías del perfil posterior retinal, como los estafilomas, modifican la superficie cóncava regular y generan otra irregular, muy particularmente inclinada, que no mantiene un radio de curvatura posterior preestablecido, y crean un punto foveal ubicado en una posición que noesladeunojocon dimensiones medias. La ecografía modo B ayuda a visualizar y valorar la morfología de esta deformación posterior, que puede crear un desnivel de unos 2 mm, pero no es útil para medir.
◊ En el momento de la medición del largo axial, algunos miopes muy elevados no llegan a fijar muy bien, es decir, pierden nitidez al mirar la luz de fijación, debido a la enorme ametropía. En este caso, un tip que puede ayudar a perfeccionar la medida del largo axial con el IOLMaster es utilizando la refracción aérea y realizar varias tomas para corroborar con las anteriores que hemos obtenido sin ella.
Elección del poder del lente intraocular
• Otradificultadquesesuma en esos rangos de lentes intraoculares es que hay pocos modelos que abarquen todo el abanico de poderes. Algunos modelos de lentes intraoculares comienzan en +6 D, otros en 0 D, otros en –6 D y otros en –15 D. La diferencia entre los poderes en este rango es de 1 D, no de 0.50 D, como en los restantes lentes intraoculares, desde +6 D hasta +30 D. Esta diferencia de +1 D crea algunos errores que se originan a la hora de elegir el poder. Por ejemplo: si el cálculo nos ofrece un resultado de +2.25 D, debemos colocar un de +3 o +2 D, cuando quizás hubiéramos elegido uno de +2.50 D.
Otro tema frecuente en estos ojos es que encontramos discordancias significativas entre las diversas fórmulas. Las diferencias surgen del método que cada fórmula utiliza para calcular la posición efectiva del lente (ELP). Holladay presentó hace más de 10 años los nueve tipos de ojos según el largo axial y la dimensión del segmento anterior. En el 90 % de los ojos largos encontró que el segmento anterior está en valores de rango normal, y en el 10 % solamente es más grande. Si la ELP se calcula infiriéndola, solo teniendo en cuenta el largo axial, el resultado será muy diferente en los ojos con segmento anterior normal o aquellos que en los que es más largo. Este error no se produce si es que existe un dato real de la medida donde se cree que va a quedar la lente intraocular, que se calcula con medidas específicas de la profundidad de la cámara anterior y del espesor del cristalino. Existen en esta franja de ojos numerosos estudios comparando las diversas fórmulas.
◊ En general, entre las fórmulas más frecuentemente usadas hasta ahora, la Haigis y la SRKT funcionan mejor. Haigis tiene menor error que la SRKT en los ojos con K mayor que 43 D y largos axiales mayores que 30 mm3.
◊ Las fórmulas más nuevas de Olsen y Barrett Universal II van ganando terreno últimamente ya que miden fehacientemente el espesor del cristalino y la cámara anterior, calculando más exactamente la posición en la que el LIO va a posicionarse dentro del bag. En otro estudio se analiza el error refractivo en la predicción tomando en cuenta nueve fórmulas4 y dos equipos: Lenstar y IOLMaster. Los resultados demostraron a la Olsen como la más exacta con las mediciones del Lenstar, pero fue la peor con los valores obtenidos por el IOLMaster; la Barrett Universal II fue la mejor con las medidas del IOLMaster. La de Olsen que viene en el equipo (Lenstar) funcionó peor que la versión Standalone Olsen, que se puede acceder a través de la página web PhacoOptics PC. En otro estudio comparando dos series de fórmulas preinstaladas en Lenstar e IOLMaster, se obtuvo mejor resultado con Olsen, seguido de la Haigis, en todos los tipos de ojo5.
◊ Otro método para calcular el poder del lente en ojos mayores que 25 mm es el del ajuste del largo axial, que proponen Koch y Wang, usando la fórmula Holladay 1 (ALoptimized Holladay I), aumentando +0.27 a +0.68 D en los poderes de lentes intraoculares arriba de +5 D y +1.13 a +1.87 D en los lentes por debajo de 5 D 6.
◊ Personalmente, desde 2012, a partir de un estudio retrospectivo personal, utilizo un método con el que optimizo el cálculo para evitar el shift hipermetrópico: calculo con IOLMaster, fórmula de Haigis optimizada, sumando +0.75 para la emetropía en todos los casos, pero agregando 1 D adicional en ojos con largos axiales mayores que 30 mm, K superiores7 a 44 D o ACD mayor que 3.8 mm .
◊ En 2017 comenzó a utilizarse la fórmula de Warren Hill-RBF que es una fórmula basada en principios de la inteligencia artificial. Se puede acceder a través de https//rbfcalculator.com. El calculador puede medir de 19 a 35 mm de largo axial. El método consiste en la incorporación a su base de datos de más de 12 000 casos operados, con los resultados posquirúrgicos, donde un modelo de inteligencia artificial encuentra similitudes y sugiere el lente a implantar. La exactitud de este método en algunos trabajos es muy promisoria.
◊ Otro método de cálculo es con la aberrometría intraoperatoria con el ORA, que algunos estudios lo posicionan como el más exacto.
Elección del lente que vamos a implantar
• Una vez calculado el poder de la lente intraocular, y con el resultado de la topografía y la biometría óptica, volvemos a conversar con el paciente sobre las posibilidades refractivas que podemos ofrecerle.
◊ En esta decisión uno debe considerar: que no siempre la emetropía es lo mejor, que la hipermetropía es siempre lo peor y que una leve miopía puede ser el mejor resultado.
◊ En general no propicio la utilización de lentes intraoculares multifocales en la miopía extrema. El multifocal de menor poder que he implantado es de +8 D en un ojo, en una paciente con una anisometropía que llevaba +15 D en el otro y con muy buen resultado. Hasta hace unos años, era una situación impensada, debido a que la mayoría de los lentes intraoculares multifocales comenzaban en +10 D y luego se expandieron a +6 D.
◊ En la actualidad existen algunos modelos desde 0 D, lo cual creo es peligroso, pues todavía es muy difícil garantizar obtener un valor suficientemente exacto del poder esférico del lente que permita una buena función en multifocalidad, debido a un error refractivo posoperatorio inesperado.
◊ También hay que tener en cuenta que muchas veces podemos no disponer un stock de tóricos, con la imposibilidad de corregir el cilindro corneal preoperatorio.
◊ El otro tema, no menor, a la hora de la elección del LIO, es el diámetro total entre las hápticas, pues en ojos extremadamente grandes un LIO estándar monopieza puede quedar inestable dentro de un saco grande. En estos casos, uno de tres piezas, de 13 mm de diámetro, se acomoda mejor en un saco capsular grande, mientras que uno de 12 mm puede desplazarse dentro del saco, dando lugar a descentraciones que pueden ser significativas en los casos de los lentes asféricos.
Como conclusión, hay que ser prudente, muy meticuloso, explicar mucho, advertir sobre riesgos y no crear expectativas descabelladas.
Referencias
- Ludwig CA, Shields RA, Chen TA. A novel classifica- tion of high myopia. Graefes Arch Clin Exp Ophthal- mol 2018 oct 256(10) 1847-56
- Cumberland P, Bountziouka V, Rahi J. Impact of varying the definition of myopia on estimates of prevalence and associations with risk factors. Br J Ophthalmol 2018 OCT: 102(102): 1407-12
- ZhuXJ,HeWW,DuY,QianDJ,DaiJH,LuY.Lens power calculation for high myopic eyes with cataract: comparison of three formulas. Chin J Ophthalmol, 2017, 53: 260-265.
- Cooke DL, Cooke TL J Comparison of 9 intraocular lens power calculation formulas. JCataract Refract Surg. 2016 Aug;42(8):1157-64
- Cooke DL, Cooke TL. Prediction accuracy of preinsta- lled formulas on 2 optical biometers. J Cataract Re- fract Surg. 2016 Mar;42(3):358-62.
- Wang L, Shirayama M, Ma X J, Koch D. Optimizing intraocular lens power calculations in eyes with axial lengths above 25 mm. J Cataract Refract Surg. 2011 Nov 37 (11): 2018-27.
- Fernandez Mendy J; Fernandez Mendy A; Fernandez Mendy H. Optimizando el Cálculo en Miopes Altos. Presentado en el Congreso Panamericano de Oftal- mología. Lima 2017.



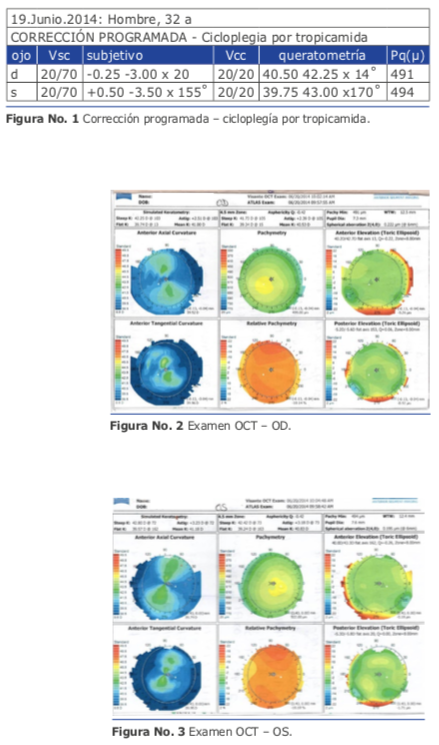 Mi peor caso de cirugía refractiva lo padecí con un hombre de 32 años que en el año 2014 me consultó para la corrección de un astigmatismo miópico elevado que habitualmente debe corregirse con Femto Láser y zona óptica grande, pero en este caso, presentaba córneas de menos de 500 micras. Usé el Excimer AMARIS 750 de Schwind. Tenía buena experiencia con la técnica de TransPRK con Mitomicina C y en las ventajas de la nueva tecnología de “smart pulse”. Realicé una ablación corneal de ambos ojos siguiendo los pasos habituales que dictaba mi experiencia:
Mi peor caso de cirugía refractiva lo padecí con un hombre de 32 años que en el año 2014 me consultó para la corrección de un astigmatismo miópico elevado que habitualmente debe corregirse con Femto Láser y zona óptica grande, pero en este caso, presentaba córneas de menos de 500 micras. Usé el Excimer AMARIS 750 de Schwind. Tenía buena experiencia con la técnica de TransPRK con Mitomicina C y en las ventajas de la nueva tecnología de “smart pulse”. Realicé una ablación corneal de ambos ojos siguiendo los pasos habituales que dictaba mi experiencia: El resultado al cabo de 1 mes fue muy bueno (Ver figura 10). La visión sin corrección mejoró 4 líneas (de 20/80 a 20/30). Pero lamentablemente el efecto logrado se perdió totalmen- te en 3 meses.
El resultado al cabo de 1 mes fue muy bueno (Ver figura 10). La visión sin corrección mejoró 4 líneas (de 20/80 a 20/30). Pero lamentablemente el efecto logrado se perdió totalmen- te en 3 meses.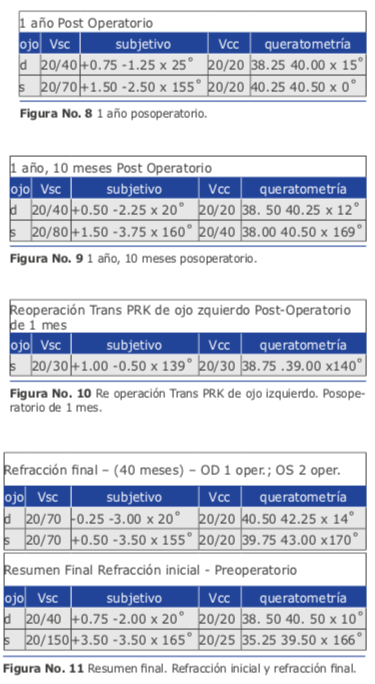
 Durante la cirugía la paciente resultó muy aprensiva. El ojo derecho logró operarse sin inconvenientes, pero en la cirugía del ojo izquier do colapsó emocionalmente (Ver vídeo).
Durante la cirugía la paciente resultó muy aprensiva. El ojo derecho logró operarse sin inconvenientes, pero en la cirugía del ojo izquier do colapsó emocionalmente (Ver vídeo).

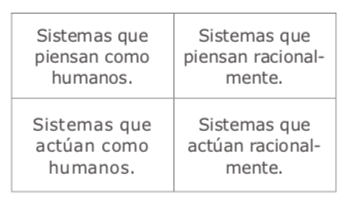 Una defifinición que logré formular a lo largo de múltiples años de investigación y trabajo en el área – y que suelo emplearla en los cursos que imparto sobre IA – es que “la inteligencia artifificial tiene como objetivo dotar la máquina de la capacidad de _______.” Y, así, uno tiene la libertad de rellenar este espacio con la capacidad que desea o, aun, escribir “lo humano”, si lo que quiere es acercarla al contexto humano. Por ejemplo, dotar la máquina de la capacidad humana de hablar, escribir, leer, ver, pintar, reconocer un objeto, tomar decisiones, conducir, etc.
Una defifinición que logré formular a lo largo de múltiples años de investigación y trabajo en el área – y que suelo emplearla en los cursos que imparto sobre IA – es que “la inteligencia artifificial tiene como objetivo dotar la máquina de la capacidad de _______.” Y, así, uno tiene la libertad de rellenar este espacio con la capacidad que desea o, aun, escribir “lo humano”, si lo que quiere es acercarla al contexto humano. Por ejemplo, dotar la máquina de la capacidad humana de hablar, escribir, leer, ver, pintar, reconocer un objeto, tomar decisiones, conducir, etc.
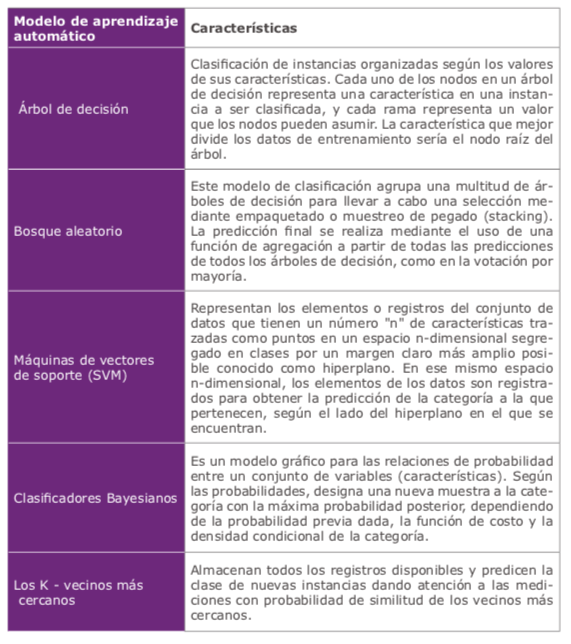
 Los métodos actuales para
Los métodos actuales para
 A) Colágeno, que supone más del 70% del peso de la córnea deshidratada, siendo el más abundante el tipo 1 (75%). (B) Proteoglicanos, incluyendo el queratán sulfato que es el más abundante (65%), cuyo núcleo proteico está compuesto de lumicán, queratocán y mimecán 1. El queratocán es expresado únicamente en el estroma corneal, por ello es considerado en ingeniería tisular como un marcador específico de diferenciación queratocítica 2. El componente celular del estroma corneal ocupa únicamente el 2-3% del volumen estromal, y en él las células predominantes son los queratocitos, células mesenquimales que derivan de la cresta neural, que se distribuyen entre las lamelas de colágeno. Los queratocitos están en estado quiescente en la córnea normal, son los responsables del constante reemplazo de la matriz extracelular estromal mediante la producción de colágeno esencial para el mantenimiento de la trasparencia corneal. Ante las agresiones, los queratocitos activan su metabolismo y se transdiferencian en fifibroblastos y miofifibroblastos, los cuales participan en la cicatrización del estroma corneal. La capacidad de renovación de los queratocitos estromales se debe a células precursoras en el estroma corneal limbar anterior, las cuales expresan marcadores de célula madre adulta como ABCG2 3.
A) Colágeno, que supone más del 70% del peso de la córnea deshidratada, siendo el más abundante el tipo 1 (75%). (B) Proteoglicanos, incluyendo el queratán sulfato que es el más abundante (65%), cuyo núcleo proteico está compuesto de lumicán, queratocán y mimecán 1. El queratocán es expresado únicamente en el estroma corneal, por ello es considerado en ingeniería tisular como un marcador específico de diferenciación queratocítica 2. El componente celular del estroma corneal ocupa únicamente el 2-3% del volumen estromal, y en él las células predominantes son los queratocitos, células mesenquimales que derivan de la cresta neural, que se distribuyen entre las lamelas de colágeno. Los queratocitos están en estado quiescente en la córnea normal, son los responsables del constante reemplazo de la matriz extracelular estromal mediante la producción de colágeno esencial para el mantenimiento de la trasparencia corneal. Ante las agresiones, los queratocitos activan su metabolismo y se transdiferencian en fifibroblastos y miofifibroblastos, los cuales participan en la cicatrización del estroma corneal. La capacidad de renovación de los queratocitos estromales se debe a células precursoras en el estroma corneal limbar anterior, las cuales expresan marcadores de célula madre adulta como ABCG2 3.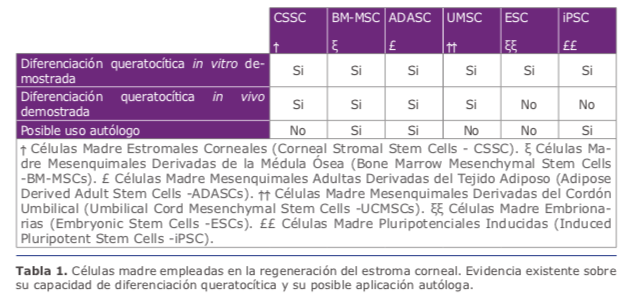 2.1. Células madre empleadas en la ingeniería tisular del estroma corneal
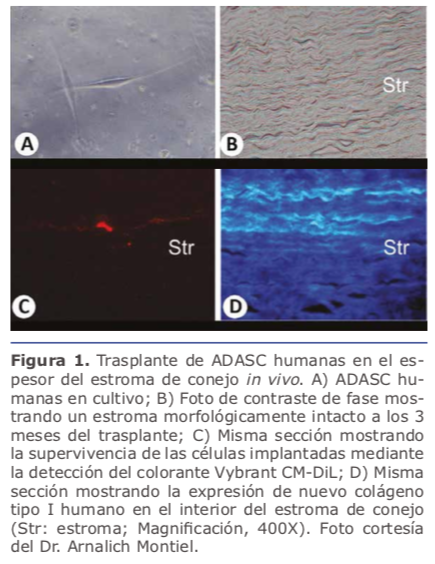
2.1. Células madre empleadas en la ingeniería tisular del estroma corneal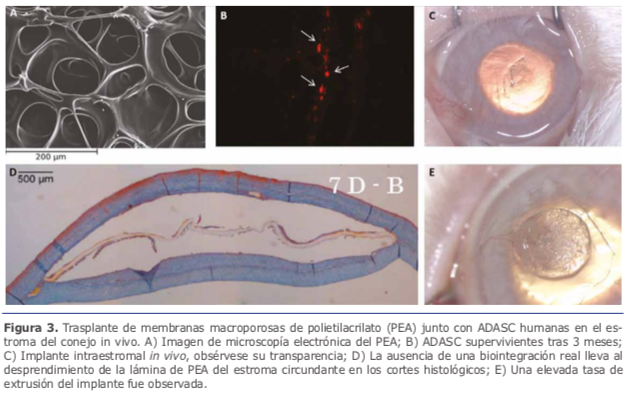 Sin embargo, nuestro equipo de investigación acaba de fifinalizar el primer ensayo clínico en humanos empleando células madre con el objetivo de regenerar el estroma corneal9. En este estudio piloto se implantaron ADASCs autólogas, en el interior de un bolsillo intraestromal asistido por láser de femtosegundo en pacientes con queratocono (estadío ≥ 4) cuya única alternativa terapéutica era ya el trasplante de córnea. La supervivencia celular in vivo mediante microscopía confocal así como la aparición de áreas parcheadas de colágeno neoformado en pequeñas cantidades con un leve aumento paquimétrico (Ver figura 2A-2B), pero este aumento paquimétrico producido no sería suficiente como para rehabilitar el grosor de una córnea muy adelgazada o debilitada. En estos casos sería necesaria la adición de algún sustrato que potencie o complemente estos resultados (Ver figura 2 C, 2D).
Sin embargo, nuestro equipo de investigación acaba de fifinalizar el primer ensayo clínico en humanos empleando células madre con el objetivo de regenerar el estroma corneal9. En este estudio piloto se implantaron ADASCs autólogas, en el interior de un bolsillo intraestromal asistido por láser de femtosegundo en pacientes con queratocono (estadío ≥ 4) cuya única alternativa terapéutica era ya el trasplante de córnea. La supervivencia celular in vivo mediante microscopía confocal así como la aparición de áreas parcheadas de colágeno neoformado en pequeñas cantidades con un leve aumento paquimétrico (Ver figura 2A-2B), pero este aumento paquimétrico producido no sería suficiente como para rehabilitar el grosor de una córnea muy adelgazada o debilitada. En estos casos sería necesaria la adición de algún sustrato que potencie o complemente estos resultados (Ver figura 2 C, 2D).


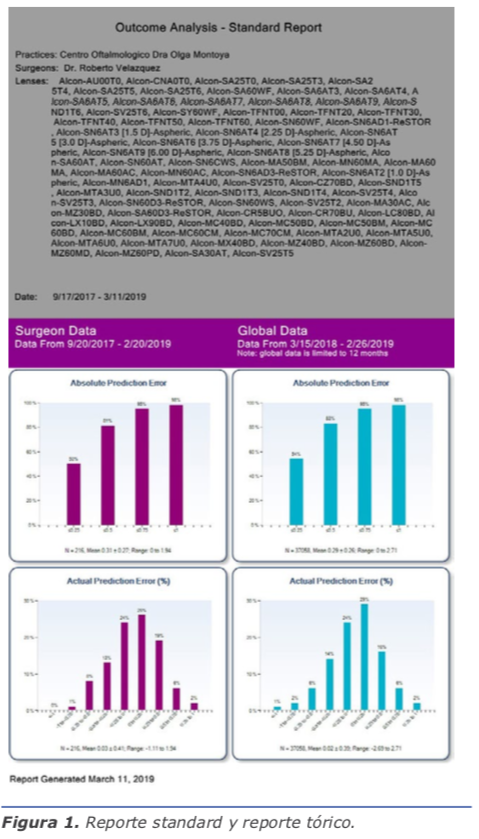 El ORATM cuenta con un programa en línea llamado AnalyzORTM. Este programa es de suma importancia, porque es aquí donde insertamos los datos de los pacientes antes de la cirugía para poder realizar la medida de manera exitosa. También es el que nos va ayudar a personalizar las constantes de nuestros lentes, una vez que llevemos un número de lentes de la misma plataforma. Al inicio, cuando empieza uno, el lente está optimizado de manera global, y en la medida sale un color amarillo a la par de la lente escogida. Hasta que realicemos un número de cirugías y coloquemos la información posquirúrgica iniciando 10 días después de operados, el sistema nos personalizará la constante y el color cambiará a plateado. Es importante realizar la importación de los datos posoperatorios para poder mejorar nuestros resultados. El AnalyzORTM muestra en gráficas, como se aprecia en la figura, el resultado de todas los lentes que utilizamos y, a su vez, nos puede mostrar el manejo del astigmatismo de nuestras cirugías en gráficas. Cuando vemos en la gráfica el error actual predictivo en porcentaje, podemos ver la tendencia si estamos hipocorrigiendo o, al contrario, dejando hipercorregidos a los pacientes. Dentro de las opciones, podemos escoger cada lente por separado y ver los resultados reales. También tenemos la posibilidad de valorar de manera eficaz los resultados de pacientes poscirugía refractiva, como es el LASIK o la queratotomía radiada. Aquí he encontrado una gran ayuda con el ORATM, ya que los resultados han sido muy satisfactorios. (Ver figuras 1 y 2)
El ORATM cuenta con un programa en línea llamado AnalyzORTM. Este programa es de suma importancia, porque es aquí donde insertamos los datos de los pacientes antes de la cirugía para poder realizar la medida de manera exitosa. También es el que nos va ayudar a personalizar las constantes de nuestros lentes, una vez que llevemos un número de lentes de la misma plataforma. Al inicio, cuando empieza uno, el lente está optimizado de manera global, y en la medida sale un color amarillo a la par de la lente escogida. Hasta que realicemos un número de cirugías y coloquemos la información posquirúrgica iniciando 10 días después de operados, el sistema nos personalizará la constante y el color cambiará a plateado. Es importante realizar la importación de los datos posoperatorios para poder mejorar nuestros resultados. El AnalyzORTM muestra en gráficas, como se aprecia en la figura, el resultado de todas los lentes que utilizamos y, a su vez, nos puede mostrar el manejo del astigmatismo de nuestras cirugías en gráficas. Cuando vemos en la gráfica el error actual predictivo en porcentaje, podemos ver la tendencia si estamos hipocorrigiendo o, al contrario, dejando hipercorregidos a los pacientes. Dentro de las opciones, podemos escoger cada lente por separado y ver los resultados reales. También tenemos la posibilidad de valorar de manera eficaz los resultados de pacientes poscirugía refractiva, como es el LASIK o la queratotomía radiada. Aquí he encontrado una gran ayuda con el ORATM, ya que los resultados han sido muy satisfactorios. (Ver figuras 1 y 2)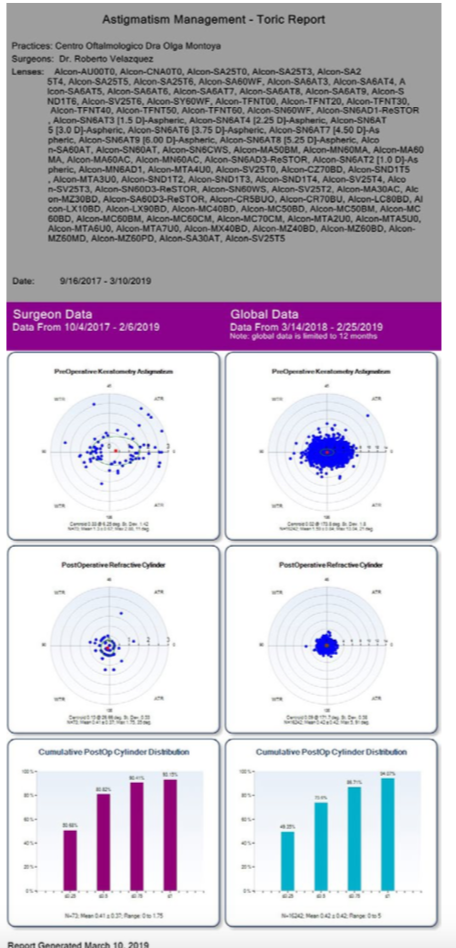 Como cirujanos hemos pasado tiempo perfeccionando las técnicas y permitiendo que la tecnología nos ayude con los pasos para poder llegar al gran momento, la implantación de un lente que le va permitir ver a nuestro paciente. ¡Qué gran momento ha llegado! Vemos el entorno, no hay alteración en la bolsa capsular, la córnea está transparente y sin ninguna alteración, y el momento de la confirmación del lente transquirúrgico llegó. Le pedimos a nuestro paciente que enfoque un punto de fijación y en 2 segundos tenemos 40 tomas que nos confirman nuestro plan.
Como cirujanos hemos pasado tiempo perfeccionando las técnicas y permitiendo que la tecnología nos ayude con los pasos para poder llegar al gran momento, la implantación de un lente que le va permitir ver a nuestro paciente. ¡Qué gran momento ha llegado! Vemos el entorno, no hay alteración en la bolsa capsular, la córnea está transparente y sin ninguna alteración, y el momento de la confirmación del lente transquirúrgico llegó. Le pedimos a nuestro paciente que enfoque un punto de fijación y en 2 segundos tenemos 40 tomas que nos confirman nuestro plan.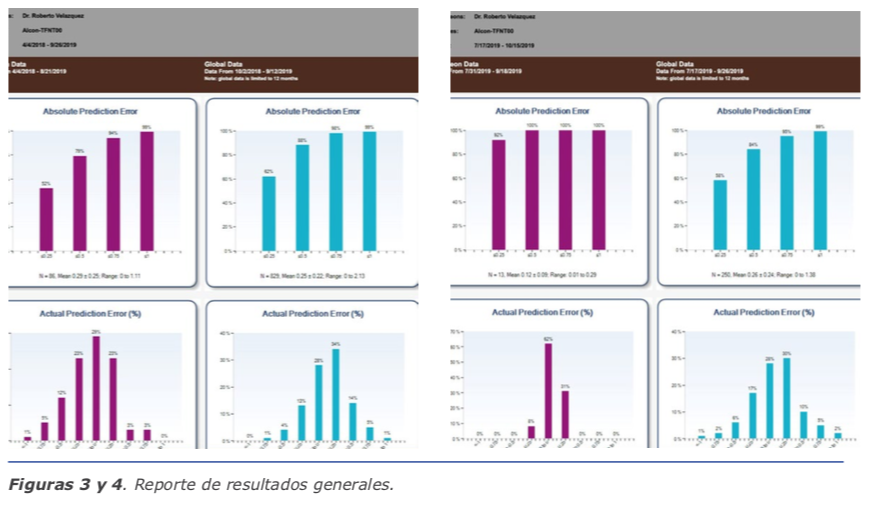 Toda esta información con la cual con- tamos hoy en día se basa en una base de datos de aproximadamente un mi- llón y medio de lentes ya implantados, pero esto es solo un 37 % de casos completados. Los usuarios del ORATM debemos colocar nuestra información posoperatoria para de esta forma poder obtener resultados más allá de lo que nos pudimos imaginar años atrás. Tomemos ventajas de las plataformas tecno- lógicas para que podamos ayudar más a nuestros pacientes. Si trabajamos en equipo, alimentando el AnalyzORTM, vamos ayudar no solo a nuestros pacientes con los resultados, sino a nuestros cole- gas que están en búsqueda de la emetropía. La optimización de las constantes de los lentes es cada día más confiable y reproducible con toda la información posoperatoria que brindemos.
Toda esta información con la cual con- tamos hoy en día se basa en una base de datos de aproximadamente un mi- llón y medio de lentes ya implantados, pero esto es solo un 37 % de casos completados. Los usuarios del ORATM debemos colocar nuestra información posoperatoria para de esta forma poder obtener resultados más allá de lo que nos pudimos imaginar años atrás. Tomemos ventajas de las plataformas tecno- lógicas para que podamos ayudar más a nuestros pacientes. Si trabajamos en equipo, alimentando el AnalyzORTM, vamos ayudar no solo a nuestros pacientes con los resultados, sino a nuestros cole- gas que están en búsqueda de la emetropía. La optimización de las constantes de los lentes es cada día más confiable y reproducible con toda la información posoperatoria que brindemos.



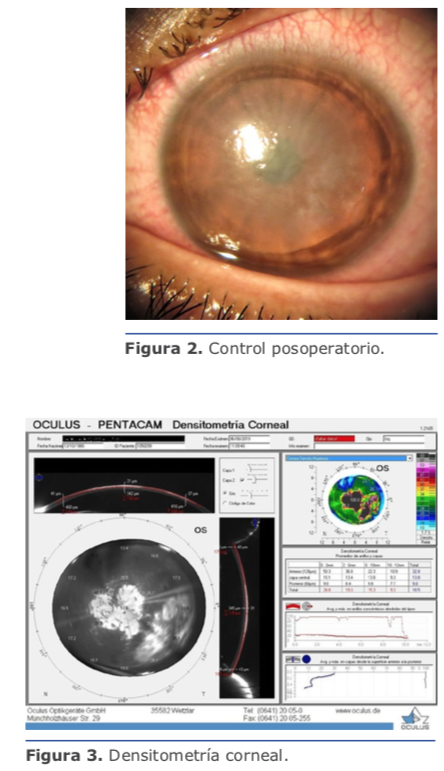
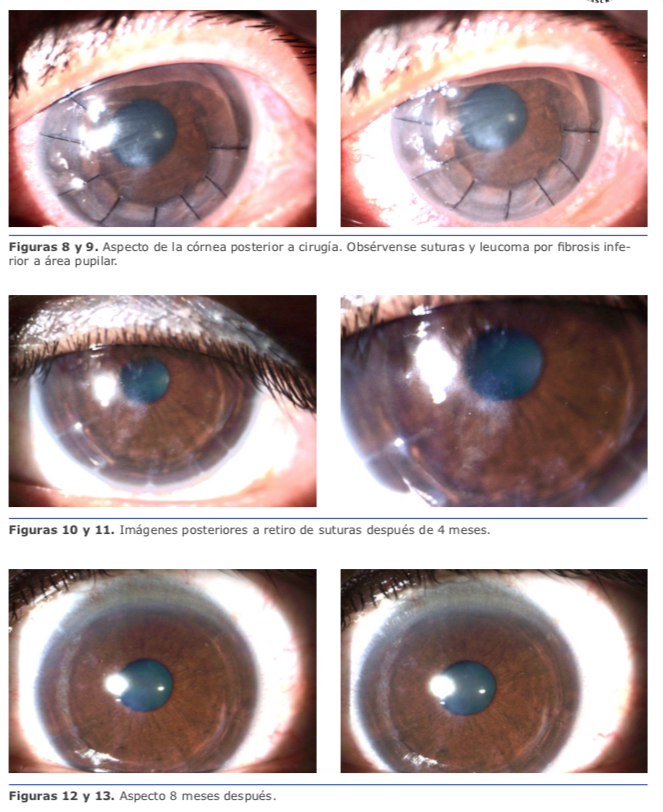
 Al momento de la intervención se encuentra, además de material gelatinoso característico de epitelización, áreas de fibrosis con marcada adherencia del colgajo al lecho estromal. Luego de limpieza meticulosa de cara interna del flap y lecho estromal utilizando esponjas Merocel, se aplica MMC 0.02 % por 30 segundos seguido de irrigación profusa de BSS. Se reposiciona el colgajo y se coloca un lente de contacto blando terapéutico.
Al momento de la intervención se encuentra, además de material gelatinoso característico de epitelización, áreas de fibrosis con marcada adherencia del colgajo al lecho estromal. Luego de limpieza meticulosa de cara interna del flap y lecho estromal utilizando esponjas Merocel, se aplica MMC 0.02 % por 30 segundos seguido de irrigación profusa de BSS. Se reposiciona el colgajo y se coloca un lente de contacto blando terapéutico.