Estado actual y avances recientes en inteligencia artificial para el diagnóstico y manejo del queratocono
Dra. María A. Henríquez – Perú
Dra. Josefina Mejías – Chile
Dr. Gustavo Hernández – Perú
Dr. Luis Izquierdo – Perú
Contacto
Dra. María A. Henríquez – mariale_1610@icloud.com
Dra. Josefina Mejías – Josefina.mejias.smith@gmail.com
Dr. Gustavo Hernández – gus11hdez@gmail.com
Dr. Luis Izquierdo – izquierdojr2109@gmail.com
Introducción
La Inteligencia Artificial (IA) es un área de la ingeniería creada en el campo de los juegos de azar y que actualmente ha logrado diversos usos en Medicina y Salud Pública, donde una detección temprana de trastornos progresivos y crónicos podría cambiar el curso de enfermedades al mejorar los algoritmos de tratamiento que detienen o ralentizan su progresión. Particularmente, en la oftalmología, la Inteligencia Artificial ha cambiado drásticamente los paradigmas en las formas de diagnóstico, clasificación y tratamiento de muchas enfermedades como el glaucoma, la degeneración macular asociada a la edad, la retinopatía diabética y las ectasias corneales como el queratocono.
Inteligencia artifificial
La Inteligencia Artifificial (IA) es un campo específifico de la informática relacionada con programas informáticos que pueden funcionar sin instrucciones directas y precisas de sus usuarios, lo que les da a las computadoras habilidades básicas iguales a las de los humanos para resolver problemas, haciéndolas parecer inteligentes1 .
El aprendizaje automático o Machine Learning (ML), es un término que surgió en la década de 1980 para un subtipo de IA, y se defifine como un conjunto de métodos que detectan automáticamente patrones en los datos que luego son incorporados como información a fifin de predecir datos futuros en condiciones inciertas y así aprender por sí mismos.
Dentro de los sistemas de aprendizaje automático existen los supervisados y no supervisados.
Aprendizaje supervisado busca entrenar un modelo a partir de datos de entrenamiento ya clasifificados, al sincronizar las ponderaciones de las entradas y mejorar la precisión de sus predicciones hasta que estén optimizadas para luego mapear los conjuntos de datos de prueba como salidas correspondientes.
Aprendizaje no super visado se trata de entrenar un modelo con datos no clasifificados(sinunprocesode clasifificación humana), como tal, en el aprendizaje no supervisado, no hay instructor ni maestro, por lo cual el algoritmo debe aprender a dar sentido a los datos sin esta guía. En este último subtipo, el más común es el aprendizaje profundo (Deep Learning DL), también conocido como red neuronal profunda e involucra capas múltiples entre las capas de entrada y salida utilizando una forma no supervisada, lo cual evita la selección manual y la clasifificación de las áreas en el estudio de los procesos de aceleración1.
La forma en la que los programas de computadora logran una capacidad de funcionamiento similar a la de los seres humanos es por medio del entrenamiento sistemático del sistema con información para que sea capaz de diferenciar los diversos patrones y escenarios, además de tomar decisiones inteligentes basadas en los datos proporcionados en un primer paso (entrenamiento) y para que produzca una clasifificación o gestión correcta para nuevos casos.
La manera en la que se entrenan los programas en el ámbito de la oftalmología es recolectando miles de fotografías, patrones complejos o datos de diferentes situaciones en las que se busca generar un diagnóstico,clasifificaciónosugerencia de tratamiento. Cuantas más imágenes se recopilen y se entreguen al sistema para que aprenda a reconocerlas, mayor será la precisión del programa.
Por lo general, el uso directo de un conjunto de datos de validación externa respalda la confiabilidad y la solidez del algoritmo de aprendizaje automático.
Ectasia corneal
Los sistemas actuales de diagnóstico y seguimiento de la evolución de las ectasias corneales requieren de información sobre la forma de la superficie anterior, la superficie posterior, el grosor corneal, la biomecánica corneal y/o la potencia refractiva2.
Los estudios sobre la ectasia corneal se han enfocado en un sistema capaz de detectar cambios corneales evidentes, como el queratocono de las córneas normales, además de otros cambios como el astigmatismo y los procedimientos refractivos utilizando datos, obtenidos de diferentes máquinas como Pentacam HR, Topógrafo Corneal Keratron, EyeSys System, videoqueratoscopio asistido por computadora (TMS1-4), Corvis, RTVue, Galilei, CASIA SS-1000, Tomey EM 3000, Sirius y sistema de topografía CSO.
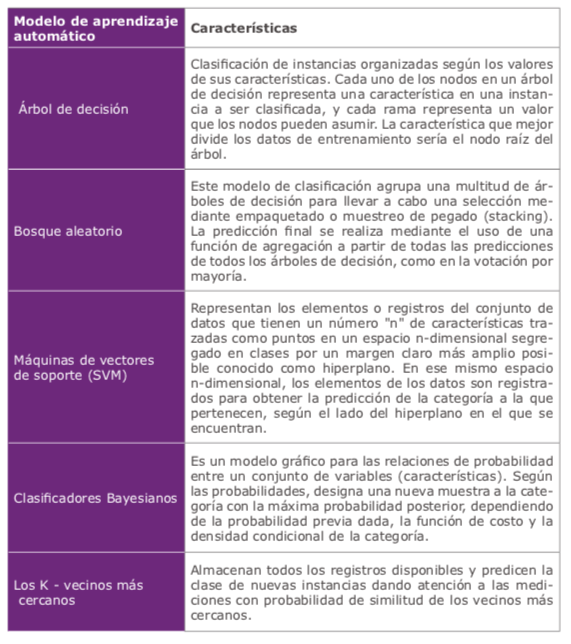
Se han probado múltiples formas diferentes de clasificadores de aprendizaje automático (MLC) como redes neuronales, árboles de decisión, análisis discriminante lineal, bosques aleatorios, máquinas de vectores de soporte, red bayesiana, agrupación basada en densidad, perceptrones multicapa, KNN, aplicados tanto en el diagnóstico como en el manejo de ectasias corneales1. (Tabla 1)
 Los métodos actuales para
Los métodos actuales para
la detección automática del
queratocono son aplicados
bajo supervisión, principal-
mente, porque se requieren
de la clasificación y el diag-
nóstico como entrada para el
aprendizaje automático posterior2,4–7,9–11,17–19,19–24. Algunos
autores han desarrollado y pro-
puesto sistemas de aprendiza-
je automático sin supervisión
ni la necesidad de clasificación
previa de las imágenes y los
datos recopilados, el cual es un
abordaje muy útil para casos
con subtipos de queratocono
difíciles de diagnosticar en la práctica clínica 2,3,5,9 , 17–19,23,25–31.
Se han realizado varios estudios que evalúan la eficacia de la IA en el diagnóstico, clasificación y manejo del queratocono y sus formas más leves. 20,31,28
Twa et al 20, evaluaron la superficie corneal anterior con un polinomio Zernike de séptimo orden y aplicaron un modelo de árbol de decisión para establecer una diferenciación entre un ojo normal y uno queratocónico, con rangos de sensibilidad, especificidad y precisión de un 92%, 93% y 94%, respectivamente. Kamiya et al 31 evalúan la precisión en el diagnóstico del queratocono por medio del uso de aprendizaje profundo aplicado a los mapas de color medidos con la tomografía de coherencia óptica del segmento anterior de swept-source (AS-OCT) con una precisión del 99,1% en la discriminación entre ojos normales y querato cónicos. Silverman et al28 evalúan algoritmos computarizados automatizados para la diferenciación entre córneas normales y queratocónicas basadas únicamente en datos de grosor epitelial y estromal. El análisis discriminante lineal por pasos (LDA) y el análisis de la red neuronal (NN) fueron realizados después dando como resultado un modelo de seis variables que proporcionó un AUC del 100% (el análisis leave-one-out resultó en una especificidad del 99,2% y una sensibilidad del 94,6%).
La IA y formas más leves del queratocono
Algunos autores se han centrado en las formas más leves del queratocono, Arbelaez et al 12 y Smadja et al 6 han demostrado la capacidad de la IA para reconocer las características subclínicas de la ectasia corneal. Arbelaez et al. realizó un gran estudio utilizando un MLC para diferenciar casos subclínicos del queratocono -de los ojos normales, el clasificador tuvo como base de entrenamiento 3.502 ojos
(877 con queratocono; 426 cade ectasia corneal mediante
sos subclínicos de queratocono-; 940 ojos con anomalías; 1259 ojos normales). El sistema logró una precisión del 97,3%, una sensibilidad del 92,0%, y una especifificidad del 97,7% en la detección de casos subclínicos del queratocono-. Smadja et al 6 entrenaron un clasifificadordeárboldedecisión basado en un total de 372 ojos (197 pacientes) divididos en tres grupos (177 ojos normales, 47 casos subclínicos del queratocono, 148 ojos quera- tocónicos), logrando un 93,6% de sensibilidad y un 97,2% de especifificidad en la detección de casos subclínicos del queratocono y un 90,0% de sensibilidad y un 86,0% de especififici- dad después de la poda.
Para Ambrosio et al. el uso de datos tomográfificos, índices biomecánicos (TBI), máquina de vectores y bosque aleatorio re- sultó ser el método más preciso para discriminar entre casos NO VAE y ojos normales. Con un valor de corte de optimización establecido en 0.29, obtuvieron una sensibilidad del 90,4% con una tasa de falsos positivos de 0.04 para detectar casos sub- clínicos de ectasia corneal con el uso de (índice biomecánico tomográfifico) TBI (especifificidad 0.96; AUROC 0.985).
En conclusión, este tipo de progreso en el diagnóstico, la clasifificación y el manejo del queratocono permitirán en un futuro cercano que día a día más personas tengan la posibilidad de una mejor detección de las enfermedades oculares crónicas más prevalentes en lugares donde el acceso a un especialista es limitado, acortando el tiempo del diagnóstico y optimizando los recursos humanos utilizados en aquellas patologías que requieren derivación o
Para mejorar la precisión de la detección de casos subclínicos tratamiento temprano.
Bibliografía
Lu W, Tong Y, Yu Y, Xing Y, Chen C, Shen Y. Applications of Artificial Intelligence in Ophthalmology: General Overview. J Ophthalmol. 2018;2018:5278196. doi:10.1155/2018/5278196
Lopes BT, Ramos IC, Salomão MQ, et al. Enhanced Tomographic Assessment to Detect Corneal Ectasia Based on Artificial Intelligence. Am J Ophthalmol. 2018;195:223-232. doi:10.1016/j.ajo.2018.08.005
Karimi A, Meimani N, Razaghi R, Rahmati SM, Jadidi K, Rostami M. Biomechanics of the Healthy and Keratoconic Corneas: A Combination of the Clinical Data, Finite Element Analysis, and Artificial Neural Network. Curr Pharm Des. 2018;24(37):4474-4483. doi:10.2174/13816128256 66181224123939
Chandapura R, Salomão MQ, Ambrósio R, Swarup R, Shetty R, Sinha Roy A. Bowman’s topography for improved detection of early ectasia. J Biophotonics. 2019;12(10):e201900126. doi:10.1002/jbio.201900126
Smolek MK, Klyce SD. Current keratoconus detection methods compared with a neural network approach. Invest Ophthalmol Vis Sci. 1997;38(11):2290-2299.
Smadja D, Touboul D, Cohen A, et al. Detection of subclinical keratoconus using an automated decision tree classification. Am J Ophthalmol. 2013;156(2):237-246.e1. doi:10.1016/j.ajo.2013.03.034
Ruiz Hidalgo I, Rodriguez P, Rozema JJ, et al. Evaluation of a Machine-Learning Classifier for Keratoconus Detection Based on Scheimpflug Tomography. Cornea. 2016;35(6):827-832. doi:10.1097/ ICO.0000000000000834
Ruiz Hidalgo I, Rozema JJ, Saad A, et al. Validation of an Objective Keratoconus Detection System Implemented in a Scheimpflug Tomographer and Comparison With Other Methods. Cornea. 2017;36(6):689695. doi:10.1097/ICO.0000000000001194
Saika M, Maeda N, Hirohara Y, Mihashi T, Fujikado T, Nishida K. Four discriminant models for detecting keratoconus pattern using Zernike coefficients of corneal aberrations. Jpn J Ophthalmol. 2013;57(6):503509. doi:10.1007/s10384-013-0269-1
Ambrósio R, Lopes BT, Faria-Correia F, et al. Integration of Scheimpflug-Based Corneal Tomography and Biomechanical Assessments for Enhancing Ectasia Detection. J Refract Surg. 2017;33(7):434-443. doi :10.3928/1081597X-20170426-02
FeiziS,YaseriM,KheiriB.PredictiveAbilityofGalileitoDistinguishSubclinical Keratoconus and Keratoconus from Normal Corneas. J Ophthalmic Vis Res. 2016;11(1):8-16. doi:10.4103/2008-322X.180707
Arbelaez MC, Versaci F, Vestri G, Barboni P, Savini G. Use of a support vector machine for keratoconus and subclinical keratoconus detection by topographic and tomographic data. Ophthalmology. 2012;119(11):2231-2238. doi:10.1016/j.ophtha.2012.06.005
SaadA,GatinelD.Topographicandtomographicpropertiesofformefruste keratoconus corneas. Invest Ophthalmol Vis Sci. 2010;51(11):55465555. doi:10.1167/iovs.10-5369
Zou HH, Xu JH, Zhang L, Ji SF, Wang Y. [Assistant diagnose for subclinical keratoconus by artificial intelligence]. Zhonghua Yan Ke Za Zhi. 2019;55(12):911-915. doi:10.3760/cma.j.is sn.0412-4081.2019.12.008
Lin SR, Ladas JG, Bahadur GG, Al-Hashimi S, Pineda R. A Review of Machine Learning Techniques for Keratoconus Detection and Refractive Surgery Screening. Semin Ophthalmol. 2019;34(4):317-326. doi:10.1 080/08820538.2019.1620812
16. Shen J, Zhang CJP, Jiang B, et al. Artifificial Intelligence Versus Clinicians in Disease Diagnosis: Systematic Review. JMIR Med Inform. 2019;7(3). doi:10.2196/10010
17. Maeda N, Klyce SD, Smolek MK. Comparison of methods for detecting keratoconus using videokeratography. Arch Ophthalmol. 1995;113(7):870874. doi:10.1001/archopht.1995.01100070044023
18. Accardo PA, Pensiero S. Neural network-based system for early keratoconus detection from corneal topography. J Biomed Inform. 2002;35(3):151159. doi:10.1016/s1532-0464(02)00513-0
19. Souza MB, Medeiros FW, Souza DB, Garcia R, Alves MR. Evaluation of machine learning classififiers in keratoconus detection from orbscan II examinations. Clinics (Sao Paulo). 2010;65(12):1223-1228. doi:10.1590/ s1807-59322010001200002
20. Twa MD, Karpecki PM, King BJ, Linn SH, Durrie DS, Schanzlin DJ. Oneyear results from the phase III investigation of the KeraVision Intacs. J Am Optom Assoc. 1999;70(8):515-524.
21. Chastang PJ, Borderie VM, Carvajal-Gonzalez S, Rostène W, Laroche L. Automated keratoconus detection using the EyeSys videokeratoscope. J Cataract Refract Surg. 2000;26(5):675-683. doi:10.1016/s08863350(00)00303-5
22. Maeda N, Klyce SD, Smolek MK, Thompson HW. Automated keratoconus screening with corneal topography analysis. Invest Ophthalmol Vis Sci. 1994;35(6):2749-2757.
23. 23. Yousefifi S, Yousefifi E, Takahashi H, et al. Keratoconus severity identifification using unsupervised machine learning. PLoS ONE. 2018;13(11):e0205998. doi:10.1371/journal.pone.0205998
24. Castro-Luna GM, Martínez-Finkelshtein A, Ramos-López D. Robust keratoconus detection with Bayesian network classififier for Placido-based corneal indices. Cont Lens Anterior Eye. December 2019. doi:10.1016/j. clae.2019.12.006
25. Soria J, Villarrubia A, Merayo-Lloves J, et al. Label-free LC-MS/MS quantitative analysis of aqueous humor from keratoconic and normal eyes. Mol Vis. 2015;21:451-460.
26. Kovács I, Miháltz K, Kránitz K, et al. Accuracy of machine learning classififiers using bilateral data from a Scheimpflflug camera for identifying eyes with preclinical signs of keratoconus. J Cataract Refract Surg. 2016;42(2):275-283. doi:10.1016/j.jcrs.2015.09.020
27. Issarti I, Consejo A, Jiménez-García M, Hershko S, Koppen C, Rozema JJ. Computer aided diagnosis for suspect keratoconus detection. Comput Biol Med. 2019;109:33-42. doi:10.1016/j.compbiomed.2019.04.024
28. Silverman RH, Urs R, RoyChoudhury A, Archer TJ, Gobbe M, Reinstein DZ. Combined tomography and epithelial thickness mapping for diagnosis of keratoconus. Eur J Ophthalmol. 2017;27(2):129-134. doi:10.5301/ ejo.5000850
29. Lavric A, Valentin P. KeratoDetect: Keratoconus Detection Algorithm Using Convolutional Neural Networks. Comput Intell Neurosci. 2019;2019:8162567. doi:10.1155/2019/8162567
30. Carvalho LA. Preliminary results of neural networks and zernike polynomials for classifification of videokeratography maps. Optom Vis Sci. 2005;82(2):151-158. doi:10.1097/01.opx.0000153193.41554.a1
31. Kamiya K, Ayatsuka Y, Kato Y, et al. Keratoconus detection using deep learning of colour-coded maps with anterior segment optical coherence tomography: a diagnostic accuracy study. BMJ Open. 2019;9(9):e031313. doi:10.1136/bmjopen-2019-031313
32. Henriquez MA, Izquierdo L, Belin MW. Intereye Asymmetry in Eyes With Keratoconus and High Ammetropia: Scheimpflflug Imaging Analysis. Cornea. 2015;34 Suppl 10:S57-60. doi:10.1097/ICO.0000000000000608

