Cirugía regenerativa del estroma corneal: un nuevo futuro para el tratamiento del queratocono
Prof. Dr. Jorge L Alió – España
Dr. Jorge L. Alió del Barrio – España Dra. Mona Zarif O.D – Líbano
Contacto
Prof. Dr. Jorge L Alió – jlalio@vissum.com
Dr. Jorge L. Alió del Barrio – jorge_alio@hotmail.com Dra. Mona Zarif O.D – monazarifaj@hotmail.com
1. INTRODUCCIÓN:
Ingeniería tisular para el reemplazo del estroma corneal
La ingeniería tisular es aquella rama de la ciencia que emplea la combinación de células, biomateriales y elementos físico-químicos con el objetivo de mejorar o reemplazar cualquier función biológica del organismo, cuando se aplica en la córnea, induce una mejora, regeneración o sustitución de las funciones del estroma corneal.
El estroma corneal supone más del 90% del espesor de la córnea, sus funciones de resistencia, transparencia y refracción son atribuibles a su compleja anatomía y ultraestructura. La matriz extracelular del estroma corneal está compuesta de:
 A) Colágeno, que supone más del 70% del peso de la córnea deshidratada, siendo el más abundante el tipo 1 (75%). (B) Proteoglicanos, incluyendo el queratán sulfato que es el más abundante (65%), cuyo núcleo proteico está compuesto de lumicán, queratocán y mimecán 1. El queratocán es expresado únicamente en el estroma corneal, por ello es considerado en ingeniería tisular como un marcador específico de diferenciación queratocítica 2. El componente celular del estroma corneal ocupa únicamente el 2-3% del volumen estromal, y en él las células predominantes son los queratocitos, células mesenquimales que derivan de la cresta neural, que se distribuyen entre las lamelas de colágeno. Los queratocitos están en estado quiescente en la córnea normal, son los responsables del constante reemplazo de la matriz extracelular estromal mediante la producción de colágeno esencial para el mantenimiento de la trasparencia corneal. Ante las agresiones, los queratocitos activan su metabolismo y se transdiferencian en fifibroblastos y miofifibroblastos, los cuales participan en la cicatrización del estroma corneal. La capacidad de renovación de los queratocitos estromales se debe a células precursoras en el estroma corneal limbar anterior, las cuales expresan marcadores de célula madre adulta como ABCG2 3.
A) Colágeno, que supone más del 70% del peso de la córnea deshidratada, siendo el más abundante el tipo 1 (75%). (B) Proteoglicanos, incluyendo el queratán sulfato que es el más abundante (65%), cuyo núcleo proteico está compuesto de lumicán, queratocán y mimecán 1. El queratocán es expresado únicamente en el estroma corneal, por ello es considerado en ingeniería tisular como un marcador específico de diferenciación queratocítica 2. El componente celular del estroma corneal ocupa únicamente el 2-3% del volumen estromal, y en él las células predominantes son los queratocitos, células mesenquimales que derivan de la cresta neural, que se distribuyen entre las lamelas de colágeno. Los queratocitos están en estado quiescente en la córnea normal, son los responsables del constante reemplazo de la matriz extracelular estromal mediante la producción de colágeno esencial para el mantenimiento de la trasparencia corneal. Ante las agresiones, los queratocitos activan su metabolismo y se transdiferencian en fifibroblastos y miofifibroblastos, los cuales participan en la cicatrización del estroma corneal. La capacidad de renovación de los queratocitos estromales se debe a células precursoras en el estroma corneal limbar anterior, las cuales expresan marcadores de célula madre adulta como ABCG2 3.
Se han llevado a cabo muchos intentos para reproducir el estroma corneal en el laboratorio, con el fifin de reducir la necesidad de córneas donantes 4, pero la elevada complejidad de este tejido hace que estos constructos artifificiales acaben fracasando.
En los últimos años, con el desarrollo de la ingeniería tisular, se desarrolló la idea de utilizar células madre oculares o extraoculares, que mediante su diferenciación hacia queratocitos adultos funcionales, sean capaces de fabricar de forma natural este tejido tan complejo de reproducir.
2. INVESTIGACIONESPRECLÍNICAS
 2.1. Células madre empleadas en la ingeniería tisular del estroma corneal
2.1. Células madre empleadas en la ingeniería tisular del estroma corneal
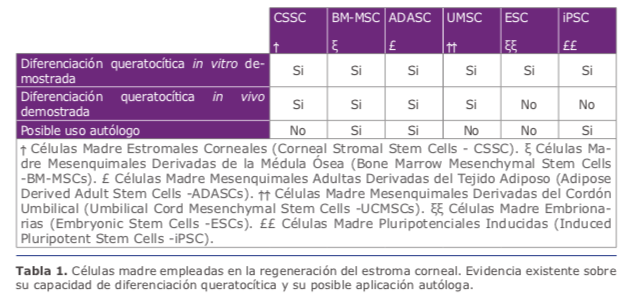
• Todas las células madre mesenquimales parecen tener un comportamiento similar in vivo, siendo capaces de conseguir la diferenciación hacia queratocitos adultos funcionales y modular el estroma corneal, presentando además propiedades inmunomoduladoras que evitan cualquier tipo de respuesta inflamatoria o rechazo aún en escenarios xenogénicos (interespecie) (Tabla 1) 1. Las CSSCs presentan ventajas respecto al resto, por el hecho de que ya son células corneales con un potencial de diferenciación más directo. Sin embargo, la obtención de células madre estromales corneales se queda limitado, técnicamente complejo y puede dañar el tejido donante, para sustituirlo surge la necesidad de disponer de una fuente extraocular de células madre con potencial de diferenciación queratocítica. En este sentido, el tejido adiposo humano ha demostrado ser una fuente ideal de células madre autólogas, ya que es un tejido de fácil acceso, fácil cultivo que las BM-MSC y las BM-MSC. Además las ADASCs han demostrado que pueden diferenciarse en múltiples líneas celulares (queratocitos, osteoblastos, condroblastos, mioblastos, hepatocitos, neuronas, etc)(Figura1A) (Tabla1)1.
2.2. Técnicas terapéuticas empleadas en la ingeniería tisular del estroma corneal
Se han ensayado diferentes técnicas in vivo para trasplantar las células con motivos de regenerar el estroma corneal. Fundamentalmente podemos hablar de cuatro tipos de abordajes:
2.2.1. Implantación intraestromal de células madre
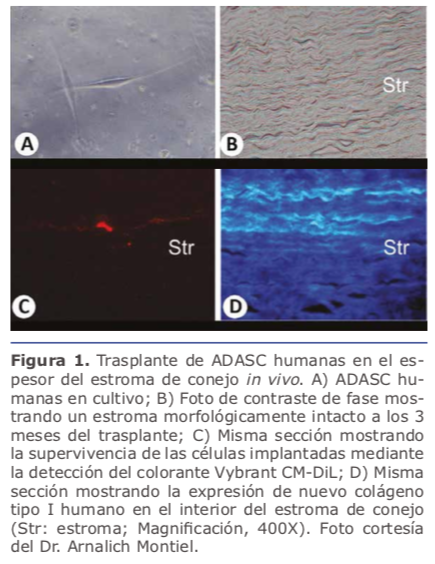
La implantación directa de células madre en el espesor del estroma corneal ha sido utilizado in vivo en modelos experimentales, demostrando la diferenciación de los diferentes tipos de células madre inyectados en queratocitos adultos funcionales y en ausencia de respuesta inflflamatoria alguna o rechazo. Nuestro grupo mediante el empleo de bolsillos intraestromales disecados manualmente o asistidos con láser de femtosegundo, fue el primero en demostrar la capacidad de las ADASCs en conseguir esta diferenciación in vivo, además de su capacidad de producir matriz extracelular humana nueva en el interior de la córnea del conejo 5. (Ver fifigura 1B-1D) Du y col. publicaron estudios sobre la recuperación de la trasparencia y el grosor corneales a los 3 meses después de la implantación intraestromal de CSSCs humanas6. Observaciones similares en estudios experimentales fueron reportadas por Liu y col. mediante el empleo de UMSCs 7 y Thomas y col. mediante el trasplante de las UMSCs trasplantadas en el estroma corneal 8.
 Sin embargo, nuestro equipo de investigación acaba de fifinalizar el primer ensayo clínico en humanos empleando células madre con el objetivo de regenerar el estroma corneal9. En este estudio piloto se implantaron ADASCs autólogas, en el interior de un bolsillo intraestromal asistido por láser de femtosegundo en pacientes con queratocono (estadío ≥ 4) cuya única alternativa terapéutica era ya el trasplante de córnea. La supervivencia celular in vivo mediante microscopía confocal así como la aparición de áreas parcheadas de colágeno neoformado en pequeñas cantidades con un leve aumento paquimétrico (Ver figura 2A-2B), pero este aumento paquimétrico producido no sería suficiente como para rehabilitar el grosor de una córnea muy adelgazada o debilitada. En estos casos sería necesaria la adición de algún sustrato que potencie o complemente estos resultados (Ver figura 2 C, 2D).
Sin embargo, nuestro equipo de investigación acaba de fifinalizar el primer ensayo clínico en humanos empleando células madre con el objetivo de regenerar el estroma corneal9. En este estudio piloto se implantaron ADASCs autólogas, en el interior de un bolsillo intraestromal asistido por láser de femtosegundo en pacientes con queratocono (estadío ≥ 4) cuya única alternativa terapéutica era ya el trasplante de córnea. La supervivencia celular in vivo mediante microscopía confocal así como la aparición de áreas parcheadas de colágeno neoformado en pequeñas cantidades con un leve aumento paquimétrico (Ver figura 2A-2B), pero este aumento paquimétrico producido no sería suficiente como para rehabilitar el grosor de una córnea muy adelgazada o debilitada. En estos casos sería necesaria la adición de algún sustrato que potencie o complemente estos resultados (Ver figura 2 C, 2D).
2.2.2. Implantación intraestromal de células madre junto con un trasportador biodegradable
Se ensayaron varios estudios experimentales con el objetivo de potenciar el crecimiento y
supervivencia de las células madre implantadas dentro del estroma corneal, se estudiaron la adición de matrices extracelulares sintéticas biodegradables junto con el componente celular. Espandar y col. usaron matrices sintéticas biodegradables de hidrogel de ácido hialurónico semisólido 10, Ma y col. usaron polylactic-co-glycolic (PLGA) biodegradable 11, observaron una mayor supervivencia y diferenciación queratocítica de las ADASCs en comparación con los casos que recibieron el trasplante celular aislado.
2.2.3. Implantación intraestromal de células madre junto con un trasportador no biodegradable
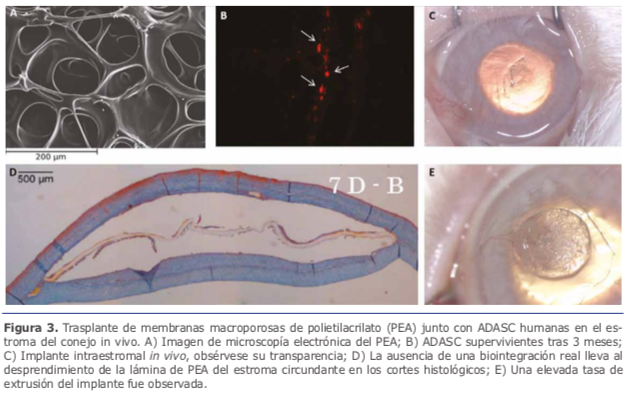
El principal obstáculo para la producción de una córnea artificial es la reproducción de la arquitectura compleja del estromal corneal. Recientes estudios han creado nuevos biomateriales como son los hidrogeles de poli-hidroxietil metacrilato, hidrogeles de colágeno-condroitín sulfato, y poliuretanos 12. La combinación de estos biomateriales junto con células pudiera generar equivalentes estromales prometedores 13. Mimura y col. emplearon precursores de fifibroblastos corneales junto con hidrogeles porosos de gelatina in vivo, pero fracasaron para el uso clínico 14. Nuestro equipo investigó la supervivencia y biointegración de injertos compuestos de membranas macroporosas de polietilacrilato (PEA) (Ver fifigura 3A) colonizadas en su interior por células madre de tipo ADASCs, trasplantados en estroma del conejo in vivo (Ver fifigura 3C) 15. Se pudo demostrar tras 3 meses de seguimiento la supervivencia in vivo de las ADASC en el interior de los injertos sintéticos (Ver fifigura 3B), pero no su diferenciación correcta en queratocitos adultos (Ver fifigura 3E). Se concluyó que las células madre no reciben el estímulo adecuado para su diferenciación queratocítica en presencia de biomateriales sintéticos, perdiendo así su posibilidad de generar nuevo colágeno e integrarse en el estroma que lo rodea (Ver fifigura 3D).
2.2.4. Implantación intraestromal de células madre junto con estroma corneal descelularizado
En los últimos años se han desarrollado múltiples métodos de descelularización corneal16. Estos tejidos acelulares proporcionan el ambiente más fifisiológico posible para permitir el crecimiento y diferenciación de las células madre en queratocitos funcionales, a la vez que proporcionan una mejoría anatómica inmediata por su aporte de tejido junto con una teórica ausencia completa de riesgo de rechazo al eliminar cualquier componente celular antigénico. Los componentes de la matriz extracelular son perfectamente tolerados aún en escenarios xenogénicos sin generar respuesta inflamatoria alguna.
Esto pone de manifiesto la importancia de trasplantar un sustituto celular junto con el soporte estructural acelular asegurando la trasparencia y la homeostasis de la córnea 17–19. De ahí nuestro grupo demostró en un estudio experimental previo la perfecta biointegración in vivo de láminas de estroma corneal humano descelularizado con y sin posterior recelularización con células ADASC humanas, trasplantadas en el interior del estroma corneal del conejo (Ver figura 4), sin observar respuesta inflamatoria alguna a pesar de ser un trasplante xenogénico 20.También pudo demostrar la diferenciación de las células madre en queratocitos adultos funcionales in vivo en el interior de estos injertos.
Mediante este modelo de trasplante se obtendrían las ventajas de la terapia celular corneal a la vez que se regenera de forma más eficiente la anatomía corneal en aquellas córneas más debilitadas, sin teórico riesgo de rechazo pues el modelo permite transformar un tejido donante alogénico en uno autólogo.
3. ESTUDIOS CLÍNICOS EN HUMANOS
Nuestro equipo de investigación ha finalizado el primer ensayo clínico realizado en humanos con seguimiento ya a 3 años, donde se emplearon láminas de tejido corneal descelularizado 9,21–25. Estos estudios se fundamentan en la extensa experiencia preclínica acumulada por nuestro grupo de investiga-
ción en los estudios antes citados 15,20. En nuestro estudio clínico se han investigado los beneficios que proporciona a la córnea patológica este tipo de injertos en casos de queratocono avanzado (estado ≥ IV), tanto en forma de láminas acelulares como laminas recelularizadas con células madre mesenquimales autólogas obtenidas del tejido adiposo (ADASc) del mismo paciente, los resultados clínicos demostraron la viabilidad de ésta técnica observando una excelente restauración anatómica de la córnea (Ver Figura 2B) 21–25.
3.1. Aprobación del estudio, diseño y materiales
Este estudio clínico fue prospectivo y aleatorizado de intervención de una serie casos consecutivos. El estudio se realizó siguiendo estrictamente los principios de la Declaración de Helsinki y se registró en ClinicalTrials.gov (Código: NCT02932852).
14 pacientes participaron en el estudio, se operaron dentro de un intervalo de tres meses y se distribuyeron aleatoriamente en tres grupos de estudio: los pacientes del grupo (G-1) fueron tratados con un implante antólogo de ADASC (n = 5 pacientes); el grupo 2 (G-2) recibió un implante de estroma corneal humano descelularizado (n = 5 pacientes) y el grupo 3 (G-3) recibió un implante de estroma corneal humano recelularizado con autólogas ADASCs (n = 4 pacientes).
Los criterios de inclusión y exclusión se definieron en artículos publicados anteriormente 9,21–25.
3.2. Metodología
3.2.1. Aislamiento, caracterización y cultivo antólogo de ADASC.
Los pacientes se sometieron a una liposucción estándar. Se obtuvieron de cada paciente aproximadamente 250 ml de grasa mezclada con anestesia local. El tejido adiposo se procesó de acuerdo con los métodos descritos en los artículos anteriores 26–28.
3.2.2. Láminas.
Se utilizó estroma corneal humano de córneas de donantes con endotelio no viable, pero con serología viral negativa. Las córneas fueron proporcionadas por el banco de ojos «Banco de Ojos para el tratamiento de la Ceguera, Centro de Oftalmología Barraquer (Barcelona, Spain) siguientes directivas 2004/23/EC and 206/17/ EC». Se siguieron los estándares de calidad y todas pruebas de seguridad para la donación de tejidos (28) humanos. Se disecaron las córneas de los donantes con láser de femtosegundo IntraLase iFS (AMO, Santa Ana, CA), se obtuvieron 2-3 láminas consecutivas de 120 (μm) de espesor y 9.0 mm de diámetro. El protocolo de descelularización se basó en publicaciones anteriores 16,20,29. 24 horas antes de la implantación, las láminas para los pacientes que recibieron tejido recelularizado se recelularizaron con ADASCs autólogas (1× 106 ADASCs). Luego las láminas se transfifirieron a la implantación. 21,22,24.
3.3.3. Procedimiento quirúrgico: Implantación ADASCs autólogas
El método para la implantación de las células madre mesenquimales se ha descrito previamente 9. Se utilizó anestesia tópica. Se usó láser de femtosegundo IntraLase iFS de 60 Khz (AMO Inc, Irvine, CA) en modo de paso único para la disección laminar corneal del receptor. Se creó un corte laminar intraestromal de 9,5 mm de diámetro a media profundidad del punto de paquimetría preoperatoria más delgado medido por el OCT de Visante (Carl Zeiss, Alemania). Se inyectaron en el bolsillo 3 × 106 de ADASCs contenidos en 1 ml de PBS. (Ver fifigura 2A, 2B)
Implantación del lentículo
Se aplicó anestesia tópica con sedación oral para todas las cirugías, el láser de femtosegundo IntraLase iFS de 60 kHz se usó en modo de paso único. La disección corneal asistida se realizó con un corte anterior de 500, a media profundidad del punto de paquimetría preoperatoria más delgado medido por el OCT de Visante (Carl Zeiss, Alemania) (Ver fifigura 2E, 2F). Después de abrir el bolsillo intraestromal corneal, la lámina se insertó, se centró y se desplegó mediante una suave cinta adhesiva y masaje desde la superfificie epitelial del huésped. En aquellos casos que recibieron una lámina recelularizada G-3, para compensar el daño celular esperado por el proceso de implantación, el bolsillo se irrigó inmediatamente antes y después de la inserción con una solución que con-
6
tenía (1× 10 ) adicional de ADASCs en 1
ml de PBS con una cánula de 25G. Luego se cerró la incisión con una sutura de nylon 10/0 interrumpida 21.
3.3.4. Cuidado postoperatorio y cronograma de seguimiento:
Después de la operación, los pacientes fueron evaluados mensualmente para registrar cualquier evidencia de incomodidad subjetiva, inflflamación ocular o pérdida visual inesperada repentina. A los efectos de la evaluación de los otros parámetros clínicos, los pacientes fueron seguidos a 1 día, 1 semana y 1,3, 6, 12 y 36 meses después de la cirugía. Con el fifin de observar la seguridad del implante durante un largo tiempo. Se evaluó la agudeza visual de distancia sin corrección (AVSC), la agudeza visual corregida (AVCC) y la agudeza visual corregida con lentes de contacto rígidas (AVCLC) in (decimales equivalentes a la escala de logMar). También se evaluaron la esfera refractiva (Rx Sphr) (D) y el cilindro refractivo (Rx Cyl) (D). El espesor corneal central (Visante CCT) (μm) (Carl Zeiss) (Ver fifigura 2), el punto más delgado en el Pentacam (Thinnest point) (μm), el volumen de la córnea (VC) (mm3), la queratometría máxima (Kmax) (D) (Ver fifigura 5, 6A, 6B), las aberrometrías corneales con diámetro máximo de pupilas de 6 mm (Pentacam; Oculus Inc., Wetzlar, Alemania) (Ver figura 6C, 6D) y la biomicroscopía con lámpara de hendidura (Ver figura 7). Mas variables estudiados se encuentran en previas publicaciones 24,25. Se usó el microscopio confocal HRT3 con un módulo de córnea Rostock RCM (Heidelberg Engineering, Heidelberg, Alemania) 23, 30.
3.3.5. Estudio de microscopía confocal
Los pacientes fueron examinados con el microscopio confocal HRT3 previamente antes de la cirugía y seguidos durante 1,3, 6 y 12 meses postoperatorios con el fin de observar en vivo el desarrollo y la evolución de las células ADASC y de las láminas descelularizadas/recelularizadas implantadas a lo largo de los meses. La metodología de recuento de células se encuentra más detallada en un estudio previamente publicado23.
4. RESULTADOS
4.1. Implantaciones ADASc autólogas: resultados clínicos
No se observaron complicaciones durante los 3 años de seguimiento hasta el momento. No se encontraron eventos adversos como “leucoma” o “haze” . Se recuperó la transparencia corneal completa en el primer día postoperatorio en todos los pacientes (Ver figura 2 A, 2B). En el caso-2 del G-1 se observaron una mejoría muy notable de unas cicatrices preoperatorios hasta los 36 meses postoperatorios (Ver figura 7A, 7B). Todos los casos presentaron una mejora de 1-2 líneas en la escala LogMar en la agudeza visual a lo largo de los 36 meses posoperatorios con respecto a los valores preoperatorios en la AVSC, AVCC y AVCLC en (de-
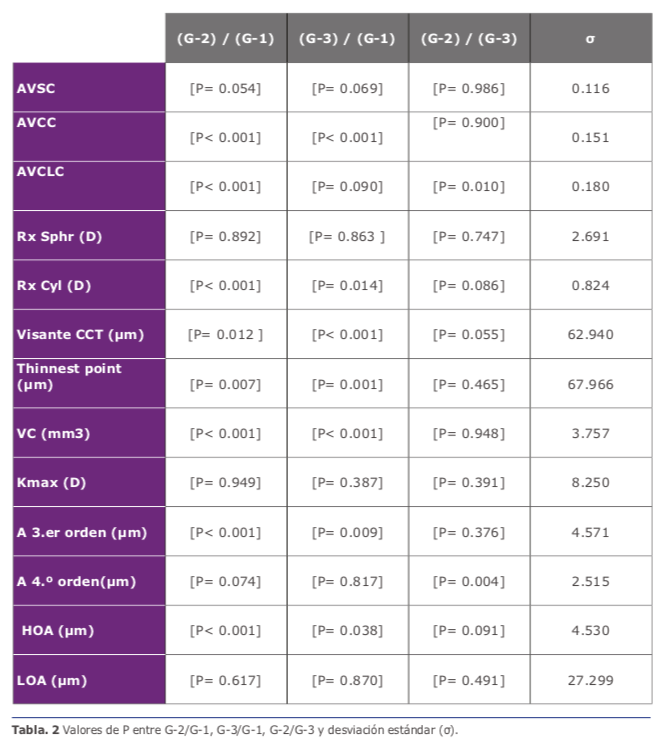
cimas). Se registró una mejora significativa en los valores medios comparando G-2 y G-3 con G-1 con todos los casos a los 36 meses postoperatorios con respecto a los valores medios preoperatorios, los valores P y la desviación estándar se presentaron en (Ver tabla 2).
Por otro lado, la Rx Sphr (D) presentó una mejora significativa hasta los 36 meses después de la operación, mientras tanto; Rx Cyl (D) presentó un cambio de 0.5 (D) hasta los 36 meses con respecto a los va- lores medios preoperatorios, los valores de P se presentaron en la 24,25. (Ver tabla 2)
Los resultados del Visante CCT (μm) (Ver figura 2A- 2D), del punto Pentcam Thin- nest (μm) y VC (mm3), mostraron unos re- sultados de valores medios estadísticamente significativos comparando G-2 y G-3 con G-1 a los 36 meses con respecto a los valores medios preoperatorios 24,25. (Ver tabla 2)
Las aberraciones con valores estadística- mente significativos se obtuvieron solo con los valores medios en aberraciones de ter- cer orden (A. 3.er) y en aberraciones de alto orden (HOA) (μm) comparando G-2 y G-3 con G-1. Los de cuarto orden (A. 4.o or- den) (μm) y de bajo orden (LOA) (μm) presentaron solo una mejora, pero con no diferencia significativa hasta los 36 meses postoperatorios (Ver tabla 2) 24,25. Tam- bién, se obtuvo un aplanamiento en los va- lores medios de 3 (D) en Kmax (D) hasta los 36 meses después de la cirugía con res- pecto a los valores medios preoperatorios, se registraron más resultados en publica- ciones anteriores 24,25.
4.2. Resultados con la implantación de la lámina: resultados clínicos
Los autores no observaron ninguna compli- cación ni eventos adversos de ningún tipo durante el seguimiento hasta los 3 años, con la excepción de que la lámina implantada
mostró una leve turbidez temprana du- rante el primer mes posoperatorio, este problema estaba relacionado con un ede- ma lenticular leve. Se observó una recu- peración corneal y total transparencia en el tercer mes posoperatorio en todos los casos (Ver figura 2E, 2F, 7C-7F) 24, 25.
Todos los pacientes con láminas desce- lularizadas o recelularizadas obtuvieron una mejoría a los 6,12 y 36 meses poso- peratorios en los valores medios con res- pecto a los valores preoperatorios, a los 3 años posoperatorios los resultados de mejoradela AVSC fuerondehasta0,13 en valores decimales casi equivalentes a una línea en escala LogMar con lámi- nas descelularizadas y recelularizadas, la AVCC mejoró dehasta0.2conláminas descelularizadas y recelularizadas, equi- valentes a 2 líneas en la escala LogMar, así como la mejoría media en AVCLC era de 0.23 con láminas descelularizadas y recelularizadas, equivalentes a más de 2 líneas en la escala de LogMar. También los resultados medios de VC (mm3) demos- traron una mejora en los valores medios de 2-3 (mm3) en ambos grupos de lámi- nas a los 6,12 y 36 meses posoperatorio con respecto a los valores preoperatorios 24,25 (Ver tabla. 2). Las otras variables de la Rx Sphr (D), el Rx Cyl (D), Vi- sante CCT (μm) (Ver figura 2E, 2F), el Pentcam Thinnest (μm) (Ver figura 5, 6A,6B), aberración de tercer orden ((A. 3.er)) (μm) (Ver figura 6C,6D), abe- rración de cuarto orden (A. 4.o orden) (μm), HOA, aberración de bajo orden LOA (μm), km anterior (D) , Km pos- terior (D), Kmax (D) y Topo Cyl (D) con láminas descelularizadas y recelulari- zadas (Ver figura 5, 6A,6B), mostraron unos resultados cercanos a los resultados de los pacientes con la implantación de solo células ADASC explicados anterior- mente y publicados en publicaciones revi- sadas preoperatorios 24,25. (Ver tabla. 2)
4.3. Estudio de microscopía confocal
Las células ADASC mostraron una forma redon- deada, más refringente y más luminosa en com- paración con los queratocitos del huésped. Sin embargo, la forma de las ADASCs se cambió de redondo a fusiforme a los seis meses después de la cirugía. 12 meses después de la cirugía, ob- servamos un aumento gradual estadísticamente significativo (p <0.001) en la densidad celular en el estroma anterior, medio y posterior 23.
Mientras las láminas descelularizadas aparecieron acelulares en el primer mes, a diferencia de las láminas recelularizadas que mostraron unas es- tructuras similares a los queratocitos corneales, el número de células aumentó durante los 12 meses de seguimiento. Las superficies anterior, media y posterior de las láminas descelularizadas y rece- lularizadas se colonizaron más por las células de tipo queratocito, hasta que mostraron una morfo- logía similar a los queratocitos corneales norma- les y alcanzaron una densidad celular con valores medios estadísticamente significativos (p <0.001) en comparación con el primer mes posoperatorio. La densidad celular del estroma corneal anterior y posterior también, mostró un aumento estadís- ticamente significativo (p <0.001) respecto a los valores preoperatorios 23.
5. CONCLUSION:
La terapia regenerativa y celular del estroma cor- neal es factible, resultando de acuerdo con nues- tras investigaciones una nueva técnica quirúrgica segura y clínicamente viable, siendo alentadores los resultados clínicos obtenidos, en los cuales se objetiva la existencia de una modesta pero signi- ficativa mejoría en todos los casos del estudio en queratocono avanzado, en los que la indicación se hizo como alternativa quirúrgica compasiva al- ternativa a la queratoplastia. Este nuevo estudio requiere aumentar en el futuro el número clínico de pacientes y demostrar la relevancia de los re- sultados clínicos observados. Es indudable que en los próximos años los nuevos ensayos clíni- cos terminaran de dar luz a un nuevo tratamiento quirúrgico, mínimamente invasivo, de las enfer- medades del estroma corneal.
BIBLIOGRAFIA
- De Miguel MP, Casaroli-Marano RP, Nieto-Nico- lau N, Martínez-Conesa, Eva M. Alió del Barrio JL, Alió JL, Fuentes S, et al. Frontiers in Rege- nerative Medicine for Cornea and Ocular Surfa- ce. Rahman AU,. 2015. 92–138 p.
- Carlson EC, Liu C-Y, Chikama T, Hayashia Y, Kao CW-C, Birk DE, et al. Keratocan, a Cornea-spe- cific Keratan Sulfate Proteoglycan, Is Regulated by Lumican. J Biol Chem. 2005;280:25541–7.
- Du Y, Funderburgh M, Mann M, SundarRaj N, Funderburgh J. Multipotent stem cells in human corneal stroma. Stem Cells. 2005;23(9):1266– 75.
- Ruberti J, Zieske J. Prelude to corneal tissue engineering – gaining control of collagen orga- nization. Prog Retin Eye Res. 2008;27(5):549– 77.
- Arnalich-Montiel F, Pastor S, Blazquez-Marti- nez, A Fernandez-Delgado J, Nistal M, Alio J, De Miguel M. Adipose-derived stem cells are a source for cell therapy of the corneal stroma. Stem Cells. 2008;26(2)::570-9.
- 6. Du Y, Carlson E, Funderburgh M, Birk D, Pearlman E, Guo N, et al. Stem cell therapy restores transparency to defective murine cor- neas. Stem Cells. 2009;27(7):1635–42.
- 7. Hongshan L, Jianhua Z, Chia-Yang L, I- Jong W, Martin S, John C, et al. Cell Therapy of Congenital Corneal Diseases with Umbilical Mesenchymal Stem Cells: Lumican Null Mice. PLoS One. 2010;5(5):e10707.
- Coulson Thomas VJ, Caterson B, Kao W. Trans- plantation of human umbilical mesenchymal stem cells cures the corneal defects of Mu- copolysaccharidosis VII mice. Stem Cells. 2013;31(10):2116–2126.
- Alió Del Barrio J, El Zarif M, de Miguel M, Azaar A, Makdissy N, Harb W, et al. Cellular Thera- py With Human Autologous Adipose-Derived Adult Stem Cells for Advanced Keratoconus. Cornea. 2017;36(8):952–60.
- Espandar L, Bunnell B, Wang G, Gregory P, McBride C, Moshirfar M. Adipose-derived stem cells on hyaluronic acid-derived scaffold: a new horizon in bioengineered cornea. Arch Ophthalmol. 2012;130(2):202–8.
- Ma X-Y, Bao H-J, Cui L, Zou J. The Graft of Au- tologous Adipose-Derived Stem Cells in the Corneal Stromal after Mechanic Damage. PLoS One. 2013;8(10):e76103.
- De Miguel M, Alio J, Arnalich-Montiel F, Fuen- tes-Julian S, de Benito-Llopis, L Amparo F, Ba- taille L. Cornea and ocular surface treatment. Curr Stem Cell Res Ther. 2010;5(2):195–204.
- Hu X, Lui W, Cui L, Wang M, Cao Y. Tissue engi- neering of nearly transparent corneal stroma. Tissue Eng. 2005;11(12):1710–7.
-
14. Mimura T, Amano S, Yokoo S, Uchida S, Yamagami S, Usui T, et al. Tissue engineering of corneal stroma with rabbit fifibroblast precursors and gelatin hydrogels. Mol Vis. 2008;14:1819–28.
15. Alió del Barrio JL, Chiesa M, Ferrer GG, Garagorri N, Briz N, Fernandez‐Del- gado J, et al. Biointegration of corneal macroporous membranes based on poly(ethyl acrylate) copolymers in an experimental animal model. Adv Sci. 2015;103(3):1106–18.
16. Lynch A, Ahearne M. Strategies for developing decellularized corneal scaffolds. Exp Eye Res. 2013;108:42–7.
17. Choi J, Williams J, Greven M, Walter K, Laber P, Khang G, et al. Bioengineering endothelialized neo-corneas using donor-derived corneal endothelial cells and decellularized corneal stroma. Biomaterials. 2010;31(26):6738–45.
18. Shafifiq MA, Gemeinhart, Richard A. Yue BYJT, Djalilian AR. Decellularized Hu- man Cornea for Reconstructing the Corneal Epithelium and Anterior Stroma. Tissue Eng Part C Methods. 2012;18(5):340–348.
19. Gonzalez-Andrades M, de la Cruz Cardona, J, Ionescu A, Campos A, Del Mar Perez M, Alaminos M. Generation of bioengineered corneas with dece- llularized xenografts and human keratocytes. Invest Ophthalmol Vis Sci. 2011;52(1):215–22.
20. Alio del Barrio J, Chiesa M, Garagorri N, Garcia-Urquia N, Fernandez-Delgado, J Bataille L, Rodriguez A, et al. Acellular human corneal matrix sheets seeded with human adipose-derived mesenchymal stem cells integrate functionally in an experimental animal model. Exp Eye Res. 2015;132:91–100.
21. Alió Del Barrio J, El Zarif M, Azaar A, Makdissy N, Khalil C, Harb W, et al. Corneal Stroma Enhancement With Decellularized Stromal Laminas With or Without Stem Cell Recellularization for Advanced Keratoconus. Am J Ophthal- mol. 2018;186:47–58.
22. Alió J, Alió Del Barrio J, El Zarif M, Azaar A, Makdissy N, Khalil C, et al. Re- generative Surgery of the Corneal Stroma for Advanced Keratoconus: 1-Year Outcomes. Am J Ophthalmol. 2019;203:53–68.
23. El Zarif M, Abdul Jawad K, Alió del Barrio JL, Abdul Jawad Z, Palazón-Bru A, De Miguel MP, et al. Corneal stroma cell density evolution in keratoconus corneas following the implantation of adipose mesenchymal stem cells and corneal la- minas: an in vivo confocal microscopy study. IOVS. 2020;61(4):22.
24. El Zarif M, Alió JL, Alió del Barrio JL, Abdul Jawad K, Palazón-Bru A, Abdul Jawad Z, et al. Corneal stromal regeneration therapy for advanced keratoco- nus: long term outcomes at 3 years. Ophthalmology. 2020;
25. El Zarif M, De Miguel MP, Alió del Barrio JL, Abdul Jawad, Karim Makdissy N, Alió JL. Corneal Stroma Regeneration Therapies. Part B: Human clinical stu- dies. Exp Eye Res. 2020;
26. Zuk P, Zhu M, Mizuno H, Huang J, Futrell J, Katz A, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001;7(2):211–28.
27. Zuk P, Zhu M, Ashjian P, De Ugarte D, Huang J, Mizuno H, et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 2002;13(12):4279– 95.
28. Bourin P, Bunnell B, Casteilla L, Dominici M, Katz A, March K, et al. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture ex- panded adipose tissue-derived stromal/stem cells: a joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the International So. Cytotherapy. 2013;15(6):641–8.
29. Ponce Márquez S, Martínez V, McIntosh Ambrose W, Wang J, Gantxegui N, Schein O, et al. Decellularization of bovine corneas for tissue engineering applications. Acta Biomater. 2009;5(6):1839–47.
30. Guthoff R, Klink T, Schlunck G, Grehn F. Die sickerkissenuntersuchung mittels konfokaler in-vivo mikroskopie mit dem rostocker cornea modul – erste er- fahrungen. Klin Monatsbl Augenheilkd. 2005;222-R8.

