Foro Catarata: El Tratamiento de la Presbicia en la Cirugía de Catarata
Coordinador:
 Dr. Virgilio Centurion
Dr. Virgilio Centurion
Brasil
Panelistas:
 Dr. Claudio Orlich – Costa Rica
Dr. Claudio Orlich – Costa Rica
 Dr. Pablo Bonnano – Argentina
Dr. Pablo Bonnano – Argentina
Presentamos situaciones de pacientes con catarata bilateral que desean corregir la visión de cerca. Los panelistas tienen experiencia en el tema y queremos saber las preferencias sobre:
1º) la biometria: equipamento e formula, 2º) la pupilometria: limites, métodos, 3º) la técnica quirúrgica, 4º) las lios que utilizam , 5º) algun comentario …, si necesario.
Caso 1
Abogado, 65a con +2.00 DE AO p/ lejos, +4.50 DE AO p/ cerca, con catarata AO, sin comorbilidades, utiliza gafas multifocales, desea corregir la visión a todas las distancias.
Viaja ± 100 km a la noche, 2 veces / semana.
Respuesta: 1. biometría; 2. pupilometría; 3. técnica quirúrgica; 4. lio; 5. comentario.
Claudio Orlich (Costa Rica)
Con este paciente, hay que conversar muy bien. Algo tiene que sacrificar si desea ver en todas las distancias, un multifocal (PanOptix o Physiol Finevision), sería mi sugerencia. Sin embargo, hay que estar muy claros con los halos, ya que conducir de noche largas distancias puede ser complicado. Ante la posibilidad de halos, no descartaría de entrada un multifocal, pero sí le hablaría muy claro con respecto a sus expectativas. Normalmente, utilizo el IOl Master 700 en casos sin cirugía refractiva previa, utilizo la fórmula de Barrett Universal II. Todos los casos de lentes multifocales los hago asistidos con láser de femtosegundo (CICAFE/FLACS) y con aberrometría intraoperatoria que generalmente me recomienda el mismo lente al plan inicial si el paciente tiene una córnea virgen.
Dr. Pablo Bonnano (Argentina)
1 Argos, formulas Barret largo axil segmentado y Haigis además comparo con calculador de ESCRS
2 Facoemulsificación capsulorrexis circular continua de 4,5 mm, Chop
4 Lio EDOF Vivity
5- La elección de lente EDOF estaría justificado por el hecho de minimizar los disturbios visuales nocturnos sobre todo porque es un paciente que conduce largas distancias en horario nocturno. Sin olvidar la importancia de explicar las limitaciones postoperatorias en su visión cercana.
Caso 2
Comerciante, 67a vende computadoras, con miopía: OD -4.00 OI -1.00 p/ lejos, con catarata, desea corregir la visión a todas las distancias.
Para cerca no utiliza gafas, utiliza L.C. en ambos ojos para el deporte.
Respuesta: 1. biometría; 2. pupilometría; 3. técnica quirúrgica; 4. lio; 5. comentario.
Claudio Orlich
No existe un lente perfecto, por lo que tenemos que tratar de seleccionar lo mejor en cada caso. Siendo una persona que utiliza mucho la visión intermedia (computador), le sugeriría un lente de rango extendido (Acrysof Vivity), dejando el ojo derecho ligeramente miope, algo que tolera bien porque lee sin gafas a pesar de la anisometropía. Explicaría que su visión de cerca no será la misma y que podría requerir gafas para algunas actividades, pero para la visión intermedia y para hacer deportes, creo que esta sería su mejor opción.
Dr. Pablo Bonnano
1 Argos, Formula Barret largo axil segmentado.
2 Pentacam Argos.
3 Facoemulsificación capsulorrexis circular continua de 4,5 mm, Chop.
4 Trifocal difractivo Panoptix.
5 Elijo lente Trifocal sobre todo por ser un paciente miope acostumbrado a tener muy buena agudeza visual de cerca sin anteojos, probablemente estaría decepcionado si colocáramos un lente EDOF, ya que perdería visión cercana. Obviamente teniendo en cuenta todas recomendaciones para el implante de lentes Trifocales sobre todo sin asociación a comorbilidades y sin signos de ojo seco.
Caso 3
Jubilado, 72a con catarata operado de Lasik miópico hace 20 años, utiliza gafas para televisión y manejar.
Utiliza, -1,75 DE OD, -0,75 DE OI, no siente falta de gafas de cerca. ¿Qué recomienda? ¿Algún examen especial?
Respuesta: 1. biometría; 2. pupilometría; 3. técnica quirúrgica; 4. lio; 5. comentario.
Claudio Orlich
Este paciente parece tolerar bien la monovisión. No descartaría dejarlo con monovisión usando una lente monofocal. Otra opción sería un rango extendido (Acrysof Vivity) con micro-monovisión. Siendo postoperado de refractiva, haría el cálculo del lente usando Panacea, introduciendo tanto el radio de curvatura anterior como posterior de la córnea en la fórmula. También realizaría una biometría con Anterion para tener un poder corneal más exacto y definitivamente utilizaría la aberrometría intraoperatoria para confirmar los resultados del Anterion y Panacea.
Dr. Pablo Bonnano
1.Fórmula Barret true K , Total k (analiza las K de Cara posterior de córneas ingresadas de Pentacam).
2 Pentacam Argos.
3 Facoemulsificación capsulorrexis circular continua de 4,5 mm Chop.
4 Si fuese posible lente Trifocal.
5 Los exámenes complementarios básicos que les realizamos a nuestros pacientes que van a someterse a cirugía de cataratas son : Biometría, Microscopía especular, OCT, Topografía y estudio de Ojo Seco (Biomicroscopía y HD Analyzer).
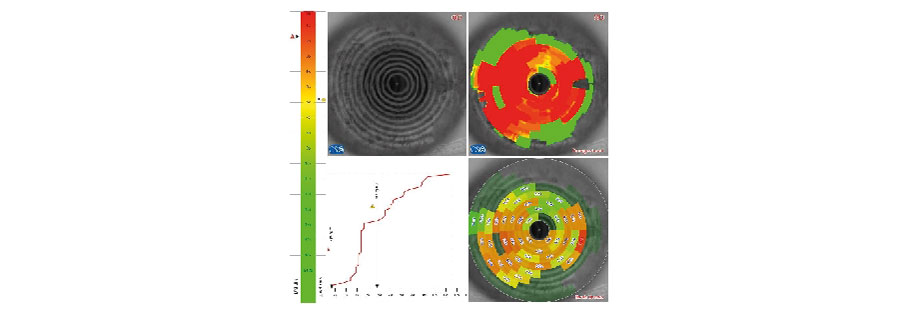
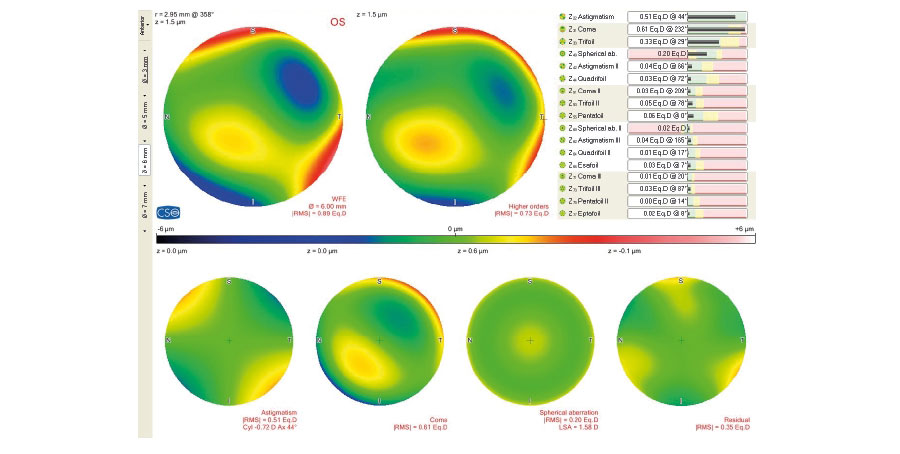
Pero, en pacientes con cirugía refractiva previa y sobre todo para definir qué clase de lente vamos a implantar, para mi es mandatorio el estudio de la córnea con Pentacam donde tenemos especial atención en:
-Forma de histograma en la pantalla de distribución de potencias en 4 mm de zona de análisis.
– Análisis de RMS de Aberraciones de Alto Orden en 4 mm.
-Análisis de Aberración esférica (Z40).
-Análisis Ratio de radios antero/posterior.
Si todos estos parámetros se encuentran en valores aceptables, mi recomendación sería la de colocar un lente Trifocal.
Caso 4
Ingeniero, 55ª utiliza computadora ± 8h / día, con gafas office (para media distancia y cerca), visión normal para lejos sin corrección
Respuesta: 1. biometría; 2. pupilometría; 3. técnica quirúrgica; 4. lio; 5. comentario.
Claudio Orlich
No realizo lensectomía en pacientes emétropes en ausencia de catarata. A este paciente, si la córnea lo permite y tolera bien las pruebas para Presbyond, lo operaría de femtolasik con Presbyond. No se especifica si tiene o no un desprendimiento del vítreo, pero debido al riesgo de un desprendimiento del vítreo, o aún peor, de retina, la disminución de la sensibilidad al contraste de un multifocal en comparación con su visión actual, y porque aún conserva una acomodación residual, me inclino más por corregir la presbicia con Presbyond y no con una lensectomía refractiva.
Dr. Pablo Bonnano
1 Argos, formula de Barret.
2 Argos Pentacam.
3 Facoemulsificación capsulorrexis circular continua de 4,5 mm, Chop.
4 Trifocal o EDOF Vivity.
5 La primera consideración es evaluar la decisión de operar o no, a un paciente emétrope. Esta decisión va a depender de la motivación espontánea que tenga el paciente para dejar de depender de anteojos de visión cercana. El paciente tiene que estar muy motivado y sobre todo con expectativas reales sobre resultados y riesgos.
Una vez tomada la decisión de la cirugía, explico perfectamente diferencias, bondades y limitaciones de lentes Trifocales y EDOF y comparto con el paciente la toma de decisión sobre qué tipo de Implante vamos a colocar. Sin dudas considero que el mayor grado de insatisfacción de los pacientes está relacionado con, expectativas irreales o la falta de información.





 Dra. Bruna V. Ventura
Dra. Bruna V. Ventura Dr. Juan José Mura – Chile
Dr. Juan José Mura – Chile Dra. Marcela Pérez – Chile
Dra. Marcela Pérez – Chile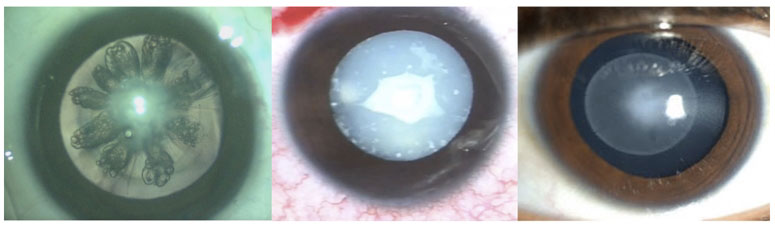


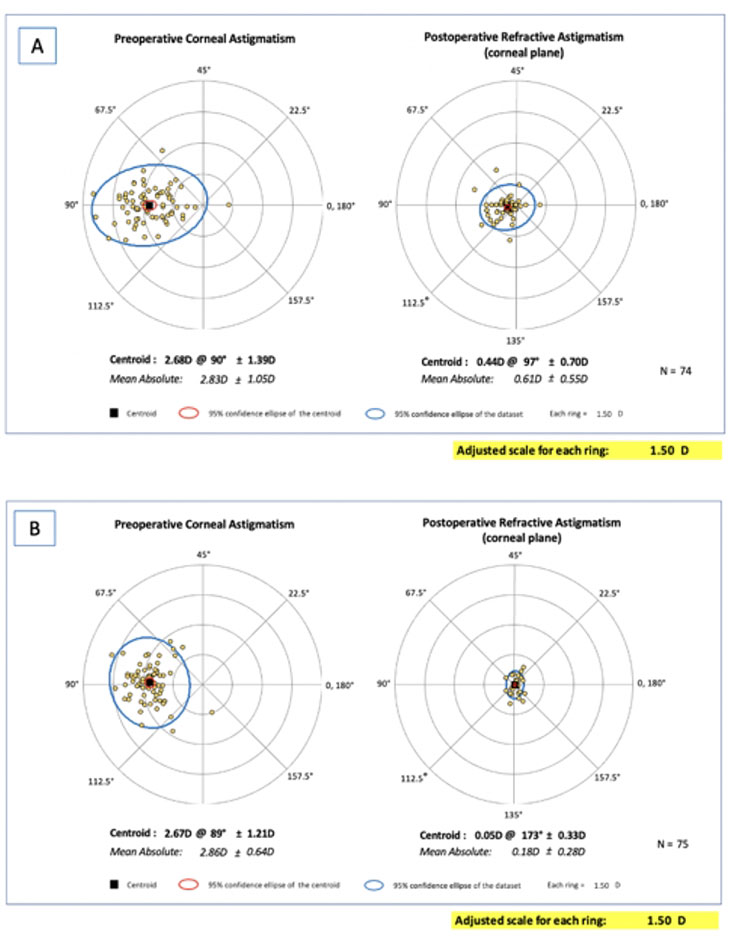 Fig 1. A) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a implante de ICL. B) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a la corrección con LASIK.
Fig 1. A) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a implante de ICL. B) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a la corrección con LASIK.
 Dr. Ticiano Gobellina
Dr. Ticiano Gobellina Dr. Alfonso Sabater – España
Dr. Alfonso Sabater – España Dr. Neto Rosatelli – Brasil
Dr. Neto Rosatelli – Brasil



 Dr. Gerardo Valvecchia
Dr. Gerardo Valvecchia  Dr. Ramiro Medina Boiko.
Dr. Ramiro Medina Boiko. Dr. David Flicker
Dr. David Flicker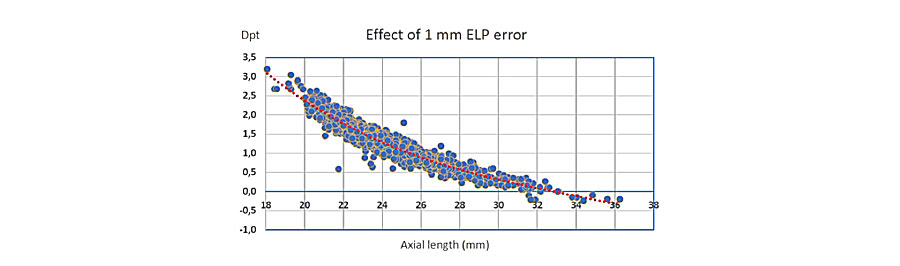
 2.¿Cuál de las siguientes no es causa de descentración de la lente intraocular?
2.¿Cuál de las siguientes no es causa de descentración de la lente intraocular? 3. ¿Cuál considera que es la fórmula para el cálculo de lente intraocular que predice con mayor precisión la posición efectiva de la lente?
3. ¿Cuál considera que es la fórmula para el cálculo de lente intraocular que predice con mayor precisión la posición efectiva de la lente?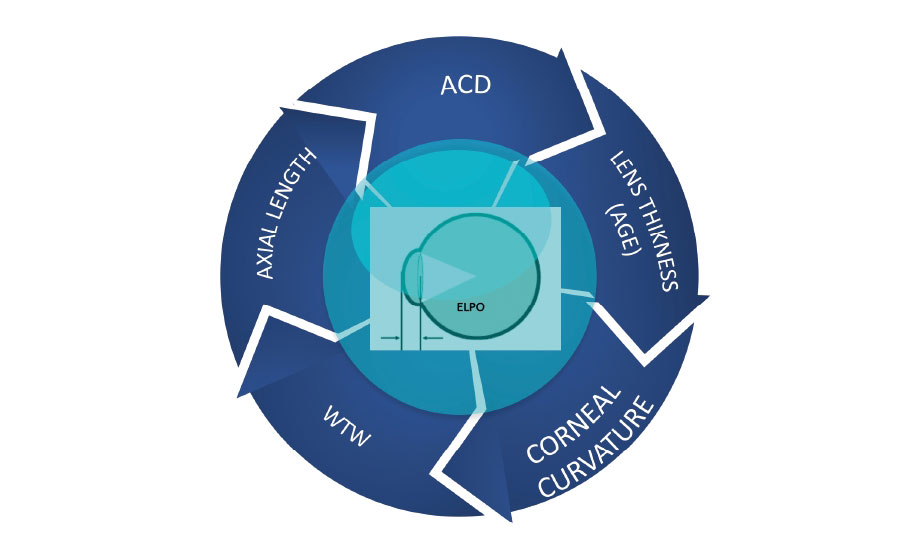

 Dra. Rachel Gómez
Dra. Rachel Gómez Dr. Luis Brenner – Noruega
Dr. Luis Brenner – Noruega Dra. Leila Gouvea – Brasil
Dra. Leila Gouvea – Brasil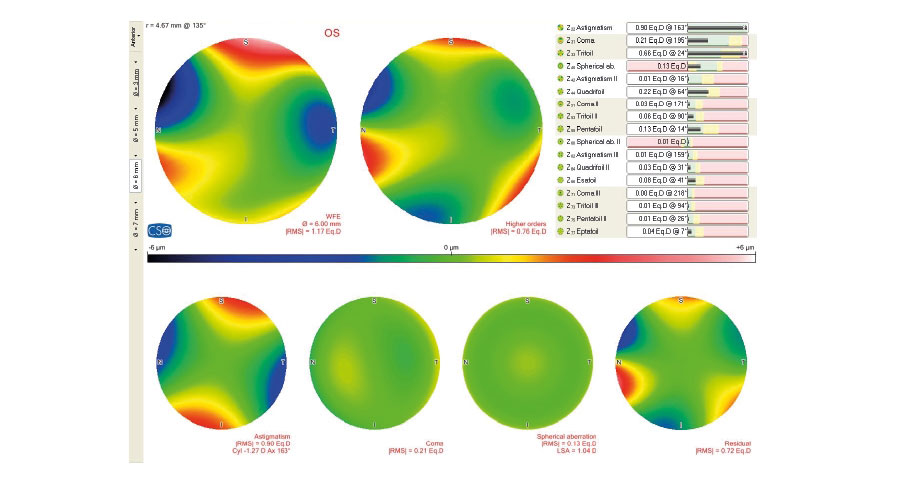
 2. ¿Cuál examen preoperatorio es más importante para definir si el implante de lentes trifocales es adecuado o no?
2. ¿Cuál examen preoperatorio es más importante para definir si el implante de lentes trifocales es adecuado o no?
