Foro Catarata: Selección de Lente Intraocular en Pacientes con Catarata y Distrofia de Fuchs
Coordinador:
 Dr. Arturo Kantor, MD
Dr. Arturo Kantor, MD
Chile- akantor@cev.cl
Panelistas:
 Dr. Felipe Mellado, MD
Dr. Felipe Mellado, MD
Chile – fmellado@cev.cl
 Dr. Juan José Mura, MD
Dr. Juan José Mura, MD
Chile – jmurac@gmail.com
INTRODUCCIÓN
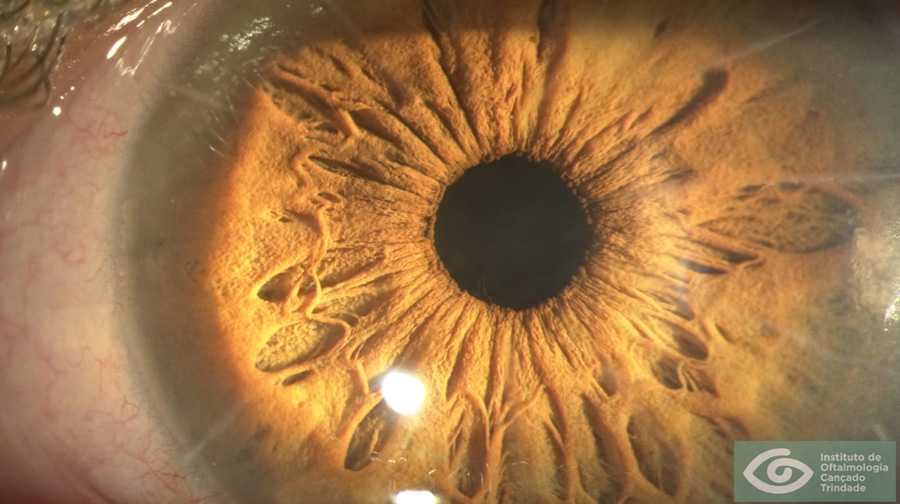
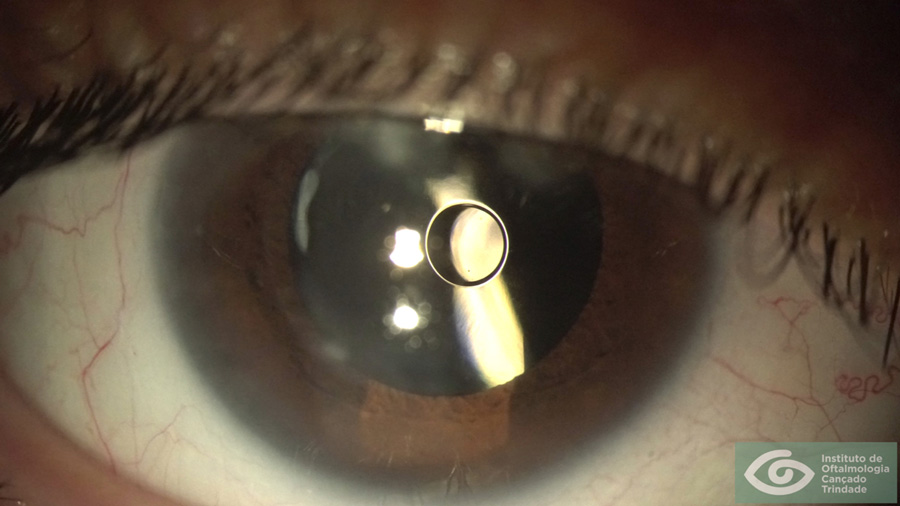
La Distrofia de Fuchs es una enfermedad de origen hereditario que afecta las capas profundas de la córnea, membrana de Descemet y células endoteliales tanto del punto de vista funcional como en su histología. Comienza en la década de los 30 años y progresa causando baja visión por edema estromal de la córnea. La cirugía de catarata puede causar una disminución del recuento de células endoteliales especialmente en estos pacientes. El riesgo de descompensar la córnea aun transparente de un paciente con Fuchs, es la principal consideración y cuidado en la técnica quirúrgica al momento de operar de cataratas a un paciente con esta condición. Sin embargo, fuera de cuidar la función endotelial hay una serie de elementos relevantes en la selección de tipo de LIO que se implantará que hace que el proceso de toma de decisiones no sea igual al que se sigue en un paciente sin Distrofia de Fuchs. Una inadecuada selección de LIO puede deteriorar aún más la calidad visual de estos pacientes.
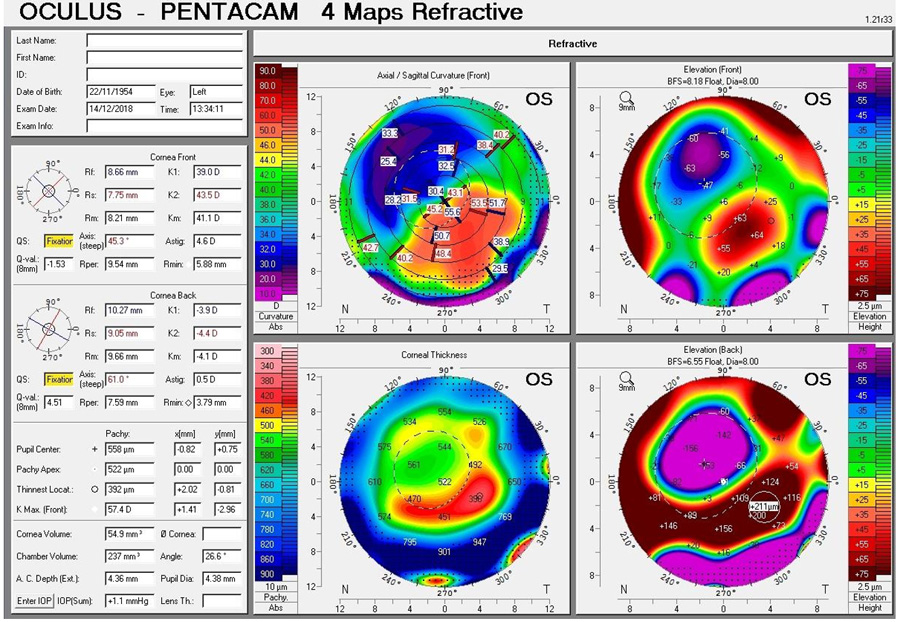
Por ejemplo, el astigmatismo corneal tanto anterior como posterior se va haciendo más asimétrico, generando mayor irregularidad en las aberraciones de alto orden de origen corneal a medida que la Distrofia de Fuchs va progresando en severidad. El origen es un aplanamiento de la córnea inferior tanto en su cara anterior como posterior1. Esto hace menos predecible la corrección del astigmatismo corneal en el plano de LIO a través de lentes tóricas.
La mayor dispersión de la luz en pacientes con Distrofia de Fuchs producto de la alteración de la anatomía corneal, genera un deterioro de la calidad visual que se correlaciona más con la dispersión de la luz hacia anterior y posterior de la córnea, que con el aumento de las aberraciones de alto orden2
Debemos entonces considerar que, al operar de catarata a un paciente con un Fuchs compensado, la córnea seguirá siendo una de las causas de su peor calidad visual y este deterioro será progresivo. Aunque en las etapas iniciales el Fuchs no incide de forma relevante en el astigmatismo corneal, y se puede corregir con relativa buena predictibilidad, este se va haciendo más irregular a medida que la enfermedad progresa y el resultado refractivo inicial se va perdiendo en el mediano y largo plazo3.
Preguntas tipo selección múltiple y sus fundamentos para ayudarnos a escoger el LIO en tres casos clínicos.
Por favor conteste las siguientes tres preguntas de selección múltiple y haga los comentarios que estime pertinente para fundamentar su respuesta.
- Un paciente de 58 años con distrofia de Fuchs evidente con guttas y brillo celofánico de la Descemet, sin edema corneal paquimetria de 520 micras, recuento de células endoteliales de 1300 por mm2, con astigmatismo queratométrico de 1.25 dioptrías y con una catarata incipiente, consulta por cirugía de catarata pero desea quedar independiente de anteojos. Usted le implantaría un:
- LIO Multifocal difractivo tórico
- LIO EDOF tórico
- LIO Monofocal tórico
- LIO Multifocal difractivo o EDOF + Incisión relajante limbar
- LIO Monofocal + Incisión relajante limbar
Dr. Felipe Mellado
R: B) LIO EDOF tórico.
Comentario:
Está demostrado como aumenta el astigmatismo y las aberraciones corneales al progresar la distrofia de Fuchs. Si en un futuro necesita cirugía de trasplante endotelial, ésta no debería alterar significativamente el astigmatismo post trasplante. No recomiendo lente multifocal dado las aberraciones de alto orden ya existentes, pero un EDOF podría ser excelente alternativa en este paciente joven para obtener algo de visión intermedia e independencia relativa de lentes. Un lente monofocal plus tórico también podría ser una alternativa. La incisión relajante limbar en el mejor de los casos rendirá 1 dioptría y es una agresión más a una córnea distrófica.
Dr. Juan José Mura
R: B)
Comentario:
Este paciente está bastante bien a esta altura, paquimetría (< 600 um) y recuento de células endoteliales adecuados. En teoría podría usarse cualquier lente, pero, por el cuadro claro y la juventud evitaría usar un multifocal difractivo; pues puede necesitar un injerto endotelial en el futuro, con el aumento de HOA que implican (especialmente DSAEK, que es lo que en general se hace por estos lares), no me gusta pensar en sumarle más dificultades al paciente. Corregiría el astigmatismo con el LIO, a pesar de estar en el límite para LRI, para evitar tocar la córnea; teóricamente el cambio en astigmatismo debiera ser mínimo con un potencial injerto endotelial.
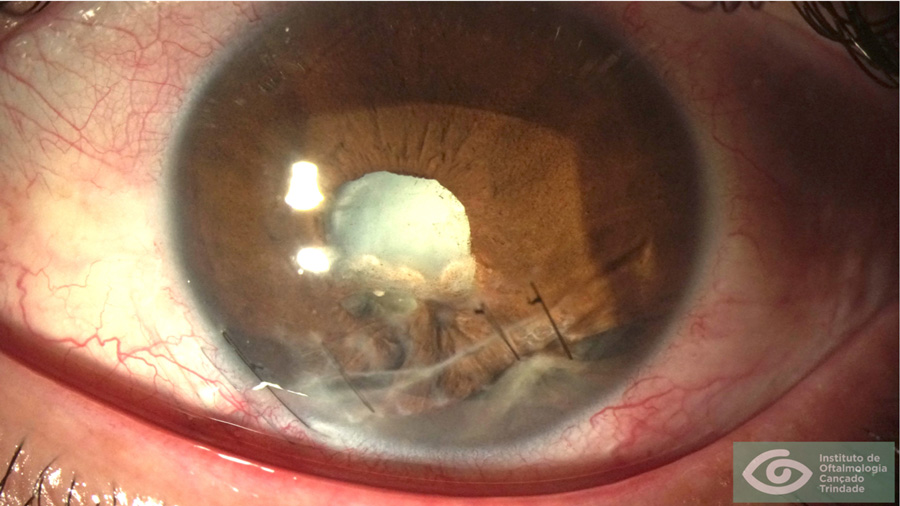
- Paciente de 85 años portador de distrofia de Fuchs compensada, sin edema corneal ni peor visión en las mañanas, paquimetría de 620 micras, recuento de células endoteliales de 950 por mm2 con abundantes guttas, astigmatismo queratométrico de 3 dioptrías, pero ve mal por una catarata nuclear densa. PIO es normal sin pseudoexfoliación de Vogt. ¿Cuál es la mejor opción de LIO?
- LIO Multifocal difractivo tórico
- LIO EDOF tórico
- LIO Monofocal tórico
- Injerto Endotelial + LIO Monofocal tórico de entrada.
Dr. Felipe Mellado
R: C) LIO monofocal torico o monofocal “plus” tórico.
Comentario:
No existe evidencia de que en pacientes sin edema matutino y con córneas con más de 800 células en el recuento endotelial, sea mejor realizar cirugía triple (faco+ trasplante endotelial) versus Faco + lío primariamente. Existe la posibilidad de que este paciente, dado su edad, no requiera cirugía endotelial nunca. Al existir abundantes guttas aumenta el scatter, por lo que no se deberían implantar LIOS trifocales; un EDOF tórico podría considerarse, pero en este paciente dado que ya presenta alteraciones endoteliales, preferiría un LIO monofocal para obtener los beneficios en calidad visual de la monofocalidad. Debe realizarse una cirugía cuidadosa con técnicas depuradas para preservar la viabilidad del endotelio al máximo. El astigmatismo se mantendrá corregido luego de un eventual trasplante endotelial.
Dr. Juan José Mura
R: B)
Comentario:
Este paciente está en el límite (620 um de paquimetría y < 1.000 células por mm2), pero está compensado todavía. Creo que una facoemulsificación por un cirujano experto (como el coordinador de esta actividad o cualquiera de los otros comentaristas) no debiera significar un cambio significativo en su condición actual. Corregiría también el astigmatismo con el LIO por las mismas razones expuestas previamente. LIO EDOF tórico (monofocal plus tórico si amanecen más conservadores me parece una excelente idea también)
- Paciente de 68 años, laboralmente muy activo, distrofia de Fuchs descompensada con edema estromal, peor visión en las mañanas al despertar, catarata subcapsular posterior por uso de corticosteroides. Paquimetría de 690 micras, no se logra conteo confiable de células endoteliales y astigmatismo queratométrico de 2 dioptrías. ¿Qué le ofrece como solución?
- Injerto endotelial + LIO Multifocal difractivo tórico.
- Injerto endotelial + LIO EDOF tórico.
- Injerto endotelial + LIO Monofocal tórico.
- Injerto endotelial + LIO Monofocal + Incisión relajante limbar
- Injerto endotelial + LIO Monofocal.
Dr. Felipe Mellado
- B) Injerto endotelial + LIO Monofocal torico
Comentario:
Siempre y cuando el astigmatismo estuviera documentado previamente al edema y fuera concordante. Este paciente presenta una distrofia de fuchs descompensada, se encuentra sintomático y con edema clínico. La cirugía de Faco sóla no es factible dado que el edema estromal se incrementará. La cirugía de elección es el trasplante endotelial, con lente tórico o tórico “plus”, ya que el trasplante no altera significativamente el astigmatismo corneal previo.
Dr. Juan José Mura
- C) Injerto endotelial + LIO Monofocal tórico.
Comentario:
Este paciente es distinto, es claramente sintomática su Distrofia de Fuchs, la córnea está descompensada en el momento actual, no es una posibilidad futura. Acá entonces es un poco diferente. Me inclinaría por realizar el injerto endotelial asociado a cirugía de catarata, pero utilizando un LIO monofocal plus tórico (puesto que el monofocal plus no agrega limitaciones en calidad visual frente al monofocal tradicional, con el potencial de agregar algún grado de visión cercana), por lo que mi alternativa no se encuentra en las respuestas
En los tres casos evitaría un lente difractivo, en los tres evitaría corregir el astigmatismo con incisiones corneales. Creo que el monofocal o monofocal tórico no tiene ninguna justificación de uso frente a los monofocales plus o monofocales plus tóricos, desde el punto de vista médico. El punto de vista económico por otro lado puede representar una barrera.
En el tercer caso puede ser que la burbuja potencialmente pueda rotar el LIO monofocal plus tórico de su posición deseada, pero es una posibilidad más lejana a la que se observa con gas/aire en cámara vítrea, pupila pequeña y contacto distribuido en forma difusa.
Referencias:
- Yoshinori Oie, Yuichi Yasukura, Nozomi Nishida, Shizuka Koh, Ryo Kawasaki, Maeda Naoyuki, Vishal Jhanji, Kohji Nishida, Fourier analysis on regular and irregular astigmatism of anterior and posterior corneal surfaces in Fuchs endothelial corneal dystrophy, AJOPHT 11598, PII: S0002-9394(20)30554-7 DOI: https://doi.org/10.1016/j.ajo.2020.09.045
- Hidenaga Kobashi, Kazutaka Kamiya, Kimiya Shimizu, Factors Influencing Visual Acuity in Fuchs’ Endothelial Corneal Dystrophy Optom Vis Sci 2018;95:21–26. DOI:10.1097/OPX.0000000000001157 Copyright © 2017 American Academy of Optometry
- Hideaki Yokogawa, P. James Sanchez, Zachary M. Mayko, MS, Michael D. Straiko,Mark A. Terry, Corneal Astigmatism Stability in Descemet Membrane Endothelial Keratoplasty for Fuchs Corneal Dystrophy, Cornea, Volume 35, Number 7, July 2016





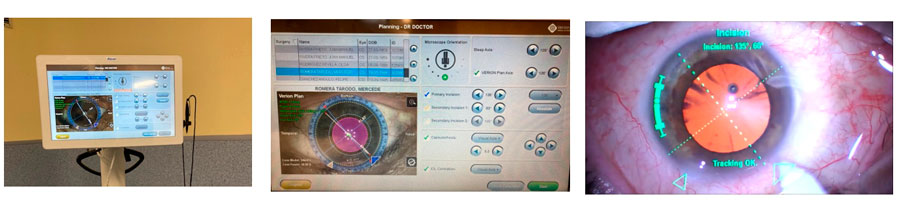




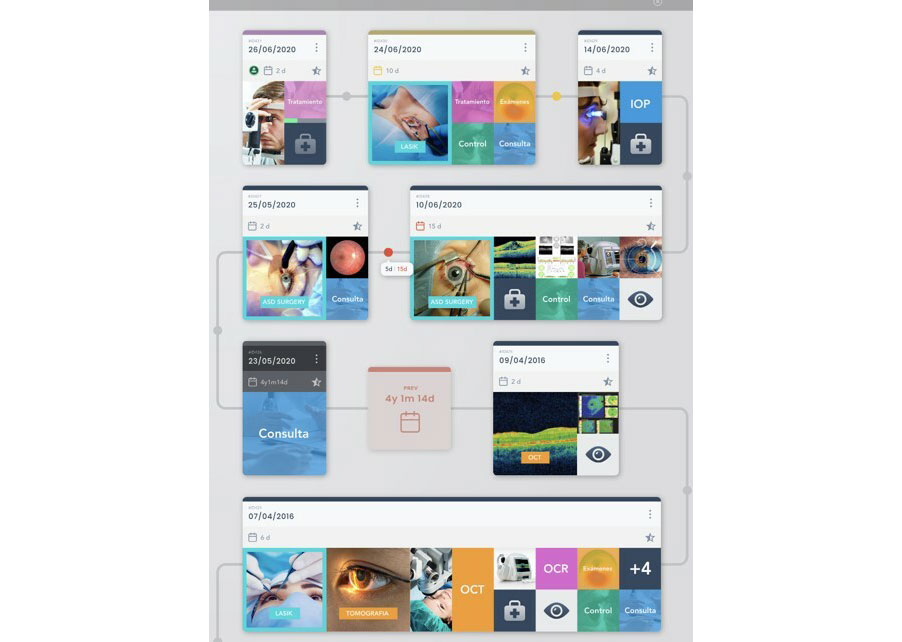 Figura 1: Imagen de vista telegráfica para optimizar tiempos de estudio de paciente en solución Revai.
Figura 1: Imagen de vista telegráfica para optimizar tiempos de estudio de paciente en solución Revai.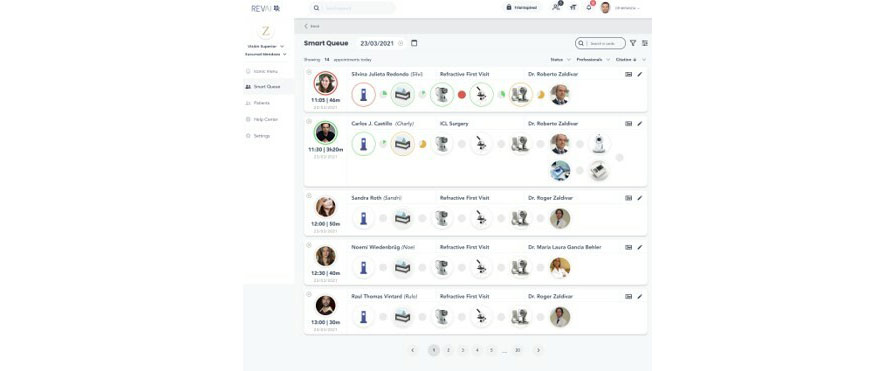 Fig 2: Smart Queue para observar flujos de pacientes y objetivar tiempos de espera en el proceso de atención.
Fig 2: Smart Queue para observar flujos de pacientes y objetivar tiempos de espera en el proceso de atención. Fig 3: Biomicroscopia
Fig 3: Biomicroscopia


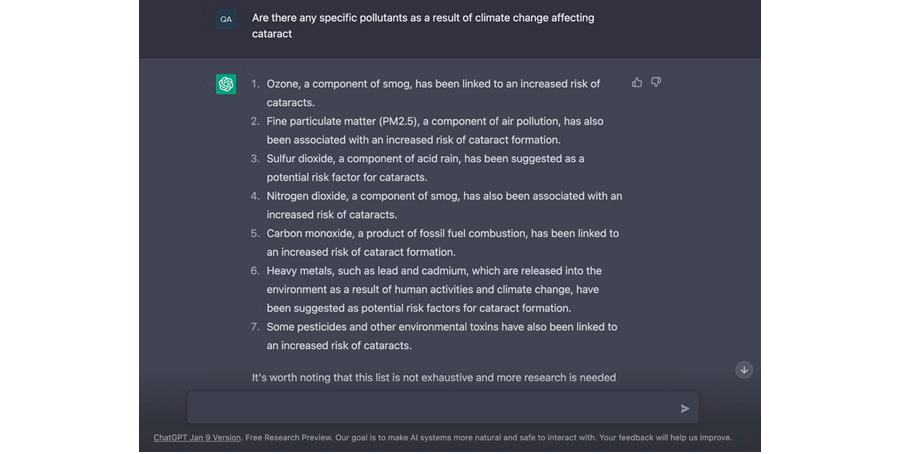 Figura 1. Captura de pantalla del ChatGPT con la respuesta más aceptada sobre la formación de cataratas secundarias al cambio climático y los contaminantes del aire.
Figura 1. Captura de pantalla del ChatGPT con la respuesta más aceptada sobre la formación de cataratas secundarias al cambio climático y los contaminantes del aire.


 Coordinador:
Coordinador: Dr. Patricio Grayeb
Dr. Patricio Grayeb Dr. Miguel Srur
Dr. Miguel Srur

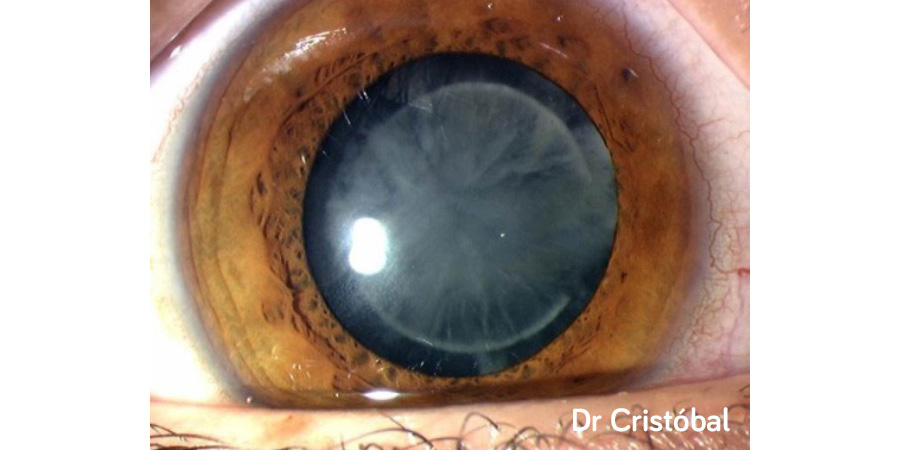
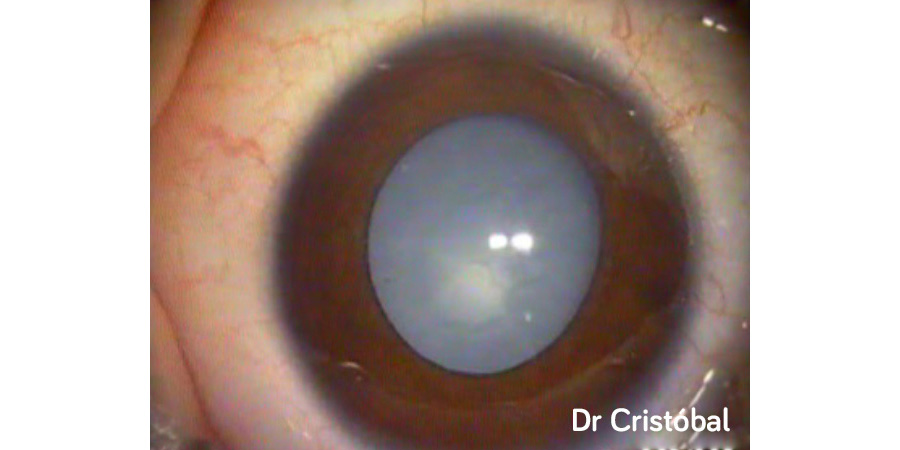 Figura 2:
Figura 2: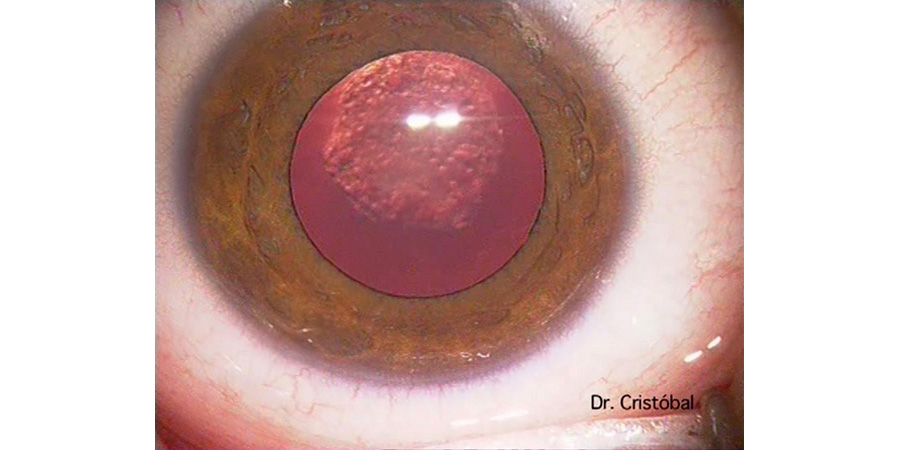 Figura 3:
Figura 3: Figura 4:
Figura 4: Figura 5:
Figura 5:  Figura 6:
Figura 6:  Figura 7:
Figura 7:
 Coordinador:
Coordinador: Claudio Orlich
Claudio Orlich Roger Zaldivar
Roger Zaldivar