Catarata y Astigmatismo irregular

Dr. Julio Fernández Mendy
Instituto de la Visión
En la evolución de la cirugía de catarata, a fines del siglo XX, hubo dos momentos paradigmáticos que resultaron determinantes en los resultados post quirúrgicos actuales: la técnica que Kelman desarrolló y posibilitó extraer el cristalino por incisión pequeña y la aparición de los Lentes intraoculares plegables.
A partir de allí se consiguió realizar incisiones prácticamente neutras, casi sin inducir astigmatismo, que permitió comenzar a manejar el astigmatismo preoperatorio e instaurar la era de los lentes intraoculares Premium. Muchos pacientes se beneficiaron, alcanzando la emetropía luego de la cirugía de Catarata.
La Cirugía de Catarata se convirtió en Facorrefractiva. La utilización de lentes tóricos comenzó a ser una práctica habitual con resultados muy favorables. No obstante, esporádicamente, se producen algunas sorpresas desagradables por errores en la selección y evaluación del paciente, y en la elección del LIO a implantar, múltiples causas que pueden llevar a este fracaso no deseado que trataré de analizar a continuación.
Como nos enseña Holladay (1), es imprescindible calcular el astigmatismo inducido quirúrgicamente (SIA) total, para ser más exacto, ya que existen otros factores que se suman al SIA debido a la incisión, como el astigmatismo de la cara posterior, un sutil tilt o descentración del LIO.
En este sentido, lo fundamental es realizar un estudio previo exhaustivo y la planificación adecuada de cada caso y, dada la disponibilidad de equipos en la actualidad para evaluar la córnea, es importante que nos familiaricemos con algún equipo en particular, ya que hay estudios que muestran diferencias significativas en las mediciones según el aparato utilizado (2).
Considerando que más del 30% de los pacientes que se van a operar de catarata tienen un astigmatismo corneal previo de más de 1 D, debemos corregir este error si queremos obtener una buena agudeza visual sin ayudas ópticas.
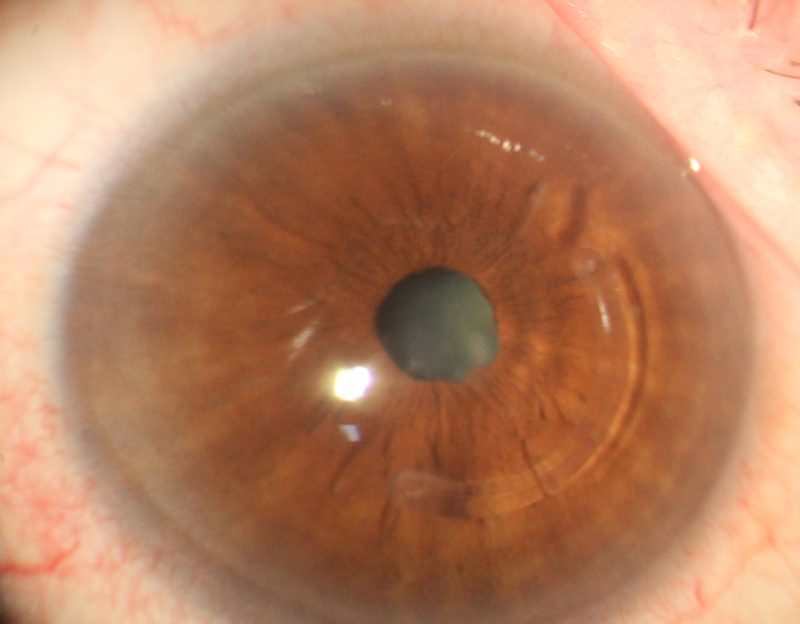
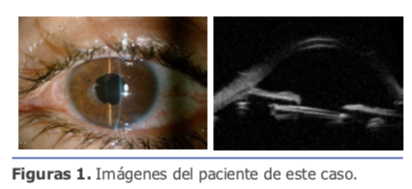
El primer paso en la evaluación del astigmatismo preoperatorio es determinar si es regular o irregular (3). Ante una córnea con una irregularidad muy evidente, como en algunos pacientes con queratoplastias penetrantes, en algunos queratoconos (figura 1), en la degeneración pelúcida, y cuando hay cicatrices corneales de traumas o cirugías refractivas, la diferencia es sencilla.
Lo difícil es cuando hay cambios sutiles, transitorios, que pasan desapercibidos, y son causantes de modificaciones en las medidas de la curvatura corneal, debidos a alteraciones en la superficie, o problemas de lubricación que, al modificar la medida del esférico y/o del cilindro a corregir, genera un resultado inadecuado en el cálculo del LIO. Cuando se detecta el ojo seco, debe tratarse y volver a evaluarlo. Si la córnea mejora y desaparecen los signos de irregularidad se trata como regular.
En los casos en los cuales es muy fácil distinguir un astigmatismo irregular, hay que bajar las expectativas que pueda tener el paciente en corregir todo defecto refractivo y explicar la dificultad existente en conseguir un resultado refractivo óptimo. A menudo el paciente ya conoce su patología y la limitación que conlleva, pero en otras no, sino que lo descubre en el preoperatorio de la cirugía de catarata.
Cuando nos enfrentamos a córneas con astigmatismos irregulares debido a cicatrices o ectasias estables, pero que contienen una zona central regular, podríamos plantearnos colocar LIO tóricos. En un estudio reciente se reporta (4), en estos casos, que se puede obtener una reducción parcial del astigmatismo, una mejora en la agudeza visual no corregida, pero también se debe advertir que puede incrementarse la dificultad en la adaptación de un lente de contacto.
Las causas más frecuentes de córneas irregulares son post trasplantes corneales penetrantes, cirugías refractivas corneales, ectasias corneales, traumatismos o cicatrices corneales post infecciones o distrofias epiteliales.
El astigmatismo irregular residual post facoemulsificación es una de las principales causas de insatisfacción. El uso de Lentes de Contacto, que continúan en constante avance tecnológico, es un excelente método para manejar este tipo de astigmatismo irregular en muchos de los pacientes que lo utilizaban previamente con buena tolerancia. El problema surge en los pacientes con intolerancia y que se resisten a utilizarlo luego de la cirugía de catarata.
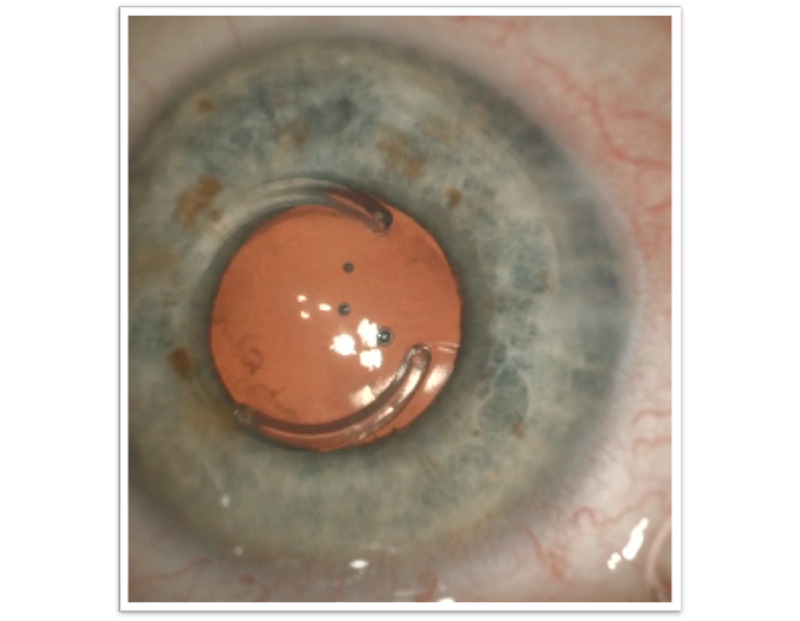
En los queratoconos y degeneración pelúcida estabilizados con segmentos intracorneales (figura 2), en los cuales los cálculos son muchas veces imprecisos, debido a la gran irregularidad, y que previamente al desarrollo significativo de la catarata corregían con anteojos con buena BCVA, se pueden operar utilizando el método de Richard Mackool, realizando la extracción del cristalino sin implantar el LIO y, dentro de los primeros días postoperatorios hacer una prolija refracción y calcular el poder esférico y cilíndrico basado en la refracción (según el equivalente esférico: si es >8D, refracción aérea x 1.75; si es entre 2 y 8 D, refracción aérea x 1.70 y si es < 2 D, refracción aérea x 1,2. Siempre con una distancia al vertex de 12 mm) (5).
En aquellos casos de catarata con cicatrices corneales superficiales, se puede realizar una PTK con Excímer laser, para transparentar y regularizar la córnea, antes de la cirugía de catarata. También está publicado realizar una PTK, para eliminar cicatrices corneales superficiales en post DMEK en un caso con queratopatía bullosa post faco (6).
Un estudio reciente reporta buenos resultados con el uso de Lentes intraoculares basados en el principio del Pinhole (Xtra Focus, Morcher) en astigmatismos irregulares de múltiples causas, colocados dentro del saco capsular (7) con otro LIO aunque también puede ser implantado como piggy bag en el surco.
Como vemos el campo del astigmatismo irregular y la cirugía de catarata es muy amplio. En la medida que la cirugía de catarata es considerada una cirugía refractiva y las exigencias cada vez más altas debemos reconocer nuestros límites, ser realistas en estos casos, transmitir la dificultad y proponer alternativas que se puedan alcanzar.
El manejo del astigmatismo irregular en la cirugía de catarata es muy complejo, los casos son muy variables y no pueden corregirse completamente, como ocurre en los astigmatismos regulares, con los lentes tóricos o las incisiones relajantes corneales, sino que requiere múltiples procedimientos, un estudio muy minucioso y gran cuota de prudencia.
Referencias
Holladay JT, Pettit G. Improving toric intraocular lens calculations using total surgically induced astigmatism for a 2.5 mm temporal incision. J Cataract Refract Surg 2019; 45:272–283.
Molina-Martín A, Piñero DP, Caballero MT, et al. Comparative analysis of anterior corneal curvature and astigmatism measurements obtained with three different devices. Clin Exp Optom 2019; 103:618–624
Hardten D, Hardten A. Handling regular and irregular astigmatism during cataract surgery. Curr Opin Ophthalmol 2021, 32:13–18
Gao Y, Ye Z, Chen W, et al. Management of cataract in patients with irregular astigmatism with regular central component by phacoemulsification combined with toric intraocular lens implantation. J Ophthalmol 2020; 2020:Article ID 3520856: 1–11
Mackool R et al. Intraocular lens power calculation after laser in situ keratomileusis: Aphakic refraction technique. J Cataract Refractive Surgery. 2006. Mar, 32(3)435-7
Maier P, Reinhard T. Phototherapeutic keratectomy for anterior stromal fibrosis following DMEK. Am J Ophthalmol Case Reports 2020; 19:100849.
Trindade BL, Trindade FC, Werner L, Trindade CL. Long-term safety of in-thebag implantation of a supplementary intraocular pinhole. J Cataract Refract Surg 2020; 46:888–892









 Dra. Liana O. Ventura – Brasil
Dra. Liana O. Ventura – Brasil Dr. Marcelo C. Ventura – Brasil
Dr. Marcelo C. Ventura – Brasil





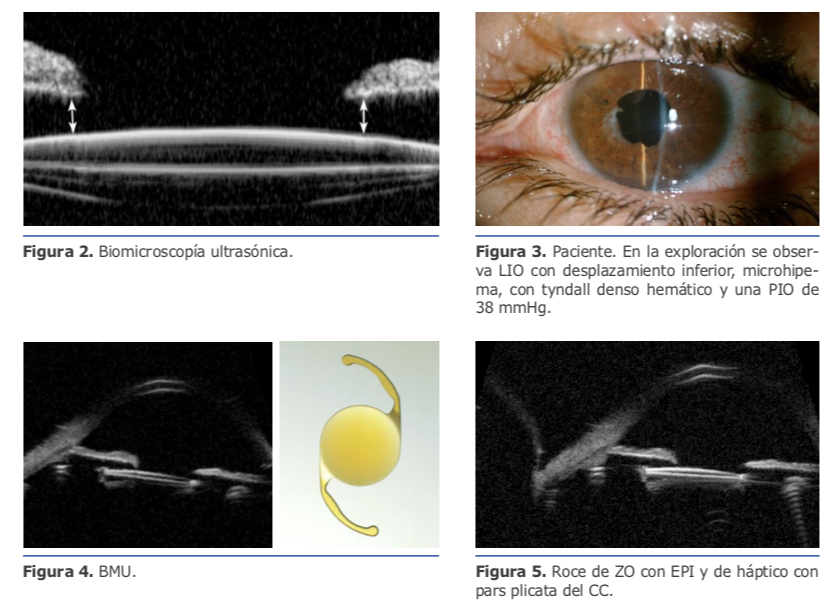
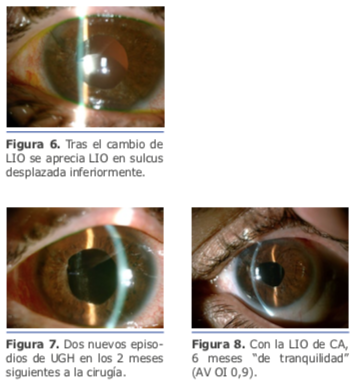 La sustitución de lente monobloque por una de 3 piezas no fue suficiente para una estabilización adecuada de la lente.
La sustitución de lente monobloque por una de 3 piezas no fue suficiente para una estabilización adecuada de la lente.

 Con estos avances tecnológicos los antiguos lentes esféricos fueron transformándose a lentes asféricos, y estos están evolucionando para alcanzar un mayor rango de visión extendida, es así como las plataformas AcrySof IQ Vivity de Alcon y TECNIS Eyhance de Johnson & Johnson han logrado ofrecer nuevas opciones de visión en el tratamiento de catarata y presbicia.
Con estos avances tecnológicos los antiguos lentes esféricos fueron transformándose a lentes asféricos, y estos están evolucionando para alcanzar un mayor rango de visión extendida, es así como las plataformas AcrySof IQ Vivity de Alcon y TECNIS Eyhance de Johnson & Johnson han logrado ofrecer nuevas opciones de visión en el tratamiento de catarata y presbicia.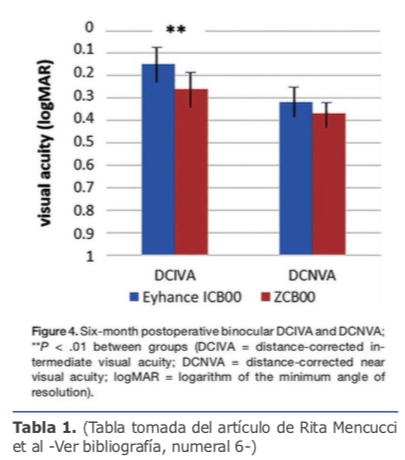 Esta tecnología logra un aumento local y continuo de potencia que va de la periferia hasta el centro de la óptica, el cual tiene una superficie posterior esférica y una superficie anterior asférica modificada, logrando una hiperprolatidad y con eso aumentar la profundidad del foco lo que proporciona una visión intermedia mejorada en comparación con una LIO monofocal asférica estándar.6 Según la compañía, las disfotopsias son comparables a una LIO monofocal asférica estándar pues compensan la aberración corneal asférica.
Esta tecnología logra un aumento local y continuo de potencia que va de la periferia hasta el centro de la óptica, el cual tiene una superficie posterior esférica y una superficie anterior asférica modificada, logrando una hiperprolatidad y con eso aumentar la profundidad del foco lo que proporciona una visión intermedia mejorada en comparación con una LIO monofocal asférica estándar.6 Según la compañía, las disfotopsias son comparables a una LIO monofocal asférica estándar pues compensan la aberración corneal asférica.

