Noticiero ALACSA – R :: Mayo 2013
Editor General
Editores
REFRACTIVA Y CÓRNEA – María José Cosentino – Argentina
Coeditores de Cirugía Refractiva y Córnea
Arturo Chayet (México)
Cesar Carriazo (Colombia)
Daniel Scorsetti (Argentina)
David Flikier (Costa Rica)
Luis Izquierdo Jr. (Perú)
Mauro Campos (Brasil)
Miguel Srur (Chile)
Renato Ambrósio (Brasil)
Roberto Albertazzi (Argentina)
Sérgio Kwitko (Brasil)
Coeditores de Catarata
Armando Crema (Brasil)
Carlos Nicoli (Argentina)
Claudia Palacio Pastrana (México)
Claudio Orlich (Costa Rica)
Daniel Badoza (Argentina)
Edgardo Carreño (Chile)
Eduardo Chávez (México)
Enrique Suárez (Venezuela)
José Luis Rincón (Venezuela)
Luis Lu (USA)
Miguel Padilha (Brasil)
Editor de Vídeo
Luis Escaf (Colombia)
Editores
REFRACTIVA Y CÓRNEA – Heriberto Mario Marotta (Argentina)
Coeditores de Cirugía Refractiva y Córnea
Alberto Habert (México)
Arturo Kantor (Chile)
Carlos Ferroni (Argentina)
Carlos Palomino (España)
David Flikier (Costa Rica)
Edna Almodin (Brasil)
Luis A. Rodríguez Torres (Venezuela)
Luis Izquierdo (Perú)
Pablo Suarez (Ecuador)
Coeditores de Catarata
Claudio Orlich (Costa Rica)
Daniel Badoza (Argentina)
Eduardo Viteri (Ecuador)
Fernando Aguilera (México)
Jorge Jaramillo (Venezuela)
Juan Carlos Corbera (Perú)
Milton Yogi (Brasil)
Ramón Lorente (España)
Director Ejecutivo
Traducción cortesía de

Servicio Internet cortesía de

Editorial
Cirugía de catarata después de trasplante de córnea
Dr. Angel Pineda Fernandez – Venezuela
Artículo de revisión
¿Qué debo saber de la pseudoexfoliación?
Dr. Daniel H. Scorsetti – Argentina
Foro Catarata
Manejo y diagnóstico del desprendimiento de descemet durante la cirugía de catarata
Coordinador: Dr. José Luis Rincón R. – Venezuela
Panelista: Dr. Fernando Aguilera Zarate – México, Dr. Luis Escaf – Colombia, Dr. Ramón Lorente Moore – España, Dr. Juan Guillermo Ortega J – Colombia
Catarata: Ciencia – Arte – Experiencia
Noticiero ALACCSA-R pregunta (colaboración del Dr. David Flikier – Costa Rica, e-mail: david@flikier.com)
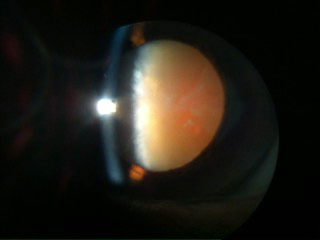
CATARATA Y PSEUDOEXFOLIACION: Se trata de un paciente masculino de 68 años de edad, quien llega a la consulta por primera vez, con el antecedente de pseudoexfoliación y de haber sido operado de catarata de ambos ojos con LIO multifocal tres años antes, pero con un resultado visual malo (agudeza visual con corrección óptica 20/70 +0.50, y muchas molestias visuales de sombras y halos) en su ojo izquierdo, con presiones oculares normales, con una cápsula posterior trasparente y un OCT que descarta patología macular. A la biomicroscopía se evidencia una descentración ínfero-nasal del lente intraocular y del complejo capsular, con respecto a la pupila, y una diálisis zonular evidente de hora 10-12, sin pseudofacodonesis y sin vítreo previo.
Dr. Arnaldo Espaillat – Republica Dominicana
Dr. Virgilio Centurion – Brasil
Dra. Linda Nasser Nasser Monterrey – México
Dr. L. Felipe Vejarano – Colombia
Dr. José G. Guerrero F. – Argentina
SBAO – Sociedade Brasileira de Administração em Oftalmologia
Nuevos médicos administradores: consejos para la gestión de la carrera profesional y vivir bien
Edson Yamamoto – Brasil
ALACCSA-R / LASCRS in ASCRS – San Francisco, April 19 – 23, 2013
ALACCSA-R / LASCRS in Pan American & Brazilian Cong. of Ophthal., Rio de Janeiro, Aug. 07 – 10, 2013
Avisos
- noticiero@alaccsa-r.info: Puede enviar sus comentario que en el próximo número iremos publicarlo.
- Las opiniones o manifestaciones aquí divulgadas son de exclusiva responsabilidad de los autores.
- Si no deseas recibir Noticiero ALACCSA-R, clique aquí.
Cirugía de catarata después de trasplante de córnea
Dr. Angel Pineda Fernandez – Venezuela
Cirujano de Segmento Anterior. Centro Oftalmológico de Valencia-CEOVAL, Valencia, Venezuela. Clínica Oftalmológica El Viñedo, Valencia, Venezuela.
E-mail: angelpinedaf@yahoo.com
La cirugía de catarata después de trasplante de córnea representa un reto importante para el cirujano de segmento anterior por la posibilidad de inducir una importante pérdida de células endoteliales del botón donante, que después lleve a su descompensación. Existen varias circunstancias por las cuales tenemos que realizar cirugía de catarata después de un trasplante de córnea: la catarata puede ser resultado de la misma patología que ocasionó la alteración corneal. En este caso, existen dos conductas: la primera es realizar el trasplante de córnea en un primer tiempo, y luego realizar la cirugía de catarata en un segundo tiempo. Esta estrategia nos permite calcular de una forma más precisa el poder del lente intraocular que se colocará, pero por otro lado requiere ser realizado en dos tiempos, aumentando el costo del mismo, la recuperación visual es más lenta y existe el posible daño al endotelio corneal donante. Generalmente esta conducta se realiza en casos de cataratas incipientes, pacientes jóvenes (para preservar la acomodación) y cuando la cámara anterior se visualiza con dificultad en el preoperatorio. La otra conducta es realizar un procedimiento triple (trasplante penetrante de córnea, extracción extracapsular de catarata y colocación de lente intraocular) en un solo tiempo quirúrgico. Esta estrategia resulta en realizar estos tres procedimientos en un mismo acto quirúrgico, con una recuperación visual más rápida y sin daño endotelial adicional al tejido donante. Sin embargo, la extracción de la catarata a “cielo abierto” puede acompañarse de aumento incontrolable en la presión del vítreo con posible ruptura de la cápsula posterior, y resultar en la peor complicación como lo es la hemorragia expulsiva durante el procedimiento. También ofrece dificultades en el cálculo del lente intraocular por falta de predicción en el poder queratométrico final.
La catarata puede producirse después del trasplante de córnea, causada por trauma quirúrgico durante el procedimiento o por uso prolongado de corticosteroides para controlar el proceso inflamatorio postoperatorio y para prevenir el rechazo al trasplante.
La cirugía de catarata con implante de lente intraocular se puede realizar para reducir errores refractivos elevados post trasplante de córnea. Con la llegada de los modernos lentes intraoculares tóricos, en cirugía de catarata, podemos reducir el cilindro residual post queratoplastia penetrante de forma significativa ofreciéndole al paciente una mejor calidad visual.
Idealmente, la cirugía de catarata debería realizarse cuando todas las suturas del trasplante de córnea ya hayan sido retiradas, que la córnea esté estable desde el punto de vista topográfico (realizando topografía corneal de forma seriada en el postoperatorio), y que las medidas queratométricas se puedan obtener de forma precisa y confiable. En trasplantes de córnea con un astigmatismo regular y relativamente simétrico, los métodos usuales para medir el poder corneal (queratómetro manual, autoqueratómetro y topografía corneal) son de gran utilidad para tal finalidad. En trasplantes de córnea con diferentes grados de asimetría, irregularidad y hasta multifocalidad en la topografía corneal, es de gran utilidad para estimar el poder corneal efectivo, para ser usado en el cálculo del lente intraocular, el Pentacam, basado en la imagen de Scheimpflug. El mismo posee el programa de Holladay para calcular el poder corneal promedio en zonas ópticas de 1mm a 6mm centrales.
La pérdida endotelial normal anual en personas normales es de 0.6%, aumentando significativamente después de cirugía intraocular. El trasplante de córnea penetrante está asociado con un aumento relativo en la pérdida endotelial, con un promedio anual de 7.8% entre el 3ero y 5to año postoperatorio, y 4.2% entre el 6to y 10mo año postoperatorio. La causa de esta pérdida endotelial acelerada después del trasplante de córnea es desconocida y no puede explicarse solo por mecanismos inmunológicos. Hayashi y Hayashi no encontraron una diferencia estadísticamente significativa en la pérdida de células endoteliales entre pacientes a los cuales se le realizó trasplante de córnea y cirugía de catarata simultáneamente y aquellos a los que se le realizó en forma separada (secuencial). Kim y Kim reportan una tasa de pérdida endotelial mayor en cirugía de catarata después de trasplante de córnea que en sujetos normales.
Por estos hallazgos, al realizar la cirugía de catarata después de un trasplante de córnea debemos hacer todos los esfuerzos por minimizar la posible pérdida de células endoteliales del tejido donante. Para tal propósito, es necesario realizar contaje de células endoteliales en el preoperatorio, así tendremos una idea de la situación que vamos a enfrentar. Generalmente es de elección realizar una facoemulsificación con incisión en córnea clara, aunque también se puede realizar por túnel escleral, lo cual según algunos cirujanos está asociado a menor pérdida de células endoteliales, aunque esto no ha sido demostrado desde el punto de vista científico. Es recomendable realizar una técnica endocapsular con implante de lente intraocular plegable en el bolsillo capsular. Sin embargo, con el uso de viscoelásticos dispersivos que protegen de forma efectiva el endotelio donante, se podría usar técnicas supracapsulares, especialmente en casos de cataratas muy blandas o cristalinos transparentes en donde se realiza la cirugía para corrección de errores refractivos residuales. Es recomendable utilizar, en medida de lo posible, poderes de vacío bajos a moderados con niveles de irrigación adecuados a esos vacíos, con la finalidad de disminuir la turbulencia en cámara anterior durante el procedimiento, lo cual también podría tener impacto sobre el endotelio. En casos de cataratas más duras o brunescentes con un recuento endotelial bajo, es razonable considerar la posibilidad de realizar una técnica tradicional de extracción extracapsular de catarata. Acar y colaboradores encontraron que la extracción extracapsular de catarata después de trasplante de córnea causó menos pérdida de células endoteliales que la facoemulsificación en pacientes con cataratas duras (12.7% versus 20.3% respectivamente, 6 meses después de la cirugía de catarata). El mecanismo de pérdida endotelial en facoemulsificación en cataratas duras es el daño mecánico causado por la energía ultrasónica y el tiempo prolongado de ultrasonido necesario para disolverlas. La pérdida endotelial después de facoemulsificación se ha reportado que varía entre 3.25% y 23.2%. En el postoperatorio, es necesario controlar aquellos factores que podrían tener efecto nocivo al endotelio: controlar el proceso inflamatorio con corticosteroides para prevenir rechazo endotelial y/o pérdida endotelial, y control adecuado de la presión intraocular.
Además de las medidas necesarias para prevenir una pérdida importante de células endoteliales, debemos proteger de forma adecuada el epitelio corneal, importante componente de la superficie ocular. Debemos evitar el uso excesivo de sustancias antisépticas potencialmente tóxicas a la superficie ocular como el yodo povidine, debemos proteger el epitelio corneal durante la cirugía con sustancias viscoelasticas y debemos controlar todos aquellos factores que podrían alterar la superficie ocular en el postoperatorio, como toxicidad de medicamentos, además de controlar las posibles causas de disfunción del film lagrimal, usando lubricantes oculares sin preservante y tratando patologías subyacentes como meibomitis y/o blefaritis.
Con todas estas medidas preventivas, las probabilidades de sobrevida del trasplante de córnea 5 años después de la cirugía de catarata es de al menos 80%. Sin embargo, se puede presentar falla endotelial del trasplante de córnea después de cirugía de catarata. En tales circunstancias, estaría indicado realizar un nuevo trasplante penetrante de córnea. En los últimos años ha ganado gran popularidad la realización de trasplante endotelial (DSAEK por sus siglas en inglés: descemet-stripping automated endotelial keratoplasty) en casos de disfunción endotelial como Distrofia Endotelial de Fuchs y descompensación corneal después de cirugía de catarata. Este procedimiento es de gran utilidad en casos de falla endotelial después de trasplante de córnea.
Referencias bibliográficas
- Acar BT, Buttanri IB, Sevim MS, Acar S. Corneal endotelial cell loss in post-penetrating keratoplasty patients after cataract suergery: Phacoemulsification versus planned extracapsular cataract extraction. J Cataract refract Surg 2011;37:1512-1516.
- Bourne WM, Hodge DO, Nelson LR. Corneal endothelium five years after transplantation. Am J Ophthalmol 1994; 118:185-196.
- De Santis U, Eandi C, Grignolo F. Phacoemulsification and customized toric intraocular lens implantation in eyes with cataract and high astigmatism after penetrating keratoplasty. J Cataract Refract Surg 2011; 37:781-785.
- Gupta N, Ram J, Chaudhary M. Acrysoftoric intraocular lens for post-keratoplasty astigmatism. Indian J Ophthalmol 2012; 60:213-215.
- Hamill MB. The triple procedure –is the best approach for the patient? Sequential surgery may be the best approach for the patient. Arch Ophthalmology 2000;118:415-417.
- Hayashi K, Hayashi H. Simultaneous versus sequential penetrating keratoplasty and cataract surgery. Cornea 2006; 25:1020-1025.
- Ing JJ, Ing HH, Nelson LR, Hodge DO, Bourne WM. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology 1998; 105:1855-1865.
- Inoue Y. Corneal triple procedure. Semi Ophthalmol 2001; 16(3):113-118.
- Kim EC, Kim MS. A comparison of endothelial cell loss after phacoemulsification in penetrating keratoplasty patients and normal patients. Cornea 2010;29:510-515.
- Muraine M, Gueudry J, Retout A, Genevois O. Keratoplasty combined with cataract surgery. J Fr Ophthalmol 2012; 35(7):546-554.
- Price FW Jr, Price MO. Endothelial keratoplasty to restore clarity to a failed penetrating graft. Cornea 2006; 25:895-899.
- Scorcia V, Lucisano A, Beltz J, Busin M. Combined descemet-stripping automated endothelial keratoplasty and phacoemulsification with toric intraocular lens implantation for treatment of failed penetrating keratoplasty with high regular astigmatism. J Cataract Refract Surg 2012; 38:716-719.
- Tehrani M, Stoffelns B, Dick HB. Implantation of a custom intraocular lens with a 30-diopter torus for the correction of high astigmatism after penetrating keratoplasty. J Cataract Refract Surg 2003; 29:2444-2447.
¿Qué debo saber de la pseudoexfoliación?
Dr. Daniel H. Scorsetti – Argentina
E-mail: danielhs@arnet.com.ar
El síndrome Pseudoexfoliativo descrito por Lindberg en 1917, es aquél en el cual se produce una sustancia de aspecto blanco fibrogranular (microfibrilla de elastina) similar a la membrana basal celular que se deposita en tejidos oculares y extraoculares tales como piel, hígado, pulmón, riñón y meninges.
Existe un mecanismo proteolítico mediado por enzimas lisosomales como la Lysy Oxidasa que facilita la alteración de los tejidos involucrados en esta patología constituyendo un trastorno genético-hereditario demostrado en un estudio realizado en Suecia e Islandia y publicado en el año 2007 por la revista Science, donde se han encontrado las alteraciones de polimorfismo genético en LOXL1 localizadas en el cromosoma 15q24.1. Esto ha permitido abrir una puerta importante en el tratamiento de base de esta patología mediante la terapia génica que en un futuro cercano podrá resolver muchas de estas situaciones.
En la oftalmología los cambios pseudoexfoliativos se ven con mayor frecuencia luego de los 60 años de edad, alcanza una prevalencia alta en Islandia y Escandinavia, predominan en la raza blanca con un 75% de bilateralidad aunque en forma asimétrica en cuanto al grado de afectación. No se han encontrado diferencias de sexo en la aparición de la misma.
Las áreas oculares involucradas son la Zónula de Zinn, el iris, el trabeculado, el cristalino y la córnea. Produciendo también modificaciones secundarias por aumento de permeabilidad de la barrera Hemato-Ocular.
La zonulopatía es debida a la debilidad progresiva del aparato suspensorio del cristalino por el mecanismo proteolítico de la enfermedad sumado al depósito del material patológico en la zónula que genera la subluxación o luxación del cristalino. La iridopatía es responsable de las sinequias posteriores con un doble epitelio pigmentado con aspecto de serrucho en la cara posterior del iris (destrucción de la membrana basal del epitelio pigmentado del iris) y engrosamiento del estroma iridiano por mayor permeabilidad de los vasos. Se pueden observar depósitos similares a ceniza en el borde libre de la pupila mediante el examen en lámpara de hendidura, al igual que los defectos del estroma mediante la retroiluminación. La trabeculopatía es generada por la obstrucción al flujo del humor acuoso hacia el canal de Schlemm por el depósito de material pseudoexfoliativo y gránulos de pigmento. Mediante el exámen gonioscópico se puede observar la doble línea pigmentada ondulada que Bussaca definió como la Línea de Sampaolesi. La facopatía es producida por los depósitos de esta sustancia patológica en la cápsula anterior del cristalino y la opacificación del mismo. Dilatando la pupila podremos observar en lámpara de hendidura una imagen similar a la escarapela donde existe un anillo central y otro periférico del material pseudoexfoliativo en la cápsula anterior del cristalino, separadas por una zona limpia de depósitos gracias al movimiento del iris, que barre como una escoba en esa zona. Finalmente la queratopatía o Distrofia de Naumann descripta en el año 2003, se produce porque estos depósitos de material anormal son tóxicos para el endotelio y entorpecen el normal funcionamiento de la bomba de Sodio-Potasio desencadenando la descompensación endotelial. Y por otro lado el aumento en la permeabilidad de la barrera hemato-ocular favorece la inflamación y el aumento de plasticidad en los procesos postquirúrgicos que en algunos casos pueden llevarnos a confusiones con las endoftalmitis y el Tass.
Consideraciones Preoperatorias:
Los pacientes que presenten pseudoexfoliación y catarata deben ser sometidos a una rigurosa evaluación oftalmológica completa y con estudios complementarios obligatorios debido a que estos pacientes en general presentan además glaucoma pseudoexfoliativo y otras alteraciones como las descritas anteriormente. Se necesita realizar un examen biomicróscopico preciso del segmento anterior, evaluar la profundidad de la cámara anterior pensando que una asimetría sugiere debilidad zonular, evaluar la pupila y su dilatación, el trabeculado y la tensión ocular, el endotelio corneal y el cristalino con su cápsula anterior además de una buena inspección del fondo de ojo mediante oftalmoscopía indirecta y los exámenes complementarios necesarios: gonioscopía, HRT, campo visual, microscopía especular, OCT anterior y posterior, etc, etc.
En presencia de catarata y glaucoma pesudoexfoliativo es conveniente evitar la cirugía combinada (catarata y glaucoma )puesto que éstas tienen un riesgo mayor de edema cistoide, agujero macular, maculopatía hipotónica, membranas epiretinales y por otro lado perdemos la oportunidad de disminuír la tensión ocular realizando solamente la cirugía de catarata. Lo importante en estos casos es intervenir al paciente con catarata tan pronto como sea posible puesto que de esa forma encontraremos menor dureza del núcleo del cristalino, mejor dilatación de la pupila, menor debilidad zonular, menor daño glaucomatoso y mayor resistencia de las estructuras oculares a las maniobras intraoperatorias.
Las dificultades intraoperatorias en general se deben a la poca dilatación de la pupila, a la mayor o menor debilidad de la zónula y a la afectación del endotelio corneal. Por todo ello es muy importante considerar el adecuado manejo intraoperatorio, cuidando al paciente y a nuestras coronarias, y para ello muchas veces deberemos recurrir a maniobras de viscodilatación pupilar, stretching manual o utilizado retractores del iris para lograr un buen acceso al cristalino. Se deben liberar las sinequias posteriores mediante espátula y si es necesario utilizar colorantes para teñir la cápsula anterior del cristalino. En el momento de la capsulorexis debemos constatar la existencia de pliegues capsulares que suponen una debilidad zonular mayor, y cuando observamos que hay alteraciones de la zónula no dudar en colocar los anillos de tensión capsular que permiten mediante una fuerza centrífuga circunferencial centrar la bolsa y posteriormente la lente intraocular además de evitar la fibrosis y la contracción capsular. Hoy en día existen varios dispositivos para lograr un mejor centrado de la bolsa como el Sistema de Mackool, los ganchos del Dr. Ahmed, los anillos del Dr. Cionni en sus diferentes formatos con o sin aletas de sutura escleral y los ganchos dobles de Yaguchi-Kazawa por nombrar algunos de ellos. La Facoemulsificación debe realizarse en la cámara posterior para evitar daños en el endotelio y con maniobras delicadas para no agredir a la zónula, es importante también que la aspiración de las masas se realice en forma lateral y no tironeando de las mismas hacia el centro de la pupila a efectos de conservar la mayor cantidad posible de zónula en buen estado. También es importante aspirar los restos de epitelio del cristalino por debajo de la rexis. Si la debilidad zonular es menor a 4 horas podremos colocar la lente en el saco capsular, si está entre 4 y 6 horas es condición sinequanon colocar un anillo de tensión capsular y si es mayor de 6 hs la lente puede ir al saco capsular pero el anillo de tensión capsular deberá suturarse a la esclera. Otra alternativa propuesta por el Dr. David Chang es colocar la lente en el sulcus con la óptica atrapada en la rexis. Estos pacientes necesitan recibir más tiempo corticoides en el postoperatorio por la ruptura de la barrera hemato ocular. Las dificultades tardías postoperatorias consisten en la fimosis capsular, lo cual puede resolverse mediante la aplicación de descargas con YAG láser en los cuatro puntos cardinales, y en la subluxación o luxación de la lente intraocular con la bolsa sacular que la contiene siendo esta última una complicación mayor que puede resolverse en algunas ocasiones de subluxación suturando las hapticas de la lente al iris o a la esclera.
En resumen frente a un paciente con esta patología debemos realizar los estudios necesarios y preparar el mejor abordaje terapéutico en cada caso, considerando todos los detalles mencionados en cuanto al tratamiento quirúrgico y especialmente actuar lo más precoz posible para evitar las complicaciones de esta patología (intra y postoperatorias) que aumentan considerablemente con el paso del tiempo.
Manejo y diagnóstico del desprendimiento de descemet durante la cirugía de catarata
Coordinador: Dr. José Luis Rincón R. – Venezuela
Panelistas: Dr. Fernando Aguilera Zarate – México, Dr. Luis Escaf – Colombia, Dr. Ramón Lorente Moore – España, Dr. Juan Guillermo Ortega J – Colombia
Dr. Rincón: 1. EN SU EXPERIENCIA, ¿CUáLES SON LAS CAUSAS MáS FRECUENTES?
Dr. Aguilera Zarate:
A) Deficiente construcción de herida corneal; B) Uso de bisturíes en condiciones no óptimas; C) Incisiones más chicas que lo necesario para la introducción de instrumentos e inyectores al ojo; D) Uso excesivo de energía (temperatura) ultrasónica.
Dr. Escaf:
1- Incisiones muy ajustadas tanto la principal como la auxiliar pueden hacer que los instrumentos y cánulas utilizados disequen la descemet al momento de entrar y salir de la cámara anterior.
2- También si la construcción de la incisión coincide con la zona de transición de la descemet en el espolón escleral, sitio de inserción de la descemet, en algunos casos se produce desincersión, lo he visto en pacientes diabéticos.
3- Otra forma de producirse es el trauma con los instrumentos cuando tratamos de rescatar un fragmento muy cerca del endotelio.
4- También se puede presentar al momento de hidratar las incisiones si la cánula infiltra la solución en el plano de la descemet y el estroma y no en el estroma medio.
5- Si se presenta una quemadura de la incisión existe la posibilidad de un desprendimiento sectorial.
Dr. Lorente Moore:
Incisiones demasiado ajustadas, utilizar puntas sin capuchones de silicona, implantes LIOs por incisiones demasiado pequeñas. La PIO baja tras cirugía es un factor muy importante ya que si está un poco alta reposiciona la Descemet al estroma. La causa demostrada (Calladine 2007) más importante es la hidratación de las incisiones debido a que las fibras estromales aumentan su tamaño el edematizarse, propiedad que no posee la membrana de Descemet. Calladine reporta una incidencia del 61% con hidratación y del 25% sin hidratación.
Dr. Guillermo Ortega J.:
Las causas más frecuentes en mi opinión tienen que ver con trauma intraoperatorio, bien por maniobras bruscas dentro de la cámara anterior durante la faco o la aspiración de corteza, o mucho más fácilmente por maniobras forzadas en las incisiones: con la pieza de mano, o más fácilmente al ingresar un lente plegado a través de incisiones muy estrechas.
Dr. Rincón: 2. ¿CóMO SE DIAGNOSTICA?
Dr. Aguilera Zarate:
A) Transoperatorio por visualización directa; B) Postoperatorio por edema corneal sectorial y visualización directa. OCT corneal y UBM.
Fig. 1: Desprendimiento descemet postoperatorio inmediato y a las 24 horas con uso de SSB.

Dr. Escaf:
1- Intraoperaoriamente si el desprendimiento en muy grande se puede observar una línea de disección y la descemet flotando en cámara anterior.
2- Clínicamente en el postoperatorio se puede observar en la lámpara de hendidura un engrosamiento de la córnea a expensas del estroma en el área de la incisión y una separación de la descemet.
3- Otra forma más visible es realizar un Pentacam u otro método y así podemos observar claramente la descemet suelta.
Dr. Lorente Moore:
El Gold Standard del diagnóstico es la OCT de dominio espectral de segmento anterior (resolución más alta que en los OCT de dominio temporal). Pentacam también es válida para el diagnóstico y con la lámpara de hendidura hay que tener mucha experiencia y “buscarlos”.
Dr. Guillermo Ortega J.:
Es importante estar atento a la aparición de una membrana transparente que flota en la cámara anterior durante las últimas etapas de la cirugía, sobre todo cuando ha habido alguna dificultad como las anotadas previamente. En el postoperatorio, la presencia de edema corneal sectorial, debe hacer sospechar este evento. Se puede confirmar con ecografía de segmento anterior, OCT e incluso con el Pentacam en las imágenes de Scheimpflug.
Dr. Rincón: 3. OPCIONES DE TRATAMIENTO Y SUS MEJORES Y PEORES RESULTADOS.
Dr. Aguilera Zarate:
A) Transoperatorio: viscoaposición con OVD dispersivo / bajar parámetros de vacío y flujo / si es posible, cambiar a nueva incisión.
B) Si no hay adherencia con uso de SSB, emplear aire al 100% tipo DSEK, esperar 20 minutos aproximadamente. Revalorar y si está adherida, intercambio del 50% del aire por SSB y dar posición de decúbito dorsal por unas horas. Dilatar para evitar bloqueo pupilar o hacer iridotomia micro en meridiano inferior.
C) Si no hay adherencia, recolocación de aire más decúbito.
Dr. Escaf:
Si se presenta durante la cirugía un desprendimiento de descemet muy extenso y apenas estoy comenzando la cirugía es una gran complicación y de ahí en adelante uso viscoelástico dispersivo durante toda la cirugía en forma continua para evitar que se aumente o riesgo de cortar la descemet, dejando aire al final de ella.
Si la diagnostico al día siguiente y dependiendo de la extensión inyecto aire intracameral o S3F6.
El aire tiene la desventaja que se evapora antes de las 12 horas y el S3F6 demora más.
Los 2 gases funcionan bien y es raro que no se pegue nuevamente la descemet, aun después de varios días de haber estado desprendida. Hay que tener en cuenta que el S3F6 se expande un 30 % más del volumen que se coloca.
En nuestra experiencia que es muy poca (3 casos) 2 nuestros y 1 remitido, con desprendimiento de descemet extensos los 3 salieron adelante. Los 2 nuestros con aire y el remitido que tenía varios días con varias posturas de S3F6 (anexo 3 fotos), en el cual hubo que aplicarle S3F6 en 3 ocasiones con una semana de intervalo, logramos pegarle la descemet después de 3 semanas de estar desprendida. La paciente recupero visión de 20 /20 y se evitó un trasplante de córnea.

Dr. Lorente Moore:
En principio, esperar. El 80% se solucionan solos al mes. En casos de desprendimientos grandes y/o enrollados lo más eficaz es la inyección intracamerular de SF6 al 15%, hasta cubrir ± 2/3 de cámara anterior. Es muy importante identificar donde esta exactamente el desprendimiento para inyectarlo desde la posición adecuada. Hay que controlar la PIO durante ± 3 horas. Si sube mucho habría que retirar algo de gas. El paciente hay que posicionarle de manera que la burbuja adhiera la descemet al estroma.
Solo he tenido dos casos con necesidad de hacerlo, en uno de ellos hubo que repetir la inyección a los 15 días. Ambos se solucionaron sin problemas.
Dr. Guillermo Ortega J.:
En ocasiones puede reaplicarse espontáneamente y es allí donde se hace el diagnóstico retrospectivo, por los pliegues residuales y la resolución del edema de manera rápida. Usualmente se llevan a cirugía y se les aplica una burbuja de aire a presión, a la manera de una queratoplastia lamelar endotelial, por varios minutos, y se deja al paciente en reposo y boca arriba para asegurarse de que se adhiera nuevamente. En casos recalcitrantes se ha propuesto el uso de gases expansivos, o suturas a través de la córnea, pero no he tenido experiencia con esto.
Dr. Rincón: 4. ¿CUáLES LAS MEDIDAS PREVENTIVAS?
Dr. Aguilera Zarate:
A) Herida de perfecta construcción, de tamaño adecuado y uso de mínimo ultrasonido que sea posible.
Fig. 2: OCT de herida corneal con microquemadura con desprendimiento de descemet localizado.

Dr. Escaf:
No realizar incisiones tan ajustadas, al sacar y entrar los instrumentos que estos no salgan del todo del ojo y si lo hacen que no tengan la irrigación activa. Además que los instrumentos no presenten microaristas, al realizar las incisiones procurar hacerlas cornea clara o esclerales y evitar la línea media entre cornea clara y limbo.
Dr. Lorente Moore:
No forzar la incisión, ni con las puntas ni con el inyector de LIO. Dejar el ojo con algo de presión. Prefiero hidratar discretamente las incisiones, porque el desprendimiento sub-incisional siempre es subclinico. Protección intraoperatoria con Viscoat (es el que más protege el endotelio debido al condroitin-sulfato).
Dr. Guillermo Ortega J.:
Las medidas preventivas son evitar maniobras agresivas contra el endotelio (no aspirar bruscamente masas corticales adheridas al endotelio). En particular, me preocupan las incisiones muy pequeñas en cornea, que obligan al cirujano a hacer mucha fuerza al inyectar el lente. Habitualmente se habla del riesgo de fracturarlo, pero poco se advierte sobre el riesgo de desprender la descemet en ese momento.
Dr. Rincón: 5. ¿CUáNDO HAY INDICACIóN DE TRASPLANTE?
Dr. Aguilera Zarate:
A) Cuando el edema no cede a pesar de aposición de descemet, o cuando no se logra la aposición adecuada. Sin embargo, Blumenthal describió varios pacientes que aun con desprendimiento de descemet completo, tuvieron resolución espontanea sin necesidad de cirugía.
Dr. Escaf:
Si definitivamente la córnea no sale adelante con todos los tratamientos y hay una franca descompensación no hay otra forma que realizar un trasplante corneal ya sea total penetrante o solo de endotelio (DSAEK).
Dr. Lorente Moore:
Si con la inyección de Sf6 (puede repetirse) no se soluciona, y pasado un tiempo prudencial de ± 4 meses sin mejoría, no habrá más remedio que indicarlo.
Dr. Guillermo Ortega J.:
Claramente cuando no se consigue reaplicarla con las maniobras anotadas, o cuando a pesar de reaplicarse, el daño endotelial es tan severo que la córnea se descompensa de manera irreversible.
Datos de Contacto de los Doctores
Dr. José Luis Rincón R., e-mail: jlrincon@cantv.net
Dr. Fernando Aguilera Zarate, e-mail: drfaguilera@gmail.com
Dr. Luis Escaf, e-mail: escaff@gmail.com
Dr. Ramón Lorente Moore, e-mail: rlorenteoftal@yahoo.es
Dr. Juan Guillermo Ortega J., e-mail: jgortega@une.net.co
Noticiero ALACCSA-R pregunta (colaboración del Dr. David Flikier – Costa Rica, e-mail: david@flikier.com):
CATARATA Y PSEUDOEXFOLIACION: Se trata de un paciente masculino de 68 años de edad, quien llega a la consulta por primera vez, con el antecedente de pseudoexfoliación y de haber sido operado de catarata de ambos ojos con LIO multifocal tres años antes, pero con un resultado visual malo (agudeza visual con corrección óptica 20/70 +0.50, y muchas molestias visuales de sombras y halos) en su ojo izquierdo, con presiones oculares normales, con una cápsula posterior trasparente y un OCT que descarta patología macular. A la biomicroscopía se evidencia una descentración ínfero-nasal del lente intraocular y del complejo capsular, con respecto a la pupila, y una diálisis zonular evidente de hora 10-12, sin pseudofacodonesis y sin vítreo previo.

¿Cuál sería su conducta a seguir?
Dr. Arnaldo Espaillat – Republica Dominicana
E-mail: a.espaillat.m@codetel.net.do
Este caso nos confirma el hecho de que el descentramiento de un lente intraocular multifocal puede producir deterioro de la agudeza visual al afectar el resultado refractivo final (astigmatismo inducido, cambios hacia miopía o hipermetropía) y alterar la calidad visual por inducción de aberraciones ópticas de alto orden, visión de halos y reflejos luminosos. Ya ha sido reportado que una descentración de más de 0.4 mms y un efecto de inclinación (“tilt”) de más de 5° en un lente intraocular multifocal afecta su desempeño óptico1-4.
Debido a lo expuesto anteriormente, la solución de las molestias del paciente consiste en centrar el lente intraocular multifocal en el eje visual o reemplazarlo por uno monofocal o multifocal de tres piezas. Debido a la fibrosis capsular y a la diálisis zonular por la pseudoexfoliación, el centramiento del lente implantado sería muy difícil y con estabilidad poco fiable por el problema zonular asociado a la pseudoexfoliación.
Antes de realizar la cirugía, le explicaría al paciente las dos opciones que existen y que en primer lugar intentaría colocar un lente intraocular de tres piezas fijado en túnel escleral, siempre y cuando pudiera extraer el lente multifocal monopieza que está subluxado. También evaluaría el astigmatismo corneal presente para decidir si implantaría un lente de tres piezas monofocal o multifocal. Si se tratara de un astigmatismo corneal igual o menor de 0.5 dioptrías intentaría el lente multifocal.
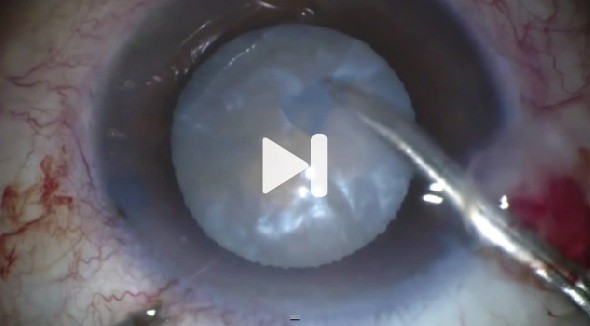
En las fotos se aprecia que la capsulorrexis es asimétrica y deja descubierta una mitad de la óptica del lente intraocular en mayor proporción que la otra mitad, además de que parece que la rexis llegara hasta casi el ecuador del saco capsular en ese mismo lado. Como la cirugía de catarata que le habían realizado para implantar el lente intraocular fue hecha hacía 3 años, es muy probable que la fibrosis capsular fuera muy fuerte para intentar liberar las hápticas del lente y extraerlo del saco capsular. Por ello, utilizando viscoelástico dispersivo y una aguja de 30 gauges, intentaría crear un punto de separación entre la rexis capsular y el borde de la óptica del lente para introducir una cantidad suficiente de viscoelástico detrás del mismo que me permitiera separarlo del saco capsular y así poder segmentarlo y extraerlo del ojo. Previo a estos pasos es importante colocar suficiente cantidad de viscoelástico dispersivo en el área de la diálisis zonular para prevenir que el vítreo entre en cámara anterior. En caso de que entre vítreo en cámara anterior durante las maniobras quirúrgicas, haría vitrectomía anterior vía Pars Plana.
En caso de que el astigmatismo corneal presente fuera el mencionado anteriormente, y debido a que el OCT macular no muestra alteración y a que en el primer ojo se pudo implantar exitosamente dentro del saco capsular un lente monopieza difractivo apodizado, implantaría un lente intraocular de tres piezas difractivo apodizado de adición de +3 dioptrías fijado a la esclera. Prefiero esta opción y no solamente implantarlo en el sulcus ciliaris, para evitar el riesgo de rotación o luxación del lente a la cámara vitrea en el futuro debido a mayores problemas con el aparato zonular de este ojo.
Los implantes de lentes intraoculares de cámara posterior suturados a esclera se han asociado a que el lente quede en posición inclinada o descentrada, riesgos de hemorragia supracoroidea, desprendimiento de retina y edema macular. Así mismo, se han reportado casos donde la sutura erosiona la conjuntiva y sirve de “vía de conducción” para las bacterias al interior del ojo lo cual se ha relacionado a endoftalmitis5-9. Como ventaja tienen el hecho de que hay menor posibilidad de daño endotelial (comparado con los lentes de cámara anterior con soporte angular) y de deformación pupilar (comparado con los lentes de cámara anterior de soporte angular y con la técnica de sutura del lente al iris).
Debido a lo anterior, decidimos la opción de fijar un lente intraocular en un túnel escleral. Esta técnica se puede realizar utilizando un pegamento tisular (ya sea el Reliseal – Reliance Life Sciences, India- o el Tisseel de laboratorios Baxter) para sellar el colgajo escleral (que protege la háptica del lente) y la conjuntiva. La técnica y el empleo del pegamento tisular ha sido desarrollada por el Dr. Amar Agarwal10 y con ella se puede utilizar tanto un lente rígido de pieza única de PMMA, como un lente de tres piezas de cámara posterior o lentes con hápticas de PMMA modificadas. Con esta técnica se externalizan las hápticas del lente intraocular a través de dos esclerotomías realizadas a 1.5 mm del limbo (debajo de un colgajo escleral de 50% de espesor de la esclera) que están a 180º de distancia una de la otra. Para asegurar un buen centramiento del lente intraocular es indispensable premarcar en el limbo corneal con un marcador de eje el meridiano exacto de localización donde se harán las esclerotomías, y confirmar que dicho meridiano pase por el centro de la córnea, que será el punto más cercano al eje visual. El extremo de cada háptica es enterrado en un túnel escleral que se realiza a 1.5 mm del limbo y paralelo al mismo.
Finalmente, el pegamento tisular se coloca debajo de la escotilla escleral para facilitar la rápida adherencia del tejido escleral, lo cual, junto con el túnel escleral van a dar una gran estabilidad al lente. El pegamento también sirve para no tener que usar suturas de cierre de la conjuntiva. En caso de no tenerlo disponible, se suturan los extemos de la escotilla escleral con nylon 9-0 y se entierran los nudos en el espesor de la misma. La conjuntiva se sutura con vicryl 10-0.
Las ventajas de este procedimiento son varias: 1- Se trabaja lejos del endotelio y el lente estará en cámara posterior, por lo que a largo plazo no existe riesgo de descompensación de la córnea por culpa del lente intraocular. 2- La técnica es más rápida que la utilizada para suturar un lente a la esclera. 3- La externalización de la mayor parte de las hápticas le da gran estabilidad al lente para que no se incline o descentre. El túnel y el pegamento tisular contribuyen a este hecho también. 4- No estará presente el riesgo inherente a la sutura en cuanto a que esta se hidrolice en el tiempo y que se relacione a luxación del lente, 5- Como la técnica permite hacer una cirugía más rápida que con el empleo de suturas, habrá menos riesgo de fototoxicidad retiniana. 6- Si se utiliza un lente de tres piezas se puede implantar a través de una incisión corneal de 3.5 mm. 7- Si se hace una incisión pequeña habrá poco astigmatismo inducido.
Como desventaja: 1- El costo del pegamento tisular (en caso de que se utilice). 2- La posibilidad de que con un lente de tres piezas se pueda romper una háptica si durante las maniobras quirúrgicas no se tiene cuidado al manipularlas. 3- Se necesita hacer vitrectomía anterior para eliminar cualquier tracción vítrea existente, sobre todo en los casos donde no existe cápsula. 4- Se necesita colocar un mantenedor de cámara anterior o colocar un puerto de infusión vía Pars Plana.
Bibliografía:
- Lawless M, et al. Outcomes of Femtosecond Laser Cataract Surgery With a Diffractive Multifocal Intraocular Lens. J Refract Surg. 2012; 28:859-864.
- Kránitz K, et al. femtosecond Laser Capsulotomy and Manual Continuous Curvilinear Capsulorrhexis Parameters and Their Effects on Intraocular Lens Centration. J Refract Surg. 2011;27(8):558-563.
- Kránitz et al. Intraocular Lens Tilt and Decentration Measured By Scheimpflug Camera Following Manual or Femtosecond Laser-created Continuous Circular Capsulotomy. J Refract Surg. 2012;28(4):259-263.
- Baumeister M, Buhren J, Kohnen T. Tilt and Decentration of Spherical and Aspheric Intraocular Lenses: effect on higher-order aberrations. J Cataract Refract Surg. 2009; 35(6):1006-1012.
- Donaldson KE, et al. Anterior Chamber and Sutured Posterior Chamber Intraocular Lenses in Eyes with Poor Capsular Support. J Cataract Refract Surg 2005; 31:903-909.
- 2- Kwong YYY, et al. Comparison of Outcomes of Primary Scleral-Fixated versus Primary Anterior Chamber Intraocular Lens Implantation in Complicated Cataract Surgeries. Ophthalmology 2007; 114:80-85.
- Evereklioglu C, Er H, Bekir NA, et al. Comparison of Secondary Implantation of Flexible Open-loop Anterior Chamber and Scleral-Fixated Posterior Chamber Intraocular Lenses. J Cataract Refract Surg. 2003;29:301-308.
- Schechter RJ. Suture-wick Endophthalmitis with Sutured Posterior Chamber Intraocular Lenses. J Cataract Refract Surg. 1990;16:755-756.
- Solomon K, Gussler JR, Gussler C, Van Meter WS. Incidence and Management of Complications of Transsclerally Sutured Posterior Chamber Lenses. J Cataract Refract Surg. 1993;19:488-493.
- Agarwal A, Kamar DA, Jacob S, et al. Fibrin Glue-assisted Sutureless Posterior Chamber Intraocular Lens Implantation in Eyes with Deficient Posterior Capsules. J Cataract Refract Surg. 2008; 34:1433-8.
Dr. Virgilio Centurion – Brasil
E-mail: centurion@imo.com.br
Opciones de tratamiento:
Explantar la LIO, que es de 3 piezas con háptico de prolene (?) y con historia de 3 años de cirugía, y:
1) caso no se dañe la cápsula y se pueda expandir la bolsa capsular, implantar un anillo de tensión capsular simple y una lente pieza única de acrílico hidrofóbico.
2) caso se dañe la bolsa capsular, lo más probable, debido a la fibrosis antigua, después del explante, haría implante de lente acrílica hidrofóbica monofocal de 3 piezas, en sulcus ciliaris.
Existe la posibilidad de hacer fijación escleral con prolene 10-0 a + hora 12, que en manos expertas alcanza buenos resultados. Lo mismo a la técnica de fijación escleral sin sutura (con adhesivo biológico) donde se aprovecharía la misma lente y no se utiliza sutura.
Mi opción personal en este caso sería la 2.
Dra. Linda Nasser Nasser Monterrey – México
E-mail: lindanassernasser@hotmail.com
A los pacientes con pseudoexfoliación no se les debería de colocar lentes intraoculares multifocales, ya que además de tener una pupila chica (lo que no permite una adecuada visión lejos-cerca), la capsulorexis son generalmente pequeñas (aumentando la posibilidad del desarrollo de fimosis capsular), pueden cursar además con diálisis zonular que ocasiona descentración del lente y distorsión visual; con el tiempo la diálisis zonular puede aumentar y el lente intraocular con todo y bolsa capsular puede luxarse a cavidad vítrea-retina. Ya enfrentándonos al caso que llega a la consulta operado y sin una estabilidad zonular trataría de colocar un anillo de tensión capsular y si este me estabiliza la bolsa y me permite centrar el lente así lo dejaría. Si a pesar de esto el lente sigue descentrado, trataría de retirarlo, siempre y cuando no tenga fibrosis (por el tiempo que tiene de operado), y colocaría un anillo capsular con un lente intraocular de tres piezas para dar mayor tensión a la bolsa capsular y que el lente quede lo mejor estable posible. Si hay fibrosis del lente y no se puede retirar o colocar un anillo capsular en la bolsa, trataría de suturar la bolsa capsular al sulcus, aun siendo una maniobra un poco más difícil y complicada podría ayudarnos a tener un lente mejor centrado y con menos distorsión visual.
Dr. L. Felipe Vejarano – Colombia
E-mail: felipev@fov.com.co
En este tipo de casos, se debió colocar un anillo de tensión capsular en el momento de la faco para evitar en gran parte este descentramiento, que si el paciente se queja de mala visión posiblemente lo tiene desde el postoperatorio inmediato, haciéndolo así he tenido muy buenos y estables resultados visuales a largo plazo; pero en este caso que seguro no se le colocó el ATC lo que haría inicialmente sería tratar de separar las cápsulas del LIO y colocar un segmento de Ahmed y suturarlo a esclera, si no se puede o no se tiene la posibilidad de adquirirlo entonces suturaría el complejo bolsa/LIO a la esclera utilizando su fibrosis y así se evitaría un desgarro en las cápsulas.
Dr. José G. Guerrero F. – Argentina
E-mail: josegguerrero@institutoguerrero.com.ar
- Preparar dos semianillos de tensión capsular de Cionni (CTS-1006) con agujas de Prolene 9/0 (NO INTERES COMERCIAL en ninguna indicación).
- Preparar dos bolsillos esclerales equidistantes, en la zona de la diálisis.
- Incisión de 3mm superior más 2 paracentesis.
- Llenado de cámara anterior con Viscoat (con midriasis buena).
- Viscodisección del saco capsular.
- Espatulado de todo el saco capsular en 360°.
- Introducción de ambos semianillos, previo pasar las agujas por la esclera y fijarlas a ella, por debajo de los bolsillos esclerales.
- Con una cánula muy delicada, separar del saco la zona de comienzo de cada asa, con viscoelástico.
- Separar con viscoelástico la óptica de la cápsula posterior.
- Con un gancho delicado, traccionar de cada axila del lente, hasta llevarlo fuera del saco a cámara anterior.
- Seccionar con una tijera delicada de puntas romas, por la mitad el IOL.
- Con pinza delicada, sacar ambas mitades.
- Por las paracentesis con dos piezas de I/A limpiar el saco capsular.
- Previo viscoelástico, implante del nuevo IOL en el saco.
- Lavado.
DESENLACE DEL CASO
En estos casos difíciles, se debe de llevar una serie de posibilidades a la sala de operaciones, debido a que durante el procedimiento se pueden presentar dificultades o complicaciones inesperadas. Se prepara el procedimiento para intentar colocar un segmento de anillo con sutura a esclera en hora 11 para intentar centrar LIO. Se coloca un viscoelástico pesado viscoadaptivo (Healon 5) en área de la diálisis zonular. Durante el procedimiento se considera que será más sencillo realizar un recambio por un LIO monofocal, donde el centraje no sea tan importante para el resultado visual (asumiendo que aún un buen centraje del LIO multifocal no iba a garantizar una agudeza visual satisfactoria) por lo que se intenta con viscodisección extraer el LIO del saco capsular. Sin embargo debido al tiempo postoperatorio, las hápticas se encuentran muy adheridas al complejo capsular, por lo que se requiere cortar el LIO, con tijeras y extraerlo en fragmentos. Se coloca un LIO monofocal de tres piezas en el sulcus, sin abotonarlo en la capsulorrexis, y se considera que la estabilidad es buena.

Evoluciona satisfactoriamente, con una agudeza visual de 20/30, con una refracción posoperatoria de neutro (-0.75 x 90). El paciente muy satisfecho por la mejoría en su agudeza visual y reducción de las molestias visuales.
Nuevos médicos administradores: consejos para la gestión de la carrera profesional y vivir bien
Edson Yamamoto – Brasil
Contador, Abogado, Profesor, Maestría en Administración de Empresas, Doctor en Ciencias.
E-mail: edson@bookeepers.com.br
¿Podemos hablar en competitividad de la profesión médica en Brasil? Esta cuestión ha sido muy discutida con la aparición de nuevos cursos de medicina cada año en el país. Son más de 13.000 médicos nuevos cada año que se juntan a los médicos ya en actividad. Según el IBGE, en 1999 había 1 médico para cada 673 habitantes en Brasil y en 2010, 1 médico para cada 551 habitantes. ¿Cómo puede ser hecha la adaptación del profesional formado en medicina, con este cambio notable en tan poco tiempo? ¿Qué hacer si el pronóstico es el resurgimiento de esta tendencia? ¿Qué caminos hacia la sostenibilidad, manteniendo el sacerdocio inherente a la profesión elegida?
Inspirado en estas cuestiones, la tesis: “Médicos convirtiéndose en médicos-administradores” (Yamamoto) – buscó respuestas junto a los médicos administradores, dirigentes de los mayores hospitales, laboratorios y empresas de salud en Sao Paulo. Estos dirigentes son los responsables por los consejos para vivir bien, el título de este artículo. Es en este material que encontramos algunos puntos de reflexión para el desafío del nuevo médico, que debe administrar su vida profesional y personal.
Para ilustrar lo que se estudia en administración, vamos a un ejemplo de concepto de mercado y clientes, y su aplicación en el libro “Administración de Marketing” (Kotler).
¿Cuál sería la mejor alternativa? ¿Abrir una fábrica de juguetes para vender en China o India? Sabiendo que en China hay una política de un hijo por pareja y en India no hay restricciones de esta naturaleza, ¿cuál mercado sería mejor? En principio se podría pensar que es mejor en India, pues son muchos niños. Sin embargo, ¿quién va a comprar juguetes? ¿Será el propio niño? Si en China hay sólo un bebé por pareja, esto va a tener toda la atención de los padres, de los abuelos paternos y maternos y de los otros adultos (clientes) que rodean al niño, ganando juguetes durante varios años.
El mismo concepto puede ser estudiado mediante el análisis del entorno del médico en el Brasil de hoy. Si analizarnos el entorno económico y demográfico, podemos notar que hay cambios profundos en el país y que transforma radicalmente el mercado con nuevas necesidades y clientes que vienen en diferentes proporciones hace pocos años. Según el IBGE, la tasa de fecundidad sigue cambiando cada año en el país, desde la aparición de los métodos anticonceptivos orales adoptados en la década de 1960. En 1980 teníamos 4 hijos por mujer y en 2007 tuvimos 1,95 hijos por mujer proyectando 1,5 hijos por mujer en 2027.
El reflejo de ello es la apertura de la ventana demográfica en Brasil, que es el número de personas con edades potencialmente activas en proceso de ascenso en contraste con la población inactiva (ancianos y niños). Este es un proceso muy favorable para la economía del país, una vez que los activos sostienen un número menor de inactivos, generando buenos resultados para la economía y mejorando la calidad de vida de la población. Esto provoca un mayor acceso a la medicina paga, sea a través de seguro médico empresarial o particular. Esto trae reflejos también en la medicina pública por la disminución proporcional de los recursos destinados a la población inactiva.
Con la mejora de la economía y de las condiciones de vida de la población hay también elevación de la media de vida de los brasileños. En la década de 1940 la expectativa de vida era de 45,5 años, pasó para 72,7 años en 2008 y según proyección del IBGE en 2050 Brasil tendrá alcanzado un nivel de 81,29 años, prácticamente lo que ocurre hoy con países como Islandia, Hong Kong, China y Japón.
Con estos cambios en la esfera económica y demográfica, ¿cuáles serán los cambios de las necesidades de demanda por servicios médicos? ¿Cuál es la incidencia de la necesidad de servicios médicos de una población joven y de una población añosa? ¿Qué servicios se necesitarán en los próximos años? ¿Qué tecnología es necesaria para atender esta demanda que se forma? ¿Cómo será el impacto de esta mejora de la economía para la exigencia de estos clientes que estarán aprovechando de este reflejo? ¿Qué técnicas a desarrollar? ¿Cómo aumentar mi competitividad? ¿Cómo ofrecer un servicio de calidad? ¿Cómo ser excelente? ¿Cómo ser útil al prójimo a través de mi especialidad y de mis acciones? Ofreciendo la medicina que me gustaría para mí si yo fuera el paciente. ¡Amando el próximo como a mí mismo! (Jesús). Este es el camino para vivir bien. ¡éxito a todos!
- Jornadas Nacionales de Oftalmología
Mayo 16 – 18, Buenos Aires – Argentina
Informaciones: www.oftalmologos.org.ar/index.php/formacion-presencial/jornadas - 28 Congreso de la SECOIR
Mayo 22 – 25, Barcelona – España
Informaciones: www.oftalmo.com/secoir - VII Congreso Internacional de Oftalmología – XV Congreso Cubano de Oftalmología
Mayo 29 – 31, La Habana – Cuba
Informaciones: Dr. Marcelino Río Torres – E-mail: oftalmologia2013@horpf.sld.cu – Tel.: (537) 265-4800 - VII Congresso Brasileiro de Catarata e Cir. Refrativa
Mayo 29 – Junio 01, Praia do Forte, Bahía – Brasil
Informaciones: www.catarata-refrativa.com.br - XXVIII Congresso Pan-Americano de Oftalmologia;
XXXVII Congresso Brasileiro de Oftalmologia
Agosto 07 – 10, Rio de Janeiro – Brasil
Informaciones: www.cbo.com.br | www.paao.org - XXXI Congress of the ESCRS
Octubre 05 – 09, Netherlands – Amsterdam
Informaciones: www.escrs.org - AAO Annual Meeting
Noviembre 16 – 19, New Orleans, LA – USA
Informaciones: www.aao.org - Joint Meeting Bascom Palmer Eye Institute
& Fundación Oftalmológica los Andes
Diciembre 05 – 07, Santiago de Chile
Informaciones: www.oftalandes.cl



ALACCSA-R / LASCRS in Pan American & Brazilian Congress of Ophthalmology, Rio de Janeiro, August 07 – 10, 2013
ALACCSA-R Program
“The Best of Cataract and Refractive Surgery in 2013” ALACCSA-R (120 min)
OS
Moderadores: William De La Peña, Virgilio Centurión, Armando Crema
Panel de Discusión: Paulo Cesar Fontes, Nestor Gullo, José Luís Rincon, Marcos Rey, José Antonio Claros
Faco Tip – Chop – Cesar Carriazo
Cirugía de catarata asistida con Láser de Femtosegundo – Edgardo Carreño
Iris suture fixation, my experience – Newton Andrade Jr.
Cirurgia da catarata em nanoftalmia – Fernando Trindade
Facoemulsificación en córneas patológicas – Miguel Angelo Padilha
Lentes Rayner M-flex near y far: experiencia personal – Marcelo Ventura
Utilidad de la Vitrectomía Anterior por Pars Plana en cirugía de catarata – Arnaldo Espaillat
II – Refractive Surgery
Moderadores: María José Cosentino, Mauro Campos, Miguel Srur
Panel de Discusión: Sergio Kwitko, Luís Izquierdo, Carmen Barraquer
The role of epithelial thickness in refractive surgery – Marcelo Netto
Complicaciones limbicas del cross linking corneal – Ramon Naranjo
LASIK for Presbyopia in emmetropic patients – María José Cosentino.
Corneal Inlay for presbyopia: is it safe? – Marcony Santhiago
Lasik em casos especiais – Waldir Portelinha
Lamellar endothelium transplant and multifocal IOL – Walton Nosé
“Casos Dificiles en Cirugía de Catarata y Refractiva” (90 min)
Moderadores: Luís Escaf, Enrique Suarez, César Carriazo
Panel de Discusión: Ronaldo Cavalcanti, Werner Zacharias, Ana Luisa Hoffing Lima
Caso 1 Leticia Arroyo
Caso 2 Leonardo Akaishi
Caso 3 José Manuel Vargas
Caso 4 Eduardo Chávez M
Caso 5 Edna Almodin
Caso 6 Pablo Suarez
Caso 7 Crisanti Stangogiannis
Caso 8 Arnaldo Espaillat