Un caso de cristalino

Dr. José Miguel Varas – Ecuador
Contacto
Dr. José Miguel Varas – jm@varas.com
A continuación quiero compartir este caso de infrecuente presentación en nuestra práctica. Se trata de una paciente de 64 años de edad, con historia conocida de más de 35 años de retinosis pigmentosa. En la valoración inicial de 1981 se encontró AV mejor corregida en ambos ojos de bultos en ambos ojos. Fondo de ojo característico con presencia masiva de espículas pigmentarias, palidez de los nervios ópticos y vasos filiformes. Sus medios ópticos trasparentes, PIO dentro de límites normales.
Se presentó a la consulta en 2016 con cuadro de más de 15 días de dolor intenso en el ojo izquierdo. Había recibido tratamiento médico en otra institución con antihipertensivos tópicos (combinación de timolol + dorzolamida 1 vez al día aunque el paciente refiere uso de más de 3 veces al día en los últimos días). Tiene antecedentes de múltiples traumatismos orbitarios durante muchos años que atribuye a su falta de buena visión, sin que se conozca de ninguno relevante en los últimos años.
Al examen encontramos visión de PL y NLP respectivamente, presión 14 y 80 mmHg. En el OD, el segmento anterior tenía un examen dentro de límites normales excepto por una catarata madura, cámara anterior ¾ y el ángulo abierto. Fondo no valorable.
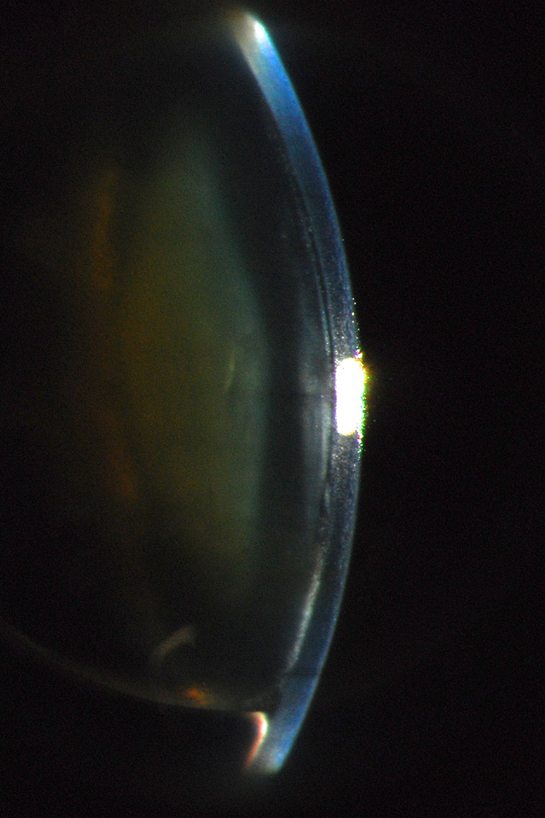
El OS tenía la córnea con transparencia limítrofe, luxación del cristalino en la cámara anterior acompañado de bloqueo pupilar, midriasis y cierre angular; como se describió previamente presión en 80 mm Hg.
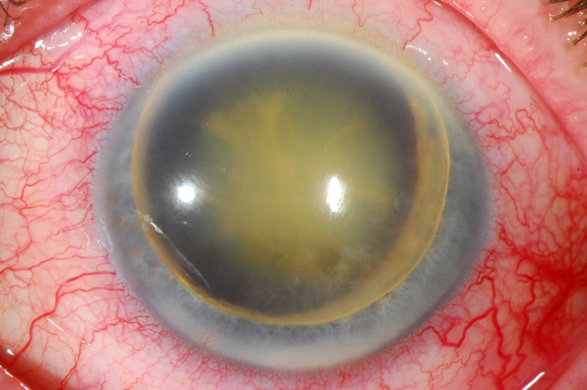
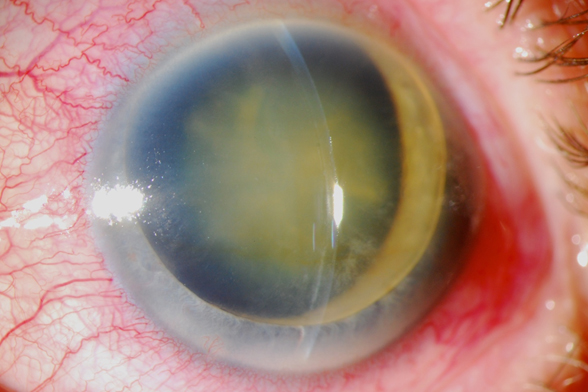
El manejo de este caso fue inicialmente aumentar el tratamiento tópico a una triple combinación (timolol+brimonidina+dorzolamida tid) y acetazolamida (250 mg tid). Reevaluación en 24 horas y programar EICC (extracción intracapsular del cristalino).
Al día siguiente con la terapia médica la presión había descendido a 55 mm Hg y se decidió programar para EICC, inicialmente se pensó en usar manitol IV, pero tras anestesia retrobulbar y balón de Honan, la PIO descendió a cerca de 40 mm Hg.
Ante esta situación no se usó manitol y se consideró eventual punción y vitrectomía mínima por la pars plana.
Inicialmente se hizo una peritomía de 10 a 2, hemostasia y túnel escleral largo hasta llegar a aproximadamente 2 mm en la córnea (se puede observar cierta tinción hemática corneal del túnel en la foto).
Al terminar la maniobra de extracción del cristalino ayudado por asa, se pudo reformar la cámara anterior fácilmente con aire y solución salina balanceada. Al tratarse de un túnel autosellante se podía palpar la normalización inmediata de la presión intraocular y la integridad de la hialoides.
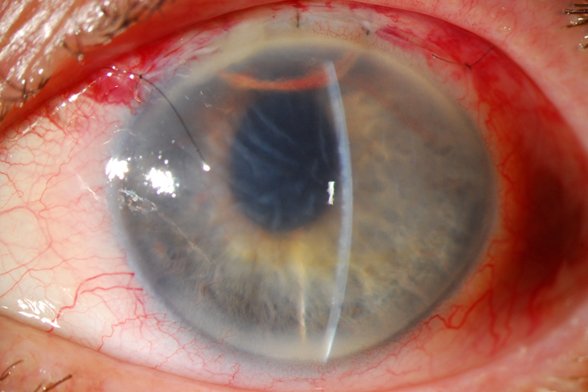
Cierre con tres puntos de nylon 10-0, cierre de la conjuntiva asimismo con nylon 10-0 y se decidió postergar una iridectomía periférica ya que el túnel corneal largo dificulta la maniobra de sujeción del iris periférico para hacer la iridectomía. Por ese motivo se decidió observar cuidadosamente la potencialidad de un nuevo bloqueo pupilar.
En el postoperatorio del primer día, y tras retirar el apósito, se evidencia cámara anterior 4/4, burbuja de aire de 1 hora de menisco superior, edema corneal marcado especialmente en la porción media y superior, pupila discretamente ascendida a pesar de ausencia de vítreo en la CA y presión intraocular de 9 mmHg sin medicación tópica.
Se suspende toda la medicación antihertensiva y se continúa combinación de tobramicina + dexametasona.
Nota:
Aunque no tengo fotos aún del postoperatorio de 7d ni edición del video, lo que se trata de demostrar es que aún es posible que en casos especiales una extracción intracapsular del cristalino es una operación viable que alivia el padecimiento del paciente.
En estos casos aunque sea factible quirúrgicamente la facoemulsificación podría no ser la mejor opción, sino todo lo contrario una fuente de complicaciones de más difícil manejo como una descompensación corneal, difícil manejo de la pupila y hialoides.