Caso Cornea Refractiva: Complicaciones en cirugía queratorrefractiva


Coordinador
Dra. Melania Cigales – mcigalesj@gmail.com
Dr. Jairo Hoyos-Chacón – jhoyoschacon@gmail.com
Invitados
Dra. María Teresa Iradier – irago@drairadier.com
Dr. Rodrigo Quesada – rquesadaeyemd@yahoo.com
Pseudoqueratocono
El queratocono es una degeneración corneal ectásica causada por un adelgazamiento progresivo de la córnea. Clínicamente se manifiesta con un incurvamiento topográfico generalmente excéntrico y un cambio refractivo progresivo con miopía y astigmatismo irregular, que ocasionan disminución de la mejor agudeza visual corregida.
La topografía corneal ha sido de gran ayuda para el diagnóstico precoz y el estudio de la evolución del queratocono. Los primeros topógrafos estudiaban solo la curvatura anterior de la córnea mediante la proyección de un disco de Plácido y hoy disponemos de sistemas más sofisticados, como las imágenes de Scheimpflug, que analizan la elevación de la cara anterior y posterior de la córnea, y su correlación con el mapa paquimétrico y con la curvatura.
Es de sobra conocida la imagen topográfica del queratocono, pero no debemos olvidar que no es patognomónica y hay que diferenciar entre el queratocono real y una imagen de pseudoqueratocono, antes de indicar un tratamiento.
Caso Clínico
Paciente varón de 54 años de edad, diagnosticado de queratocono unilateral hace 4 años, que acude solicitando una segunda opinión porque le han propuesto implantar anillos intracorneales con finalidad refractiva. Refiere disminución de agudeza visual en ojo derecho desde hace 8 años sin otra sintomatología ocular.
Agudeza visual
sin corrección:
Ojo derecho = 20/100
Ojo izquierdo = 20/15
Agudeza visual corregida:
Ojo derecho (-1,00 -3,00 x 90º) = 20/25
Ojo izquierdo (neutro) = 20/15
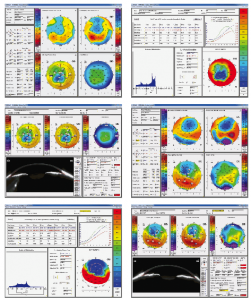
La topografía de disco de Plácido mostraba incurvamiento temporal inferior en ojo derecho, compatible con un queratocono unilateral (Fig. 1).
La topografía Pentacam del ojo derecho mostraba elevaciones normales de la cara anterior y posterior, así como una córnea gruesa de 600 micras (Fig. 2).
Por retroiluminación a la lámpara de hendidura, se observaba una irregularidad corneal en el ojo derecho con BUT bajo, coincidente con el área de incurvamiento topográfico (Fig. 3).
En su opinión:
¿Este paciente tiene queratocono? ¿Por qué?
¿Cuál es su orientación diagnóstica? ¿Solicitaría alguna exploración especial para confirmar su diagnóstico?
¿Qué tratamiento indicaría?
Respuestas de los panelistas:
¿Este paciente tiene queratocono?
Dra. María Teresa Iradier: En mi opinión este paciente no presenta un queratocono, aunque la imagen topográfica en el mapa de curvatura sagital frontal sea de AB/SRAX >22º con una Kmax de 48,9 D. Existen distrofias corneales que pueden cursar con alteraciones topográficas similares al queratocono que causan cambios refractivos sin relación con el mismo.
¿Por qué? Porque no se cumplen los criterios de ectasia corneal en los mapas de Pentacam de paquimetría y elevación.
El caso presenta:
paquimetría mínima: 597 micras (patológico <470 micras) y diferencia con paquimetría del ápex: 10 micras (patológico >10 micras);
elevación de cara anterior: 10 micras; elevación de cara posterior: 3 micras (patológico >12 micras en cara anterior y >15 en cara posterior);
diferencia entre el punto más fino de paquimetría de OD y OI: 8 micras (patológico >30 micras).
Dr. Rodrigo Quesada: En lo personal, no me parece un caso de queratocono por varias razones: la edad de presentación es totalmente atípica, el queratocono generalmente es una ectasia no inflamatoria que suele debutar en la segunda década de la vida, con una historia natural donde su mayor progresión se da entre los 20 y 30 años y mucho menos agresiva posterior a los 35 años. El colágeno corneal sufre normalmente un endurecimiento fisiológico, produciendo en la mayoría de los casos una estabilidad después de los 40 años. A pesar de ser una enfermedad asimétrica, su presentación clínica es casi siempre bilateral, presentando algunos hallazgos oftalmológicos y topográficos en el ojo contralateral, y la exploración clínica y el Pentacam en el ojo izquierdo son completamente normales.
Adicionalmente, el índice de asimetría de superficie está sumamente elevado, y el incurvamiento topográfico (que se asemeja a la presentación topográfica de queratocono) coincide directamente con el área de irregularidad corneal que observamos en la lámpara de hendidura, por lo que descartaría que se trate de un queratocono.
Finalmente es importante analizar el mapa epitelial: un patrón en forma “donut”, caracterizado por adelgazamiento epitelial en el centro, rodeado por un anillo de epitelio más grueso que coincide con el vértice de la elevación posterior, es un signo de queratocono. En este caso encontramos ausencia de dicho patrón lo que nos hace pensar que la topografía es anormal por otra causa.
¿Cuál es su orientación diagnóstica? ¿Solicitaría alguna exploración especial para confirmar su diagnóstico?
Dra. María Teresa Iradier: A mi juicio se trata de una distrofia de la membrana basal (EBMD) por las características de la imagen de retroiluminación en huella dactilar.
Aunque las distrofias de la membrana basal cursan habitualmente con episodios de dolor asociados a disminución de visión, en ocasiones pueden evolucionar en brotes indoloros y autolimitados con cambios refractivos fluctuantes y diplopía debidos a edema corneal focal.
La alteración en la síntesis de la membrana basal, la migración anormal de células epiteliales basales, la pérdida de desmosomas y de uniones intercelulares son las causas de la falta de adherencia del epitelio. Las imágenes en huella dactilar corresponden a material fibrogranular depositado entre la membrana basal y la de Bowman.
Sí, solicitaría un mapa epitelial. La imagen del mapa epitelial del caso estudiado presenta un engrosamiento del epitelio en la zona correspondiente a la imagen en AB, y un epitelio de menor espesor en la zona más plana de la córnea. Esto confirma que no se trata de una ectasia corneal, pues la imagen no es la característica en forma de “donut”.
En córneas con queratocono la zona de mínima paquimetría y máxima elevación se corresponde con el mínimo espesor epitelial, lo cual no se cumple en este caso.
Dr. Rodrigo Quesada: Creo que estamos ante un pseudoqueratocono producido por la imagen que genera el defecto en la superficie anterior de la córnea, que se refleja por la cámara de Scheimpflug y los anillos de Plácido como un incurvamiento inferior típico que se asemeja claramente a un queratocono.
Me gustaría agregar dos cosas: una aberrometria y una OCT de segmento anterior para medir la profundidad del defecto corneal.
¿Qué tratamiento indicaría?
Dra. María Teresa Iradier: Indicaría tratamiento a base de colirios lubricantes y soluciones hipertónicas durante el día, y aplicación de gel y pomada lubricante por la noche. En ocasiones es muy útil el uso de lentes de contacto terapéuticas.
Si no responden al tratamiento médico, puede practicarse PTK con láser excimer.
No soy partidaria de practicar desbridamientos ni micropunciones, medidas muy agresivas que suelen practicarse en urgencias oftalmológicas. En el caso de realizarse, estos tratamientos deben hacerse en cirugía programada y por un oftalmólogo experto en superficie ocular.
En mi experiencia, las medidas terapéuticas conservadoras con una buena monitorización suelen ser suficientes para mejorar la sintomatología.
Dr. Rodrigo Quesada: Hay que tratar de corregir la irregularidad en la superficie de la córnea. Primero realizaría una desepitelización y vería la condición del estroma. En base a eso, programaría una ablación guiada por topografía para corregir el astigmatismo irregular, usaría mitomicina y hablaría con el paciente de una probable segunda intervención para terminar de corregir luego el defecto refractivo residual, de ser necesario.
Resolución del caso por la Dra. Melania Cigales y el Dr. Jairo Hoyos-Chacón
En este caso el Pentacam descartaba el diagnóstico de queratocono, pues las elevaciones de la cara anterior y posterior eran normales, y la córnea era gruesa. Nunca debemos olvidar que la base del queratocono es el adelgazamiento corneal.
Solicitamos una OCT corneal (Fig. 4), que descartó el adelgazamiento corneal típico del queratocono y además mostraba un área donde el epitelio estaba separado de su membrana basal, algo que sospechábamos por la imagen biomicroscópica.
El mapa de espesor corneal de la OCT (Fig. 5) mostró que el epitelio corneal estaba engrosado en la zona temporal inferior, coincidiendo con el área incurvada en la topografía. A nivel estromal el grosor era uniforme.
Establecimos el diagnóstico de pseudoqueratocono epitelial causado por un síndrome de erosión recidivante asintomático. Tratamos este caso mediante desepitelización mecánica de la córnea y vendaje con lente de contacto terapéutica durante cuatro días hasta la completa reepitelización. Al mes del tratamiento la agudeza visual sin corrección era de 20/20 y el ojo estaba emétrope. La comparativa de la topografía con disco de Plácido (Fig. 6) muestra la regularización topográfica tras el tratamiento de desepitelización mecánica.
Comparando la OCT corneal antes y después del tratamiento (Fig. 7), podemos observar como el epitelio se adhirió a su membrana basal, y en el mapa de espesores se aprecia la regularización del grosor epitelial.
La conclusión de este caso es que no debemos establecer un diagnóstico de queratocono solo por el cambio refractivo astigmático y la imagen topográfica de la curvatura anterior, pues una irregularidad corneal puede simular clínicamente un queratocono.