El pintor de barcos, atardeceres y tormentas
Los colores de William Turner

Por Omar López Mato
omarlopezmato@gmail.com

Autorretrato – Turner
Hosco y huraño, prepotente y avaro, Joseph Mallord William Turner fue un amante de la luz ,del mar y las tormentas, a punto tal de atarse al mástil de un barco para ser testigo de una tempestad en medio del océano, y así capturar la experiencia que volcaría en varias de sus obras, de extraña originalidad que lo convirtieron en uno de los pintores más notables de su generación.
Las únicas lealtades en su vida fueron a su arte (“no conozco ningún genio sino el genio del trabajo duro”), a la docencia que ejerció toda su vida y a su padre, con quien convivió por tres décadas hasta su muerte. Su madre pasó los últimos años de su existencia en un manicomio. Mantuvo romances con varias mujeres y hasta se afirma que tuvo descendencia que no reconoció. Jamás se casó y cómo dijimos ,compartió la vida con su progenitor ,cuya muerte fue un duro golpe que solo lo convirtió en un individuo más excéntrico y depresivo.

El naufragio_Turner
Turner temía al deterioro propio del envejecimiento ,”el señor Tiempo” era su enemigo. Y también lo era el frío que, en sus palabras, lo convertía en un “invalido sufriente”. Sabía que debía cuidarse del mal tiempo para “no ser un prisionero de invierno”. A los 70 años ya no tenía dientes, circunstancia que lo obligaba a vivir tomando leche y jugo de carne. Aunque se sospecha que era diabético, nunca dejó de lado el ron ni al sherry que tomaba en abundancia y en cada ocasión propicia, como cuando le dijeron que iba a morir.
Hacia finales de 1851, el Dr Price, el médico de toda su vida, le diagnosticó una severa afección cardíaca. Al recibir la noticia, Turner preguntó “¿Así que me estoy convirtiendo en una nulidad?”. Cuando el doctor se limitó a confirmar su impresión diagnóstica, Turner dijo que era mejor tomar otra copa de sherry… era una forma de brindar por el final inexorable que se avecinaba.
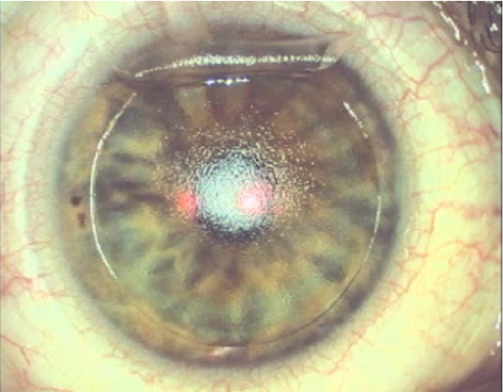
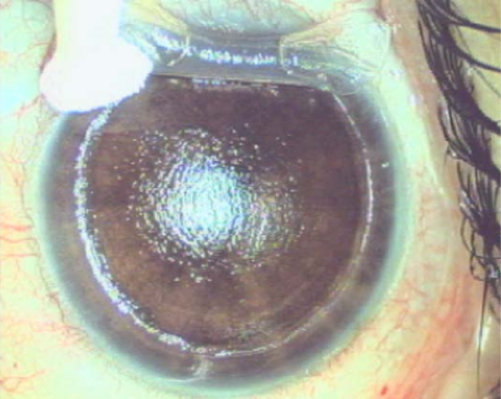
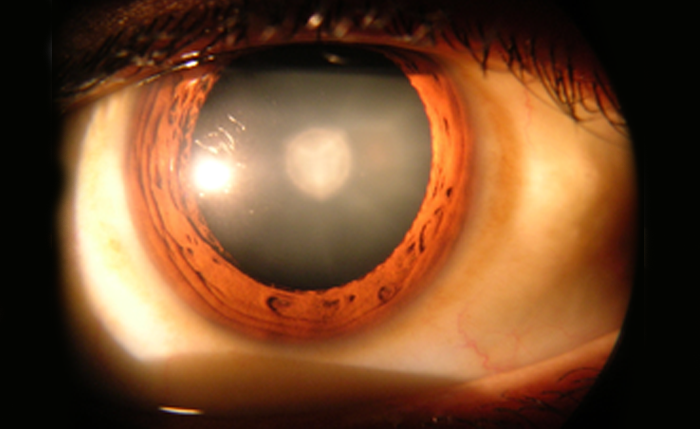
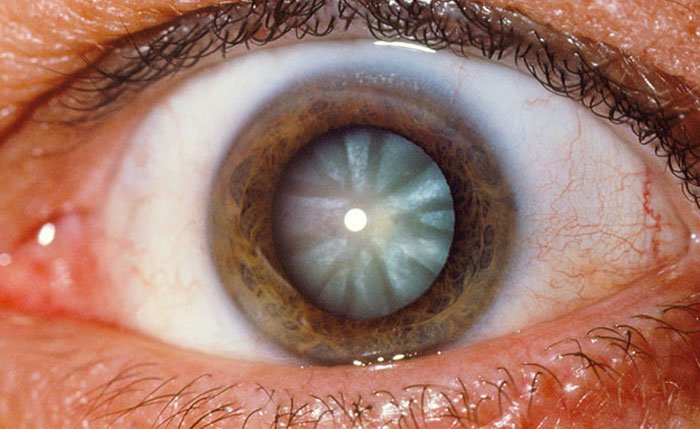
Desde hacía tiempo el pintor notaba un deterioro en la visión y, aunque las cataratas fueron una limitación en las carreras de otros artistas como Monet, Mary Cassatt o Edgar Degas, en el caso de Turner llevaron a cambiar su estilo y su paleta hacia formas más imprecisas (arte abstracto) y colores más cálidos, porque el cristalino cataratoso suele adquirir una tonalidad brunescente, actuando como filtro cromático . De allí la abundancia de rojo y amarillo en sus obras finales y la exaltación de azul que experimentan los pacientes operados de catarata .
Algunos estudiosos se atreven a afirmar que los cambios más influyentes en la pintura del Siglo XlX serian “el fruto de ojos enfermos”. No sabemos que pensaba Turner sobre este tema, porque era un estudioso del color y especialmente de las teorías cromáticas de Goethe.
El deterioro de su salud lo obligó a abandonar su trabajo de docente en Perspectiva y Geometría que había impartido puntualmente a lo largo de 30 años. Decía que la Royal Academy era como un “viñedo de arte”. A la National Gallery le donó 37.000 objetos, entre escritos, dibujos y pinturas. Entre sus obras expuestas en esta galería se destaca “El último viaje del Temeraire”, una nave emblemática de la marina inglesa, gemela del “Victory”, nave insignia del almirante Nelson. El cuadro muestra al Temeraire, desarbolado y conducido por un remolcador hacia su desguace , marcando el final de una era gloriosa. Este cuadro, pintado 12 años antes de su muerte, era una metáfora del deterioro impuesto por la propia vejez. Como escribiera John Ruskin, el crítico de arte admirador de Turner. “La nave se desliza hacia su tumba… jamás el sol del atardecer posará sobre él su vestido de oro”.
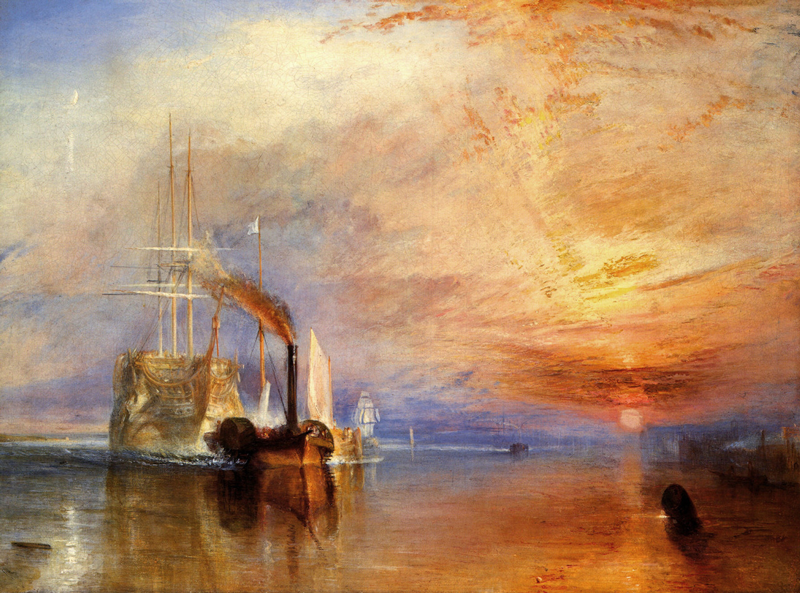
El último viaje del Temeraire Turner
“El último viaje del Temeraire“ se ha convertido en la obra más célebre de Inglaterra y la preferida del público que visita la
National Gallery.
Turner decidió pasar sus momentos finales en su casa de
Chelsea, casi sin fuerza para levantarse de la cama. Desde su lecho podía ver el cielo y el sol ,las estrellas y la luna . Sus últimos bosquejos trataron de captar la luz del amanecer.
La mañana del 19 de diciembre de 1851, el sol iluminó su rostro con el brillo que amaba reflejar en sus pinturas. Murió a las 9 horas, sin decir palabra. Su cuerpo fue conducido a su casa sobre Queen Anne Street y colocado en la galería donde había expuesto sus obras en vida. Pocos amigos y muchos admiradores desfilaron ante su ataúd rodeado de pinturas. Fue inhumado en la Catedral de Saint Paul, junto a otro grande de la pintura británica, Sir Joshua Reynolds.
“Mi trabajo es pintar lo que veo, no lo que sé”, y, a pesar de sus ojos enfermos ,Turner pintó lo que vio ,exaltando el esplendor del color.

Steam-Boat off a Harbour s Mouth in Snow Storm Turner