El 2020 sin lugar a dudas fue un año de cambios, retos y nuevas oportunidades. En el ámbito académico surgieron los webinar y congresos virtuales como una forma de globalización del conocimiento. Sin embargo, la alta calidad científica de los artículos publicados en revistas prestigiosas nos demuestra que nuestros colegas alrededor del mundo no descansaron en la búsqueda de la evidencia científica y la generación de conocimiento que aporte al manejo de las patologías corneales. Preparamos un recuento de los mejores artículos del último trimestre del 2020 por subtemas.
ECTASIAS
El crosslinking (CXL) con debridamiento epitelial es la primera línea de tratamiento para el queratocono en progresión. Debido al corto tiempo desde su introducción (a mediados del año 2000) los resultados a largo plazo son limitados y no hay consenso acerca de la tasa de fracaso. En este estudio retrospectivo1 los autores se propusieron evaluar el resultado a largo plazo de CXL convencional de 27 ojos de 22 pacientes (mínimo de 10 años y un máximo de 13 años) con el objetivo de evidenciar si dicho procedimiento es capaz de detener en forma segura la progresión del queratocono en la mayoría de los pacientes. Los resultados mostraron un significativo aplanamiento y regularización de la superficie corneal con disminución de la curvatura corneal, mejoría en la agudeza visual y modificación en la refracción debido a un cambio hipermetrópico, con una tasa de fracaso del 7.4%. Estos hallazgos coinciden con otros reportes. La mayor fortaleza de este estudio es la evaluación avanzada de los resultados refractivos utilizando el método de Harris and Kaye al transformar los datos en Long’s matrix formalism que no separa esfera, cilindro y eje2,3; y en la evaluación de los cambios del cono con el sistema ABCD. El uso combinado de sistemas de evaluación en lugar de un solo parámetro para detectar progresión reduce el riesgo de falsos negativos y permite una visión más comprensiva de los cambios en queratocono.

El CXL transepitelial con oxígeno suplementario surge como alternativa promisoria en el tratamiento del queratocono progresivo. Una serie de casos prospectiva4 incluyó 27 ojos de 24 pacientes con queratocono progresivo que se sometieron a CXL personalizado. Este incluye el uso de riboflavina al 0.25% transepitelial, una dosis total de luz ultravioleta A (UV-A) mayor que la usada en el crosslinking convencional y la utilización de oxígeno intraoperatorio suplementario (Figura 1). Esto se basa en la certeza de cuáles son los factores que limitan la eficacia del CXL tradicional: la atenuación de la luz ultravioleta en su paso por el epitelio corneal, la difusión limitada de la riboflavina tradicional en el estroma y el consumo metabólico de oxígeno por
parte del epitelio corneal. Los ojos tratados con esta técnica (oxígeno ≥90%) mostraron aplanamiento en la curvatura corneal, reducción de la aberraciones de alto orden, una mejora significativa en la agudeza visual de lejos con corrección en relación a los ojos tratados sin oxígeno suplementario (oxígeno ∼20%) al año de seguimiento. No se observaron efectos adversos significativos pero es necesario estudios a largo plazo con inclusión de mayor número de pacientes para confirmar los hallazgos de los autores.
En cuanto al queratocono en niños, un estudio de cohorte prospectivo comparó la eficacia y seguridad del CXL acelerado transepitelial (o epi-on) con el CXL estándar epi-off en niños de hasta 18 años con queratocono en progresión.5 Los resultados mostraron que ambos procedimientos son efectivos para detener la progresión de la ectasia a 5 años de seguimiento, aunque CXL estándar epi-off lo hizo en un grado significativamente mayor y con un efecto de aplanamiento mayor (detuvo la progresión en el 100% de los casos).
Un nuevo abordaje terapéutico en queratocono fue presentado en un estudio prospectivo, consecutivo, no comparativo de pacientes con queratocono avanzado.6 Se seleccionaron 22 pacientes con indicación de queratoplastia y pacientes donantes en quienes se realizaría SMILE (Small Incision Lenticule Extraction). Ambos grupos de pacientes fueron programados para el mismo día quirúrgico y previamente emparejados, de modo tal que los pacientes con miopía elevada se sometieron a cirugía corneal al mismo tiempo que aquellos con queratocono recibieron el lentículo donante derivado de SMILE. Luego de un seguimiento de un año, los resultados demostraron el potencial de esta cirugía para restaurar el volumen estromal, mejorar la agudeza visual de lejos con y sin corrección sin signos de progresión de la ectasia o evidencia de rechazo. El espesor corneal aumentó al menos 110 ± 11 μm lo que equivale generalmente al espesor del lentículo (120 μm). En cuanto a la morfología corneal la cara anterior mostró un significativo aplanamiento, con una reducción del poder corneal de aproximadamente 2 D en promedio (54.68 ± 2.77 to 51.95 ± 2.21 D). También se demostró que la disección lamelar corneal mediante láser de femtosegundo es segura, y no está influenciada por la queratometría, paquimetría y topografía preoperatoria. El resultado más significativo es la ausencia de complicaciones al año de seguimiento.
Hablando de anillos, el 2020 nos permitió valorar los hallazgos biomicroscópicos y el manejo de la necrosis estromal anterior asociada al implante de INTACS de larga data.7 En este estudio prospectivo longitudinal de una serie de casos se hizo un seguimiento de mínimo 5 años a 98 ojos que se sometieron al implante de anillos corneales intraestromales. En 9 casos (9.18%) se detectó necrosis estromal anterior. Todos los casos ocurrieron luego de 9 años del implante y con anillos de 130o de arco. La necrosis se ubicó en el área inferotemporal principalmente. El 77.8 % de los casos se produjeron con anillos de sección hexagonal de 7 mm y los restantes con anillos de 6 mm de sección oval. El principal síntoma en todos los casos fue sensación de cuerpo extraño. En ningún caso hubo antecedentes de trauma ni infiltrados corneales, tampoco se obtuvo crecimiento de microorganismos en los cultivos. El tamaño de la necrosis fue entre 1 y 3 mm en todos los pacientes. Los pacientes tratados con INTACS pueden presentar necrosis estromal aguda luego de 5 años del implante por lo que es primordial monitorizar a estos pacientes a largo plazo para resolver las complicaciones a tiempo.
En cuanto a métodos de examen,8 se publicó un interesante estudio prospectivo transversal. La premisa fue la observación clínica de que el adelgazamiento paquimétrico y epitelial ocurren en ubicaciones similares en el queratocono. Se propuso desarrollar un índice de adelgazamiento coincidente (CTN) para cuantificar ese adelgazamiento y evaluar su capacidad para detectar queratocono. Se tomaron imágenes de ojos con diferentes grados de queratocono y controles normales, y se comparó el índice CTN con la paquimetría mínima y la queratometría máxima. Concluyeron que es un biomarcador cuantitativo derivado de imágenes que es específico del queratocono por lo que es un parámetro novedoso. La alta sensibilidad que el índice CTN proporciona evidencia de que puede usarse para complementar los estándares clínicos actuales en la detección y seguimiento del queratocono temprano a moderado.
TRASPLANTES
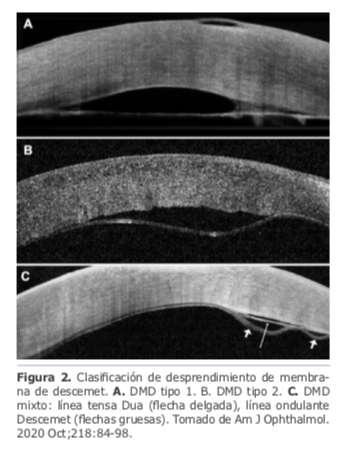
El profesor Harminder Dua presenta una nueva clasificación del desprendimiento de membrana de descemet (DMD)9, en el cual cobra especial importancia la capa de Dua, descrita por el mismo autor en el año 2013.10 Es una serie de 41 casos de DMD caracterizados clínica e histopatológicamente y evaluados con OCT de córnea, proponiendo la siguiente clasificación:
• Tipo 1: DMD recto y tenso similar al radio de un círculo, doble contorno que corresponde a la Dua y la Descemet (MD) que permanecen adheridas entre sí (Figura 2a).
• Tipo 2: DMD ondulante en el cual solo se desprende la descemet, la Dua permanece adherida en el estromal (Figura 2b)
• Mixto: Línea recta y tensa (Dua) y línea ondulante (MD), cada una separada del estroma y separadas entre sí (Figura 2c).
Haciendo alusión a clasificaciones previas, refieren que el DMD tipo 1 y mixto siempre son planares (≤1mm) y el tipo 2 puede ser planar o no planar (>1mm) dependiendo de la trayectoria de la MD. El DMD tipo 1 es el de más difícil manejo debido al acortamiento temprano que existe por la fibrosis de la capa de Dua. En todos los casos de hidrops corneal encontraron ruptura de la membrana de descemet y la capa de Dua. Los 41 casos fueron evaluados de forma independiente por 3 especialistas diferentes, logrando 100% de concordancia en la clasificación de cada tipo de DMD y el estudio histopatológico disponible en 5 casos coincidió con los hallazgos por OCT.
Múltiples estudios publicados en el último trimestre del 2020 tuvieron como objetivo determinar variables que mejoran o empeoran el pronóstico de los trasplantes endoteliales, en especial DMEK.
El grupo de Devers Eye Institute publicó una serie de casos retrospectiva11 de 857 casos de DMEK realizados entre el 2013 y 2018, encontrando una tasa de re-burbuja del 12,6% sin diferencia significativa respecto a la edad del donante, conteo endotelial, tiempo de preservación, tiempo entre la muerte y la preservación o el diagnóstico de diabetes mellitus en el donante. La pérdida endotelial a 6 meses fue de 32,7% para los casos de tejidos previamente pelados y 29,9% para los tejidos precargados, sin diferencia estadísticamente significativa entre ambos grupos.
Otro estudio publicado por David Rootman12 evaluó la supervivencia a 4 años de DMEK en pacientes con cirugía de glaucoma previa, compararon 51 ojos a los que se les realizó DMEK y que ya tenían cirugía previa de glau-coma versus 43 ojos con Distrofia de Fuchs en los cuales se realizó cirugía de catarata + DMEK. La supervivencia a 12, 24, 36 y 48 meses para los ojos con dispositivos de drenaje fue de 72%, 53%, 35% y 17% mientras en los ojos con cirugía de glaucoma pero sin dispositivos de drenaje fue 79%, 75%, 56% y 47% con diferencia en el límite de significancia (p = 0.08), ambos grupos tuvieron supervivencia significativamente menor al compararlos con el grupo de fuchs (88% a 4 años). La pérdida endotelial al 4 años en los ojos con cirugía de glaucoma previa fue 59% y en ojos con Fuchs 47% estadísticamente significativa. Este mismo grupo publicó su técnica y resultados en 9 casos de DMEK en afaquia y aniridia con un solo caso viable al final del seguimiento (tasa de falla del 88%) concluyendo que en estos ojos extremadamente complejos, su técnica de elección es el DSAEK, debido a la compleja manipulación y mantenimiento del aire en ojos unicamerales.13
Una serie de casos retrospectiva14 evaluó los factores perioperatorios en 36 pacientes (18 ojos) a quienes se les realizó DMEK en ambos ojos en momentos diferentes y que presentaron desprendimiento del tejido en las dos ocasiones. Encontraron que el riesgo de desprendimiento del tejido en el segundo ojo cuando el primero tuvo desprendimiento es 2.8 veces mayor y si el desprendimiento del primer ojo fue clínicamente significativo (<30% de la superficie del tejido) el riesgo es 15.7 veces mayor; sugiriendo tomar medidas en la técnica del segundo ojo como el uso de gas, una burbuja más grande o evitar la combinación con cirugía de catarata.
La revista The Ocular Surface dedicó especial atención en el último trimestre a los artículos relacionados con queratoprótesis (Kpro), uno de los estudios publicados15 evaluó los resultados a largo plazo en 68 ojos: 70.6% con trasplante penetrante fallido y 29.4% como implante primario, el promedio de seguimiento fue 90.9 ± 19.7 meses. La probabilidad de mantener o mejorar la agudeza visual fue de 80% a 5 años y 52.5% a 10 años. La complicación más frecuente fue la membrana retroprotésica en el 61,8% de los casos, endoftalmitis 13,2%, edema macular cistoide 14,7% y desprendimiento de retina coroideo con necesidad de vitrectomía posterior en 17.6%. Los pacientes en quienes se realizó vitrectomía posterior en el mismo momento de la kpro tuvieron agudeza visual igual o mejor en un 88.5% comparado con 64.1% de quienes no se les realizó vitrectomía posterior. Ninguna de las características de la prótesis (Titanio, PMMA, pseudofaquia, afaquia) estuvo relacionada con mayor incidencia de melting corneal o membrana retroprotésica. En pacientes con enfermedad de la superficie ocular hubo peor pronóstico, con una tasa de retención de la prótesis significativamente menor al compararlo con aquellos sin enfermedad de la superficie ocular (46.8% vs 75.8%).
CIRUGÍA REFRACTIVA
El Dr. Jodhbir Mehta y colaboradores publicaron un estudio16 comparativo entre LASIK vs SMILE realizado en 24 ojos (12 pacientes) entre el 2012 y 2016; a cada paciente se le asignó un ojo para cada tipo de tratamiento. Todos los pacientes fueron evaluados con microscopía confocal y evaluación clínica de ojo seco, estos parámetros fueron comparados con 12 ojos normales pareados por edad. Todos los ojos que tenían 5.5 años de seguimiento, independiente de la técnica empleada, presentaron una disminución en parámetros de densidad nerviosa corneal comparado con individuos normales, pero cuando se compararon con el grupo que tenía 2.7 años de seguimiento los valores fueron mejores para el grupo de 5.5 años, indicando una mejoría persistente pero no completa de la densidad nerviosa corneal. Al comparar ambas técnicas encontraron que a 4.1 años de seguimiento, los ojos con LASIK presentaron una disminución significativa de la densidad y longitud de nervios corneales al compararlo con SMILE, y esta afectación estuvo más correlacionada con la magnitud de la corrección en ojos con LASIK versus ojos con SMILE.
Otro estudio17 contralateral quiso evaluar diferencias en remodelación epitelial en pacientes con transPRK realizado con dos plataformas diferentes: SmartSurfACE (Schwind Amaris 1050) y StreamLight (Alcon Allegretto Wave Eye-Q). El seguimiento se realizó a 1 mes, 3 meses y 6 meses con aberrometría epitelial. Los resultados visuales y refractivos fueron comparables entre ambos grupos, sin embargo, se encontraron mayores diferencias en las aberraciones epiteliales en los ojos con Streamlight al compararlo con el estado preoperatorio, indicando mayor remode-lamiento epitelial temprano debido a que esta plataforma realiza primero la ablación del epitelio y posteriormente la ablación del componente refractivo, asumiendo un grosor epitelial homogéneo en toda la superficie corneal.
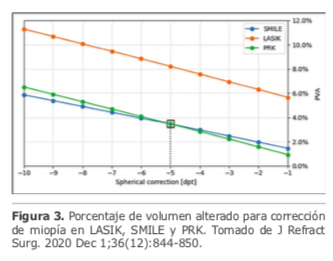
El porcentaje de volumen corneal alterado (PVA) es una forma de determinar el tejido afectado en cirugía refractiva que considera la tridimensionalidad de la córnea, a diferencia del PTA que lo hace solo en función del grosor, este concepto fue propuesto en el 2018 por un grupo de investigadores encabezado por el Dr. Damien Gatinel. En el 2020 se publicó un trabajo18 en el cual este mismo grupo elaboró el cálculo del PVA para corrección de miopía y astigmatismo miópico de una córnea estándar con volumen de 57 mm3 (diámetro 10mm y grosor 500 micras). Encontraron que el PVA en PRK y SMILE fue casi dos veces menor que con LASIK (Figura 3) y en correcciones bajas PRK tiene menor PVA que SMILE debido a un mínimo de grosor que debe tener el lentículo, lo cual ocurre al contrario para correcciones altas en la cuales aumenta el consumo (PVA) en PRK versus SMILE por la necesidad de ampliación de la zona óptica.
SUPERFICIE OCULAR
La Sociedad de Córnea realizó una importante labor durante varios años al crear un Grupo Internacional de Trabajo en Deficiencia de Células Madre Limbares. Esto comenzó en el año 2012 y el grupo se dividió en comités. Se realizó una búsqueda de literatura por parte de los miembros del grupo de trabajo con el objetivo de establecer un consenso global19 sobre las estrategias para el manejo clínico y quirúrgico de la deficiencia de células madre limbares. Los resultados fueron los siguientes: la superficie ocular debe ser optimizada siempre y en forma previa a cualquier solución terapéutica. La optimización se logra tratando cualquier enfermedad de la superficie ocular asociada, como ojo seco, anormalidades de los párpados o conjuntiva, inflamación de la superficie ocular y deficiencia de las glándulas de Meibomio.
En casos unilaterales (bilaterales subtotales) son preferibles los trasplantes autólogos de células madre limbares usando la menor cantidad posible de tejido donante como SLET (trasplante epitelial limbar simple), cultivos ex-vivo autólogos de células madre limbares y CLAU/KLAU (autotrasplante queratolimbar) debido los buenos resultados a largo plazo de estos procedimientos, con pocas complicaciones. En casos de deficiencia de células madre limbares (totales bilaterales) con párpados y función lagrimal normal, las opciones incluyen trasplante alogénico de células madre limbares, COMET (trasplante de células epiteliales cultivadas de mucosa oral), transplante ex-vivo de cultivo de células epiteliales autólogas, y queratoprótesis de Boston tipo I, aunque aún no está claro cuál es más seguro y efectivo. En casos severos y bilaterales con gran compromiso de la superficie ocular y una probable tasa de éxito baja, COMET, queratoprótesis de Boston II, OOKP (osteo-odonto queratoprótesis) y queratoprótesis de hueso tibial, son las posibilidades para intentar una rehabilitación visual. Sin embargo, cualquiera de estas opciones debe elegirse en base a la disponibilidad, la experiencia del cirujano, contraindicaciones para inmunosupresión sistémica y deseos del paciente.
En cuanto al cultivo de células madres, el grupo de trabajo de J. Shimazaki20 mediante un análisis retrospectivo de 246 procedimientos quirúrgicos consecutivos (162 ojos de 139 pacientes), concluyeron que en el 70 a 80 % de los ojos intervenidos que recibieron trasplante de células cultivadas, se lograron resultados satisfactorios en la reconstrucción de la superficie ocular a largo plazo. Tanto el método de preparación del cultivo de células como el procedimiento quirúrgico empleado no influyeron en el resultado final, mientras que el defecto epitelial persistente, el Síndrome de Stevens-Johnson y la necrolisis epidérmica tóxica si fueron un significativo factor de riesgo y de fracaso.
Además, otro análisis retrospectivo de una serie de casos en adultos y niños con Síndrome de Stevens-Johnson21 demostró que la intervención quirúrgica temprana y definitiva para evitar queratopatía relacionada con los párpados, logra una significativa mejora del pronóstico visual a largo plazo. Debido a la complejidad tanto en el diagnóstico como en el tratamiento de los casos con deficiencia de células madres limbares, es preferible remitir al paciente o trabajar en equipo con un especialista con experiencia en esta patología.
En cuanto a los métodos complementarios para el diagnóstico de patología de la superficie ocular, se publicó un interesante estudio22 acerca del rol de la tomografía de coherencia óptica (OCT) en la caracterización del patrón vascular en neoplasia escamosa de la superficie ocular (OSSN). En un estudio transversal de 15 pacientes se diagnosticó neoplasia escamosa de la superficie ocular mediante el análisis clínico y de OCT. Intencionalmente no se realizó biopsia para el diagnóstico debido a que el propósito del estudio fue analizar el patrón vascular del tumor y las adyacencias en su estado natural. Se pudo demostrar la habilidad para visualizar y cuantificar la densidad y características de la red vascular en todos los casos de OSSN independientemente de las características clínicas. El hallazgo más interesante fue que la rica vascularización de OSSN pareció ser significativamente más alta dentro del tumor, luego adyacente al tumor y, finalmente, dentro de los 200 μm de tejido subepitelial debajo del tumor; y como es de esperarse esa vascularización fue más densa en el componente conjuntival que en el corneal. Las imágenes de OCT han sido una herramienta poderosa en la caracterización de OSSN. Carol L. Karp, su equipo y otros autores han demostrado previamente que OSSN tiene características típicas en OCT que incluyen engrosamiento epitelial, hiperreflectividad y una transición abrupta entre el epitelio normal y anormal. Los hallazgos sientan bases para futuros estudios prospectivos que puedan evaluar qué características detectadas por OCT pueden ayudar en el diagnóstico y subtipificación de OSSN, guiar el tratamiento y monitorizar la respuesta al mismo.
OJO SECO
El sondaje intraductal de las glándulas de Meibomio (GM) puede ofrecer un posible enfoque terapéutico para estos pacientes, pero hasta la fecha no existen ensayos aleatorizados. Por este motivo se realizó un ensayo clínico controlado, aleatorizado, doble ciego en el que incluyeron 42 pacientes con obstrucción refractaria de las glándulas de Meibomio asociado con aumento de la sensibilidad palpebral.23 Los pacientes recibieron el siguiente tratamiento: grupo 1 sondaje de GM más ungüento de sulfacetamide/prednisolone post procedimiento (Blephamide®) ; grupo 2 sondaje de GM más ungüento lubricante (GenTeal®) luego del procedimiento; grupo 3 sondaje simulado (el borde palpebral fue tocado sin penetración real de las GM) más ungüento lubricante GenTeal. Los ungüentos se utilizaron dos veces al día por dos semanas, una vez por día antes de dormir por dos semanas más con un total de cuatro semanas. El sondaje fue realizado en el párpado superior de ambos ojos. Los resultados se evaluaron en base a los síntomas medidos por el índice de enfermedad de la superficie ocular (OSDI, Ocular Surface Disease Index, Allergan, Inc, Irvine, California) la evaluación de síntomas de ojo seco (SANDE, Symptom Assessment iN Dry Eye), así como el tiempo de ruptura de la lágrima (TBUT, tear break-up time). El grupo 1 mostró una mejoría estadísticamente significativa en ambos test, OSDI y SANDE. El grupo 2 evidenció una mejoría estadísticamente significativa sólo en el test SANDE. Mientras que el grupo 3 no mostró ningún cambio significativo en los síntomas. No hubo cambios estadísticamente significativos en los signos clínicos en ningún grupo en el control a las cuatro semanas, excepto por la mejora de la sensibilidad palpebral en el grupo de sondaje simulado.
Se concluyó que el grupo 1 fue el más beneficiado con esta estrategia terapéutica.
Se publicó una interesante revisión sobre la luz pulsada intensa (IPL). IPL fue desarrollada originalmente para uso en dermatología, se introdujo para el tratamiento de la disfunción de las glándulas de Meibomio (DGM) en 2015.24 Desde entonces, se ha intentado perfeccionar este nuevo enfoque. IPL puede mejorar la estabilidad de la película lagrimal, la funcionalidad de las glándulas de Meibomio y la sensación subjetiva de sequedad ocular. Los efectos beneficiosos son complejos y aún no se comprenden del todo. Se sugirió que reduce las telangiectasias, erradica los ácaros Demodex, produce licuefacción de las secreciones, modula la secreción de moléculas pro y antiinflamatorias, y suprime metaloproteinasas. Sin embargo, en la literatura revisada, hubo una gran variabilidad en la selección de pacientes, criterios de evaluación, protocolos de tratamiento y duraciones. Numerosos estudios informan que IPL es eficaz y segura para tratar la DGM. Se necesitan estudios comparativos para ser concluyentes, pero no se puede negar que existe un potencial sugerente para introducir mejoras en esta alternativa terapéutica.
El dolor corneal neuropático (NCP) es una entidad descrita recientemente, que se caracteriza por nervios corneales disfuncionales que causan síntomas inespecíficos, como dolor, ardor, prurito, fotofobia o sensación de sequedad ocular, así como falla en la resolución de los mismos con los tratamientos convencionales. La posible ausencia de hallazgos objetivos en el examen con lámpara de hendidura o la superposición con otras condiciones oculares, hace que esta entidad sea extremadamente difícil diagnosticar. La neuralgia post cirugía refractiva es bien conocida y ha incrementado el interés en la misma por parte de oftalmólogos y científicos. Un estudio publicado por el equipo de inmunología ocular del Massachusetts Eye and Ear y Tufts Medical School25 planteó la hipótesis de que, a pesar de las diversas etiologías, los niveles de dolor y el impacto en la calidad de vida del dolor corneal neuropático son tan graves como en la neuralgia postherpética. Se propusieron comparar las características clínicas de NCP luego de cirugía refractiva con la neuralgia posherpética para lograr un diagnóstico más certero, definir los objetivos del tratamiento y mejorar los resultados. Las puntuaciones de intensidad del dolor mostraron que el dolor luego de cirugía refractiva es tan severo como el post herpético. Las puntuaciones OSDI mostraron que los síntomas de malestar ocular y la frecuencia de los mismos son similares en ambos grupos.
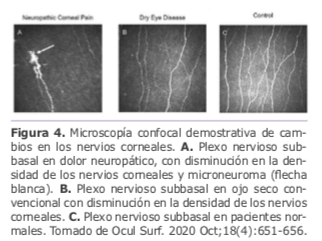
El microneuroma es un hallazgo en la microscopia confocal (IVCM) que consiste en el alargamiento terminal de los nervios corneales sub basales, los mismo autores del estudio anterior plantearon en otra publicación26 que el microneuroma puede posicionarse como un biomarcador específico para el diagnóstico de NCP. Compararon 25 pacientes con NCP con 30 pacientes con ojo seco convencional y 16 controles sanos. En las imágenes de IVCM se observó disminución de la densidad del nervio corneal tanto en los pacientes con NCP como en pacientes con diagnóstico de ojo seco, sin diferencia estadísticamente significativa entre ambos grupos; sin embargo, se detectó la presencia de microneuroma en todos los pacientes del grupo de NCP, pero en ningún paciente con ojo seco ni en pacientes sanos, lo cual sugiere un papel importante del microneuroma como biomarcador en el diagnóstico objetivo de NCP.
REFERENCIAS
Vinciguerra R, Pagano L, Borgia A, Montericcio A, Legrottaglie EF, Piscopo R, Rosetta P, Vinciguerra P. Corneal Cross-linking for Progressive Keratoconus: Up to 13 Years of Follow-up. J Refract Surg. 2020 Dec 1;36(12):838-843. doi: 10.3928/1081597X-20201021-01. PMID: 33295997.
Kaye SB. Objective evaluation of refractive data and astigmatism: quantification and analysis. Eye (Lond). 2014 Feb;28(2):154-61. doi: 10.1038/eye.2013.266. Epub 2013 Dec 13. PMID: 24336294; PMCID: PMC3930272.
Long WF. A matrix formalism for decentration problems. Am J Optom Physiol Opt. 1976 Jan;53(1):27-33. doi: 10.1097/00006324-19760100000005. PMID: 937469.
Mazzotta C, Sgheri A, Bagaglia SA, Rechichi M, Di Maggio A. Customized corneal crosslinking for treatment of progressive keratoconus: Clinical and










 Luego, o casi al unísono, se produjo un segundo acercamiento por su estética, por su estilo. Romero es el creador de un sub-género que tiene sus propios códigos, desarrollados por él y repetido por una serie de directores. A diferencia de lo que se podría creer, Romero se basa en la novela “I am legend” de Richard Matheson1,5 (1954) y su trabajo no surge como continuación o desarrollo a partir de experiencias previas como “White Zombie” (1932) o “I walked with a Zombie” (1943); al igual que en la novela nos enfrentamos a una plaga apocalíptica que está a punto de eliminar a la raza humana, pero los monstruos de Romero no son vampiros, son una idea original. “George Romero creó a los zombis4, él hizo las reglas, dispararles en la cabeza, si te muerden quedas infectado, los muertos regresando a la vida, George hizo todo eso». Incluso en un comienzo hablaba de “ghouls” (necrófagos), sólo a partir de “Dawn of the Dead” (1978) se comenzó a hablar de zombis. Pero los zombis de Romero tienen características propias, se alejan del vudú haitiano y del trabajo de esclavos africanos resucitados y sin voluntad en las plantaciones de caña de azúcar, para transformarse en caníbales con urgencia por carne humana, lentos y torpes pero al mismo tiempo poderosos y temibles al alcanzar grandes números y carecer del miedo que siembra dudas en nosotros los vivos. A pesar de lo rico del mito creado, se podría decir que los zombis de Romero nunca son los protagonistas y sólo plantean límites a los conflictos que enfrentan los personajes, son una restricción, pero no el problema que se quiere reflejar en pantalla. Incluso el miedo es provocado más por los ángulos usados por la cámara, atacando a los personajes desde abajo o desde arriba; por la iluminación sistemática de sólo parte de los rostros o por el uso del silencio que permite identificar en forma permanente el gruñir de los zombis como fondo más que por el ejército de no muertos en sí mismo.
Luego, o casi al unísono, se produjo un segundo acercamiento por su estética, por su estilo. Romero es el creador de un sub-género que tiene sus propios códigos, desarrollados por él y repetido por una serie de directores. A diferencia de lo que se podría creer, Romero se basa en la novela “I am legend” de Richard Matheson1,5 (1954) y su trabajo no surge como continuación o desarrollo a partir de experiencias previas como “White Zombie” (1932) o “I walked with a Zombie” (1943); al igual que en la novela nos enfrentamos a una plaga apocalíptica que está a punto de eliminar a la raza humana, pero los monstruos de Romero no son vampiros, son una idea original. “George Romero creó a los zombis4, él hizo las reglas, dispararles en la cabeza, si te muerden quedas infectado, los muertos regresando a la vida, George hizo todo eso». Incluso en un comienzo hablaba de “ghouls” (necrófagos), sólo a partir de “Dawn of the Dead” (1978) se comenzó a hablar de zombis. Pero los zombis de Romero tienen características propias, se alejan del vudú haitiano y del trabajo de esclavos africanos resucitados y sin voluntad en las plantaciones de caña de azúcar, para transformarse en caníbales con urgencia por carne humana, lentos y torpes pero al mismo tiempo poderosos y temibles al alcanzar grandes números y carecer del miedo que siembra dudas en nosotros los vivos. A pesar de lo rico del mito creado, se podría decir que los zombis de Romero nunca son los protagonistas y sólo plantean límites a los conflictos que enfrentan los personajes, son una restricción, pero no el problema que se quiere reflejar en pantalla. Incluso el miedo es provocado más por los ángulos usados por la cámara, atacando a los personajes desde abajo o desde arriba; por la iluminación sistemática de sólo parte de los rostros o por el uso del silencio que permite identificar en forma permanente el gruñir de los zombis como fondo más que por el ejército de no muertos en sí mismo. Si bien Romero en varias entrevistas insiste en que la elección del protagonista se debió solamente a que fue el que mejor audicionó, parecen demasiadas coincidencias (si fuera cierto nunca deberíamos volver a menospreciar el valor del azar).
Si bien Romero en varias entrevistas insiste en que la elección del protagonista se debió solamente a que fue el que mejor audicionó, parecen demasiadas coincidencias (si fuera cierto nunca deberíamos volver a menospreciar el valor del azar).





 Dr. Manuel Alejandro Garza León
Dr. Manuel Alejandro Garza León