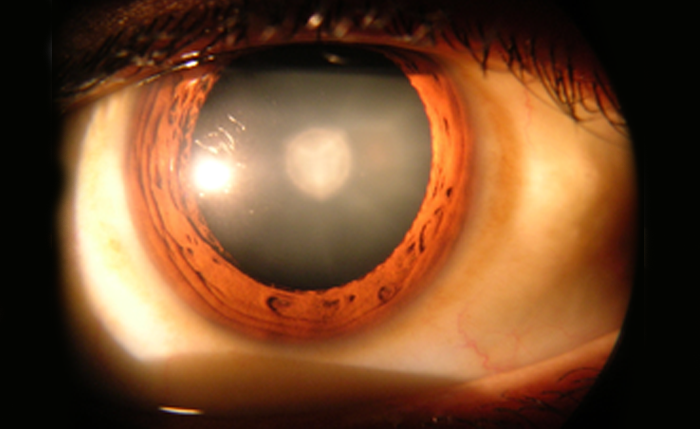
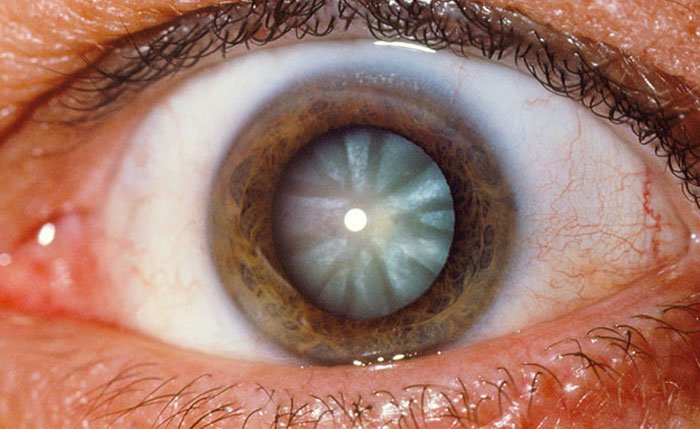
Afinando resultados con lio tóricos
Dr. Oscar Guerrero Berger México
Contacto
Dr. Oscar Guerrero Berger – droscarguerrero@gmail.com
Introducción
Todos aquellos que usamos anteojos desde la infancia, y pasamos por las pruebas de visión y refracción en consultorios oftalmológicos, recordamos el proceso de observar los optotipos de una forma inicialmente borrosa, y que progresivamente se tornaba nítida. Este proceso solo se alcanza si las aberraciones de bajo orden fueron adecuadamente neutralizadas tanto en su componente esférico como astigmático.
Actualmente la cirugía de cristalino busca mediante diversos métodos, tecnologías y lentes intraoculares un objetivo similar al logrado por el oftalmólogo al momento de ejecutar la mejor refracción posible. Sin embargo, la diferencia entre la refracción clí- nica y el cálculo esférico/astigmático de un lente intraocular (LIO) radica en el componente subjetivo de la prueba.
Dado lo anterior, e indistintamente de la disponibilidad de equipo con el que se cuente, hay conceptos que son necesarios entender para la mejor realización de un análisis queratométrico prequirúrgico.
- Estudio clínico en consultorio.
- Preoperatorio queratométrico/ biométrico.
- Decisión manejo astigmático.
- Abordaje quirúrgico.
- Evaluación de resultados.
1. Estudio clínico en consultorio
La historia/exploración clínica son ele- mentos necesarios para establecer con certeza las condiciones astigmáticas naturales del paciente, descartando condiciones patológicas que generen posibles astigmatismos irregulares u otra condición inadvertida.
Los estudios queratométricos habitua- les de consultorio, mediante quera- tómetros manuales o automatizados, representan el primer filtro para la toma de decisiones (no así la refrac- ción manifiesta, cuyo valor predictivo es bajo, en vista de que el astigma- tismo lenticular será evidentemente excluido en caso de un procedimiento facorrefractivo). Así las variables en consultorio a considerar son:
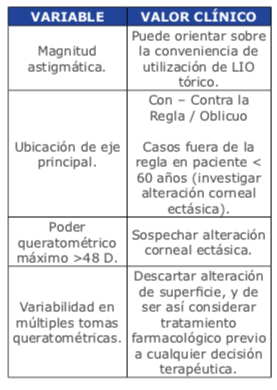
Teniendo certeza en los puntos mencio- nados, el oftalmólogo podrá empezar a tener herramientas de juicio suficientes para seguir una línea terapéutica ade- cuada basada en conocimiento y correc- to criterio. Será decisión del médico tra- tante solicitar estudios queratométricos/ biométricos más sofisticados para un eventual proyecto quirúrgico.
2.Preoperatorio queratométrico/ biométrico
La gama de posibilidades de estudios diagnósticos prequirúrgicos es actual- mente amplia. La biometría – querato- metría más precisa, la que normalmente es conocida y manejada por el cirujano, con conocimiento amplio y con calibra- ciones de equipos de forma periódica.
Algunos de los estudios queratométricos más utilizados en la actualidad son:
- Interferómetros: El más usado IOL Master (Zeiss®), dependiendo de la versión que se trate, resulta muy útil en ojos sanos con córneas vír- genes. Su última versión 700 incor- pora una queratometría telecén- trica que la hace más precisa que sus antecesores. Además, al estar asociado con OCT permite calcular el grosor del cristalino y ACD, me- jorando su precisión. El sistema in- cluye análisis tórico de Barret.
- Refractómetros: Lenstar (Haag- Streit) es uno de los equipos más precisos en la actualidad. Su análisis queratométrico dual zone de 32 pun- tos permite ser uno de los más pre- cisos. Su biometría incorpora grosor de cristalino y ACD, que asociado a los módulos RBF-Hill, lo convierten en uno de los pilares actuales.
c.Tomógrafos corneales:
Pentacam (Occulus) es la videocámara de Scheim- pflug más usada. Tiene la capacidad de analizar la cara posterior corneal y hacer de forma individual el ajuste queratométri- co y astigmático. Su últi- ma versión XL incorpora un biómetro óptico en el mismo equipo.
- ORA
- Ultrasonido: Con su mis- ma vigencia, con la téc- nica de inmersión bien realizada y con fuente queratométrica confiable, el ultrasonido sigue sien- do uno de los gold stan- dard en cálculo de lente.
Indistintamente de la tecno- logía que se emplee, existen herramientas online que son gratuitas para todo el público, como la fórmula Barret Uni- versal II, el calculador RBF Hill, así como el calculador Ba- rret Toric, que permite vaciar los datos de los equipos que se utilicen para generar un re- sultado. Siempre valorar que el índice de refracción corneal del equipo sea de 1.3375.
3. Decisión de manejo quirúrgico
Con la información clínica así como biométrica/queratomé- trica, es decisión del oftalmó- logo plantear el implante de un LIO tórico mono o multifocal.
EnLIOshaydebatesobrecuál
es el mínimo de astigmatismo a tratar. No hay consenso en la actualidad. Los rangos varían entre 0.5 a 1 D dependiendo de la escuela quirúrgica. Las tendencias actuales que con- sideran al astigmatismo de la cara posterior establecen que si el astigmatismo es con la regla, al estar sobrestimado, se debe tratar cuando alcan- ce una magnitud de 1.25 a 1.50 D, mientras que por el contrario, en casos contra la regla, debe ser tratados des- de 0.5 D.
El manejo astigmático basado en cara posterior puede reali- zarse a través de nomogramas (Barret es el más aceptado actualmente) o bien de forma individualizada analizando la córnea posterior del paciente.
Por otra parte, las escue- las que no incluyen a la cara posterior por considerarla matemáticamente desprecia- ble, mencionan que los resul- tados clínicos no tienen dife- rencia significativa.
Lo que si podemos establecer es que, independientemen- te del criterio que se tome, hay que ser muy precisos y estrictos en las lecturas que- ratométricas y biométricas, y siempre recordar que el as- tigmatismo corneal es una entidad cambiante por natu- raleza, siendo su eje el prin- cipal afectado con el paso de los años.
Adicionalmente, el conocimiento del astigmatismo inducido por el ciru- jano es esencial para el cálculo co- rrectivo tórico adecuado.
4. Abordaje quirúrgico
Los factores quirúrgicos determinan- tes para la reproducibilidad del éxito en el implante de LIOs tóricos son los siguientes:
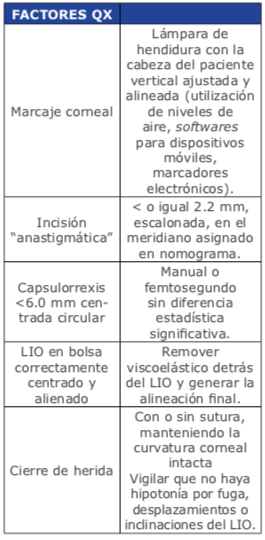
5. Evaluación de resultados
El valor astigmático posquirúrgico es la re- sultante entre el astigmatismo prequirúr- gico queratométrico con el astigmatismo inducido quirúrgico (LIO tórico + astigma- tismo inducido por cirujano).
La revisión posquirúrgica debe incluir la observación de la posición del LIO en el meridiano correcto (softwares de com- putación, ej.: Goniotrans, pueden ser de ayuda para estos fines). Correlacionarlo con la refracción manifiesta del paciente. En caso de sutura retirarla en los prime- ros días para tener información astigmá- tica real.
En caso de sorpresas refractivas con astigmatismos inesperados posquirúr- gicos, es recomendable revisar la infor- mación prequirúrgica así como la ali- neación del LIO. De mucha utilidad son algunos softwares diseñados para esta- blecer error de magnitud y orientación tórica (Panacea®, www.astigmatismfix. com) y las posibilidades de corrección mediante reorientación vs. recambio de LIO vs. Excimer láser complementario. En casos de recambio de LIO, es reco- mendable que se realice dentro de los primeros 3 meses posquirúrgicos.
La decisión de implantar LIOs tóricos generará como consecuencia satisfac- ción visual en el paciente. Dicho éxito es directamente proporcional a lo metó- dico y preciso de la evaluación prequi- rúrgica y a la ejecución quirúrgica.





 Somos el país más frecuentado del Caribe, nuestros visitantes llegan atraídos por los más variados motivos:
Somos el país más frecuentado del Caribe, nuestros visitantes llegan atraídos por los más variados motivos: