No se han escatimado esfuerzos para crear métodos de detección para el queratocono precoz en los últimos veinte años. Las evaluaciones topográficas y tomográficas han evolucionado de observaciones cualitativas1 a mediciones cuantitativas, y se han descrito muchos parámetros para ayudar a distinguir ojos normales de ojos con queratocono.1-10 Se han empleado diversos modelos de aprendizaje estadísticos, automatizados o computarizados para detectar el queratocono, y se han creado sistemas automatizados para su detección partiendo de la topografía de superficie anterior y posterior, la tomografía corneal total y el perfil paquimétrico.11-19
A pesar de que estos enfoques han mejorado la eficacia del detección del queratocono, aún existen casos para los que no se puede emitir un diagnóstico confiable y es probable que el queratocono sin diagnosticar continúe siendo la principal causa de ectasia corneal pos-LASIK.20-32 En mi clínica usamos un protocolo de detección con 20 puntos que engloba todo, desde datos demográficos hasta diagnósticos, y que pueden resumirse en estos 10 puntos:
1. No se debe dejar de lado la anamnesis detallada del paciente
Es fácil pasar por alto la anamnesis e ir directamente a la evaluación de las imágenes diagnósticas, pero los datos demográficos y la anamnesis del paciente pueden aportar valiosa información. Factores como antecedentes familiares, etnia, antecedentes de frotamiento ocular, enfermedades atópicas y la edad desempeñan su correspondiente papel en la tomada de decisión clínica. Es posible que los pacientes no citen algunos puntos o piensen que no merecen atención, por lo que es importante insistir en que recuerden incluso los más mínimos detalles (frotamiento ocular, por ejemplo) durante la anamnesis.
2. Obtener los antecedentes de refracción
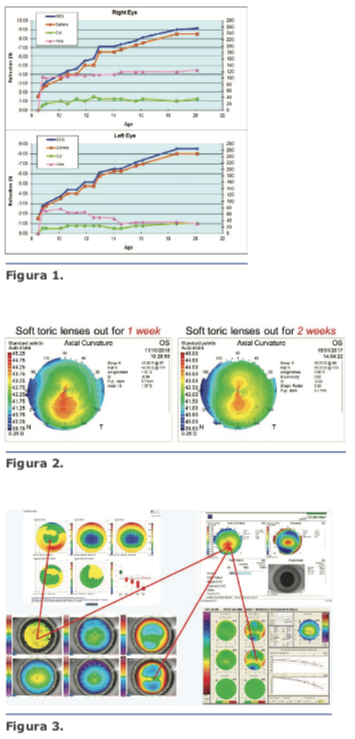
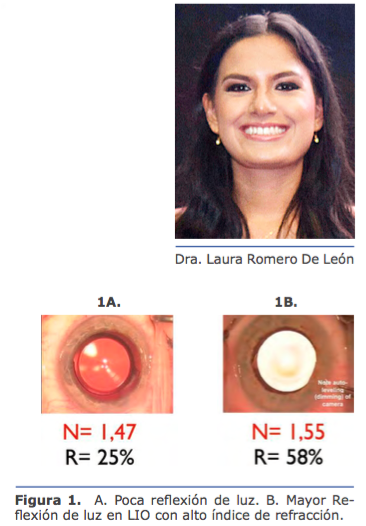
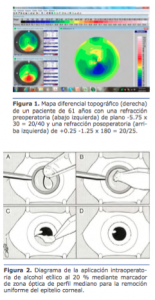
La evaluación de la refracción, especialmente el cilindro y el eje, es fundamental en casos de sospecha de queratocono. Captar todos los antecedentes de refracción puede brindar otra pista en esos casos. Esto es más importante en pacientes más jóvenes, en los que la enfermedad puede continuar su curso. No es tarea fácil para el personal reunir los antecedentes de refracción, especialmente si el paciente ha sido examinado por distintos oftalmólogos a lo largo de los años, pero el esfuerzo vale la pena y puede brindar valiosa información (Figura 1).
3.Tener paciencia (repetir cualquier prueba necesaria, como deformación de lentes de contacto, problemas de superficie ocular, etc.)
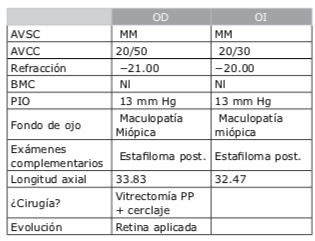
Lo que buscamos durante el cribado de los candidatos a la cirugía refractiva son las más mínimas alteraciones corneales que puedan indicar los primeros signos de queratocono. Para encontrar pequeñas alteraciones, es esencial que la superficie ocular se encuentre en estado normal y en perfectas condiciones. Solo después de eso podremos confiar en nuestras mediciones e imágenes diagnósticas. Aunque normalmente se mantienen a los pacientes sin lentes de contacto por un tiempo determinado (según el tipo de lente) antes de la evaluación, es posible que solo eso no sea suficiente. En la Figura 2 se muestra la alteración en la topografía corneal de un paciente después que se le hubiera pedido que continuara sin usar lentes de contacto por más tiempo tras su consulta inicial. Además de la deformación de los lentes de contacto, la enfermedad de la superficie ocular puede reducir la calidad del examen. Si por medio de lámpara de hendidura o de imagen diagnóstica se detecta la presencia de ojo seco u otro problema que afecte el mapa corneal, sometemos al paciente a un tratamiento intensivo durante algunas semanas o meses y después se repiten todas las pruebas. Pese a la inconveniencia que pueda causarle al paciente tener que volver a la clínica varias veces antes de que podamos tomar una decisión final sobre el tratamiento, bien como suponer más tiempo de trabajo para el personal, no se puede atropellar el proceso de decisión, que precisa valerse de información fiable en todo momento.
4. Examinar el ojo de las más diversas maneras (cuanto mayor sea la variedad, mejor será)
Desde mi punto de vista, es imposible entender completamente lo que pasa en un ojo con tan solo utilizar un dispositivo, como un tomógrafo, por ejemplo. Cada dispositivo aporta una información específica, y es importante contar con el mayor número de puntos de medición posible. En nuestra clínica, cada paciente pasa por una topografía que se realiza con dos dispositivos, una tomografía también con dos dispositivos, una OCT, una aberrometría y una histéresis corneal. Si aún persisten dudas, se le hace una ultrasonografía digital de frecuencia muy elevada (VHF, en inglés) al paciente. Estos exámenes pueden compararse lado a lado para obtener un cuadro completo y detallado.
5. Conocer los puntos fuertes y débiles de cada dispositivo
Como se mencionó en el punto 4, es importante utilizar varios dispositivos para evaluar el ojo antes de la cirugía refractiva corneal. Con esto en mente, cada dispositivo tendrá ciertas fortalezas y debilidades. Por ejemplo, un topógrafo con disco de Plácido aportará datos de curvatura más precisos que un dispositivo con sistema de Scheimpflug, en el que los datos de curvatura se derivan de la elevación en vez de su medición directa. Por lo tanto, cualquier cambio de la curvatura axial captado por el sistema de disco de Plácido recibiría más importancia. De nuevo, tenemos que analizar el queratocono desde una perspectiva global en vez de basarnos en un solo examen.
6. Buscar la correspondencia entre dispositivos e imágenes
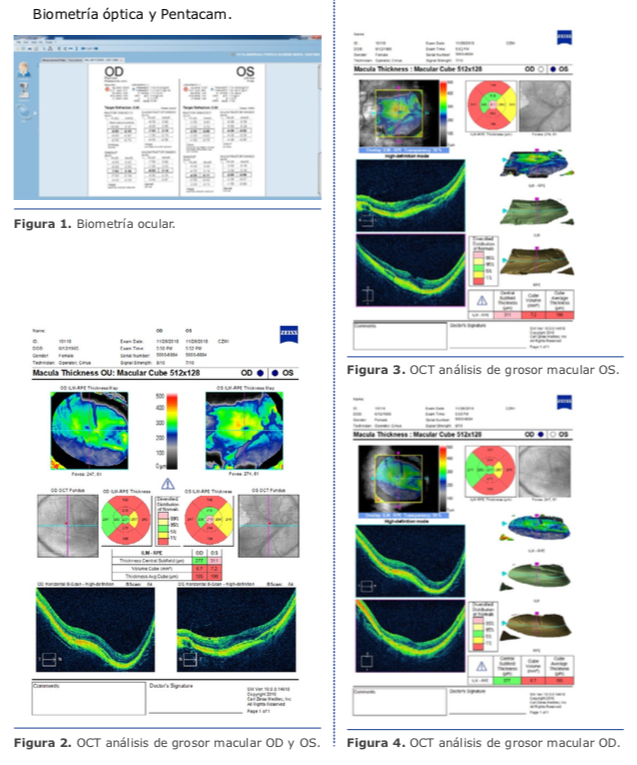
Es importante observar todos los datos al mismo tiempo. Creamos una hoja «maestra», como puede verse en la Figura 3, para cualquier paciente con la más leve sospecha de queratocono. La correspondencia entre los exámenes es un componente crucial. Es posible decidirse por un diagnóstico de queratocono aun cuando los resultados de una prueba sean normales, y a la inversa, es posible excluirlo, pese a la obtención de resultados altamente sospechosos en una prueba, desde que los otros datos no complementen todo el cuadro. Hasta hace poco, todos los dispositivos comercializados presentaban muy buen resultado en un aspecto y, por lo tanto, es importante tratar de correlacionar estas imágenes para tener un panorama completo de lo que está sucediendo. El MS-39 (CSO, Florencia, Italia) es el primer dispositivo que registra y ofrece en una única pantalla los datos de epitelio, curvatura y elevación.
7. Comparar el ojo derecho con el ojo izquierdo
Así como es importante comparar todos los dispositivos en una sola proyección, también es importante comparar el ojo izquierdo con el derecho en una sola pantalla. La mayoría de los dispositivos, como el Pentacam® (Oculus Wetzlar, Alemania), incluye una opción de software para producir mapas que muestran las diferencias que existen entre los ojos de un paciente. Como alternativa, esto puede llevarse a cabo cualitativamente analizando lado a lado las pruebas de ambos ojos durante la evaluación de un paciente con queratocono dudoso. La asimetría entre los ojos es un factor de riesgo para el queratocono.
8. Incluir el mapa epitelial en el protocolo de cribado
 Además del dispositivo de ultrasonido digital Insight 100 VHF (ArcScan Inc, Golden, CO), ahora también puede medirse el espesor epitelial mediante sistemas de OCT, especialmente el RTVue − Avanti (Opto-vue, Fremont, CA) y el MS-39. Es de amplio conocimiento que en el queratocono ocurren cambios del espesor epitelial, puesto que curvaturas extremas conducen a la ruptura del epitelio, como se observa a menudo del punto de visto clínico. El adelgazamiento epitelial sobre el cono se ha demostrado mediante análisis histopatológico de córneas con queratocono (Scroggs et al.33) y, posteriormente (Haque et al.34), mediante software personalizado y un sistema de OCT HumphreyZeiss (Humphrey Systems, Dublín, California).
Además del dispositivo de ultrasonido digital Insight 100 VHF (ArcScan Inc, Golden, CO), ahora también puede medirse el espesor epitelial mediante sistemas de OCT, especialmente el RTVue − Avanti (Opto-vue, Fremont, CA) y el MS-39. Es de amplio conocimiento que en el queratocono ocurren cambios del espesor epitelial, puesto que curvaturas extremas conducen a la ruptura del epitelio, como se observa a menudo del punto de visto clínico. El adelgazamiento epitelial sobre el cono se ha demostrado mediante análisis histopatológico de córneas con queratocono (Scroggs et al.33) y, posteriormente (Haque et al.34), mediante software personalizado y un sistema de OCT HumphreyZeiss (Humphrey Systems, Dublín, California).
Se observó que el perfil promedio del espesor epitelial en una población con queratocono presentaba significativamente mayor irregularidad que el de una población normal. El epitelio se presentaba más delgado en el ápice del cono, y esta delgada zona epitelial se encontraba rodeada por una corona de epitelio espeso.35
9. Incluir el mapa epitelial en el protocolo de cribado
Nuestros estudios con ultrasonido digital VHF han demostrado que el perfil del espesor epitelial en ojos normales es, en promedio, más espeso en la región inferior que en la superior y levemente más espeso en la región nasal que en la temporal. Hay muy poca variación del espesor epitelial en la hemicórnea inferior y superior. En cambio, como se ha mencionado anteriormente, para ojos con queratocono, el mapa de los promedios del espesor epitelial reveló la existencia de un patrón anular epitelial, caracterizado por una zona central localizada de adelgazamiento sobrepuesta al cono estromal, rodeada por un anillo de epitelio engrosado. En estadios iniciales del queratocono, esperaríamos ver el patrón de adelgazamiento epitelial localizado, rodeado por una corona de epitelio engrosado, que coincide con un cono sospechoso respecto a la mejor esfera de referencia (best-fit sphere, BFS) de elevación posterior. La coincidencia del adelgazamiento epitelial junto con un ápice excéntrico de BFS de elevación posterior puede revelar si se atribuye importancia o no a un ápice excéntrico de BFS de elevación posterior que ocurre simultáneamente con una topografía de superficie anterior normal.36
En otras palabras, en la presencia de una topografía normal o cuestionable de la superficie anterior, el adelgazamiento del epitelio que coincide con la ubicación del ápice de la BFS de elevación posterior representaría el total de enmascaramiento o compensación de un cono estromal subsuperficial y pronosticaría alteraciones en la BFS de elevación posterior que, claramente, representan el queratocono.36
10. Incluirelmapaepitelialenelprotocolo de cribado
Por el contrario, encontrar un epitelio más espeso en una superficie topográfica de mayor curvatura o un ápice excéntrico de BFS de elevación posterior implicaría que el aumento de la curvatura no se debe a un queratocono en el estroma subsuperficial, sino más probablemente a un engrosamiento localizado del epitelio. El examen de las irregularidades del perfil del espesor epitelial es un método de gran sensibilidad para analizar la topografía de la superficie estromal – por aproximación. Por lo tanto, esta técnica ofrece una mayor sensibilidad y especificidad para el diagnóstico de queratocono con suficiente antelación respecto a cualquier alteración topográfica detectable de la superficie anterior de la córnea.
En resumen, es importante obtener un cuadro clínico completo del paciente, incluidos los datos demográficos, diagnósticos y de los exámenes. Con los avances en el cribado del queratocono, que incluyen desde la topografía hasta la tomografía y, ahora, el epitelio, estamos viendo un cambio en el procedimiento diagnóstico habitual, que nos capacita a prestar una mejor asistencia a nuestros pacientes. En el futuro, los avances en algoritmos y el aprendizaje automático profundo pueden ser otras herramientas que ayuden en la detección temprana del queratocono.
Referencias bibliográficas:
1. Rabinowitz YS, McDonnell PJ. Computer-assisted cor- neal topography in keratoconus. Refract Corneal Surg. 1989;5:400-408.
2. Rabinowitz YS. Videokeratographic indices to aid in scree- ning for keratoconus. J Refract Surg. 1995;11:371-379.
3. Rabinowitz YS. Tangential vs sagittal videokeratographs in the «early» detection of keratoconus. Am J Ophthalmol. 1996;122:887-889.
4. Rabinowitz YS, Rasheed K. KISA% index: a quantitative videokeratography algorithm embodying minimal topo- graphic criteria for diagnosing keratoconus. J Cataract Refract Surg. 1999;25:1327-1335.
5. Smolek MK, Klyce SD. Current keratoconus detection methods compared with a neural network approach. In- vest Ophthalmol Vis Sci. 1997;38:2290-2299.
6. Maeda N, Klyce SD, Smolek MK. Comparison of methods for detecting keratoconus using videokeratography. Arch Ophthalmol. 1995;113:870-874.
7. Nesburn AB, Bahri S, Salz J, Rabinowitz YS, Maguen E, Hofbauer J, Berlin M, Macy JI. Keratoconus detected by videokeratography in candidates for photorefractive ke- ratectomy. J Refract Surg. 1995;11:194-201.
8. Chastang PJ, Borderie VM, Carvajal-Gonzalez S, Roste- ne W, Laroche L. Automated keratoconus detection using the EyeSys videokeratoscope. J Cataract Refract Surg. 2000;26:675-683.
9. Maeda N, Klyce SD, Smolek MK, Thompson HW. Auto- mated keratoconus screening with corneal topography analysis. Invest Ophthalmol Vis Sci. 1994;35:2749- 2757.
10. Kalin NS, Maeda N, Klyce SD, Hargrave S, Wilson SE. Automated topographic screening for keratoconus in re- fractive surgery candidates. Clao J. 1996;22:164-167.
11. Ambrosio R, Jr., Caiado AL, Guerra FP, Louzada R, Roy AS, Luz A, Dupps WJ, Belin MW. Novel pachymetric pa- rameters based on corneal tomography for diagnosing keratoconus. J Refract Surg. 2011;27:753-758.
12. Ambrosio R, Jr., Alonso RS, Luz A, Coca Velarde LG. Corneal-thickness spatial profile and corneal-volume dis- tribution: tomographic indices to detect keratoconus. J Cataract Refract Surg. 2006;32:1851-1859.
13. Fontes BM, Ambrosio R, Jr., Salomao M, Velarde GC, Nose W. Biomechanical and tomographic analysis of unilateral keratoconus. J Refract Surg. 2010;26:677-681.
14. Bae GH, Kim JR, Kim CH, Lim DH, Chung ES, Chung TY. Corneal topographic and tomographic analysis of fellow eyes in unilateral keratoconus patients using Pentacam. Am J Ophthalmol. 2014;157:103-109 e101.
15. MuftuogluO,AyarO,OzulkenK,OzyolE,AkinciA.Poste- rior corneal elevation and back difference corneal eleva- tion in diagnosing forme fruste keratoconus in the fellow eyes of unilateral keratoconus patients. J Cataract Re- fract Surg. 2013;39:1348-1357.
16. ChanC,AngM,SaadA,ChuaD,MejiaM,LimL,Gatinel D. Validation of an Objective Scoring System for Forme Fruste Keratoconus Detection and Post-LASIK Ectasia Risk Assessment in Asian Eyes. Cornea. 2015;34:996- 1004.
17. Saad A, Gatinel D. Validation of a New Scoring System for the Detection of Early Forme of Keratoconus. Int J Kerat Ect Cor Dis. 2012;1:100-108.
18. Saad A, Gatinel D. Topographic and tomographic properties of forme fruste keratoconus corneas. Invest Ophthalmol Vis Sci. 2010;51:5546-5555.
19. Mahmoud AM, Nunez MX, Blanco C, Koch DD, Wang L, Weikert MP, Frueh BE, Tappeiner C, Twa MD, Roberts CJ. Expanding the cone location and magnitude index to include corneal thickness and posterior surface information for the detection of keratoconus. Am J Ophthalmol. 2013;156:1102-1111.
20. Randleman JB, Trattler WB, Stulting RD. Validation of the Ectasia Risk Score System for preoperative laser in situ keratomileusis screening. Am J Ophthalmol. 2008;145:813-818.
21. Randleman JB, Woodward M, Lynn MJ, Stulting RD. Risk as- sessment for ectasia after corneal refractive surgery. Ophthalmo- logy. 2008;115:37-50.
22. Seiler T, Quurke AW. Iatrogenic keratectasia after LASIK in a case of forme fruste keratoconus. J Cataract Refract Surg. 1998;24:1007- 1009.
23. Speicher L, Gottinger W. Progressive corneal ectasia after la- ser in situ keratomileusis (LASIK). Klin Monatsbl Augenheilkd. 1998;213:247-251.
24. Geggel HS, Talley AR. Delayed onset keratectasia following laser in situ kera tomileusis. J Cataract Refract Surg. 1999;25:582-586.
25. Amoils SP, Deist MB, Gous P, Amoils PM. Iatrogenic keratectasia after laser in situ keratomileusis for less than -4.0 to -7.0 diopters of myopia. J Cataract Refract Surg. 2000;26:967-977.
26. McLeod SD, Kisla TA, Caro NC, McMahon TT. Iatrogenic keratoco- nus: corneal ectasia following laser in situ keratomileusis for myo- pia. Arch Ophthalmol. 2000;118:282-284.
27. Holland SP, Srivannaboon S, Reinstein DZ. Avoiding serious cor- neal complications of laser assisted in situ keratomileusis and pho- torefractive keratectomy. Ophthalmology. 2000;107:640-652.
28. Schmitt-Bernard CF, Lesage C, Arnaud B. Keratectasia induced by laser in situ keratomileusis in keratoconus. J Refract Surg. 2000;16:368-370.
29. Rao SN, Epstein RJ. Early onset ectasia following laser in situ ke- ratomileusus: case report and literature review. J Refract Surg. 2002;18:177-184.
30. Malecaze F, Coullet J, Calvas P, Fournie P, Arne JL, Brodaty C. Cor- neal ectasia after photorefractive keratectomy for low myopia. Ophthalmology. 2006;113:742-746.
31. Randleman JB, Russell B, Ward MA, Thompson KP, Stulting RD. Risk factors and prognosis for corneal ectasia after LASIK. Ophthalmology. 2003;110:267-275.
32. Leccisotti A. Corneal ectasia after photorefractive keratectomy. Graefes Arch Clin Exp Ophthalmol. 2007;245:869-875.
33. ScroggsMW,ProiaAD.Histopathologicalvariationinkeratoconus. Cornea. 1992;11:553-559.
34. Haque S, Simpson T, Jones L. Corneal and epithelial thickness in keratoconus: a comparison of ultrasonic pachymetry, Orbscan II, and optical coherence tomography. J Refract Surg. 2006;22:486- 493.
35. Reinstein DZ, Archer TJ, Gobbe M, Silverman RH, Coleman DJ. Epithelial, stromal and corneal thickness in the keratoconic cor- nea: three-dimensional display with Artemis very high-frequency digital ultrasound. J Refract Surg. 2010;26:259-271.
36. ReinsteinDZ,ArcherTJ,GobbeM.CornealEpithelialThicknessPro- file in the Diagnosis of Keratoconus. J Refract Surg. 2009;25:604- 610.



 Dr. Pablo Suárez: Para el cálculo de la lente debemos tener varios puntos claros en cuanto a la medición de los diferentes compartimentos del ojo. Para ello, creo que se deben valorar los siguientes tipos de ojos miopes:
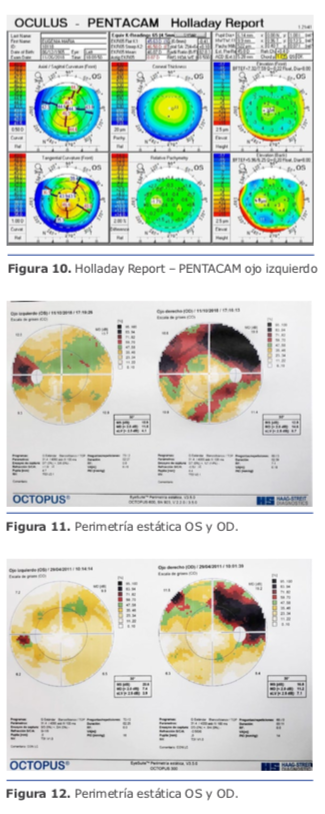
Dr. Pablo Suárez: Para el cálculo de la lente debemos tener varios puntos claros en cuanto a la medición de los diferentes compartimentos del ojo. Para ello, creo que se deben valorar los siguientes tipos de ojos miopes: Dr. Juan Guillermo Ortega: Los cálculos de miopías extremas suelen producir hipermetropía posoperatoria porque magnifican el poder del lente a implantar. Este hallazgo produjo lo que se denomina el ajuste de Wang-Koch, que es particularmente útil en fórmulas antiguas como Holladay 1, y que originalmente se proponía para longitudes axiales superiores a 25,2 mm. SRK/T se comporta mejor, y Haigis todavía más, porque es menos sensible a esta aberración de medida óptica. Las fórmulas más recientes como Barrett Universal, Hill RBF y PANACEA se comportan mucho mejor en estos casos. (Ver figura 15)
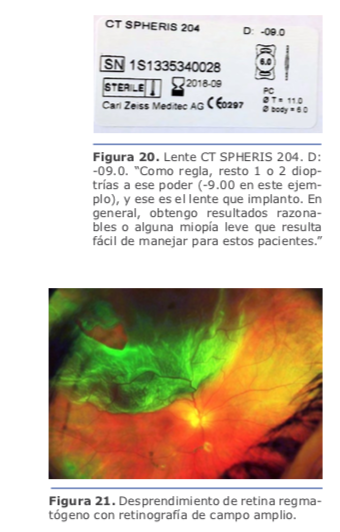
Dr. Juan Guillermo Ortega: Los cálculos de miopías extremas suelen producir hipermetropía posoperatoria porque magnifican el poder del lente a implantar. Este hallazgo produjo lo que se denomina el ajuste de Wang-Koch, que es particularmente útil en fórmulas antiguas como Holladay 1, y que originalmente se proponía para longitudes axiales superiores a 25,2 mm. SRK/T se comporta mejor, y Haigis todavía más, porque es menos sensible a esta aberración de medida óptica. Las fórmulas más recientes como Barrett Universal, Hill RBF y PANACEA se comportan mucho mejor en estos casos. (Ver figura 15) Esta lente es de una sola pieza de acrílico (Rayacril) de borde cuadrado en 360 grados con una baja incidencia de opacidad capsular muy importante para evitar o retrasar lo más posible la apertura de la cápsula posterior con YAG en estos tipos de pacientes, y una óptica grande de 6,25 mm que permite realizar un examen minucioso de la retina periférica para el control o posibles tratamientos a futuro, por 12.50 mm de longitud ideal para estos pacientes que presentan un bag grande. (Ver figura 18)
Esta lente es de una sola pieza de acrílico (Rayacril) de borde cuadrado en 360 grados con una baja incidencia de opacidad capsular muy importante para evitar o retrasar lo más posible la apertura de la cápsula posterior con YAG en estos tipos de pacientes, y una óptica grande de 6,25 mm que permite realizar un examen minucioso de la retina periférica para el control o posibles tratamientos a futuro, por 12.50 mm de longitud ideal para estos pacientes que presentan un bag grande. (Ver figura 18)
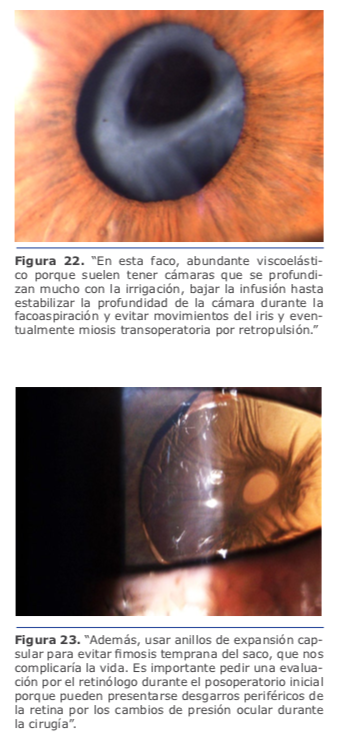 Durante la cirugía trato de evitar cambios bruscos o descompresiones excesivas de la cámara anterior al retirar el faco o la aspiración, siempre colocando viscoelástico o manteniendo la irrigación constante para evitar mayores movimientos del vítreo hacia adelante. En general, realizo un túnel corneal un poco más corto y utilizo una pinza de rexis recta, no curva, para mejor acceso a la cápsula posterior y no abrir el labio de la córnea ni que se deforme el túnel, ya que tenemos que trabajar mucho más abajo por la amplia cámara anterior que tienen este tipo de pacientes. Luego el resto de la cirugía sigue de forma habitual. (Ver figura 21)
Durante la cirugía trato de evitar cambios bruscos o descompresiones excesivas de la cámara anterior al retirar el faco o la aspiración, siempre colocando viscoelástico o manteniendo la irrigación constante para evitar mayores movimientos del vítreo hacia adelante. En general, realizo un túnel corneal un poco más corto y utilizo una pinza de rexis recta, no curva, para mejor acceso a la cápsula posterior y no abrir el labio de la córnea ni que se deforme el túnel, ya que tenemos que trabajar mucho más abajo por la amplia cámara anterior que tienen este tipo de pacientes. Luego el resto de la cirugía sigue de forma habitual. (Ver figura 21)

 Además del dispositivo de ultrasonido digital Insight 100 VHF (ArcScan Inc, Golden, CO), ahora también puede medirse el espesor epitelial mediante sistemas de OCT, especialmente el RTVue − Avanti (Opto-vue, Fremont, CA) y el MS-39. Es de amplio conocimiento que en el queratocono ocurren cambios del espesor epitelial, puesto que curvaturas extremas conducen a la ruptura del epitelio, como se observa a menudo del punto de visto clínico. El adelgazamiento epitelial sobre el cono se ha demostrado mediante análisis histopatológico de córneas con queratocono (Scroggs et al.33) y, posteriormente (Haque et al.34), mediante software personalizado y un sistema de OCT HumphreyZeiss (Humphrey Systems, Dublín, California).
Además del dispositivo de ultrasonido digital Insight 100 VHF (ArcScan Inc, Golden, CO), ahora también puede medirse el espesor epitelial mediante sistemas de OCT, especialmente el RTVue − Avanti (Opto-vue, Fremont, CA) y el MS-39. Es de amplio conocimiento que en el queratocono ocurren cambios del espesor epitelial, puesto que curvaturas extremas conducen a la ruptura del epitelio, como se observa a menudo del punto de visto clínico. El adelgazamiento epitelial sobre el cono se ha demostrado mediante análisis histopatológico de córneas con queratocono (Scroggs et al.33) y, posteriormente (Haque et al.34), mediante software personalizado y un sistema de OCT HumphreyZeiss (Humphrey Systems, Dublín, California).


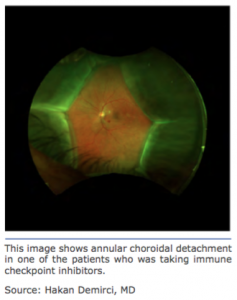 The article by Thomas et al. detailed uveal ef- fusion in three patients and is the rst report of such a risk associated with immuno¬therapy. The inhibitors taken by the patients includ- ed antiprogrammed cell death protein-1(an- ti-PD-1) and antiprogrammed cell death ligant-1 (anti-PD-L1) monoclonal antibodies. The three patients who presented to the Kel- logg Eye Center included a 68-year-old African American male with adenocarcinoma and two white men, 52 and 85 years old, respec¬- tively, who both had cutaneous melanoma.
The article by Thomas et al. detailed uveal ef- fusion in three patients and is the rst report of such a risk associated with immuno¬therapy. The inhibitors taken by the patients includ- ed antiprogrammed cell death protein-1(an- ti-PD-1) and antiprogrammed cell death ligant-1 (anti-PD-L1) monoclonal antibodies. The three patients who presented to the Kel- logg Eye Center included a 68-year-old African American male with adenocarcinoma and two white men, 52 and 85 years old, respec¬- tively, who both had cutaneous melanoma.

 En la evaluación del paciente con glauco- ma y catarata encontramos que la agudeza visual, el campo visual, la percepción del color y la sensibilidad al contraste pueden estar alteradas, siendo reversibles sólo los defectos asociados a la catarata, por lo que el compromiso en el campo visual y en la sensibilidad al contraste permanecerán afectados aún después de una cirugía de catarata exitosa, y el resultado refractivo puede no ser el deseado en los pacientes que desean menor dependencia de gafas. Por tal motivo, el oftalmólogo debe ser muy claro con las expectativas del paciente y debe conocer los benecios
En la evaluación del paciente con glauco- ma y catarata encontramos que la agudeza visual, el campo visual, la percepción del color y la sensibilidad al contraste pueden estar alteradas, siendo reversibles sólo los defectos asociados a la catarata, por lo que el compromiso en el campo visual y en la sensibilidad al contraste permanecerán afectados aún después de una cirugía de catarata exitosa, y el resultado refractivo puede no ser el deseado en los pacientes que desean menor dependencia de gafas. Por tal motivo, el oftalmólogo debe ser muy claro con las expectativas del paciente y debe conocer los benecios CAMBIOS FUNCIONALES
CAMBIOS FUNCIONALES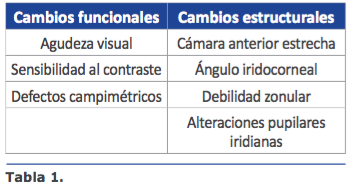 Pupila e iris:
Pupila e iris: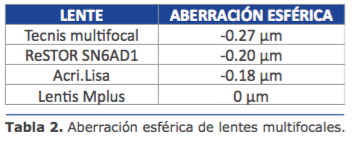 La primera LIO asférica fue comercializada en el año 2002. En la actualidad las hay con per l de asfericidad nulo y con per l asférico negativo, en aras de lograr mejoría signi cativa en la sensibilidad al contraste y disminuir los fenómenos disfotópsicos, como glare y halos. Adicionalmente se les han añadido cualidades de multifocalidad y/o toricidad.
La primera LIO asférica fue comercializada en el año 2002. En la actualidad las hay con per l de asfericidad nulo y con per l asférico negativo, en aras de lograr mejoría signi cativa en la sensibilidad al contraste y disminuir los fenómenos disfotópsicos, como glare y halos. Adicionalmente se les han añadido cualidades de multifocalidad y/o toricidad.
 3. La ablación guiada por topografía no solo tiene la ventaja de contar
3. La ablación guiada por topografía no solo tiene la ventaja de contar
 En SMILE hacemos un procedimiento realmente intraestromal, mínimamente invasivo, no hay duda de que se res- peta de una mejor manera la biomecánica corneal2, comparada con los otros procedimientos y haciendo tratamientos por debajo de 140 micras, respetamos mucho más el plexo nervioso de la córnea. Se logra el menor daño posible utilizando un solo equipo alta- mente preciso, que requiere mucho me- nos mantenimiento o condiciones ambientales menos estrictas de sala que el láser excimer. Con SMILE, además, podemos corregir miopía y astigmatismo muy por arriba del rango que frecuentemente vemos, con la posibilidad de corregir hasta 10 dioptrías de miopía y 5 dioptrías de astigmatismo.
En SMILE hacemos un procedimiento realmente intraestromal, mínimamente invasivo, no hay duda de que se res- peta de una mejor manera la biomecánica corneal2, comparada con los otros procedimientos y haciendo tratamientos por debajo de 140 micras, respetamos mucho más el plexo nervioso de la córnea. Se logra el menor daño posible utilizando un solo equipo alta- mente preciso, que requiere mucho me- nos mantenimiento o condiciones ambientales menos estrictas de sala que el láser excimer. Con SMILE, además, podemos corregir miopía y astigmatismo muy por arriba del rango que frecuentemente vemos, con la posibilidad de corregir hasta 10 dioptrías de miopía y 5 dioptrías de astigmatismo.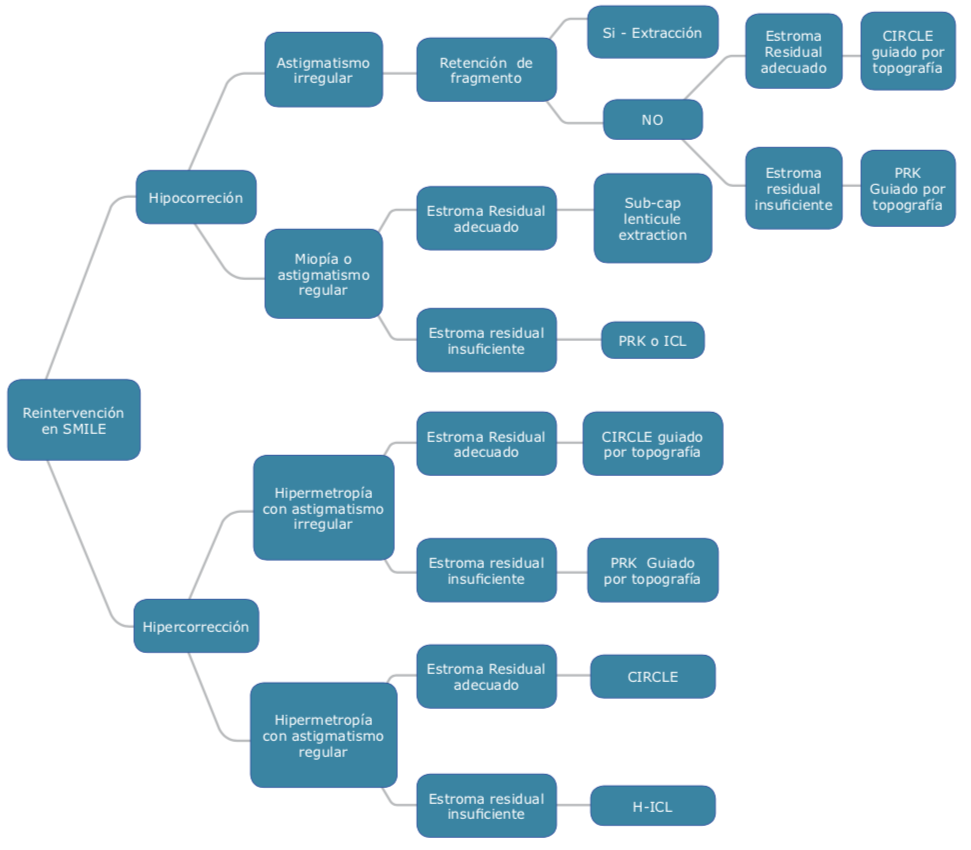 Dr. Claudio Orlich: Existe una tendencia a hipocorregir el cilindro en la mayoría de los estudios9, esto asociado a varios factores. Para mí, el más importante es la ciclo- torsión. A todos los casos con astigmatismo de 0.75 D o más los marco en la lámpara de hendidura con una aguja con tinta a las III y IX, y una vez realizada la succión, roto la interfase para que la retícula del equipo coincida con las marcas de la córnea. Esta compensación me ha permitido mejorar mucho la corrección del cilindro y alcanzar resultados similares al LASIK. En general los mejores resultados los obtengo en miopías con astigmatismos menores que la esfera. En cilindros irregulares, astigmatismos mixtos o cilindros muy altos con poca miopía, prefiero realizar un LASIK guiado por topografía.
Dr. Claudio Orlich: Existe una tendencia a hipocorregir el cilindro en la mayoría de los estudios9, esto asociado a varios factores. Para mí, el más importante es la ciclo- torsión. A todos los casos con astigmatismo de 0.75 D o más los marco en la lámpara de hendidura con una aguja con tinta a las III y IX, y una vez realizada la succión, roto la interfase para que la retícula del equipo coincida con las marcas de la córnea. Esta compensación me ha permitido mejorar mucho la corrección del cilindro y alcanzar resultados similares al LASIK. En general los mejores resultados los obtengo en miopías con astigmatismos menores que la esfera. En cilindros irregulares, astigmatismos mixtos o cilindros muy altos con poca miopía, prefiero realizar un LASIK guiado por topografía.