Faco en ametropias extremas

Dr. Daniel Badoza Argentina
Debemos considerar ametropía extrema al paciente miope, en especial con largos axiales mayores de 30 mm, o al hipermétrope con largo axial menor de 21 mm.
La facoemulsificación en las ametropías extremas suponen muchos desafíos, tanto antes, durante y luego de la cirugía. Preoperatoriamente la dificultad más frecuente está relacionada con la medición del largo axial y el cálculo de la lente intraocular. Consideramos el largo axial como la distancia entre el vértice corneal hasta la capa de fotorreceptores a nivel de la mácula.
 Durante la cirugía, debemos adaptarnos a ciertas incomodidades que presentan estos ojos en comparación con los normales, así como prevenir las descompresiones bruscas, que nos predisponen al desprendimiento de retina en los ojos muy largos o a la hemorragia supracoroidea en los muy cortos. En el seguimiento posoperatorio, debemos controlar la retina en los ojos largos.
Durante la cirugía, debemos adaptarnos a ciertas incomodidades que presentan estos ojos en comparación con los normales, así como prevenir las descompresiones bruscas, que nos predisponen al desprendimiento de retina en los ojos muy largos o a la hemorragia supracoroidea en los muy cortos. En el seguimiento posoperatorio, debemos controlar la retina en los ojos largos.
Empezaremos con los cuidados que necesitan los pacientes con ojos extremadamente largos. Como dijimos antes, la principal preocupación está dada en la medición del largo axial y el cálculo del poder de la lente intraocular.
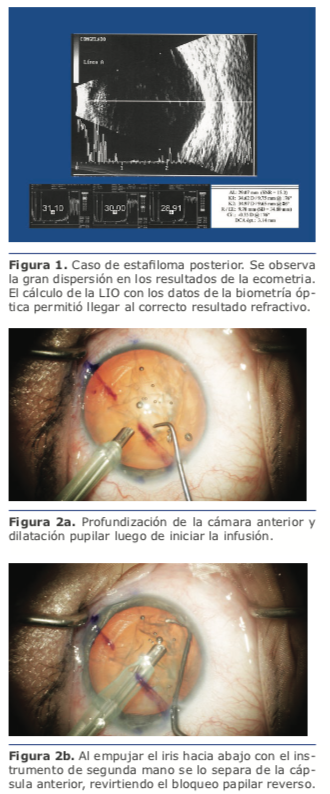
En estos casos se hace imperioso el uso de la biometría óptica para obtener mediciones precisas del largo axial. El principal motivo es la frecuente presencia de estafiloma posterior, que torna dificultosa la alineación correcta de la sonda, siendo inevitables las posiciones
oblicuas de la misma que no concuerden con el eje visual. Por el contrario, la biometría óptica, al requerir que el paciente fije en la luz del láser, permite una correcta medición del eje visual (ver figura 1).
Al calcular el poder de la lente intraocular, no todas las fórmulas son aplicables en ojos largos. Es frecuente la hipocorrección, es decir, que el paciente tenga una refracción más hipermetrópica de la que hemos intentado. Esa hipocorrección es más pronunciada cuanto mayor sea el largo axial.
Está generalizada la idea de que la fórmula más útil es la SRK/T. Si bien ésta brinda muy buenos resultados, son preferibles las fórmulas que consideran la profundidad de la cámara anterior (ACD), como, por ejemplo, las de Haigis, Barrett, Olsen y Panacea, diseñada por nuestro colega David Flikier, de Costa Rica. Tener en cuenta la ACD nos permite estimar la posición efectiva de la lente (ELP), reduciendo las chances de las sorpresas refractivas hipermetrópicas.
 Otra particularidad en el cálculo de la lente en estos ojos es que frecuentemente necesitan LIO de bajas dioptrías, y muchas veces de dioptrías negativas, las que se caracterizan por su configuración en menisco, que geométricamente son más delgadas que las biconvexas. Esto genera un cambio en la constante, por lo que debe tenerse en cuenta que, si en nuestro calculador utilizamos la constante de la versión con dioptrías positivas, la refracción intentada será distinta a la que buscamos.
Otra particularidad en el cálculo de la lente en estos ojos es que frecuentemente necesitan LIO de bajas dioptrías, y muchas veces de dioptrías negativas, las que se caracterizan por su configuración en menisco, que geométricamente son más delgadas que las biconvexas. Esto genera un cambio en la constante, por lo que debe tenerse en cuenta que, si en nuestro calculador utilizamos la constante de la versión con dioptrías positivas, la refracción intentada será distinta a la que buscamos.
Durante la cirugía de ojos largos, es posible que el cirujano no esté cómodo debido a que debe utilizar los instrumentos con una orientación más vertical de la que está acostumbrado, ya que la ACD suele ser más mayor que en los ojos normales.
Cuando se inicia o se detiene la infusión, las fluctuaciones de la ACD suelen ser amplias. Esto genera estiramientos de las fibras zonulares que pueden generar dolor, por lo que es
bueno agregar anestesia intracameral en estos casos. Es muy frecuente que el inicio de la infusión haga que el iris contacte con el anillo remanente de la cápsula anterior, generando una adhesión en los 360 grados, que provoca un bloqueo pupilar inverso. Descripto por los doctores Cionni y Osher1 como síndrome de retropulsión del cristalino y el iris (lens-iris diaphragm retropulsion syndrome), se manifiesta por un desplazamiento posterior del diafragma iridocristalineano, profundización marcada de la cámara anterior, abombamiento hacia atrás del iris, dilatación pupilar extrema (ver figura 2a), y malestar para el paciente. Para detener el bloqueo pupilar, se debe separar mecánicamente el iris de la cápsula (ver figura 2b), ya sea con la punta de faco o de I/A, o con otro instrumento desde la paracentesis. Una vez que la presión en la cámara anterior se normaliza, la posición del iris se adelanta, aunque muchas veces el diámetro pupilar se reduce con respecto al previo a la aparición del síndrome. He visto casos donde la adhesión es tan fuerte que, al resolver el bloqueo, algún sector del epitelio pigmentario del iris puede desprenderse del mismo.
La principal preocupación en el posoperatorio en los ojos con más de 30 mm de largo axial es el desprendimiento de retina (DR). Fisiopatológicamente, se cree que lo predisponen los cambios en el vítreo que se generan con las descompresiones transitorias de la cámara anterior durante la cirugía, así como la reducción del volumen ocupado por la lente intraocular, que es significativamente más delgada que el cristalino. Habría un adelantamiento de la cápsula posterior con una reducción de la protuberancia del cristalino. Este mayor espacio en el segmento posterior permitiría que el vítreo se mueva, aumentando las posibilidades de que se produzca el desprendimiento posterior de vítreo (DPV). Está demostrada la asociación entre el DPV y la aparición de desgarros retinales periféricos que pueden llevar al DR.
En ojos normales el DR afecta al 0.1 % de
los ojos sin operar con miopía mayor que −5D.2 En estudios con técnicas modernas de facoemulsificación,3,4 el DR pseudofáquico en ojos miópicos fue reportado en 1.5-2.2 % de los ojos, pero estos estudios no tuvieron grupo control.
En un estudio con gran número de pacientes a los que se les realizó la facoemulsificación en un ojo y se utilizó como grupo control el ojo no operado, se concluyó que la operación aumenta el riesgo de DR en 4.23 veces.5 En ese mismo estudio, se confirmó que la incidencia de DR, independiente del estado fáquico o pseudofáquico, es mayor en varones, miopes altos y menores de 50 años. Desafortunadamente, no se ha realizado un estudio similar limitando la población a ojos largos, por lo que no hay datos que permitan conocer con precisión la magnitud en la que la facoemulsificación aumenta el riesgo de DR en estos ojos. Por estos motivos, es necesario ser meticuloso en la prevención del DR luego de la facoemulsificación en los ojos muy largos.
En primer lugar, cuando un paciente con buena agudeza visual tolera perfectamente la lente de contacto, no se le debería aconsejar la intervención. En caso de intolerancia a las lentes de contacto, en lugar de realizar una facoemulsificación prematuramente, es preferible conservar el cristalino implantando una lente intraocular fáquica de cámara posterior, combinada con excimer en casos con miopías mayores a 17D. Recordemos que en 2018 fue aprobado el implante de EVO Visian ICL en pacientes de hasta 60 años. Es fundamental informar al paciente que el objetivo de implantar la LIO fáquica es “ganar tiempo” para que pueda corregir su miopía sin predisponer a un DPV prematuramente, con la expectativa que llegar al menos hasta los 65 años con su cristalino sin operar. De este modo, para cuando la catarata se desarrolle, el DPV ya se habría producido, reduciéndose los riesgos de DR pseudofáquico. En segundo lugar, durante la cirugía es im-
portante prevenir las fluctuaciones severas o abruptas de la profundidad de la cámara anterior, a fin de mantenerla estable. Para ello, la incisión debe ser lo más angosta que permita la máquina de faco que se esté utilizando (hoy en día hay máquinas que permiten heridas para faco microcoaxial de 1.8 mm con excelente estabilidad de cámara). Con el mismo objetivo, programe la máquina con parámetros facodinámicos lentos. Al introducir o extraer de la cámara anterior la punta de faco, es conveniente que la botella de infusión (o la presión programada en máquinas con infusión activa) esté baja.
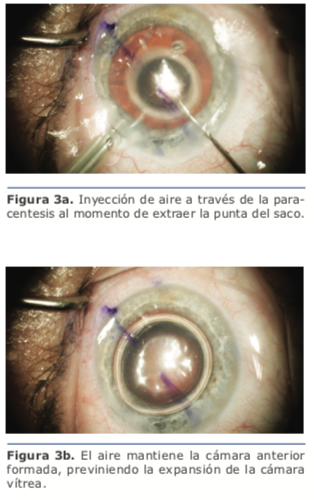
Recomiendo maniobras para mantener la cámara anterior formada en los pasos en que dejamos de tener infusión en la cámara anterior. Al terminar de emulsificar los cuadrantes, se baja la presión de infusión (o la altura de la botella) al mínimo posible, y mientras se extrae la punta a través de la incisión, se inyecta aire a través de la paracentesis (ver figura 3a y 3b). De la misma forma, al terminar la aspiración de los restos corticales y el pulido de la cápsula, se reduce la presión de infusión, pero en este paso al extraer la punta de I/A se introduce viscoelástico a través de la paracentesis, quedándonos el saco ya abierto para la implantación de la LIO. Al terminar la cirugía, luego de aspirar el viscoelástico, reducimos la presión de infusión, aflojamos el blefaróstato, y reformamos con solución balanceada la cámara edematizando la paracentesis a medida que sacamos la punta de I/A.
En cuanto a la ametropía extrema hipermetrópica, se da en ojos menores de 21 mm. Se pueden clasificar en microftalmos simple o complejo, nanoftalmos o microftalmos anterior relativo (MAR).
El concepto de microftalmos es el de un ojo con largo axial corto y segmento anterior normal, el de MAR es el de un ojo con largo axial normal y segmento anterior pequeño, mientras que el nanoftalmos es el de un ojo de menores dimensiones tanto en su largo axial como en su segmento anterior.
En cuanto al microftalmos, hay reportes disimiles en distintas poblaciones. En el Norfolk Eye Study, el microftalmos con largos axiales menores a 21 mm se presentó en el 1.2%, mientras que fue menor a 20 mm en el 0.27% de los pacientes.6
El microftalmos simple es aquel que no presenta comorbilidades oculares y en cuyo caso no hay riesgos asociados. En el microftalmos complejo, hay malformaciones asociadas en la retina y/o la coroides (por ejemplo, coloboma).
El MAR suele estar asociado a patología del segmento anterior, como ángulo estrecho, pupila pequeña, cierre angular, córnea guttata o pseudoexfoliación.7
plana, suelen presentar cristalinos de dimensiones normales o más gruesos, así como engrosamiento de la esclerótica o la coroides.
En el preoperatorio, 42 % de los casos presentan comorbilidades que limitan la visión. El glaucoma de cierre angular se presenta en el 42 % de los casos, con cierre agudo y crónicoenel23%yel19%deloscasos, respectivamente.8
Por todas estas características, en la evaluación prequirúrgica de los ojos micro o nanoftálmicos debemos prestar atención a la presión intraocular, la gonioscopia, el conteo endotelial, y la evaluación ecográfica de la coroides y la esclera.
Así como con los ojos largos, la medición del largo axial debe ser realizada mediante biometría óptica, o en su defecto, con biometría ultrasónica con técnica de inmersión. Cuando se realiza la biometría ultrasónica con técnica de contacto, la compresión ejercida con la sonda es causa de medidas erróneas del largo axial, llevando a hipercorrecciones en el cálculo de la LIO. En los ojos cortos, errores mínimos en la medida del largo axial conducen a grandes errores en el cálculo de la LIO. El error en estos ojos suele ser miópico, dando mejores resultados las fórmulas de Barrett y Olsen.9
En cuanto a las opciones de LIO, están disponibles lentes con alto poder dióptrico, o la técnica de piggy-back, en la que la segunda lente es implantada en el surco, siempre que haya una cámara anterior profunda que permita el implante. La técnica de piggy-back ofrece la ventaja de recambiar la lente anterior con facilidad en caso de sorpresa refractiva. En ese caso, multiplicando las dioptrías en el plano del anteojo por 1.5, obtendremos las dioptrías en que debemos corregir la lente del surco.
En los ojos nanoftálmicos nos encontramos con un largo axial menor a 20 mm, con distancia blanco ablancomenora11mmyACD menor a 2.2 mm. Estos ojos con dimensiones reducidas del diá metro corneal y cámara anterior ciente en cuanto a los riesgos. En los casos de
MAR, el pronóstico visual puede verse afectado por una ambliopia previa, por trauma en el iris, por ruptura capsular, por edema macular cistoide, descompensación corneal o glaucoma maligno. En los ojos nanoftálmicos, a esa lista de complicaciones debemos agregarle la efusión coroidea y la hemorragia supracoroidea.
La técnica quirúrgica nos enfrenta con ciertos desafíos en los ojos extremadamente cortos. La anestesia más recomendable es la tópica. La anestesia general puede ser necesaria en casos extremos o pacientes con ojo único. Es inconveniente la anestesia perio parabulbar debido a que puede aumentar la presión orbitaria o la de las venas epiesclerales. El balón de Honan o el masaje periocular antes de la operación puede ayudarnos a reducir la presión ocular. Se debe medicar al paciente con manitol 20 % (2 mg/kg) a fin de deshidratar el vítreo y reducir los riesgos de hipertensión de polo posterior.
Hay que estar preparados para el manejo de la pupila pequeña, así como de la cámara anterior plana. En algunos casos, puede ser necesario realizar una corevitrectomia por pars plana para ampliar la cámara, en otros se puede considerar la esclerotomía profiláctica.
En cuanto a las complicaciones, en estos ojos (en especial los nanoftálmicos) hay una incidencia mayor de trauma iridiano, desprendimiento de Descemet, edema corneal, ruptura capsular, edema macular cistoide, efusión uveal y dispersión del humor acuoso.
En conclusión, los ojos con ametropías extremas implican un desafío tanto en lo que respecta al cálculo de la lente intraocular como a la prevención y el manejo de complicaciones. La recompensa es el agradecimiento de los pacientes por la mejora en su calidad de vida que obtuvieron gracias a nuestra labor.
Referencias
Cionni RJ, Barros MG, Osher RH. Management of lens-iris retropulsion syndrome during phacoemulsification. J Cataract Refract Surg 2004;30:953-956
Burton TC. The influence of refractive error and lattice degeneration on the incidence of retinal detachment. Tr Am Ophthalm Soc 1989; 87:143-157
Alió JL. Lens surgery (cataract and refractive lens exchange) and retinal detachment risk in myopes: still an issue? Br J Ophthalmol 2011; 95:301-3
Neuhann IM, Neuhann TF, Heinmann H, et al. Retinal detachment after phacoemulsification in high myopia: analysis of 2356 cases. J Cataract Refract Surg 2008;34:1644-57
Bjerrum SS, Mikkelsen KL, La Cour M. Risk of pseudophakic retinal detachment in 202226 patients using the fellow nonoperated eye as reference. Ophthalmol 2013;120:2573-2579
Day AC, Khawaja AP, Peto T, et al. The small eye phenotype in the EPIC-Norfolk eye study: prevalence and visual impairment in microphthalmos and nanophthalmos. BMJ Open 2013;3:e003280. doi:10.1136/bmjopen-2013-003280
Nihalani BR, Jani UD, Vasavada AR, Auffarth Gu. Cataract surgery in relative anterior microphthalmos. Opthalmol 2005;112:1360-7
Steijns D, Bijlsma WR, Van der Lelij A. Cataract surgery in patients with nanophthalmos. Ophthalmology 2013;120:266–70.
Cooke DL, Cooke TL. Comparison of 9 intraocular lens power calculation formulas. J Cataract Refract Surg 2016;42:1157-1164

