Luxación tardía del complejo LIO – SACO con multifocal
Coordinador:
 Dr. Oscar Asís – España
Dr. Oscar Asís – España
oasisv@gmail.com
Panelistas:
 Dr. Juan J. Mura – Chile
Dr. Juan J. Mura – Chile
jmurac@gmail.com
 Dr. Alex León – Chile
Dr. Alex León – Chile
m.alexleon@gmail.com
Resumen:
Paciente varón, 78 años, operado de facomultis (TECNICS ZMBOO) bilateral, hace 12 años sin complicaciones. Ultimo control hace 1 año: A-V AO 20/20 lejos y J1 cerca, resto de estudios, dentro de la normalidad. Consulta, sacar la en la actualidad, por pérdida brusca de A-V OI. Al examen: A-V OI: bultos. BMC: luxación de complejo LIO–SACO.
Presentación del caso
Es un hecho, que cada vez se colocan más lentes multifocales intraoculares. Paralelamente a ello, va disminuyendo la edad de implantación de las mismas. Existe consenso en relación a que: las lentes multifocales deben indicarse en ojos sanos.
Compartiendo lo anteriormente expuesto, nos parece destacable realizar algunas salvedades. La salud ocular actual, en una persona joven, no es una condición estática, si no más bien dinámica. Partiendo de esta base, es frecuente que nos encontremos en consulta con pacientes portadores de lentes multifocales intraoculares, operados hace años, con patologías asociadas de reciente aparición como: DMAE, glaucoma, etc. La pregunta es: ¿y ahora qué?, ¿qué conducta terapéutica asumimos en estos casos? La publicación reciente de algunos trabajos, en los que se asocia multifocalidad con patología ocular, puede contribuir a solventar estas dudas.
1. Las lentes intraoculares multifocales se pueden utilizar en pacientes vítrectomizados?.1
2. Lentes intraoculares multifocales: indicaciones relativas y contraindicaciones para la implantación.2
3. Resultados a corto plazo de la vitrectomía pars plana combinada con cirugía de facoemulsificación más implante de lentes intraoculares multifocales para membranas epirretinianas.3
Con la finalidad de no extendernos, se plantea en estos artículos que la pareja: multifocalidad – patología ocular, puede ser un matrimonio no tan mal avenido.
Después de este preámbulo, expondremos el caso. Paciente varón, 78 años, operado de facocon LIO multifocal (TECNICS ZMBOO) bilateral, hace 12 años sin complicaciones. Ultimo control hace 1 año: AV AO 20/20 lejos y J1 cerca, resto de estudios, dentro de la normalidad. Consulta, en la actualidad, por pérdida brusca de AV OI. Al examen: AV OI: bultos. BMC: luxación de complejo LIO– SACO. Evaluando la cohorte de elementos que le acompañan, consideramos a este, “mi peor caso“. Paciente decide intervenirse de catarata y no depender de gafas, y al cabo de un tiempo le acontece esto. Importante destacar que sin, la medicina basada en la evidencia, no aporta ninguna luz frente a esta complicación. Ante este cuadro, se plantean dos opciones:
1. Vitrectomía con explante LIO-SACO y posterior implante de LIO, con la técnica con la que cada quien se sienta más cómodo.
2. Vitrectomía y sutura de la LIO M implantada. Optamos por la segunda opción, con la técnica que detallaremos a continuación (como puede verse en el video).
Técnica quirúrgica
1. Vitrectomía posterior 25 G por tres vías.
2. Extrusión de un háptica de la LIO por paracentesis. Con la finalidad, en casos como este, que la lente NO se precipite al fondo del ojo.
3. Anudado de dicho háptica con prolene 10-0.
4. Marcaje limbar de 2 puntos equidistantes con anillo de Méndez.
5. Incisiones conjuntivales próximas a estas marcas.
6. Esclerotomías de 1/3 del grosor escleral a 2mm perpendiculares al limbo, coincidentes con las marcas previas.
7. Sutura, con las agujas rectas de prolene en la esclerotomía contra lateral, tutelando con agujas 27G.
8. Extrusión de la 2o háptica y, con prolene enhebrado por paracentesis contralateral, se anuda nuevamente dicha háptica.
9. Se procede a suturarlo como ya se ha explicado.
10. Marcaje del centro geométrico de la córnea, con la finalidad de hacerlo coincidir con el anillo central de la LIO.
11. Tracción de ambas suturas para centrar la len- te, posteriormente se anudan los cabos y se en- tierran los nudos.
13. Extracción de trócares.
14. Se cierra conjuntiva con inyección intrateno- niana de antiinflamatorio.
La evolución post-quirúrgica de este caso ha sido muy buena, habiendo recuperado el paciente su AV.
1. ¿Qué hubieran hecho ante ese caso?
Dr. Juan J. Mura:
1. Levantar el borde de la rhexis, se puede usar una espátula plana o una aguja (con el bi- sel apuntando hacia abajo) conectada a una jeringa con OVD.
3. Separar el resto de la rhexis de la cara anterior del LIO y reformar el saco con OVD. Al mismo tiempo ir ubicando ganchos de Grieshaber para estabilidad.
4. Una vez que tengamos liberada la rhexis en 360o utilizaría 2 segmentos de Ahmed 6D para fijar el saco con sutura de GoreTex 8-0.
5. Para ello ubico el primer segmento al frente (hora 6 ó 7) y lo fijo con un gancho de Grieshaber en el eyelet.
6. Luego ubico el segundo segmento de Ahmed en hora 12 ó 1 con el GoreTex pasado por el eyelet. Creo espacio con OVD dispersivo y luego cohesivo. Peritomia y 2 esclerotomías con cuchillete 25G (MVR) a 2 mm del limbo.
7. Con pinza de Snyder MST (25G) tomo primero un cabo del GoreTex y lo externalizo por la esclerotomía. Luego repito la maniobra con el segundo cabo.
8. Mismo procedimiento para el segundo segmento.
9. Para evitar el tilt, el GoreTex de las 12-1 lo paso por encima del eyelet a la derecha y el GoreTex del segmento 6-7 lo paso por encima el eyelet a la izquierda; con eso equilibro las tensiones. El hacerlo con GoreTex, tomando las precauciones descritas evita en gran medida que se produzca tilt del LIO.
REFERENCIAS
- Bussa, John J. Multifocal IOLs can be used in post-vitrectomy patients. Ocular Surgery News U.S Edition. 2014
- Braga-Mele R, Chang D, Dewey S, et al. Multifocal intraocular lenses: relative indications and contrain- dications for implantation. J Cata- ract Refract Surg. 2014;40(2):313-322. doi:10.1016/j.jcrs.2013.12.011
- Patel, Sunny B et al. “Short-term outcomes of combined pars plana vitrectomy for epiretinal membra- ne and phacoemulsification surgery with multifocal intraocular lens im- plantation.” Clinical ophthalmology (Auckland, N.Z.) vol. 13 723-730. 23 Apr. 2019, doi:10.2147/OPTH.S195928


 Dr. Víctor L Pérez – EE.UU.
Dr. Víctor L Pérez – EE.UU. Dr. Matías Soifer – EE. UU.
Dr. Matías Soifer – EE. UU.









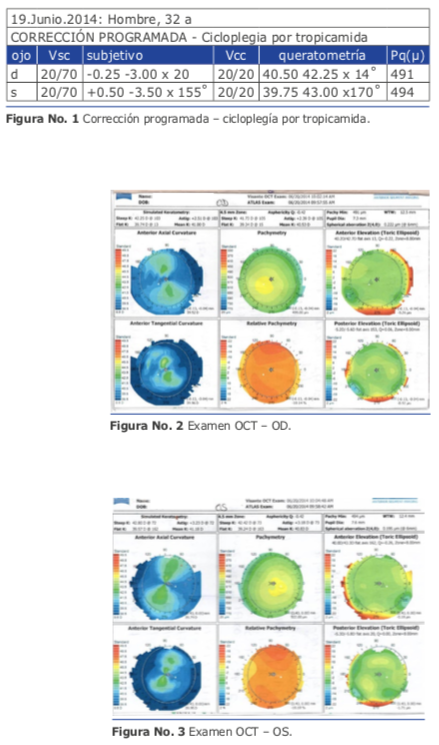 Mi peor caso de cirugía refractiva lo padecí con un hombre de 32 años que en el año 2014 me consultó para la corrección de un astigmatismo miópico elevado que habitualmente debe corregirse con Femto Láser y zona óptica grande, pero en este caso, presentaba córneas de menos de 500 micras. Usé el Excimer AMARIS 750 de Schwind. Tenía buena experiencia con la técnica de TransPRK con Mitomicina C y en las ventajas de la nueva tecnología de “smart pulse”. Realicé una ablación corneal de ambos ojos siguiendo los pasos habituales que dictaba mi experiencia:
Mi peor caso de cirugía refractiva lo padecí con un hombre de 32 años que en el año 2014 me consultó para la corrección de un astigmatismo miópico elevado que habitualmente debe corregirse con Femto Láser y zona óptica grande, pero en este caso, presentaba córneas de menos de 500 micras. Usé el Excimer AMARIS 750 de Schwind. Tenía buena experiencia con la técnica de TransPRK con Mitomicina C y en las ventajas de la nueva tecnología de “smart pulse”. Realicé una ablación corneal de ambos ojos siguiendo los pasos habituales que dictaba mi experiencia: El resultado al cabo de 1 mes fue muy bueno (Ver figura 10). La visión sin corrección mejoró 4 líneas (de 20/80 a 20/30). Pero lamentablemente el efecto logrado se perdió totalmen- te en 3 meses.
El resultado al cabo de 1 mes fue muy bueno (Ver figura 10). La visión sin corrección mejoró 4 líneas (de 20/80 a 20/30). Pero lamentablemente el efecto logrado se perdió totalmen- te en 3 meses.
 Durante la cirugía la paciente resultó muy aprensiva. El ojo derecho logró operarse sin inconvenientes, pero en la cirugía del ojo izquier do colapsó emocionalmente (Ver vídeo).
Durante la cirugía la paciente resultó muy aprensiva. El ojo derecho logró operarse sin inconvenientes, pero en la cirugía del ojo izquier do colapsó emocionalmente (Ver vídeo).

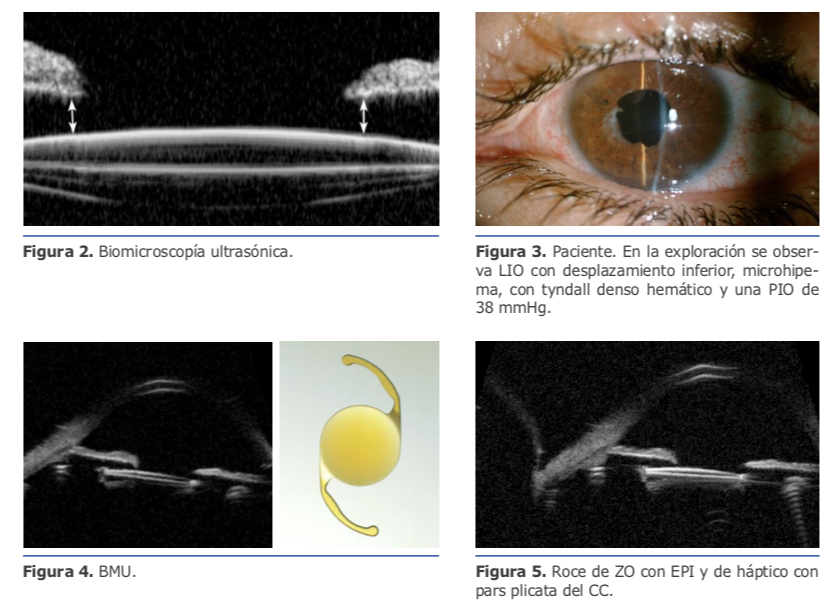
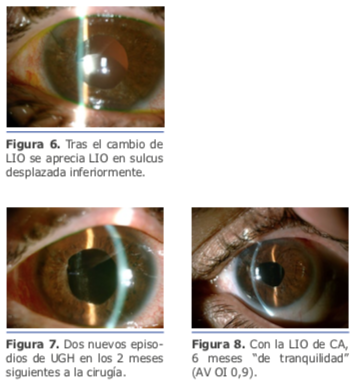 La sustitución de lente monobloque por una de 3 piezas no fue suficiente para una estabilización adecuada de la lente.
La sustitución de lente monobloque por una de 3 piezas no fue suficiente para una estabilización adecuada de la lente.