Conceptos imprescindibles sobre segmento posterior para segmentistas anteriores

Prof. Dr. Marcelo Zas
marcezas@gmail.com
Resumen:
La cirugía de catarata con facoemulsificación e implante de LIO y la aplicación de drogas antiangiogénicas intravítreas constituyen los dos procedimientos intraoculares más frecuentes en la práctica oftalmológica, seguidas por las cirugías de glaucoma y las queratoplastias modernas.
Todos estos actos quirúrgicos pueden generar morbilidad en el segmento posterior; estas posibles complicaciones pueden ser leves, moderadas o graves dependiendo de las condiciones clínicas y preoperatorias del paciente, del acto quirúrgico en sí y del adecuado seguimiento posoperatorio.
Hoy contamos con gran cantidad de tecnología para realizar en el preoperatorio una rigurosa evaluación del estado del humor vítreo, la retina central y periférica, el epitelio pigmentario retinal y la interfase vitreo-macular; estos parámetros son los que determinarán el resultado visual posoperatorio.
Hoy contamos con gran cantidad de tecnología para realizar en el preoperatorio una rigurosa evaluación del estado del humor vítreo, la retina central y periférica, el epitelio pigmentario retinal y la interfase vitreo-macular; estos parámetros son los que determinarán el resultado visual posoperatorio.
El cirujano de segmento anterior debe contar con esta tecnología para evaluar y decidir el mejor acto quirúrgico dependiendo de cada caso.
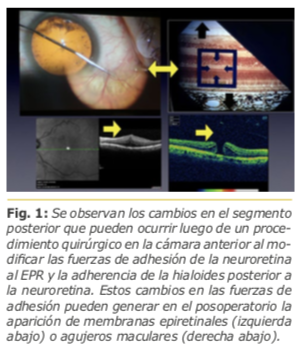
Los procedimientos quirúrgicos que involucran a la cámara anterior, por ejemplo, la facoemulsificación con implante de LIO, pueden modificar las fuerzas de adherencia o tracción vitreoretinales anteroposteriores y/o tangenciales como así también el estado físico-químico del humor vítreo.
Estos cambios pueden generar en el posoperatorio patologías de la interfase vítreo-macular, como la aparición de membranas epiretinales o agujeros maculares. Fig. 1
Asimismo, estos fenómenos pueden generar en el posoperatorio un desprendimiento posterior del vítreo (DPV) permitiendo posibles desgarros y/o desprendimientos de retina regmatógenos en el posoperatorio, aún en casos de cirugías de catarata no complicadas.
Es por esto que el estudio con el SD-OCT en el preoperatorio de facoemulsificación es de relevancia para evaluar la integridad de la interfase vítreo-macular, así como una adecuada realización de fondo de ojo documentada mediante fotografía panorámica.
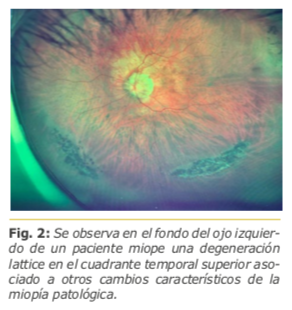
Ripandelli y colaboradores1 evaluaron 453 pacientes emétropes con 5 años de seguimiento luego de una cirugía de catarata, en la cual la tasa de desprendimiento de retina (DR) llegó al 3.1%. De este grupo de pacientes que presentó DR, un 7.4% había desarrollado un DPV en el postoperatorio, en comparación con un 1.1% de pacientes que ya presentaban un DPV en el preoperatorio. Los autores concluyen que la relación entre el DR y la cirugía de catarata se relaciona en forma directa con la génesis del DPV en el posoperatorio y más aún si el paciente presenta una o más degeneraciones lattice. Fig. 2. Un dato importante a resaltar en este estudio es que la edad del paciente no sería un factor de riesgo para la aparición de DR.
Hilford y colaboradores2 evaluaron 149 pacientes durante 77 meses de seguimiento y la tasa de DR posoperatoria llegó a un 4%. La tasa del DPV fue de 50.8% en los pacientes operados, en comparación con un 20% en los ojos no operados. Según estos autores sí habría una relación con la edad del paciente, en la cual a menor edad (menores de 60 años) la tasa de DR llega un 6%, versus un 0.6% en pacientes mayores de 70 años.
Las tres complicaciones más graves de la cirugía de catarata en el segmento posterior son la endoftalmitis posoperatoria, el síndrome de Irvine-Gass o edema macular pseudofáquico, y el DR pseudofáquico.
El DR pseudofáquico tiene como principales factores de riesgo a los ojos que presenten un largo axil de más de 26 mm (miopes), sexo masculino, antecedentes de DR en el ojo contralateral, ruptura de la cápsula posterior con pérdida de vítreo y presencia de degeneración lattice.
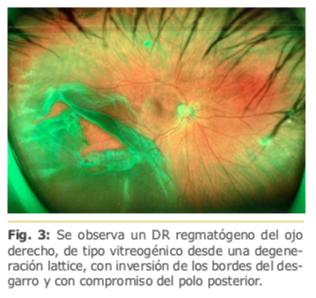
Esta forma de DR se caracteriza por presentar roturas retinales más periféricas, habitualmente en la inserción posterior de la base vítrea, son más extensos, menos sintomáticos que los DR fáquicos, rápidamente evolutivos -comprometiendo el polo posteriory presentan una mayor tendencia a desarrollar una proliferación vitreoretinal o PVR. Fig. 3.
En el intraoperatorio presentan una visualización de la cavidad vítrea más difícil, ya que pueden acompañarse de pupila pequeña o con mala dilatación y/o lente intraocular con restos corticales, lo que hace que estos casos constituyan un desafío para el cirujano vitreoretinal.
Conclusiones:
• La facoemulsificación modifica el estado físico y químico del humor vítreo.
• La miopía benigna y la miopía patológica tienen per se una historia natural de la enfermedad con un mayor riesgo de DR.
• El DR tiene una prevalencia de 1/10000 habitantes por año en la población general, pero es 10 veces más frecuente en la población miope.
• Siempre se debe ser claro con las expectativas visuales del paciente previamente a la cirugía de catarata, realizando una rigurosa evaluación del segmento posterior e interfase vítreo-macular con el SD-OCT junto a una rigurosa observación y documentación panorámica del fondo de ojo.
• El DR pseudofáquico constituye un desafío quirúrgico para el cirujano vitreoretinal por presentar mayor tasa de complicaciones (PVR) que el DR fáquico.
REFERENCIAS BIBLIOGRÁFICAS:
- Ripandelli G, Coppé AM, Parisi V, Olzi D, Scassa C, Chiaravalloti A, Stirpe M. Posterior vitreous de- tachment and retinal detachment after cataract surgery. Ophthalmology. 2007 Apr;114(4):692-7. doi: 10.1016/j.ophtha.2006.08.045. Epub 2007 Jan 17. PMID: 17208303.
- Hilford, D., Hilford, M., Mathew, A. et al. Pos- terior vitreous detachment following cataract surgery. Eye 23, 1388–1392 (2009). Published: 05 September 2008
- Hikichi T, Yoshida A. Time course of develop- ment of posterior vitreous detachment in the fellow eye after development in the first eye. Ophthalmology. 2004 Sep;111(9):1705-7. doi: 10.1016/j.ophtha.2004.02.015. PMID: 15350326.
- Alio JL, Grzybowski A, El Aswad A, Romaniuk D. Refractive lens exchange. Surv Ophthalmol. 2014 Nov-Dec;59(6):579-98. doi: 10.1016/j.sur- vophthal.2014.04.004. Epub 2014 May 9.













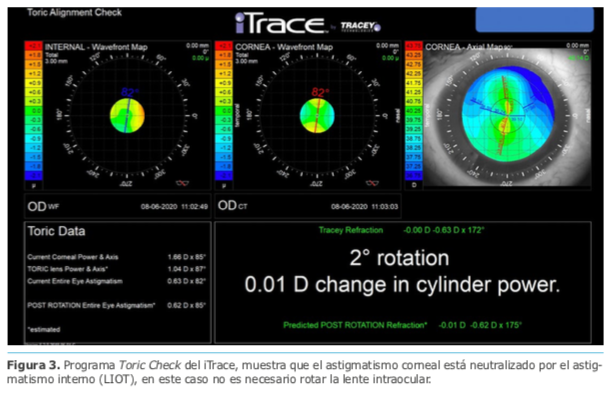
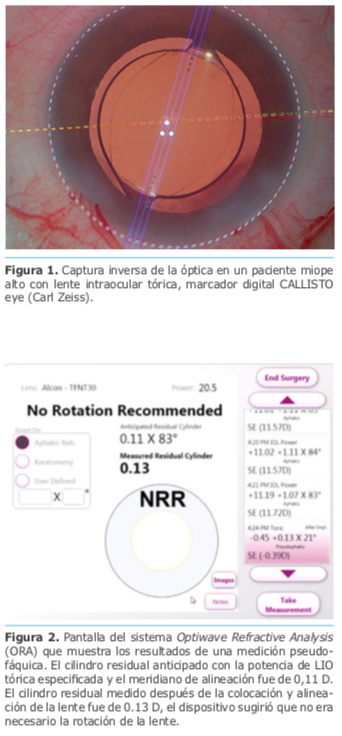



 Dr. Luis Zunino – Argentina
Dr. Luis Zunino – Argentina Dra. Eliana Acosta – Argentina
Dra. Eliana Acosta – Argentina