Opacidad de lente intraocular transoperatorio
Coordinadores
Dr. Oscar Guerrero Berger – México
Dr. Samuel Josué Ávalos – México
Panelistas
Dr. Eduardo Viteri – Ecuador
Dr. Arnaldo Espaillat – Rep. Dominicana
Propósito: Presentar un caso clínico en el que se realiza una facoemulsificación convencional con colocación de lente intraocular tórico que presenta una opacificación al colocarlo.
Antecedentes: Los materiales de los lentes intraoculares han evolucionado con los años, haciéndolos más compatibles con las estructuras oculares, más resistentes y con mayor capacidad de deformación para ser introducidos por incisiones pequeñas. Sin embargo, existen casos en los que estos materiales pueden sufrir un cambio en su conformación, causando reducción visual en el paciente de forma transitoria o no, dependiendo del caso.
Presentación de caso: Se trata de un paciente masculino de 55 años de edad en quien se realiza facoemulsificación. Al colocar el lente intraocular en bolsa capsular se observa una opacidad densa central, por lo cual se decidió retirarlo en el mismo tiempo quirúrgico y posteriormente colocar un nuevo lente en un segundo tiempo.
Conclusiones: Además de conocer los biomateriales que se utilizan para fabricar los lentes intraoculares y su compatibilidad con las estructuras oculares, se deben seguir las indicaciones de los fabricantes para conocer los posibles efectos adversos que puedan presentar.
Introducción:

 Los materiales de los lentes intraoculares que se implantan en el mundo son diversos y con propiedades físicas específicas. Algunos de estos materiales pueden sufrir una pérdida de su transparencia secundaria a estímulos diversos.
Los materiales de los lentes intraoculares que se implantan en el mundo son diversos y con propiedades físicas específicas. Algunos de estos materiales pueden sufrir una pérdida de su transparencia secundaria a estímulos diversos.
La etiología de la opacificación de algunos lentes es múltiple, siendo bien estudiado que los lentes de acrílico presentan una incidencia muy baja en esa materia. Sin embargo, se ha demostrado que algunos lentes de acrílico pueden calcificarse con el paso del tiempo.1-4
La exposición de los lentes de acrílico hidrofílicos a aire o gas pueden generar su opacificación. Está documentada la opacificación de estos lentes después de realizar queratoplastias endoteliales al realizar tamponade con gas en cámara anterior.5, 6
El 11.3 % de la tasa de explante de lentes intraoculares se debe a opacidad, siendo la tercera causa de explante de lente intraocular.7 Es por ello que debe decidirse el material correcto para cada caso.
Si bien, usualmente la opacidad del lente intraocular se presenta después de meses o años del posoperatorio, presentamos un caso en el cual el lente intraocular se vuelve opaco inmediatamente después de su introducción en el segmento anterior al terminar la facoemulsificación.
Caso clínico:
En el año 2015 se revisó un paciente masculino de 55 años de edad que acudió por presentar catarata de ojo izquierdo. A la exploración física presentó: ojo izquierdo con agudeza visual de 20/400 que corrige a 20/60 con una refracción de +4.00: -6.25 x 0o, compatible con un astigmatismo mixto sin datos de ectasia.
Los párpados y anexos sin alteraciones, córnea clara, cámara anterior formada con catarata LOCSIII de NO2 NC2 C1 P1, fondo de ojo sin alteraciones. Las queratometrías por interferometría son 39.0 x 6 / 45.5 x 96, y EKR Pentacam presenta valores de 40.2 x 14 / 43.3 x 104.
Se decide realizar facoemulsificación de ojo izquierdo con colocación de lente intraocular tórico monofocal, eligiendo la plataforma AT TORBI 709M para este caso. Se realiza el calculo de lente intraocular, sugiriendo emetropía con un valor de sph +22.50 con cyl +4.50 a 103o.
Se realiza una facoemulsificación con ino cisión de 2.2 mm a 135 grados, con técnica convencional sin complicaciones. a Durante la toma y la colocación del lens te intraocular en su respectivo cartucho s el mismo se encuentra transparente (ver figura 1). Sin embargo, al colocar el lente AT TORBI 709M dentro de la bolsa capsular, se observa que se forma inmediatamente una opacidad central de color blanco, de aspecto difuso aparentemente en el interior del lente. Al aspirar el viscoelástico y tocar el lente con la punta de irrigación y aspiración, ésta no desaparece (ver figura 2).
Se decide retirar el lente intraocular debido a que se desconoce la etiología de tal opacidad. Para ello, se realiza un corte a la mitad del lente en plato y se retira por la incisión principal (ver figura 3). En un segundo tiempo quirúrgico, se implanta un nuevo lente intraocular de la misma plataforma el cual no presenta ninguna alteración.
Discusión:
Este caso fue presentado en el año 2015 cuando los lentes tóricos de plato se introdujeron de manera importante al mercado. El personal hospitalario almacenó el viscoelástico y el lente intraocular en un mismo paquete, dentro de refrigerador a +2 oC. Minutos antes de la cirugía el paquete fue llevado a la sala quirúrgica para su inmediata utilización. En ese año no se tenía conocimiento de este fenómeno térmico asociado a este tipo de lentes intraoculares.
En la literatura se encuentran pocos reportes de opacidad transitoria del lente intraocular. Los lentes AT TORBI 709M se componen de acrílico hidrofílico (25 % de agua) con recubrimiento hidrofóbico almacenados en solución salina balanceada. Tyagi et al. reportaron opacidad transitoria en lentes hidrofílicos después de pasarlos de temperaturas debajo de 0 oC a 20 oC la cual desapareció después de 3 horas de implantarse, sin presentar cambios en la geometría o química del lente.8
También se ha reportado que el lente intraocular AT LISA Tri 839mp, el cual se compone igualmente de acrílico hidrofílico (25 %) con superficie hidrofóbica, presentó opacidad inmediata al pasarlo de un medio ambiente de -3 oC a las estructuras oculares, el cual permaneció con esta opacidad por 1 hora hasta que se retiró.9
Un caso similar fue reportado por Gutierrez et al., quienes observaron una condensación transitoria de 24 horas en un lente intraocular hidrofílico, que fue relacionado con la temperatura ambiente.10 Se ha propuesto que las opacidades se forman por condensaciones del agua con los cambios de temperatura.11
Aunque los nuevos materiales de lentes intraoculares hidrofílicos contienen una superficie hidrofóbica, también se ha documentado que estos lentes pueden tener depósitos de fosfato de calcio.12
El instructivo proporcionado por la casa comercial recomienda almacenar en un ambiente de 20 oC, lo cual puede prevenir que se presente una opacidad reversible al pasar de una temperatura baja a una temperatura ambiente de forma abrupta.
Conclusión
Los lentes hidrofílicos con cubierta hidrofóbica pueden presentar opacificación transitoria debido a la condensación de moléculas de agua secundaria a cambios de temperatura. Esta opacidad es transitoria y resuelve en horas de acuerdo con los casos publicados. A saber de los autores, este es el único caso reportado en donde el lente intraocular tórico AT TORBI 709M presenta dichos cambios relacionados con la temperatura. Por lo tanto, antes de retirar un lente intraocular por una opacidad transquirúrgica, debe descartarse que no haya sido previamente almacenado a temperaturas bajas.
Preguntas relacionadas con el caso
1. ¿Qué consideraciones se deben tomar en cuenta a nivel hospitalario/clínico para el adecuado control de calidad del manejo de lentes intraoculares?
Dr. Eduardo Viteri: En los primeros años de implante de lentes intraoculares su manejo era relativamente sencillo, pues las diferencias eran únicamente el poder dióptrico y el sitio de implante, los cuales eran de fálente que se va a implantar en ese momento.
En la medida de lo posible sería recomendable limitar la cantidad de proveedores, modelos y materiales de lentes intraoculares. Definir los proceasos de procuraduría y asegurarse de
conocer las peculiaridades de cada tipo de lente, especialmente de los “custom made” y lentes de uso poco frecuente o nuevas marcas.
Finalmente, la correcta identificación del modelo, diseño y poder del lente a implantar en cada ojo es responsabilidad ineludible del cirujano. Una simple medida de seguridad para reducir la posibilidad de errores en la implantación consiste en que el único lente que se permite en nuestro quirófano es
Dr. Arnaldo Espaillat: Los lentes intraoculares deben ser almacenados según la marca (fabricante), tipo de lente (monofocal, bifocal, trifocal, foco extendido, monofocal de foco extendido, de implante en el sulcus) y según el poder dióptrico del lente. Además, se deben seguir las instrucciones del fabricante en cuanto a su condición de almacenamiento relacionado a la temperatura. También se debe tener condiciones estables de humedad en el lugar de almacenamiento.
2. ¿Qué otros fenómenos inesperados han experimentado con cualquier modelo de lentes intraoculares?
Dr. Eduardo Viteri: Aunque personalmente he sido muy conservador en los lentes intraoculares que he implantado, resultó inesperada la aparición tardía de glistening en lentes de cil identificación. En la medida en que
la tendencia a individualizar el lente de acrílico hidrofóbico que, aunque todavía no me ha llevado a cambiar lentes, considero que afecta la calidad visual, especialmente con lentes multifocales.
En nuestro medio son muy pocos los casos de lentes intraoculares opacos que he visto o se han reportado. Hasta donde conozco se debieron principalmente a pequeños lotes de lentes de bajo costo que ocasionalmente se han traído del exterior a título personal.
Dr. Arnaldo Espaillat: Con el lente intraocular CT Lucia 601, de la casa Zeiss, tuve sorpresas refractivas hipermetrópicas (algunas de hasta de 2 dioptrías de equivalentes esférico) en el posquirúrgico temprano (primera semana) y que entre la tercera y cuarta semana se reducía a la mitad. Eso ocurrió en siete casos de un total de 29 implantados. La compañía Zeiss, luego de enviarle toda la documentación en la que le demostraba los datos biométricos, fórmulas de cálculos de poder dióptrico utilizadas, pruebas de exámenes oftalmológicos donde demostraba que no eran casos asociados a ninguna patología oftalmológica preni posquirúrgica, ni en donde hubiera ocurrido ninguna complicación en el transo posquirúrgico, reconoció de que se debía al diseño de angulación de 5 grados de sus hápticas lo cual podía producir “en casos muy específicos” que tomara unos días en lograr su posición efectiva final. Nunca más volví a implantar ese lente intraocular.
Bibliografía
- Bompastor-Ramos, P., Póvoa, J., Lobo, C., Rodriguez, A. E., Alió, J. L., Werner, L., & Murta, J. N. (2016). Late postoperative opacification of a hydro- philic–hydrophobic acrylic intraocular lens. Journal of Cataract & Refractive Surgery, 42(9), 1324–1331.
- Yang Y, Peng M, Duan Y, Huang X, Li K, Lin D. Opacification of a Hydrophilic Acrylic Intraocular Lens. J Coll Physicians Surg Pak. 2017 Mar;27(3):S58-S60.
- Tehrani M, Mamalis N, Wallin T, Dick HB, Stoffelns BM, Olson R, Fry LL, Clifford WS. Late postoperative opacification of MemoryLens hydrophilic acrylic in- traocular lenses; case series and review. J Cataract Refract Surg 2004; 30:115–122
- Mojzis P, Studeny P, Werner L, Piñero DP. Late opa- cification of a hydrophilic acrylic intraocular lens in Europe. Eur J Ophthalmol. 2016 Feb 15;26(2):e24-6
- Mojzis, P., Studeny, P., Werner, L., & Piñero, D. P. (2016). Opacification of a hydrophilic acrylic intrao- cular lens with a hydrophobic surface after air in- jection in Descemet-stripping automated endothe- lial keratoplasty in a patient with Fuchs dystrophy. Journal of Cataract & Refractive Surgery, 42(3), 485–488.
- Ahad MA, Darcy K, Cook SD, Tole DM. Intraocular lens opacification after descemet stripping au- tomated endothelial keratoplasty. Cornea 2014; 33:1307–1311
- Fernández-Buenaga R, Alio JL, Muñoz-Negrete FJ, et al. Causes of IOL explantation in Spain. Eur J Ophthalmol. 2012;22:762‒768.
- Tyagi, P., Shah, N., & Jabir, M. (2011). Intraoperative clouding of a posterior chamber intraocular lens. International Ophthalmology, 31(6), 483–484. doi:10.1007/s10792-011-9481-5.
- Liu Q, Zhang S, Wang X, Cao W, Jia Y. Acute clouding of trifocal lens during implantation: a case report. BMC Ophthalmol. 2017;17(1):242.
- Gutierrez L, Rodríguez P, García DA. Intraoperative Opacification of a hydrophilic acrylic with hydropho- bic surface IOL with spontaneous resolution in 24 hours. J Refract Surg. 2013 May;29(5):360-2.
- Kato, K., Nishida, M., Yamane, H., Nakamae, K., Tagami, Y., & Tetsumoto, K. (2001). Glistening for- mation in an AcrySof lens initiated by spinodal de- compositionof the polymer network bytemperatu- re change. Journal of Cataract & Refractive Surgery, 27(9), 1493–1498.
- Gartaganis SP, Prahs P, Lazari ED, Gartaganis PS, Helbig H, Koutsoukos PG, Calcification of Hydrophilic Acrylic Intraocular Lenses with a Hydrophobic Surface: Laboratory Analysis of 6 Cases, American Journal of Ophthalmology (2016).









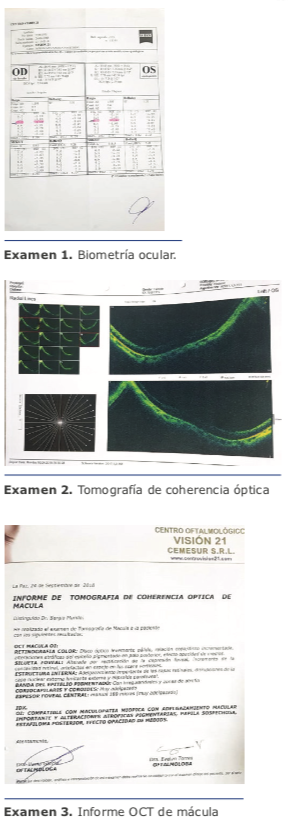
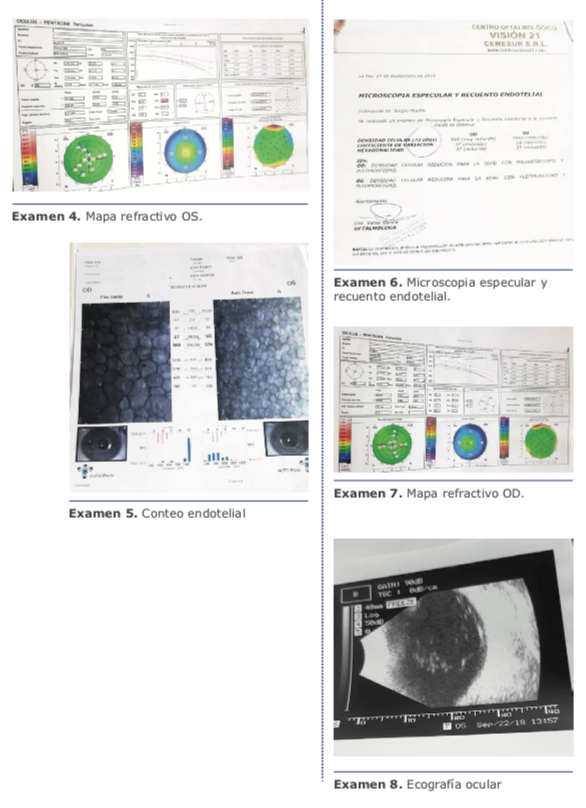 Biomicroscopía, córnea clara, CA formada,
Biomicroscopía, córnea clara, CA formada,

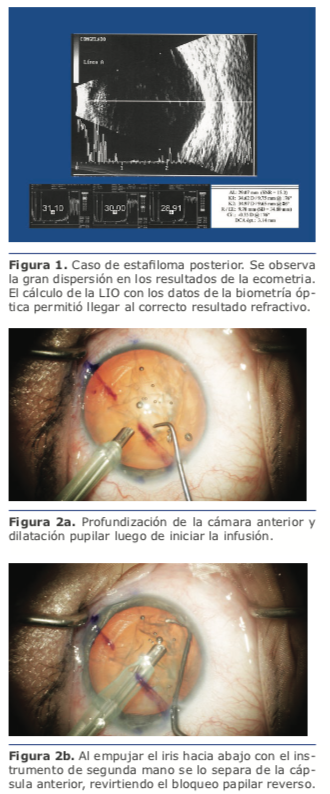 Durante la cirugía, debemos adaptarnos a ciertas incomodidades que presentan estos ojos en comparación con los normales, así como prevenir las descompresiones bruscas, que nos predisponen al desprendimiento de retina en los ojos muy largos o a la hemorragia supracoroidea en los muy cortos. En el seguimiento posoperatorio, debemos controlar la retina en los ojos largos.
Durante la cirugía, debemos adaptarnos a ciertas incomodidades que presentan estos ojos en comparación con los normales, así como prevenir las descompresiones bruscas, que nos predisponen al desprendimiento de retina en los ojos muy largos o a la hemorragia supracoroidea en los muy cortos. En el seguimiento posoperatorio, debemos controlar la retina en los ojos largos.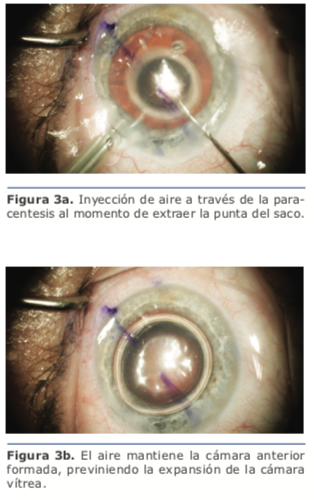 Otra particularidad en el cálculo de la lente en estos ojos es que frecuentemente necesitan LIO de bajas dioptrías, y muchas veces de dioptrías negativas, las que se caracterizan por su configuración en menisco, que geométricamente son más delgadas que las biconvexas. Esto genera un cambio en la constante, por lo que debe tenerse en cuenta que, si en nuestro calculador utilizamos la constante de la versión con dioptrías positivas, la refracción intentada será distinta a la que buscamos.
Otra particularidad en el cálculo de la lente en estos ojos es que frecuentemente necesitan LIO de bajas dioptrías, y muchas veces de dioptrías negativas, las que se caracterizan por su configuración en menisco, que geométricamente son más delgadas que las biconvexas. Esto genera un cambio en la constante, por lo que debe tenerse en cuenta que, si en nuestro calculador utilizamos la constante de la versión con dioptrías positivas, la refracción intentada será distinta a la que buscamos.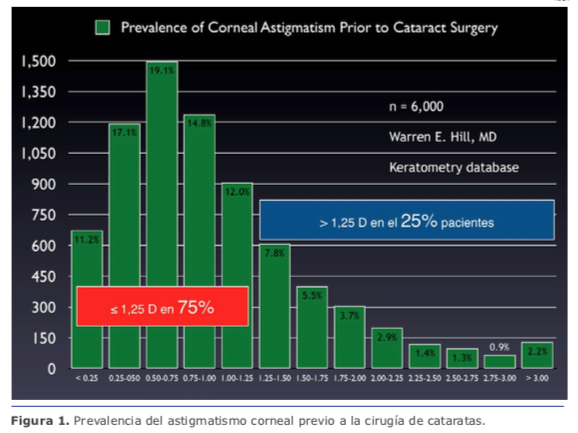

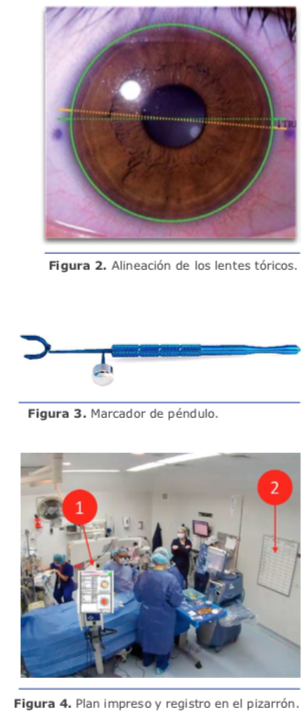 Con esto, como fue mencionado, tenemos resuelto el 75 % de los astigmatismos. En mi práctica, las ILR no son una alternativa en astigmatismos ≥1.50 D (la regresión es casi de regla). Para esos casos, recomiendo lentes intraoculares tóricos.
Con esto, como fue mencionado, tenemos resuelto el 75 % de los astigmatismos. En mi práctica, las ILR no son una alternativa en astigmatismos ≥1.50 D (la regresión es casi de regla). Para esos casos, recomiendo lentes intraoculares tóricos. Durante mucho tiempo la recomendación fue determinar nuestro astigmatismo quirúrgi- co inducido (SIA) considerando un valor absoluto y no un vector como realmente debemos hacerlo. Actualmente la recomendación es utilizar el valor de centroide de 0.1 de SIA en el calculador de Barrett para los cirujanos que operan por temporal, lo que brinda resultados consistentes, con muy poca variación, incluso utilizando incisiones de tamaño variable entre 2.20 mm y 2.75 mm.
Durante mucho tiempo la recomendación fue determinar nuestro astigmatismo quirúrgi- co inducido (SIA) considerando un valor absoluto y no un vector como realmente debemos hacerlo. Actualmente la recomendación es utilizar el valor de centroide de 0.1 de SIA en el calculador de Barrett para los cirujanos que operan por temporal, lo que brinda resultados consistentes, con muy poca variación, incluso utilizando incisiones de tamaño variable entre 2.20 mm y 2.75 mm. Dicho esto, para astigmatismos entre 1.5 D y 4.25 D (desde 0.4 D en astigmatismo ATR, pues recordemos que debemos invertirlo a 0.4 WTR), en lo personal utilizo la plataforma Acrysof® Toric. Con este grupo de pacientes, agregamos un 24 % de los casos, con lo que tenemos cu-
Dicho esto, para astigmatismos entre 1.5 D y 4.25 D (desde 0.4 D en astigmatismo ATR, pues recordemos que debemos invertirlo a 0.4 WTR), en lo personal utilizo la plataforma Acrysof® Toric. Con este grupo de pacientes, agregamos un 24 % de los casos, con lo que tenemos cu-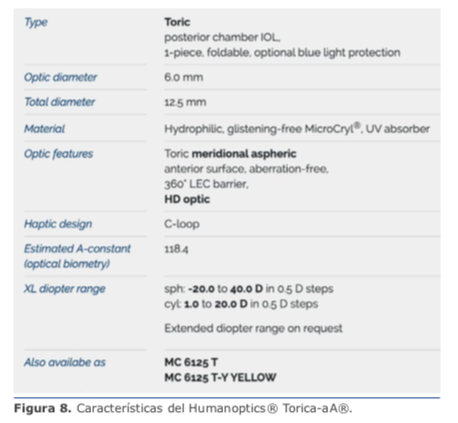 cional del LIO producto del diámetro del saco capsular es importante saber que contamos con el anillo endocapsular (CTR) de Henderson, manufacturado por FCI® MR-10C (https://fci-ophthalmics.com/pro- ducts/henderson-ctr) y Morcher® Eyejet CTR type 10C (http://www. morcher.com/nc/en/products/cap- sular-rings.html). Este CTR fue diseñado para facilitar la aspiración de la corteza, pero dado su diseño se puede utilizar para entregar soporte adicional al LIO y evitar movimientos posteriores. Ver figura 11.
cional del LIO producto del diámetro del saco capsular es importante saber que contamos con el anillo endocapsular (CTR) de Henderson, manufacturado por FCI® MR-10C (https://fci-ophthalmics.com/pro- ducts/henderson-ctr) y Morcher® Eyejet CTR type 10C (http://www. morcher.com/nc/en/products/cap- sular-rings.html). Este CTR fue diseñado para facilitar la aspiración de la corteza, pero dado su diseño se puede utilizar para entregar soporte adicional al LIO y evitar movimientos posteriores. Ver figura 11. La capsulorrexis debe cubrir 0.50 mm a 0.75 mm del borde del LIO en 360o, de tal forma que podamos prevenir el descentramiento, la capsulofimosis y las opacidades capsulares posteriores. Al quedar parte del LIO descubierto, se pueden ver rápidamente desplazamientos de la óptica que comprometen significativamente los resultados.
La capsulorrexis debe cubrir 0.50 mm a 0.75 mm del borde del LIO en 360o, de tal forma que podamos prevenir el descentramiento, la capsulofimosis y las opacidades capsulares posteriores. Al quedar parte del LIO descubierto, se pueden ver rápidamente desplazamientos de la óptica que comprometen significativamente los resultados.

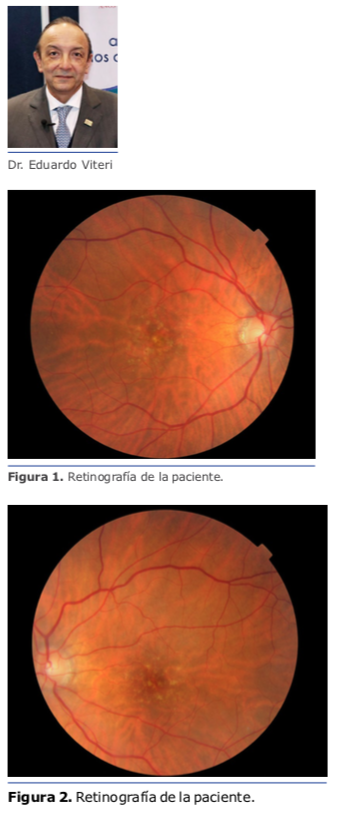 En este caso le explicaría a la paciente su condición y moderaría sus expectativas a un nivel razonable acorde con el estado actual y la probable evolución futura de su mácula. Si solamen- te tiene alguna drusa pequeña podría considerar implantar lentes multifocales tóricos. Si se encuentran múltiples drusas, mi recomendación sería implantar lentes monofocales tóricos, calculando el poder para monovisión, apuntando a una miopía entre -1.75 D y – 2.00 D en el ojo no dominante. A esta y a todos los pacientes les explico claramente que no es posible ase- gurar o garantizar una total independencia de gafas.
En este caso le explicaría a la paciente su condición y moderaría sus expectativas a un nivel razonable acorde con el estado actual y la probable evolución futura de su mácula. Si solamen- te tiene alguna drusa pequeña podría considerar implantar lentes multifocales tóricos. Si se encuentran múltiples drusas, mi recomendación sería implantar lentes monofocales tóricos, calculando el poder para monovisión, apuntando a una miopía entre -1.75 D y – 2.00 D en el ojo no dominante. A esta y a todos los pacientes les explico claramente que no es posible ase- gurar o garantizar una total independencia de gafas.

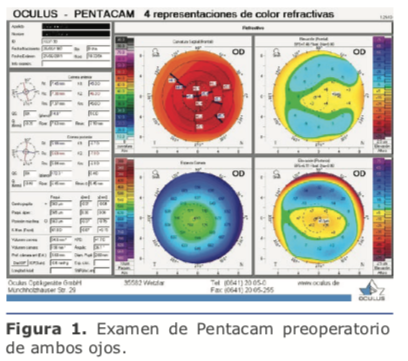
 2. ¿Qué conducta recomienda, tanto para ojo derecho como izquierdo?
2. ¿Qué conducta recomienda, tanto para ojo derecho como izquierdo?
