Caso Córnea Refractiva: Ojo seco
Coordinador:
Dr. Nicolás López – Argentina
Panelistas
Dra. María José Cosentino – Argentina Dr. Carlos Ferroni – Argentina
Dr. César Carriazo – Colombia
Contacto
Dr. Nicolás López – nico942003@hotmail.com
Dra. María José Cosentino – majose.cosentino@icloud.com Dr. Carlos Ferroni – carlos_ferroni@yahoo.com.ar
Dr. César Carriazo – ccarriazo@carriazo.com
Paciente de 32 años, con antecedente de cirugía refractiva por PRK hace 8 años. Acude a la consulta por déficit visual en su visión lejana desde hace aproximadamente un año, el cual asocia a un viaje que hizo a ciudad de México, D.F., durante 3 meses.
Desea evaluar alternativas quirúrgicas para la emetropía. El paciente no recuerda refracción previa a su cirugía refractiva.
Antecedentes generales: Sin antecedentes patológicos de jerarquía.
Antecedentes oftalmológicos: Cirugía refractiva bilateral hace 8 años.
Cirugía de retina en OI por DR traumático hace 2 años con reporte de ese momento de servicio de neuroftalmología de pupila de Adie postraumática.
Síndrome de ojo seco severo en actual tratamiento con lubricantes en gotas y gel, ciclosporina, tapones de silicona tipo puntum plugs y cápsulas de omega-3 vía oral.
Observaciones: Paciente con requerimientos y expectativas visuales altas, de profesión microcirujano, no tolera lentes de contacto y, debido a su profesión, se le dificulta el uso de gafas.
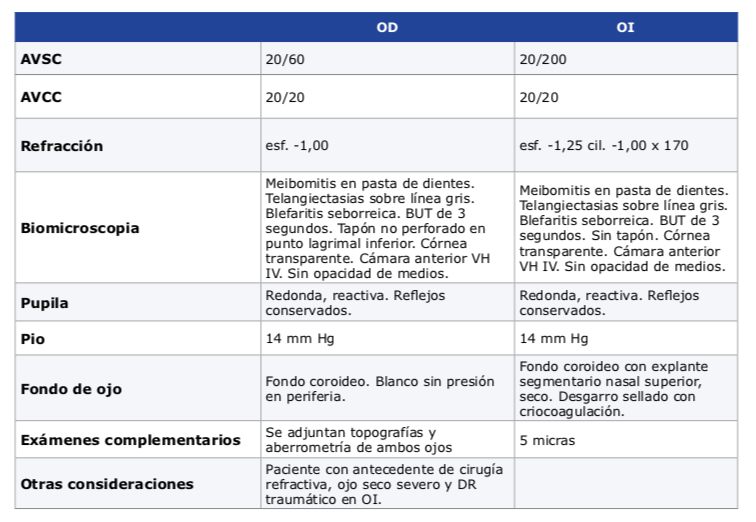
AVSC: OD 20/60 OI 20/200
Refracción Subjetiva:
OD esf. -1,00 20/20
OI esf. -1,25 cil. -1,00 x 170 20/20
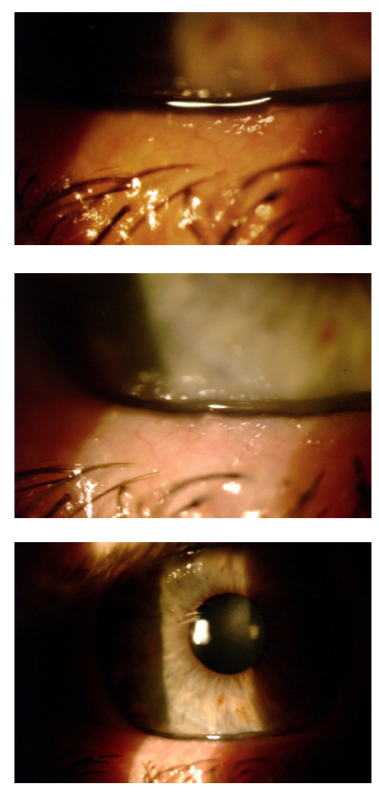
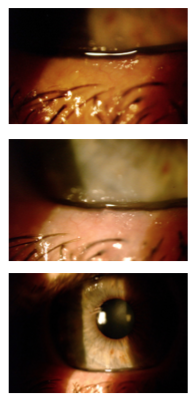
BMC: Meibomitis en pasta
de dientes. Telangiectasias que llegan a línea gris. Blefaritis seborreica.
BUT de 3 segundos.
Córnea transparente. No se observan discos.
Cámara anterior VH IV
Sin opacidad de medios.
Iris normal, pupilas redondas, reactivas. Reflejos fotomotor y consensual conservados.
PIO: 14 mm Hg AO.
FO: Fondo coroideo, máculas satisfactorias. En
OD blanco sin presión temporal superior. En OI explante segmentario en cuadrante nasal supe- rior con desgarro sellado por crio.
N.O. Papilas bordes netos, excavación 0,4 AO
Paciente manifiesta pérdida de sensibilidad al contraste en condiciones escotópicas sobre fon- dos oscuros y rojos.
Paquimetría mínima: OD 463 μm; OI 466 μm
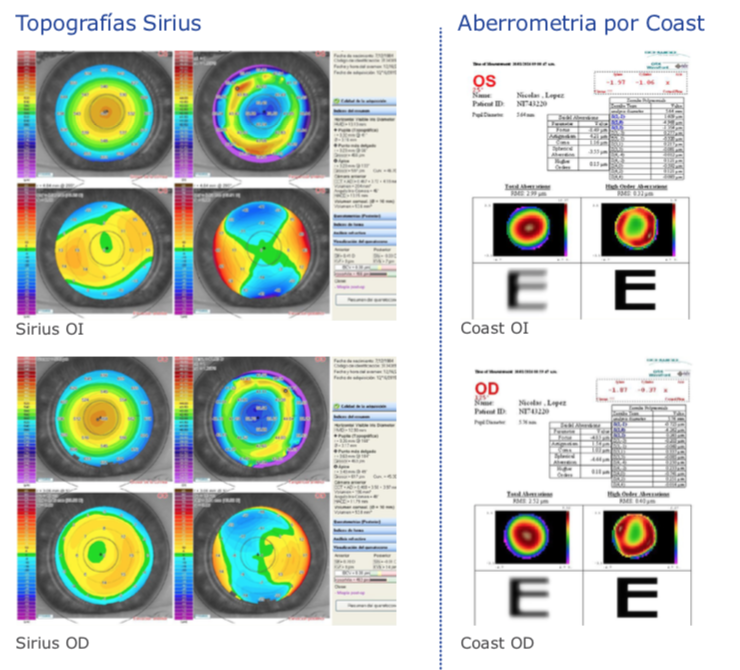
Pupila topográfica: OD 3,17 mm; OI 3,16 mm
Pupila según aberrometría Coast: OD 5,76 mm; OI 5,59 mm
Zona óptica de ablación: 5,5 mm AO
1. ¿Qué causas considera, en este caso, más significativas en la regresión del paciente?
Dra. María José Cosentino: Al no tener los datos completos preparatorios el binomio ojo seco-blefaritis, podemos inferir que es un factor determinante en la regresión que presenta el paciente. Habría que evaluar cuál era la ametropía inicial del caso, los valores queratométricos al momento de la cirugía, etc. para saber si este caso de ametropía posoperatoria fue multifactorial.
Dr. Carlos Ferroni: Muchas regresiones pueden explicarse solo a la memoria
biológica de la córnea, aunque también de- pende del tipo de ablación y el tamaño de la zona óptica empleada.
Dr. César Carriazo:
• Alteración de la superficie ocular por el síndrome de ojo seco.
• Otro aspecto es el antecedente del trata- miento de superficie realizado (PRK) en una miopía relativamente alta (muy posi- blemente alrededor de 5 D).
• Recordar que cuanto más alto es el de- fecto, mayor será la participación del epi- telio en la remodelación corneal y, por ende, la regresión.
2. ¿Realiza el retrata- miento como prime- ra medida? De no ser así, ¿qué tratamien- to emplearía?
Dra. María José Cosentino:
La primera medida en este tipo de casos es compensar y me- jorar la superficie ocular (S.O.) pues: a) las refracciones no
son debidamente confiables; b) como es bien sabido, la S.O. al- terada produce alteraciones en cantidad y calidad visual e indu- ce nuevamente a la regresión.
Dr. Carlos Ferroni: Si no re- solvemos el problema de ojo seco, cualquier tratamiento re- fractivo será un fracaso. Por ende, primero abordamos el problema de superficie y en se- gundo lugar, el refractivo.
Dr. César Carriazo: No se debe hacer tratamiento refrac- tivo en estas condiciones. Hay que tratar inicialmente el ojo seco. Tampoco es aconsejable el uso de lentes de contacto
La corrección refractiva debe hacerse con anteojos.
3. ¿Cómo solucionaría el problema de ojo seco específicamente en este paciente?
Dra. María José Cosentino: Dado el tra- tamiento ya realizado por el paciente y su cuadro clínico, mi opción en estos casos es realizar luz pulsada intensa (IPL). Mi expe- riencia en estos casos es extraordinariamen- te buena.
Dr. Carlos Ferroni: El tratamiento em- pleado en este paciente en particular no está brindando los resultados esperados, por lo tanto debemos proceder de manera diferente y buscar otras etiologías.
En cuanto a tratamiento, podríamos imple- mentar el uso de suero autólogo, pero con- sideramos que el caso requiere estudios más profundos.
- Evaluación del funcionamien- to palpebral.
- Implante de PP (polietileno poroso) superiores.
- Estudiodeenfermedadessistémicas y del sistema inmunológico general del paciente para descartar enfer- medades que pueden afectar la cali- dad o cantidad del film lagrimal.Debemos descartar conectivopatías, enfer- medades reumáticas, dermatológicas etc.
Dr. César Carriazo: Haría tratamiento de limpieza, varias sesiones de luz pulsada (IPL) y seguiría con el régimen de lubrica- ción y control inmunológico.
4. ¿Qué tiempo emplea en cada uno de sus tratamientos?
Dra. María José Cosentino: Realizo tres a cuatro sesiones de luz pulsada intensa,
separadas por 30 días entre cada sesión. Y agrego un refuerzo de omega-3 vía oral.
Dr. Carlos Ferroni: En términos generales utilizamos un período no menor de 60 días. Debemos evaluar el tiempo de utilización de la cefalosporina, ya que para la obtención de resultados debemos esperar un periodo de 6 a 8 meses según diferentes autores.
Dr. César Carriazo: El manejo de ojo seco necesita entre 6 meses y un año ya que el tratamiento con IPL idealmente es mensual y se hace en cuatro sesiones. Luego hay que hacer seguimiento de estabilidad refractiva.
5. ¿Qué abordaje quirúrgico esco- gería para devolverle al pacien-
te la emetropia? De elegir técnicas de superficie, ¿prefiere técnica de PRK o TransPRK?Dra. María José Cosentino: Una vez con- trolada la S.O., realizo técnica de PRK con mitomicina C. Asimismo, indico ciclospori- na tópica y omega-3 vía oral durante los si- guientes 90 días posoperatorios.
Dr. Carlos Ferroni: El vicio de refracción del paciente no es muy elevado, por lo que el tratamiento debe ser lo más exacto posible. La alteración de la superficie afecta la esta- bilidad refractiva dándonos resultados varia- bles e inexactos. Una vez estabilizada la re- fracción y a pesar de las paquimetrías bajas, realizaríamos excímer láser con técnica de PRK. Consumiremos unos 20 a 25 micras.
En este caso emplearía mitomicina al 0,05 %, ya que no tendremos posibilidad de un segundo retratamiento.
Dr. César Carriazo: Técnica de superficie. PRK debido a que es un paciente operado previamente con técnica de superficie y por esta razón hay unas capas de epitelio diferentes entre la periferia y el centro de la ablación. Estas capas no son tenidas en cuenta al mo- mento de hacer TransPRK. El TransPRK es una
técnica que se basa en el princi- pio de promediar el espesor de capas de epitelio de una córnea no intervenida.
6. ¿Qué lechos residua- les maneja en su prác- tica habitual tenien- do en cuenta la técnica que decidirá emplear en este paciente?
Dra. María José Cosentino:
El lecho estromal residual en este caso se encuentra dentro de los parámetros de seguridad.
Dr. Carlos Ferroni: La ten- dencia actual es dejar un lecho de 300 a 350 micras y es a lo que nos ceñimos.
Dr. César Carriazo: Hago muy pocos casos de PRK debi- do a que por nuestra ubicación geográfica tenemos mucho haze. En la mayoría de mis pacientes hago LASAK (LASIK anterior) con discos entre 90
y 120 micras. Por esta razón tengo lechos residualesde estroma en la mayoría de nuestros casos por encima de 300 micras.
7. ¿Qué zona óptica y qué zona de transición le realizaría al paciente considerando que posee una zona óptica de 5,5 mm y que refiere altera- ción en la calidad visual vs. paquimetría limítrofe y regresión?
Dra. María José Cosentino:
Trato de programar una zona óptica y de transición amplias, pues la ametropía así lo per- mite. Esto evita regresiones y estabiliza la corrección de la ametropía, al tiempo que impe- diría aumentar la sintomatolo- gía relacionada con la sensibili- dad de contraste del paciente. Considerando la ametropía y
la paquimetría, diagramaría un perfil de 6 a 9 mm.
Dr. Carlos Ferroni: La zona óptica que emplearía es de 6,5 con zona de transición auto- mática generada por el equipo.
Emplearía mitomicina al 0,05 % para la pre- vención de haze.
Dr. César Carriazo: Se puede pensar en aumentar la zona óptica a 6 mm, pero por las consideraciones de este caso, yo le de- jaría la misma zona óptica ya que se extir- pa menos tejido y corremos menor riesgo. Considero que con la pupila que maneja y logrando la emetropía estos síntomas serían fácilmente tolerables.
8. ¿En estos casos prefiere técnicas de Wavefront o Aberration free?
Dra. María José Cosentino: En este tipo de casos prefiero realizar ablaciones conven- cionales y no personalizadas. ¿Por qué? Pues las películas lagrimales inestables pueden producir artefactos en las mediciones aberro- métricas, en cuyo caso estaríamos compen- sando aberraciones erradas o inexistentes.
Dr. Carlos Ferroni: Prefiero Wavefront. No extirparíamos mucho más tejido y los requi- sitos visuales del paciente lo ameritan.
Dr. César Carriazo: Aberration Free. Siendo una segunda PRK y en paciente como estos, cuya superficie epitelial no es saluda- ble, la ablación asférica da mayor seguridad en la obtención de la ametropía. Pensaría en Wavefront en otro tipo de paciente.
9. ¿Cómo maneja las expectativas del paciente?
Dra. María José Cosentino: Focalizo el tra- tamiento en el mejoramiento de la S.O., que es en verdad la clave del éxito de este caso.
Dr. Carlos Ferroni: Estamos frente a un paciente que no solo tiene una regresión refractiva, sino que presenta una altera- ción importante de superficie que puede ser recidivante y afectará su calidad visual en distintos momentos o periodos. Debe cono- cer y reconocer los síntomas iniciales de un cuadro de ojo seco para actuar rápidamen- te en consecuencia.
Debemos informarle que, al me- nos a nivel corneal, no podremos intentar otro tratamiento y saber que a futuro existen tratamientos alternativos intraoculares.
Dr. César Carriazo: Diciéndole la verdad: su condición no es la me- jor, pues el ojo seco es una contra- indicación relativa para tratamientos refractivo-corneales.
10. ¿Cómorealizaloscon- troles posoperatorios?
Dra. María José Cosentino: Mis controles posoperatorios son los ha- bituales de una PRK: primero, segun- do, tercero y cuarto día hasta extraer el lente de contacto; luego a la se- mana, primer mes, tercer mes, sexto mes y al año. Sin olvidar, un refuerzo de luz pulsada a los doce meses de la última sesión.
Dr. Carlos Ferroni:-Rutinariamente controlamos al paciente los tres primeros días, luego a la semana y pa- samos a control de un mes, seis me- ses y anuales.
En este caso, los controles mensua- les serían por lo menos hasta el sexto u octavo mes, con la idea de contro- lar superficie y/o aparición de haze. Utilizamos antibióticos con corticoides durante el posoperatorio y con- tinuamos con fluorometolona cuatro veces por día en ritmo decreciente.
Recomendamos el uso de lentes con filtro UV mayor de 400 al menos por 8 meses.
Dr. César Carriazo: Controlamos a nuestros pacientes al siguiente día, a la semana y, si todo va bien, al año posoperatorio. En este caso hay que hacer controles más seguidos.
Resolución del caso por el Dr. Nicolás López
Se decide como primera medida trabajar sobre el ojo seco del paciente, teniendo en cuenta que representa una de las posibles causas de regresión miópica, siendo que el paciente manifiesta inestabilidad refractiva. Se decide retirar el tratamiento que el paciente está utilizando, continuando solo con lubricante sin conservante, y realizar tratamiento de IPL bilateral en un esquema de una sesión mensual durante 4 meses con dos refuerzos posteriores a los 3 y 6 meses.


 Laser de Femtosegundo y Cirugía de Facoemulsificación Durante una sesión de trabajos libres que comparaban la técnica de facoemulsificación manual vs. la técnica con el laser del femtosegundo (FLACS), se habló de distintos y variados aspectos a comparar entre un técnica y la otra.
Laser de Femtosegundo y Cirugía de Facoemulsificación Durante una sesión de trabajos libres que comparaban la técnica de facoemulsificación manual vs. la técnica con el laser del femtosegundo (FLACS), se habló de distintos y variados aspectos a comparar entre un técnica y la otra.