Foro Córnea Refractiva
Coordinador
Dr. Mauro Campos – Brasil
Panelistas
Dr. Ernesto Otero – Colombia
Dr. Claudio Orlich – Costa Rica
Contacto
Dr. Mauro Campos – mscampos@uol.com.br Dr. Ernesto Otero – eo@barraquer.com.co
Dr. Claudio Orlich – orlichclaudio@hotmail.com

Dr. Claudio Orlich

Dr. Ernesto Otero
1.¿Cuáles son las principales características ideales de un inlay refractivo?
Dr. Ernesto Otero: Las principales características de un inlay corneal refractivo son:
a. Que sea biocompatible.
b. Que permita el flujo fisiológico normal de nutrientes corneales.
c. Que corrija la visión de cerca sin comprometer la distancia.
Dr. Claudio Orlich: Lo principal es su biocompatibilidad, que no genere inflamación o haze, idealmente con un índice de refrac- ción igual o muy similar al de la córnea, que permita el paso de nutrientes a través de éste y con un sistema de inyección que reduzca la manipulación del dispositivo por parte del cirujano.
2.¿Cuánto tiempo ha usado inlays? ¿Qué modelos ha probado?
Dr. Ernesto Otero: Por 3 años. Now
Dr. Claudio Orlich: En el 2011 implante 20 inlays de Presbia y recientemente, en el 2014, implante 22 inlays Kamra.
3. ¿Cuál es su modelo actual de elección? ¿Cómo funciona?
Dr. Ernesto Otero: En realidad ninguno. Hemos abandonado el uso de inlays de corrección de presbicia en este momento.
Dr. Claudio Orlich: Actual- mente no utilizo inlays. Mi ex- periencia con ellos no fue bue- na, a pesar de tener algunos pacientes que están contentos después de varios años de ope- rados, el porcentaje de pacien- tes insatisfechos y pacientes a los cuales fue necesario explan- tarles el dispositivo fue tan alto, que en mi opinión no se justifica utilizarlos en este momento, so- bretodo existiendo otras opcio- nes más seguras y con índices de satisfacción mucho mayores.
Hay tres diferentes: el Kamra funciona como un agujero es- tenopeico aumentando la pro- fundidad de foco, el Raindrop aumenta la curvatura corneal central, generando una espe- cie de pequeña ectasia central y el Presbia es un verdadero lente con graduación, cuyo efecto es el mismo de una len- te de adición. Todos se implan- tan de forma monocular en el ojo no dominante.
4.¿Cuál es su técnica quirúrgica y su proceso de concentración?
Dr. Ernesto Otero: Cuando los usá- bamos, la técnica quirúrgica consistía en hacer un bolsillo con el iFs150 a una profundidad de 200 μ o 100 μ debajo del lecho de un colgajo de LASIK previo. La incrustación (Kamra) se insertaba y se centraba bajo microscopio. El análi- sis preoperatorio del centro se realizó con el analizador HD.
Dr. Claudio Orlich: Cuando los utili- cé, los hice todos con láser de femto- segundo, inicialmente con el Intralase, utilizando una máscara en la interfase (2011) y posteriormente con el soft- ware para crear bolsillos para inlays (2014) del mismo equipo. Si el implan- te quedaba muy superficial podría ha- ber melting corneal y extrusión, por lo que se recomendaba implantarlos en- tre 200 a 250 micras. Cuanto más pro- fundo, más irregular era la disección del láser, el lecho estromal no queda- ba liso, sino más bien rugoso, que sin duda afectaba el desempeño del inlay. Para el centrado del Kamra utilizába- mos el AcuTarget HD y para los Pres- bia, de forma manual, guiándonos por el reflejo de una luz de fijación del que- ratoscopio incorporado al microscopio quirúrgico, que permitía darnos una idea de la posición con respecto al eje visual del paciente.
5. ¿Quién es el candidato ideal?
Dr. Ernesto Otero: El candidato ideal es aquel con un 20/20 perfecto en el ojo dominante y un -1.00 D en el ojo no dominante. Si está motivado, la cirugía refractiva debe realizarse antes de LASIK o durante PRK para lograr estos resultados.
Dr. Claudio Orlich: En este momento, después de haber uti- lizado dos de los tres inlays dis- ponibles en el mercado creo que no se justifica su implantación, es un riesgo para el cirujano por el alto grado de insatisfacción.
6. ¿Cuáles son las complica- ciones más comunes?
Dr. Ernesto Otero: La compli- cación más común es la descen- tración. Una incrustación des- centrada de más de 200 μ debe volver a centrarse. Otra compli- cación común es el edema sobre el dispositivo. Esto limita la agu- deza visual. Los pacientes deben recibir esteroides (suaves) du- rante alrededor de 6 meses.
Dr. Claudio Orlich: Descen- tramiento, haze, halos, pliegues en el inlay, mala calidad de vi- sión. En el Presbia son frecuen- tes los depósitos metálicos en el dispositivo (ver foto 1) ya que vienen en un frasco con solución salina y deben colocarse en una especie de plato metálico para su manipulación antes de la im- plantación. Otra desventaja del Presbia es que al ser un lente con graduación, en un paciente con 45 años se le implanta un +1.50 y a los 50 años, cuando esta adición es insuficiente, se programa un explante del +1.50 para implantar un inlay con Add mayor. Aunque generalmen- te nos dicen lo contrario, estos dispositivos no son reversibles, son removibles, frecuentemente dejan un pequeño leucoma una vez explantados.



 La tolerancia del Flexivue® es excelente sin ningún reporte de extrusión o re- chazo del material. Los resultados expues- tos a continuación provienen de un estudio prospectivo intervencionista realizado por Malandrini y colaboradores en Prato, Italia, en el que se analizaron 81 ojos implanta- dos con este dispositivo. (2) La agudeza visual preoperatoria promedio era de 0.76 logMAR en visión próxima sin corrección (Bps) y de 0.00 LogMAR en visión lejana (Volsco). Treinta y seis meses posopera- torios, estas agudezas visuales fueron en promedio de 0.10 LogMAR en VPsc y 0.15
La tolerancia del Flexivue® es excelente sin ningún reporte de extrusión o re- chazo del material. Los resultados expues- tos a continuación provienen de un estudio prospectivo intervencionista realizado por Malandrini y colaboradores en Prato, Italia, en el que se analizaron 81 ojos implanta- dos con este dispositivo. (2) La agudeza visual preoperatoria promedio era de 0.76 logMAR en visión próxima sin corrección (Bps) y de 0.00 LogMAR en visión lejana (Volsco). Treinta y seis meses posopera- torios, estas agudezas visuales fueron en promedio de 0.10 LogMAR en VPsc y 0.15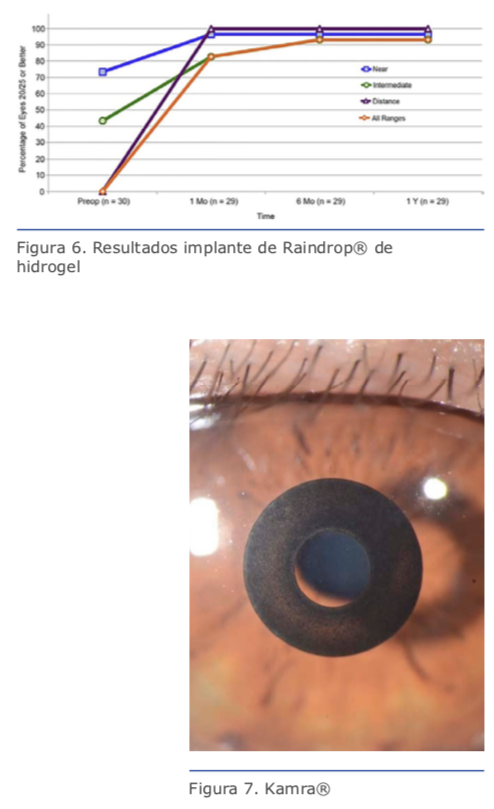 Como podemos ver, la queratofaquia (inlays corneales) ha evolucionado enormemente desde su postulación por Barraquer en los años 50. Obviamente tienen unos benefi- cios significativos como los son su relativa facilidad de implante y la posibilidad de ex- plante (video) en caso de insatisfacción del paciente, su bajísimo índice de complica- ciones y, según los estudios presentados, la satisfacción es alta en los pacientes. Como desventajas se encuentran primero el cos- to, el cual es elevado en estos dispositivos, la necesidad de la utilización de tecnología de punta como el láser de femtosegundo de alta frecuencia (150 Hz o superior) y dis- positivos que ayuden al centrado, como el AccuTarget. Es mi percepción, sin embargo, que todavía estos dispositivos deben ma- durar para poder llenar las expectativas de los pacientes y los cirujanos. Especialmente manteniendo ese efecto “WOW” que cada vez más esperan nuestros pacientes y que aún no vemos con estos dispositivos. Este efecto “WOW” debe ser más rápido y noto- rio cuanto más costoso es el dispositivo que utilizamos. Algo que aún no logramos ob- servar con este tipo de procedimiento.
Como podemos ver, la queratofaquia (inlays corneales) ha evolucionado enormemente desde su postulación por Barraquer en los años 50. Obviamente tienen unos benefi- cios significativos como los son su relativa facilidad de implante y la posibilidad de ex- plante (video) en caso de insatisfacción del paciente, su bajísimo índice de complica- ciones y, según los estudios presentados, la satisfacción es alta en los pacientes. Como desventajas se encuentran primero el cos- to, el cual es elevado en estos dispositivos, la necesidad de la utilización de tecnología de punta como el láser de femtosegundo de alta frecuencia (150 Hz o superior) y dis- positivos que ayuden al centrado, como el AccuTarget. Es mi percepción, sin embargo, que todavía estos dispositivos deben ma- durar para poder llenar las expectativas de los pacientes y los cirujanos. Especialmente manteniendo ese efecto “WOW” que cada vez más esperan nuestros pacientes y que aún no vemos con estos dispositivos. Este efecto “WOW” debe ser más rápido y noto- rio cuanto más costoso es el dispositivo que utilizamos. Algo que aún no logramos ob- servar con este tipo de procedimiento.



 Somos el país más frecuentado del Caribe, nuestros visitantes llegan atraídos por los más variados motivos:
Somos el país más frecuentado del Caribe, nuestros visitantes llegan atraídos por los más variados motivos: