Ingresa a https://alaccsachile2024.com/
Top Ten Curva de Desenfoque: Valioso instrumento propedéutico en la Era de las lentes avanzadas
Top Ten Curva de Desenfoque:
Rafael Lani-Louzada, Brasil
lanilouzada@gmail.com

 Milton Yogi, Brasil
Milton Yogi, Brasil
milton@godoctor.com.br
La curva de desenfoque se ha convertido en una herramienta propedéutica valiosa para comprender mejor el rendimiento visual de un sistema óptico específico y su profundidad de enfoque. Comprender el razonamiento de este examen y estandarizar su metodología es fundamental para caracterizar y comparar las diversas lentes intraoculares (LIO) que se ofrecen a los pacientes. En este artículo, enumeramos diez aspectos que consideramos relevantes para realizar este examen.
En la actual era de la cirugía de cataratas con fines refractivos y de corrección de la presbicia, la curva de desenfoque se ha convertido en una herramienta propedéutica valiosa para comprender mejor el rendimiento visual de un sistema óptico específico y su profundidad de enfoque. Comprender el razonamiento de este examen y estandarizar su metodología es fundamental para caracterizar y comparar las diversas lentes intraoculares (LIO) que se ofrecen a los pacientes.
Basada en el concepto óptico de vergencia, que corresponde a la recíproca de la distancia del objeto en metros, la curva de desenfoque permite al investigador evaluar la capacidad visual funcional del paciente para diferentes distancias y, por lo tanto, su independencia de gafas, al mismo tiempo que mantiene fija la distancia de la tabla de optotipos.
En este artículo, enumeramos diez aspectos que consideramos relevantes para realizar este examen.
La curva de desenfoque debe comenzar obteniendo la mejor corrección para visión lejana del paciente en el foróptero, que representa el desenfoque “cero” (0.00 D). No se debe descuidar una refractometría de calidad.
La prueba debe realizarse en un ambiente con condiciones fotópicas de iluminancia (80 – 100 lux). Se recomienda que la tabla de optotipos, ya sea Snellen o ETDRS, tenga un contraste del 100% y se presente con una luminancia promedio de 85 cd/m², pudiendo variar entre 80 cd/m² y 100 cd/m². 1
El desenfoque se obtiene al agregar lentes de prueba positivas o negativas a la corrección para visión lejana, y se registra la agudeza visual en logMAR para cada nivel de desenfoque. Cada lente, especialmente las negativas, se relaciona con una convergencia específica y, por lo tanto, simula una distancia específica. Pueden categorizarse en zonas: cerca (-4.00 D a -2.00 D, o 25 cm a 50 cm), intermedia (-2.00 D a -0.50 D, o 50 cm a 2 m) y lejos (-0.50 D a +0.50 D, o 2 m a infinito óptico), cuya área bajo la curva representa una métrica objetiva de comparación 2. Otro método comparativo es evaluar la agudeza visual en niveles específicos de desenfoque: 0.00 D (lejos), -1.25 D o -1.50 D (80 cm o 66 cm, respectivamente; intermedio) y -2.50 D o -3.00 D (40 cm o 33 cm, respectivamente; cerca) 3,4.
Es interesante utilizar tablas de agudeza visual que permitan la presentación aleatoria de optotipos entre las diferentes lentes probadas, evitando así un posible sesgo de memorización 5.
La Academia Americana de Oftalmología recomienda probar el desenfoque entre +1.50 D y -2.50 D, variando en incrementos de 0.5 D, excepto entre +0.50 D y 0.50 D, donde la variación debe ser de 0.25 D 1. Sin embargo, esta guía puede modificarse según la lente estudiada y la profundidad de enfoque esperada. Varios grupos de investigación trabajan con desenfoques negativos mayores a -2.50 D (equivalente a una distancia de 40 cm), que pueden variar entre -3.00 D (equivalente a una distancia de 33 cm) y -5.00 D (equivalente a una distancia de 20 cm) 2,6,7. El desenfoque positivo ha sido objeto de debate: Galvis y colaboradores argumentan que, dado que la luz reflejada/emitida por los objetos cotidianos llega al sistema visual del paciente con vergencia negativa, el desenfoque positivo no aporta información clínicamente útil y, además, prolonga el tiempo del examen y puede cansar al paciente, perjudicando la confiabilidad del resultado 8,9.
Muchos exámenes de agudeza visual para visión lejana, incluida la curva de desenfoque, se realizan a una distancia de 4 metros de la tabla de optotipos, lo que corresponde a una vergencia de -0.25 D. En este caso, la vergencia de la tabla debe considerarse e incorporarse a la curva de desenfoque, lo que significa que el desenfoque de -2.00 D representa en realidad -2.25 D, por ejemplo, y así sucesivamente 8,10. Si la prueba se realiza a una distancia de 6 metros de la tabla de optotipos, la vergencia correspondiente de -0.17 D no es clínicamente significativa y puede ser desestimada 8.
Dado que este examen tiene como objetivo simular cómo el paciente ve los objetos a diferentes distancias en la vida diaria, se prefiere que la curva se realice de manera binocular 8, especialmente en casos en los que se ha implantado la misma lente intraocular en ambos ojos, o incluso en casos de combinación de diferentes diseños de LIO en cada ojo (mix-and-match) 6. De esta manera, se optimiza el tiempo del examen, lo que favorece un resultado más fiable al reducir la fatiga del paciente. Sin embargo, en algunos casos, el investigador puede optar por la curva de desenfoque monocular 11.
Un dato relevante que se puede extraer de la curva de desenfoque es la profundidad de enfoque del sistema óptico estudiado, lo cual es extremadamente útil en el contexto actual en el que se busca ofrecer al paciente la máxima independencia de gafas posible de acuerdo con sus características ópticas y sus expectativas posoperatorias. En una curva de desenfoque bien realizada, la profundidad de enfoque corresponde a la extensión de las lentes con las que se logra una agudeza visual promedio de 0.2 logMAR (= 20/32) o mejor 3.
En la curva de desenfoque, se consideran valores medios de agudeza visual por debajo de 0.05 logMAR como “visión clara” óptima, mientras que los valores medios por encima de 0.2 logMAR (= 20/32) son “aceptables” 3. El valor de 0.3 logMAR (= 20/40) se considera el cutoff de visión funcional.
La curva de desenfoque se ve influenciada por el tamaño de la pupila y la longitud axial. Por lo tanto, se debe medir el tamaño de la pupila del paciente en las mismas condiciones fotópicas de iluminación del entorno, preferiblemente en el momento de realizar la curva. Se recomienda que los datos de desenfoque se presenten y comparen estratificando los grupos según diferentes tamaños de pupilas (pequeño: <3.0 mm; medio: ≥3.0 mm y ≤4.0 mm; y grande: >4.0 mm) y longitudes axiales (corta: <21.0 mm; media: ≥21.0 mm y ≤26.0 mm; y larga: >26.0 mm) 1.
Referencias
MacRae S, Holladay JT, Glasser A, et al. Special Report: American Academy of Ophthalmology Task Force Consensus Statement for Extended Depth of Focus Intraocular Lenses. Ophthalmology. 2017;124(1):139-141. doi:10.1016/j.ophtha.2016.09.039
Wolffsohn JS, Jinabhai AN, Kingsnorth A, et al. Exploring the optimum step size for defocus curves. J Cataract Refract Surg. 2013;39(6):873-880. doi:10.1016/j.jcrs.2013.01.031
Gil MA, Varón C, Cardona G, Buil JA. Visual acuity and defocus curves with six multifocal intraocular lenses. Int Ophthalmol. 2020;40(2):393-401. doi:10.1007/s10792-019-01196-4
He L, Hong X, Suryakumar R, Sarangapani R. Metric-based visual acuity and defocus curve simulation of two multifocal intraocular lens models. Clinical Ophthalmology. 2020;14:4579-4586. doi:10.2147/OPTH.S264912
Gupta N, Naroo SA, Wolffsohn JS. Is randomisation necessary for measuring defocus curves in pre-presbyopes? Contact Lens and Anterior Eye. 2007;30(2):119-124. doi:10.1016/j.clae.2007.02.005
Tarib I, Diakonis VF, Breyer D, Höhn F, Hahn U, Kretz FTA. Outcomes of combining a trifocal and a low-addition bifocal intraocular lens in patients seeking spectacle independence at all distances. J Cataract Refract Surg. 2019;45(5):620-629. doi:10.1016/j.jcrs.2019.01.013
Gundersen KG, Potvin R. Trifocal intraocular lenses: A comparison of the visual performance and quality of vision provided by two different lens designs. Clinical Ophthalmology. 2017;11:1081-1087. doi:10.2147/OPTH.S136164
Galvis V, Tello A, Carreño NI, Berrospi RD, Niño CA, Serna VH. Defocus curve and vergence related to viewing distance. J Cataract Refract Surg. 2020;46(5):803. doi:10.1097/j.jcrs.0000000000000158
Galvis V, Escaf LC, Escaf LJ, et al. Visual and satisfaction results with implantation of the trifocal Panoptix® intraocular lens in cataract surgery. J Optom. 2022;15(3):219-227. doi:10.1016/j.optom.2021.05.002
Rodríguez-Vallejo M, Burguera N, Rocha-de-Lossada C, Aramberri J, Fernández J. Refraction and defocus curves in eyes with monofocal and multifocal intraocular lenses. J Optom. Published online July 1, 2023. doi:10.1016/j.optom.2023.01.005
Böhm M, Petermann K, Hemkeppler E, Kohnen T. Defocus curves of 4 presbyopia-correcting IOL designs: Diffractive panfocal, diffractive trifocal, segmental refractive, and extended-depth-of-focus. J Cataract Refract Surg. 2019;45(11):1625-1636. doi:10.1016/j.jcrs.2019.07.014
Digitalización en la
Cirugía De Cristalino

Dr. Alfonso Arias Puente. MD, PhD. FEBOphth
No tengo conflicto de interés con el contenido de esta editorial
Digitalización es el proceso de transformar procesos analógicos y objetos físicos en digitales. Lo que antes se hacía en papel, sin conexión y con archivadores aislados ahora está completamente informatizado. La Historia Clínica Informatizada que empezó en los años 90 fue la primera incorporación a esta nueva tecnología: ahora está universalmente aceptada
La transformación digital de los circuitos de salud es un reto de futuro convertido en una necesidad del presente. De hecho, ya es una realidad en muchos hospitales.
Digitalizar un servicio de salud permite: registrar datos relevantes de los pacientes, interpretarlos de manera precisa y automática, prevenir, detectar y tratar problemas de salud de manera más rápida (1).
La digitalización de los quirófanos hace que una cirugía no sea un acto aislado, sino que forme parte de un proceso asistencial complejo que empieza con el paciente en la consulta y finaliza con el alta médica.
La transformación digital integra a todas las áreas forman parte del proceso asistencial:
- consulta: donde se explora al paciente, se indica y se planifica la cirugía
- valoración anestésica
- admisión: gestión y programación quirúrgica
- cirugía
- informe de alta
Los beneficios de esta digitalización afectan fundamentalmente al manejo de la información. Integrar todos estos requerimientos aporta valor añadido desde el punto de vista de seguridad del usuario, planificación de la actividad, de los recursos materiales y humanos, cumplimentación de los listados de verificación quirúrgica, así como de la experiencia del paciente y del profesional (2).
La implementación tecnológica va más allá, pues el apoyo proporcionado mediante el uso de inteligencia artificial y big data para la gestión y tratamiento del gran volumen de datos que se generan permite predecir futuros comportamientos, corregir errores, sugerir acciones de mejora o identificar posibles ineficiencias en la programación quirúrgica. (3)
En cirugía oftalmológica, y en especial en la cirugía de cristalino, en particular, al igual que en otras áreas de actividad médica, las nuevas tecnologías médicas proporcionan en la actualidad mejoras en eficiencia y prestaciones. Y es que antes de realizar una cirugía se realiza la planificación quirúrgica, qué procedimiento se realizará y cómo. Las nuevas herramientas digitales resultan claves a la hora de tomar decisiones antes de una intervención quirúrgica.
En la actualidad disponemos de plataformas quirúrgicas que ofrecen la posibilidad de establecer un nexo de unión real de la consulta al quirófano. La plataforma ZEISS EQ Workplace® (Carl Zeiss-Meditec) y VISION PLANNER® (Alcon) permiten conectar todas las pruebas diagnósticas, datos biométricos, y plan quirúrgico de un paciente obtenidos en la consulta y ser enviadas directamente al quirófano estando disponible de forma automática en el microscopio quirúrgico en el momento de la cirugía.
Como hemos señalado anteriormente la digitalización de la cirugía de cristalino permite realizar todos los actos médicos como un único proceso asistencial.
En la consulta se llevan a cabo todas las pruebas diagnósticas, su visualización y análisis, el cálculo y elección de la lente intraocular (LIO), se diseña el plan quirúrgico personalizado para cada paciente y una vez confirmado todos los datos son transferidos directamente al quirófano donde estarán disponibles en el momento de la cirugía. (Fig 1)

Fig, 1.- Conexión entre exploración en consulta, planificación quirúrgica y quirófano
En el quirófano todo el plan quirúrgico diseñado desde la consulta está disponible permitiendo realizar una cirugía guiada con ubicación de las incisiones, tamaño de la capsulotomía, alineamiento de la LIO en casos de toricidad, etc. (Fig 2)
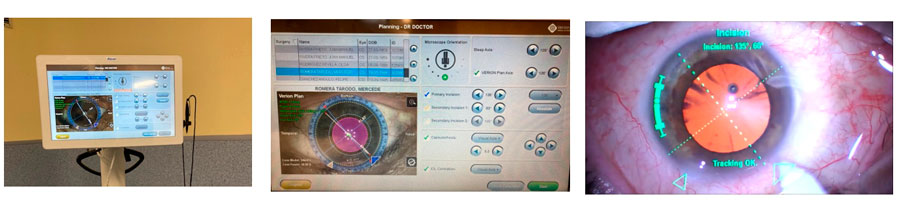
Fig, 2.- Planificación quirúrgica en quirófano
Este proceso digital permite también el registro y análisis de todos los datos preoperatorios, preoperatorios y postoperatorios ofreciendo su trazabilidad y una mayor seguridad y eficacia de todo el proceso quirúrgico.
Esta forma de trabajar nos permite explotar los numerosos datos que se generan durante la experiencia clínica de un paciente. Los datos, imágenes o conclusiones que antes se archivaban en una historia clínica para su almacenaje, ahora se fusionan y complementan mutuamente para conformar fuentes de información de alto valor para el profesional médico que, no solo ahorran tiempo en la realización de los procesos, sino que empoderan las capacidades tanto del profesional como del equipamiento médico especializado.
A pesar de que el uso de la tecnología digital está aumentando de forma notable y rápida en todas las especialidades quirúrgicas no hay consenso sobre lo que realmente significa el concepto de “cirugía digital”’. En el estudio Delphi sobre consenso en cirugía digital se acordó definirla como “el uso de la tecnología para la mejora de la planificación preoperatoria, la realización de la cirugía, el soporte terapéutico y el entrenamiento para mejorar los resultados y reducir los riesgos”. (1)(4)
En estos momentos la digitalización de la cirugía de cristalino ofrece unas claras ventajas:
- MAYOR EFICIENCIA: el traspaso de datos de forma automática desde la consulta al quirófano, la posibilidad de realizar cirugía guiada por imagen con una mayor precisión quirúrgica, la optimización de los tiempos de consulta y quirófano. El registro y análisis automáticos de datos clínicos y quirúrgicos pre y postoperatorios dando trazabilidad a los datos y su tratamiento a través de la Inteligencia Artificial para establecer modelos de predicción de resultados y eficiencia del proceso.(5)
- MAYOR SEGURIDAD: Evita uso de papel: archivo digital, reduce la posibilidad de errores en la planificación quirúrgica y comparte criterios de seguridad con la Historia Clínica Electrónica.
La digitalización de la cirugía se está implantando de forma acelerada pero en el futuro próximo se enfrenta a varios retos: (1) (6)
1º La tecnología digital está ya disponible pero no todos los hospitales y centros están preparados para ello. Se necesita inversión, cambio de estructuras y resultados que avalen el coste.
2º Es imprescindible la implicación de los profesionales y de los pacientes con esta digitalización. Es necesario crear una educación digital que ponga en valor sus beneficios sobre la cirugía convencional y que estos sean reconocidos.
3º Están pendientes de resolver los problemas legales, de protección de datos y de consentimiento informado que genera el manejo de los datos clínicos a través de inteligencia artificial.
Estamos en medio de una revolución tecnológica en salud a nivel global que está cambiando nuestra forma de actuar en el cuidado de nuestros pacientes como consecuencia de la transición digital pero faltan estudios científicos que avalen con evidencia científica la mejora en eficiencia y seguridad para los cirujanos y para los pacientes.
BIBLIOGRAFÍA
- Lam K., Abràmoff MD.,, Balibrea., Bishop SM., et al. A Delphi consensus statement for digital surgery. npj Digital Medicine (2022) 5:100; https://doi.org/10.1038/s41746-022-00641-6
- Maier-Hein, L. et al. Surgical data science for next-generation interventions. Nat. Biomed. Eng. 1, 691–696 (2017).
- Abramoff, M. D. et al. Foundational considerations for artificial intelligence utilizing ophthalmic images. Ophthalmology https://doi.org/10.1016/
- Niederberger, M. & Spranger, J. Delphi technique in health sciences: A map. Front. Public Health 8, 457 (2020j.ophtha.2021.08.023 (2021).
- Hashimoto, D. A., Rosman, G., Rus, D. & Meireles, O. R. Artificial intelligence in surgery: promises and perils. Ann. Surg. 268, 70–76 (2018).
- Raza M., Venkatesh KP., Diao JA., Kvedar JC . Defining digital surgery for the future npj Digital Medicine (2022) 5:155 ; https://doi.org/ 10.1038/s41746-022-00706-6
Lo invitamos a revivir y disfrutar el webinar de ALACCSA – R junto con SECOIR que tuvo lugar el pasado 15 de julio.
Coordinador:
 Dr. Antonio Méndez Noble
Dr. Antonio Méndez Noble
antoniomendez@mac.com
Panelistas:
 Dr. Edgar A. González
Dr. Edgar A. González
edgar.agm10@hotmail.com
 Dra. Ned Davila Avila
Dra. Ned Davila Avila
nedmerari@gmail.com
Dr. Antonio Méndez Noble
Es importante remarcar los avances que ha tenido la cirugía refractiva. Por lo pronto no es tiempo de hablar de miopía, hipermetropía y/o astigmatismo. Nuestra nueva frontera la hemos alcanzado con temas de presbicia.
Como lo hemos visto en otros tiempos es importante tener en cuenta las características de nuestro paciente a tratar. Donde se abren una serie de opciones de tratamiento. Conocer y saber aplicar cada una de ellas es importante, ya que nuestro paciente, como siempre es el caso en cirugía refractiva, no está enfermo y solo requiere de gafas.
De esta manera se aborda el tema con dos expertos en cirugía refractiva en una zona en el noroeste de
México, Tijuana B. C. caracterizada entre otras cosas por su gran turismo médico en cirugía refractiva.
Dr. Edgar A. González
¿Cuándo escoge un lente multifocal para el manejo de la presbicia?
- Paciente con catarata
- Paciente hipermétrope
- Mayor de 50 años
- Sin patología ocular agregada
Todas las anteriores
Comentario:
En el tratamiento de presbicia con implante de lente intraocular una de las principales indicaciones es la edad del paciente mayor a 60 años, ya que diversos estudios reportan una mayor incidencia de desprendimiento de retina regmatógeno (DRR) en personas menores a 60 años (0.50%), comparado con pacientes mayores a 75 años, donde la incidencia disminuye significativamente (0.04%)1,2. Considerando otros factores de riesgo para DRR posterior a cirugía de catarata hay que mencionar la longitud axial (LA) mayor a 25 mm, en donde se reporta aumento de la incidencia de esta complicación en comparación con LA < 23.73 mm (p <0.001)2, por lo que pacientes hipermétropes presentan menor riesgo de esta complicación. En éste sentido vale la pena mencionar la necesidad de una revisión adecuada de la retina periférica para descartar la presencia de lesiones predisponentes que puedan aumentar el riesgo de DRR antes y posterior a la cirugía3,4,5.
Otro criterio a cumplir es la ausencia comorbilidades sistémicas y oculares, que pueden ser contraindicación relativa o absoluta de implante de lente intraocular multifocal, principalmente aquellas que tienen el potencial de afectar de manera negativa la sensibilidad al contraste, como diabetes mellitus, glaucoma, o alteraciones de superficie ocular como son síndrome de ojo seco y blefaritis que deben ser evaluados y tratados previamente al procedimiento quirúrgico1.
Dra. Ned Davila Avila
¿Cuándo escoge un lente multifocal para el manejo de la presbicia?
- Paciente con catarata
- Paciente hipermétrope
- Mayor de 50 años
- Sin patología ocular agregada
Todas las anteriores
Comentario:
Mi paciente candidato ideal es un paciente hipermétrope con catarata sintomática, mayor de 50 años, ¿por qué? Está descrito que la incidencia de desprendimientos de retina es mayor en los sujetos menores de 50 años operados de cirugía de catarata que en pacientes mayores, cabe destacar que el riesgo es acumulativo con el tiempo, aproximadamente 2,3 veces mayor comparado con el riesgo basal1.
Las personas con defectos refractivos hipermetrópicos tienen alto porcentaje de satisfacción con lentes multifocales (algunos reportes entre 84.3 y 93.56) 2-3, esto puede estar relacionado con la dependencia de anteojos prequirúrgicos tanto para visión lejana y cercana.
Por otro lado, es importante considerar que “los lentes premium son para pacientes con ojos premium”. Como parte de la valoración general recomiendo tratar ojo seco (en caso de que el paciente tenga), medir aberraciones corneales de alto orden, tamaño pupilar, ya que pueden tener impacto negativo en la sensibilidad al contraste y disfotopsias3,4,5. También descartar padecimientos en la retina como retinopatía diabética, degeneración macular relacionada con la edad y las membranas epirretinianas, que aunque se consideran contraindicaciones relativas podrían tener un impacto negativo en el desempeño del lente multifocal4.
Dr. Edgar A. González
¿Cuándo está indicada la cirugía corneal para presbicia?
- Entre los 40 y 50 años de edad
- Pacientes hipermétropes mejores de 3 Dioptrías
- Toleran monovisión
- Pacientes con cristalino transparente
Todas las anteriores
Comentario:
Existen hoy en día diversas técnicas quirúrgicas para la corrección de presbicia a través de la aplicación de láser excimer y en general las podemos dividir en tres grupos:
-Monovisión: Un ojo se trata para enfocar de lejos (ojo dominante) y el otro ojo enfoca para cerca (ojo no dominante), las cuáles se reportan con una tasa de éxito de entre el 50 y 75% según la serie revisada1,2.
-Cirugías que a través de un perfil de ablación específico incrementan la profundidad de foco, un ejemplo de éstas técnicas es el Presbyond, la cuál induce un cambio controlado en la asfericidad corneal y en la aberración esférica, dejando el ojo dominante emétrope, y el ojo no dominante con una refracción de -1.50 D. Ésta es la cirugía que personalmente ofrezco para tratamiento de presbicia, puesto que en la literatura han reportado buenos resultados: AV binocular de 20/25 o mejor en el 99 – 100% de los casos y visión cercana > J3 en el 95 a 99% de los casos3, estadística que he podido comprobar con los casos que he tratado.
-Cirugías de ablación multifocal. Se ablaciona un área corneal central corregida para lejos y un área en periferia media corneal corregida para cerca (asfericidad negativa)3,4.
Es necesario mencionar qué en cualquier caso, los criterios de cirugía no difieren en cuánto a las características a cumplir como cualquier otra cirugía láser, entiéndase una topografía corneal normal, refracción estable, y ausencia de enfermedades oculares, como ojo seco, presencia de catarata, infecciones actuales o previas, como herpes5; y sistémicas; así como el uso de medicamentos, que contraindiquen el procedimiento. Una vez cumplidos estos criterios el paciente ideal es aquel que presente presbicia manifiesta, acompañando de un error refractivo para la visión lejana por lo que la edad idónea para estos procedimientos es en pacientes menores a 50 años y mayores de 40. El rango de error refractivo tratable en estos procedimientos se ha descrito de miopía de -8.00 D hasta hipermetropía de +3.00 D3; pacientes con refracciones fuera de este rango pudieran no tener una buena satisfacción.
Además de la valoración antes mencionada es sumamente importante valorar las necesidades del paciente y su personalidad, determinar el ojo preferente, así como la tolerancia a la monovisión, esto nos ayudará a estimar la capacidad de neuroadaptación y detectar pacientes que sean visualmente demandantes con expectativas poco realistas6.
Dra. Ned Davila Avila
¿Cuándo está indicada la cirugía corneal para presbicia?
- Entre los 40 y 50 años de edad
- Pacientes hipermétropes mejores de 3 Dioptrías
- Toleran monovisión
- Pacientes con cristalino transparente
Todas las anteriores
Comentario:
La cirugía corneal para tratar presbicia tiene lugar en aquellos pacientes con cristalino transparente considerados jóvenes para realizar una cirugía de catarata.
Existen varias estrategias para lograr mejorar la visión cercana, hablando de la monovisión realizada con Lasik o PRK, el ojo dominante se corrige a la emetropía y el ojo no dominante con un target variable, usualmente entre -1.50 y -2.0 con previa prueba de tolerancia. Actualmente se sabe que cuando el desenfoque monocular del ojo no dominante alcanza 2.5 dioptrías o más, existe una disminución significativa de la sensibilidad al contraste y se inhibe la binocularidad, seguido de supresión que vuelve al sistema óptico monofocal (más complicado de tolerar). Sin embargo, disminuir la cantidad de anisometropía disminuye la visión cercana 1,2.
Por otro lado, en mi práctica clínica utilizo la cirugía Presbyond ® que combina el efecto de micro-monovisión (ojo no dominante con target -1.5 D, ojo derecho calculado a emetropía) y modifica la aberración esférica corneal para aumentar la profundidad de foco. Con este tratamiento los pacientes hipermétropes adquieren una visión sin corrección lejana de 20/20 o mejor en el 98.5% y una agudeza visual cercana sin corrección de J2 o mejor en el 95.6% de los casos, aunque también ha demostrado buen desempeño en pacientes emétropes y con astigmatismo miópico 1,2,3.
Un paciente administrador en compañía transnacional, que llega a consulta por no ver bien de cerca, tiene 45 a. de edad, AV binocular de 20/25 mejora a 20/20 con +1.00 esférico en cada ojo. Con esa corrección mejora visión cercana a J2, requiere de +1.00 para ver cómodamente J1. Sin lentes ve J3 y no quiere usar gafas. ¿Qué hacen en esta situación?
Dr. Edgar A. González
Se le indican gafasMedicamento mióticoLentes de contactoLasik- Lente multifocal / EDOF
- Implante corneal.
Comentario:
A mi criterio considero que éste paciente no es un buen candidato a una corrección quirúrgica, debido a varios factores. Como primer punto podría considerarse que el paciente es emétrope y su único problema es la presbicia, aunque deberíamos evaluar la refracción bajo cicloplejia debido a que es probable que presente hipermetropía latente, caso en el cuál podríamos platicar con el paciente sobre la posibilidad de un tratamiento en otro momento, cuando presente aumento de la hipermetropía manifiesta con consecuente disminución de la AV lejana y dependiendo de la edad en la que ésto se presente podríamos considerar en su momento cirugía láser o implante de lente multifocal /EDOF, pero en este momento no consideraría ninguno de éstos tratamientos. Por el contrario, podríamos iniciar con tratamientos menos invasivos que podrían ir desde el uso de gafas, que además nos ayudarían a lograr que se manifieste su hipermetropía, uso de lente de contacto, que en caso de tolerar monovisión, se podría hacer con lente de contacto, o en su caso lente de contacto multifocal. Otra opción viable y que ha demostrado tener cierta tasa de éxito es el tratamiento de pilocarpina a dosis bajas (1.25%, una aplicación al día), en donde se ha observado mejoría de 3 líneas de visión cercana en el 30.7% de los pacientes, comparado con placebo (8.1%)3.
Independientemente de las opciones, es importante explorar las necesidades y expectativas del paciente, que es lo que espera de la cirugía, y en nuestro caso exponerle los probables resultados que podemos obtener, así de ésta manera llegar con él a una decisión que sea benéfica y viable.
Un paciente administrador en compañía transnacional, que llega a consulta por no ver bien de cerca, tiene 45 a. de edad, AV binocular de 20/25 mejora a 20/20 con +1.00 esférico en cada ojo. Con esa corrección mejora visión cercana a J2, requiere de +1.00 para ver cómodamente J1. Sin lentes ve J3 y no quiere usar gafas. ¿Qué hacen en esta situación?
Dra. Ned Davila Avila
- Se le indican gafas
- Medicamento miótico
- Lentes de contacto
Lasik- Lente multifocal / EDOF
- Implante corneal.
Comentario:
Los pacientes más desafiantes para el tratamiento de presbicia son el grupo de emétropes (Agudeza visual 20/25 o mejor), esto se debe a que suelen tener grandes expectativas visuales por tener una buena visión lejana y no acostumbran a utilizar lentes, por lo tanto la exigencia visual en el postoperatorio es alta.
Parte de la valoración preoperatoria incluye explicar de manera detallada a los pacientes un panorama real de lo que pueden ofrecer estas cirugías y sus posibles efectos no deseados como disminución de la calidad visual lejana.
En el caso de los tratamientos no quirúrgicos, una de las opciones es el tratamiento con pilocarpina, que puede inducir miosis y contracción del cuerpo ciliar que también ayudaría en la acomodación del cristalino. El uso diario de clorhidrato de pilocarpina solución oftálmica al 1,25% en monoterapia es el régimen que ha sido aprobado por la FDA de EE. UU. Su uso ha sido controvertido, ya que se han reportado algunas asociaciones entre el inicio del tratamiento con pilocarpina al 1,25% con casos de desprendimiento de retina (3 ojos de 2 pacientes) 1,2.
Respecto al tratamiento de lasik presbyond ® en pacientes emétropes, es complicada la inducción de aberración esférica por la cantidad de refracción a tratar, pero se realiza un protocolo de micro-monovisión asférica, sin embargo, se le atribuye a la micro-monovisión la mejoría de la visión cercana. Esto es respaldado con los resultados de Reinstein, et al, 2012, donde encontraron que los ojos dominantes tratados para visión lejana, solo 34% tuvo visión cercana de J7 o mejor, comparada con los ojos no dominantes, donde el 94% vió J2 o mejor 3.
Mi manejo en este contexto sería un lasik para presbicia. Sugiero en este grupo en especifico, realizar prueba de tolerancia ambulatoria con lentes de contacto con el target -1.5 D en el ojo no dominante, ya que se ha reportado un porcentaje de retratamientos en este grupo del 11.8% y post quirúrgicamente hasta 3.4% de los pacientes no toleraron la micro-monovisión 3.
1 Referencias
Jorge L. Alio, Ana B. Plaza-Puche, Roberto Férnandez-Buenaga, Joseph Pikkel, Miguel Maldonado, Multifocal intraocular lenses: An overview, Surv Ophthal, 2017, Volume 62, 611-34.
Thylefors, J., Jakobsson, G., Zetterberg, M. and Sheikh, R. (2022), Retinal detachment after cataract surgery: a population-based study. Acta Ophthalmol, 100: e1595-e1599.
Haug SJ & Bhisitkul RB (2012): Risk factors for retinal detachment following cataract surgery. Curr Opin Ophthalmol 23: 7–11.
Behndig A, Montan P, Stenevi U, Kugelberg M & Lundstrom M: One million cataract surgeries: Swedish National Cataract Register 1992-2009. 2011, J Cataract Refract Surg 37: 1539–1545.
Clark A, Morlet N, Ng JQ, Preen DB & Semmens JB (2012): Risk for retinal detachment after phacoemulsification: a whole-population study of cataract surgery outcomes. Arch Ophthalmol 130: 882–888
2 Referencias
Olsen T, Jeppesen P. The incidence of retinal detachment after cataract surgery. Open Ophthalmol J. 2012;6:79-82. doi: 10.2174/1874364101206010079. Epub 2012 Sep 7. PMID: 23002414; PMCID: PMC3447164.
Galvis V, Escaf LC, Escaf LJ, et al. Visual and satisfaction results with implantation of the trifocal Panoptix® intraocular lens in cataract surgery. J Optom. 2022;15(3):219-227. doi:10.1016/j.optom.2021.05.002
Nicula CA, Popescu R, Rednik AM, Nicula D, Bulboaca AE, Stanescu I. Refractive Lens Exchange in Hyperopic Presbyopes with the Acrysof IQ Panoptix Intraocular Lens: One-Year Results and Analysis of the Literature. Ther Clin Risk Manag. 2020;16:1125-1137. Published 2020 Nov 19. doi:10.2147/TCRM.S279065
Grzybowski A, Kanclerz P, Tuuminen R. Multifocal intraocular lenses and retinal diseases. Graefes Arch Clin Exp Ophthalmol. 2020 Apr;258(4):805-813. doi: 10.1007/s00417-020-04603-0. Epub 2020 Jan 18. PMID: 31955239; PMCID: PMC7575463.
Fernández J, Alfonso Sánchez JF, Nieradzik M, Valcárcel B, Burguera N, Kapp A. Visual performance, safety and patient satisfaction after bilateral implantation of a trifocal intraocular lens in presbyopic patients without cataract. BMC Ophthalmol. 2022;22(1):341. Published 2022 Aug 10. doi:10.1186/s12886-022-02556-y
3 Referencias:
Jain S et al. Success of monovision in presbyopes: review of the literature and potential applications to refractive surgery. Surv Ophthalmol 1996; 40:491-499
Garcia-Gonzalez M et al. Visual outcomes of LASIK-induced monovision in myopic patients with presbyopia. Am J Ophthalmol 2010; 150 (3):381-6.
Stival LR et al. Presbyopic Laser Excimer Ablation: A Review. J Refract Surg 2018; 34(10):698-710.
Ryan A, O’Keefe M. Corneal approach to hyperopic presbyopia treatment: six-month outcomes of a new multifocal excimer laser in situ keratomileusis procedure. J Cataract Refract Surg. 2013;39:1226-1233.
René Moreno, A. Miguel Srur, B. Carlos Nieme, Cirugía refractiva: indicaciones, técnicas y resultados, Revista Médica Clínica Las Condes, Volume 21, Issue 6, 2010. Pages 901-910,
Jorge L. Alio, Ana B. Plaza-Puche, Roberto Férnandez-Buenaga, Joseph Pikkel, Miguel Maldonado, Multifocal intraocular lenses: An overview, Surv Ophthal, 2017, Volume 62, 611-34
4 Referencias:
Reinstein DZ, Couch DG, Archer TJ. LASIK for hyperopic astigmatism and presbyopia using micro-monovision with the Carl Zeiss Meditec MEL80 platform. J Refract Surg. 2009 Jan;25(1):37-58. doi: 10.3928/1081597X-20090101-07. PMID: 19244952.
Reinstein DZ, Archer TJ, Gobbe M. LASIK for Myopic Astigmatism and Presbyopia Using Non-Linear Aspheric Micro-Monovision with the Carl Zeiss Meditec MEL 80 Platform. J Refract Surg. 2011 Jan;27(1):23-37. doi: 10.3928/1081597X-20100212-04. Epub 2010 Mar 1. PMID: 20205360.
Reinstein DZ, Carp GI, Archer TJ, Gobbe M. LASIK for presbyopia correction in emmetropic patients using aspheric ablation profiles and a micro-monovision protocol with the Carl Zeiss Meditec MEL 80 and VisuMax. J Refract Surg. 2012 Aug;28(8):531-41. doi: 10.3928/1081597X-20120723-01. PMID: 22869232.
5 Bibliografía:
Ryan A, O’Keefe M. Corneal approach to hyperopic presbyopia treatment: six-month outcomes of a new multifocal excimer laser in situ keratomileusis procedure. J Cataract Refract Surg. 2013;39:1226-1233.
Jorge L. Alio, Ana B. Plaza-Puche, Roberto Férnandez-Buenaga, Joseph Pikkel, Miguel Maldonado, Multifocal intraocular lenses: An overview, Surv Ophthal, 2017, Volume 62, 611-34
Waring GO 4th, Price FW Jr, Wirta D, McCabe C, Moshirfar M, Guo Q, Gore A, Liu H, Safyan E, Robinson MR. Safety and Efficacy of AGN-190584 in Individuals With Presbyopia: The GEMINI 1 Phase 3 Randomized Clinical Trial. JAMA Ophthalmol. 2022 Apr 1;140(4):363-371.
6 Referencias:
Grzybowski, A.; Ruamviboonsuk, V. Pharmacological Treatment in Presbyopia. J. Clin. Med. 2022, 11, 1385. https://doi.org/ 10.3390/jcm11051385
Al-Khersan H, Flynn HW Jr, Townsend JH. Retinal Detachments Associated With Topical Pilocarpine Use for Presbyopia. Am J Ophthalmol. 2022;242:52-55. doi:10.1016/j.ajo.2022.05.011
Reinstein DZ, Carp GI, Archer TJ, Gobbe M. LASIK for presbyopia correction in emmetropic patients using aspheric ablation profiles and a micro-monovision protocol with the Carl Zeiss Meditec MEL 80 and VisuMax. J Refract Surg. 2012 Aug;28(8):531-41. doi: 10.3928/1081597X-20120723-01. PMID: 22869232
Dispositivos de glaucoma no vallados

Coordinado por:
Dr. Gabriel Lazcano
Panelistas:

Dr. Juan Carlos Gutierrez
 Dr. Gustavo Espinoza
Dr. Gustavo Espinoza
¿Cómo es que funcionan los dispositivos no vallados para disminuir la presión intraocular en los pacientes con glaucoma?
Dr. Juan Carlos Gutierrez
Para decirlo en pocas palabras, básicamente son un tubo que comunica la cámara anterior con un plato que se encuentra localizado en el espacio subconjuntival, el área, el material y las características de este plato pueden variar en los diferentes implantes, pero al final se va a crear un reservorio de líquido ahí, dónde se absorbe el humor acuoso; que dependiendo de la técnica seleccionada para implantarlo, se permeabilizará totalmente en cierto momento (seleccionado por el cirujano).
Dr. Gustavo Espinoza
Estos dispositivos reducen la presión intraocular favoreciendo el drenaje del humor acuoso desde la cámara anterior hasta el espacio subconjuntival. Específicamente, los dispositivos de drenaje para glaucoma constan de un tubo que está conectado a un plato el cual se fija a la esclera y sobre el cual se forma un reservorio de humor acuoso.
¿Cuál es la diferencia en el manejo postoperatorio temprano entre los dispositivos valvulados y no valvulados para el tratamiento de glaucoma?
Dr. Juan Carlos Gutierrez
Los dispositivos valvulados empiezan a funcionar inmediatamente, esto te da la ventaja de lograr presiones bajas desde el momento de la cirugía, y hay condiciones específicas como el glaucoma neovascular en dónde esta característica es necesaria y se vuelve una ventaja, puedes dejar la cámara anterior totalmente llena de viscoelástico sin importar si es dispersivo o cohesivo y esto incluso te ayudará en el posoperatorio temprano. Sin embargo, tienes la limitación, a la larga, del área del plato del dispositivo que es más pequeño.
Con respecto a los dispositivos no valvulados, como se ha descrito en diferentes estudios tienen una tendencia a tener una tasa mayor de complicaciones tempranas como la hipotonía más frecuentemente, sin embargo esto se puede prever con la oclusión del tubo ya sea con vicryl, o como yo prefiero con nylon intraluminal y prolene; sin embargo, con cualquiera de estas técnicas de oclusión que elijas estás obligado a manejar tempranamente un tubo sin fluido y un dispositivo no funcionante aún, por lo que tienes que echar mano, ya sea de fenestraciones en la pared del tubo y/o el uso de medicamentos tópicos hipotensores tempranamente, mientras se logra liberar la oclusión del lumen del tubo; entonces algo que debes tomar en cuenta al momento de seleccionar el dispositivo a implantar es la pregunta: ¿Necesito bajar la presión inmediatamente o mi paciente tolera unas semanas de manejo hipotensor?
Dr. Gustavo Espinoza
La diferencia de principal es que los dispositivos no valvulados muchas veces requieren manejo hipotensor desde el postoperatorio inmediato ya que en la técnica operatoria se restringe el flujo de acuoso hacia el plato mientras que los no valvulados comienzan a funcionar desde un principio con una reducción de la presión intraocular inmediata. Otra de las diferencias es que pasadas las 4 a 6 semanas iniciales (periodo necesario para la formación de la cápsula fibrosa) en los dispositivos no valvulados debemos retirar las suturas que ocluyen el tubo, sea que estas estén en el interior del lumen del tubo o que estén externas y se retiren con láser. No obstante, algunos cirujanos utilizan suturas reabsorbibles para la oclusión del tubo con el fin de evitar la manipulación postoperatoria y que el drenaje de acuoso se produzca espontáneamente alrededor del mes.
¿Cuáles son las diferencias a largo plazo en términos de reducción de presión intraocular y número de medicamentos entre los dispositivos evaluados y no evaluados para el tratamiento de glaucoma?
Dr. Juan Carlos Gutierrez
Definitivamente para mantener cifras tensionales bajas a largo plazo el tamaño del plato es importante, y de los dispositivos no valvulados tenemos 250 mm y 350 mm, por el contrario con el valvulado estamos limitados a 184 mm, por lo cual no es difícil inferir que los platos más grandes se van a traducir clínicamente en presiones más bajas y/o menos medicamentos; otro aspecto a tomar en cuenta es la remodelación del quiste alrededor del plato, que ya se ha visto, produce quistes más permeables y menos gruesos si le damos tiempo suficiente sin el estímulo del flujo del humor acuoso y todos los mediadores que éste tiene a las vesícula, por lo que mantener el tubo ocluido en los dispositivos no valvulados también da una ventaja.
Dr. Gustavo Espinoza
Existen 2 ensayos clínicos aleatorizados con seguimiento a 5 años que fueron realizados para determinar las diferencias entre ambos grupos de dispositivos. Lo que se logró concluir de ambos estudios fue que la presión intraocular y la carga de medicamentos era más baja para el grupo de pacientes operados con dispositivos no valvulados. Sin embargo, esta mayor reducción de la presión intraocular venía acompañado de un mayor riesgo de falla asociada a complicaciones dentro de las cuales la principal era la hipotonía. Por ende, los autores de ambos estudios concluyeron que si el objetivo era reducir la presión intraocular de forma rápida en el contexto de una hipertensión ocular aguda, la mejor opción podría ser un dispositivo valvular. Por el contrario, si lo que se buscaba era una mayor reducción de la presión intraocular y de medicamentos a largo plazo en un caso de un paciente con un glaucoma crónico la mejor opción sería la de un dispositivo de drenaje no valvulado.
Consideraciones sobre cirugía de catarata
en pacientes con Distrofia de Fuchs

Dr. Arturo Kantor
Centro de la Visión
akantor@cev.cl
La Distrofia de Fuchs es una enfermedad de origen hereditario que afecta las capas profundas de la córnea, membrana de Descemet y células endoteliales tanto del punto de vista funcional como en su microestructura. Comienza en la década de los 30 años deteriorando la calidad visual primero por la irregularidad de Descemet (guttas y mayor refringencia) que aumentan la difracción y dispersión de la luz. Los pacientes se quejan de deslumbramiento a contraluz y pueden no alcanzar una agudeza visual perfecta a pesar de una adecuada corrección de su ametropía. Progresa causando baja de visión por edema estromal de la córnea, la cual es peor al despertar hasta que el edema estromal y epitelial bajan de forma constante la visión.
Cuando nos enfrentamos a la necesidad de operar de cataratas a un paciente portador de Distrofia de
Fuchs, habitualmente nuestra principal preocupación y esfuerzo está centrada en evitar descompensar una córnea que aún tiene buena transparencia y grosor. La cirugía de cataratas puede causar una disminución del recuento de células endoteliales especialmente en estos pacientes, entonces cuidamos al extremo el momento de operar evitando dejar que la catarata progrese demasiado en densidad o dureza, para reducir al máximo la energía utilizada al removerla. También prestamos atención a los detalles de la técnica quirúrgica. Por ejemplo, el tipo de incisión a usar para evitar desprendimientos de la Descemet, más frecuentes en Fuchs, uso de viscoelásticos tanto cohesivos como dispersivos, hacer la facoemulsificación en el saco capsular, lo más lejos posible del endotelio corneal o la técnica con láser (FLACS) para reducir la energía dentro la cámara anterior, solo por nombrar algunas opciones.
Sin embargo, fuera de cuidar la función endotelial hay una serie de elementos relevantes en la selección de tipo de LIO que se implantará que hacen que el proceso de toma de decisiones no sea igual al que se sigue en un paciente sin Distrofia de Fuchs. Una inadecuada selección de LIO puede deteriorar aún más la calidad visual de estos pacientes.
En esta condición, el astigmatismo corneal tanto anterior como posterior se va haciendo más asimétrico, generando mayor irregularidad en las aberraciones de alto orden de origen corneal a medida que la Distrofia de Fuchs va progresando en severidad. Se produce por un aplanamiento de la córnea inferior tanto en su cara anterior como posterior [1]. Esto hace menos predecible la corrección del astigmatismo corneal en el plano de LIO a través de lentes tóricas, por lo cual debe considerarse con atención si la magnitud de astigmatismo corneal justifica su corrección. En astigmatismo corneales sobre 2.5 dioptrías un LIO tórico reducirá el astigmatismo total del ojo sin eliminarlo por completo, pero a medida que el astigmatismo disminuye, los resultados dependerán más de la evolución de la córnea.
La mayor dispersión de la luz en pacientes con Distrofia de Fuchs producto de la alteración de la anatomía corneal, genera un deterioro de la calidad visual que se correlaciona más con la dispersión de la luz hacia anterior y posterior de la córnea, que con el aumento de las aberraciones de alto orden[2]. Esta condición hace poco aconsejable el uso de LIOs multifocales difractivas pues la suma de las aberraciones de alto orden de estos LIOS con las aberraciones de alto orden de la córnea, pueden deteriorar la calidad visual de manera significativa.
Debemos entonces considerar que, al operar de catarata a un paciente con un Fuchs compensado, la córnea seguirá siendo una de las causas de su peor calidad visual y este deterioro será progresivo. Aunque en las etapas iniciales el Fuchs no incide de forma relevante en el astigmatismo corneal, y se puede corregir con relativa buena predictibilidad, este se va haciendo más irregular a medida que la enfermedad progresa y el resultado refractivo inicial se va perdiendo en el mediano y largo plazo[3].
Si estimamos como alto el riesgo de requerir a futuro una queratoplastia endotelial (basado en los síntomas, rol de la córnea respecto de la catarata en la calidad visual, el seguimiento del recuento de células endoteliales y paquimetría), debemos tener presente que salvo que podamos asegurar que haremos un DMEK exitoso, las otras queratoplastias endoteliales en sus diversas variantes cambiarán el astigmatismo original que se pretendió corregir e inducirán también un cambio refractivo hipermetrópico que en promedio es de 1.25 dioptrías. Esto implica crear expectativas realistas en estos pacientes que esperan tener el mismo resultado refractivo de sus conocidos operados con lentes premium pero sin tener distrofia de Fuchs.
Referencias:
- Yoshinori Oie, Yuichi Yasukura, Nozomi Nishida, Shizuka Koh, Ryo Kawasaki, Maeda Naoyuki, Vishal Jhanji, Kohji Nishida, Fourier analysis on regular and irregular astigmatism of anterior and posterior corneal surfaces in Fuchs endothelial corneal dystrophy, AJOPHT 11598, PII: S0002-9394(20)30554-7 DOI: https://doi.org/10.1016/j.ajo.2020.09.045
- Hidenaga Kobashi, Kazutaka Kamiya, Kimiya Shimizu, Factors Influencing Visual Acuity in Fuchs’ Endothelial Corneal Dystrophy Optom Vis Sci 2018;95:21–26. DOI:10.1097/OPX.0000000000001157 Copyright © 2017 American Academy of Optometry
- Hideaki Yokogawa, P. James Sanchez, Zachary M. Mayko, MS, Michael D. Straiko,Mark A. Terry, Corneal Astigmatism Stability in Descemet Membrane Endothelial Keratoplasty for Fuchs Corneal Dystrophy, Cornea, Volume 35, Number 7, July 2016
Top Ten Cirugía Moderna Facorefractiva: la importancia del éxito
Top Ten Cirugía Moderna Facorefractiva:
la importancia del éxito

Dr Néstor Gullo, Jr
La Plata – Argentina
nestorgullo@icloud.com
Hoy en día la Cirugía Moderna de Catarata ha cambiado, es el procedimiento más frecuente y eficiente para corregir los defectos refractivos: Miopía-Hipermetropía-Astigmatismo y Presbicia.
Para lograr ese camino debemos tener un paciente optimizado, donde se conjuga, la tecnología, las expectativas, el estilo de vida y su estado clínico.
Considero que los TIPS DEL ÉXITO están en estos puntos:
- Explicación de la Cirugía de Catarata Refractiva
- Selección adecuada del paciente
- Medición del astigmatismo corneal
- Cálculo del Lente Intraocular
- Manejo del astigmatismo
- Uso correcto de Lentes para corregir la presbicia
Explicación de la cirugía de catarata refractiva
Una palabra puede marcar la diferencia, más simple es mejor.
Evitemos palabras como Monofocal (el paciente no logra a veces interpretar el concepto), es mejor usar términos como estándar o convencionales.
Evitemos el término de Premium, porque muchas veces sugiere que debe pagar para algo selectivo o de lujo, y los pacientes inconscientemente estarán menos inclinados a pagar una suma de dinero por algo que podría ser solo un lujo y no interpretar el valor real de lo que uno desea explicarle referente a las lentes intraoculares .
Es preferible hablar de tecnología avanzada, como lo son los productos electrónicos (televisores, computadoras).
No generemos altas expectativas, no comencemos diciendo: nunca más va a usar anteojos.
Comencemos preguntando que tipo de visión desearía el paciente con las lentes básicas (monofocales), le explicamos que logrará buena AV de lejos y va a necesitar anteojos de cerca en todas sus distancias. En cambio con las lentes multifocales o trifocales, va a ser mejor su visión en ese aspecto.
En estos casos, le suelo mostrar a mis pacientes una foto de la cabina de una avión moderno, para que vean la complejidad y la nueva tecnología: “Una imágen vale más que cien palabras”.
Explicar el Glare y el halo antes de operarlo.
TODO LO QUE SE DISCUTE “ANTES” DE LA CIRUGÍA SON “EXPECTATIVAS”.
TODO LO QUE SE DISCUTE “DESPUÉS” DE LA CIRUGÍA SON “COMPLICACIONES”.
Medición del Astigmatismo Corneal
Siempre más de una medida (Queratometría: manual, automatizada, topografía corneal).
La K manual y automatizada nos brinda información CUALITATIVA.
La Topografía de córnea nos da información CUALITATIVA y CUANTITATIVA.
Debemos lograr medir no solo cara anterior si no la cara posterior, lo cual es clave en pacientes con lentes tóricos.
Estos pacientes pueden experimentar una hipercorrección post operatoria en pacientes con astigmatismo a favor de la regla-(WTR).
Y una hipocorrección en pacientes con astigmatismo en contra de la regla (ATR).
La importancia de la Refracción Manifiesta (MR) : la misma puede darnos información sobre el astigmatismo, especialmente si el astigmatismo topográfico es mayor al astigmatismo de la refracción manifiesta en pacientes a favor de la regla y si el astigmatismo en la refracción manifiesta es mayor al astigmatismo topográfico en pacientes en contra de la regla.
(TOPO ASTIG > MR ASTIG EN WTR) (MR ASTIG > TOPO ASTIG IN ATR)
Perlas para el manejo del astigmatismo
Pensar en astigmatismo:
Primera consideración : ¿El paciente tiene astigmatismo tratable?
Considerar el astigmatismo antes de calcular la lente intraocular.
Calcular el astigmatismo antes que la corrección esférica.
Demostrarnos por qué no corregiría ese astigmatismo .
Lo ideal es reducir el astigmatismo <0.50 D post op .
Primera elección : Lente tórica
> 1.25 a WTR
> 0.75 a ATR
Cálculo del Lente Intraocular
Fundamental la optimización de la superficie ocular (preoperatoria, intraoperatoria, postoperatoria)
El ojo seco es el enemigo de la exactitud.
El ojo seco degrada la satisfacción de las lentes multifocales o trifocales.
Las estadísticas demuestran que el 92 % de los pacientes candidatos a cirugía de catarata presentan alguna Disfunción de la Glándula de Meibomio (MGD).
Nuestros pacientes siempre son evaluados y tratados y considerados para la cirugía moderna con lentes correctoras de presbicia (mínimo 1 mes con lágrimas y ciclosporinas).
Opciones terapéuticas (Inmunomoduladores, Lifitegrast, Ciclosporina, Otx-Ded,Loteprednol)
El estudio de Demodex es fundamental. Las estadísticas nos dicen que el 69 % de los pacientes con blefaritis tienen Demodex presente. El 60 % de los pacientes usan lágrimas. 51 % de usuarios de lentes de contacto. Ell 56 % de los pacientes con Catarata presentan Demodex y collaretes.
Debemos comparar las mediciones con el cálculo de lente intraocular .- Utilizamos los nuevos equipos tanto los TD-PCI (Iol master 500 , Lenstar 900, Pentacam AXL , Galilei G6) como los SS-OCT (Iol master 700, Argos, Anterion, Eyestar 900).
Si coinciden las mediciones procedemos, de lo contrario seguimos estudiando a nuestro paciente desde la superficie ocular y su córnea anterior y posterior, hasta lograr coincidencia en las medidas.
Las fórmulas modernas son muy útiles (Barrett Universal II,Hill RBF V3,0 , Kane – Ladas, EVO, Nallasamy, Hoffer QST….).
Parámetros tales como: pupilas grandes – mayores halos, pupilas pequeñas – impacta la visión de cerca, efecto EDOF. Ojos cortos- alta incidencia de error refractivo post op . Alto ángulo Kappa – reduce la calidad de la imagen.
La importancia de la pupilometría:
(Fotópica-Mesópica : Dinámica)
Ideales pupilas de 3 mm
Aquellas de 5 mm, se comportan de noche como un miope de – 1.50 D.
Aquellas de 7 mm, se comportan de noche como un miope de – 3 D.
El Valor real del Exámen Preoperatorio:
- El hallazgo de una patología previo a la cirugía implica una “expectativa” en el postopertorio.
- El hallazgo de la misma patología después de la cirugía es una “complicación”.
Todos estos “sistemas” nos ayudan realmente a conseguir una mayor eficacia en nuestras cirugías, sin embargo ninguno de ellos puede conseguir variar el CRITERIO MÉDICO, que prima por encima de la tecnología.
Vitrectomia Anterior en Ruptura Capsular Posterior durante Cirugía de Catarata: Abordaje Vía Anterior o Vía Pars Plana.
Vitrectomía Anterior en Ruptura Capsular Posterior durante Cirugía de Catarata:
Abordaje Vía Anterior o Vía Pars Plana.

Coordinador:
Dr. Manuel Nicoli, MD – Argentina
manuelnicoli@hotmail.com
Panelistas:

Dr. Guido Bregliano, MD – Argentina
guidobregliano@gmail.com
 Dr. Virgilio Centurión, MD – Brasil
Dr. Virgilio Centurión, MD – Brasil
centurion@imo.com.br
 Dra. Bruna Ventura, MD PhD – Brasil
Dra. Bruna Ventura, MD PhD – Brasil
brunaventuramd@gmail.com
La ruptura capsular posterior (RCP) con prolapso vítreo a cámara anterior durante la cirugía de catarata es una complicación de consideración que debe ser abordada para ser resuelta en forma efectiva. La vía que elegimos para realizar la vitrectomía anterior, ya sea vía anterior o vía pars plana, va a determinar los resultados postoperatorios a temprano y largo plazo, más aún si esa RCP se acompañan de caída de restos de cristalino al vítreo.1
Existen diversas opiniones entre los cirujanos de segmento anterior por cual vía debe encararse dicha complicación. Los cirujanos de segmento posterior recomiendan el abordaje vía pars plana, ya que sostienen que la extracción del vítreo de cámara anterior se realiza de una forma más fisiológica y segura para el cuerpo vítreo.
El manejo del vítreo en cámara anterior mediante vitrectomía anterior es un punto muy importante y crítico dentro de la formación quirúrgica de los oftalmólogos jóvenes.2 Con la llegada de la cirugía faco-refractiva, la utilización de lentes de última generación, y los equipos de facoemulsificación que mejoraron en forma sustancial la vitreo dinámica de los vitrectomos anteriores actuales, los cirujanos de segmento anterior nos vemos en el gran desafío de mejorar nuestra técnica quirúrgica, sumando la vitrectomía anterior como una herramienta más dentro de nuestro perfil quirúrgico.
En base a esto, formulamos 3 preguntas relacionadas al manejo de la RCP y su vía de resolución.
Dr. Virgilio Centurión
¿Cuándo se tiene una RCP con prolapso vitreo en cámara anterior durante la facoemulsificación, cuál es la vía de elección para realizar la vitrectomía anterior?
Vía Anterior.- Vía Pars Plana.
Comentarios:
- Es la vía más familiar al cirujano de catarata
- Es una complicación que vai de 1.0 – 2% por lo tanto foco frecuente
- Se utiliza incisión 1.0 -1.5 mm
¿Realiza la vitrectomía anterior en forma bimanual, colocando la irrigación por vía anterior?
Si.
No.
Comentarios:
En mi rutina opero todos los casos con la incisión principal (2.4 mm) a 125º, tanto en el ojo derecho como el izquierdo y la incisión auxiliar a 20º (1.00 mm) y hago una incisión a 150º (1.0 mm) cuando voy a realizar la vitrectomía.
¿Cuál es el seteo habitual que tiene su vitrectomo anterior para realizar la vitrectomía?
- Corte al máximo, Vacío moderado, Asp Flow bajo. Altura de botella baja.
- Corte al máximo, Vacío moderado, Asp Flow moderado. Altura de botella moderada.
- Corte, Vacío y Asp Flow bajos.
Otra: Corte 3.000 CPM, Vacío 280 mmHg, Asp Flow 10 cc/min, Presión 42 mmHg, Altura 57 cm.
Comentarios:
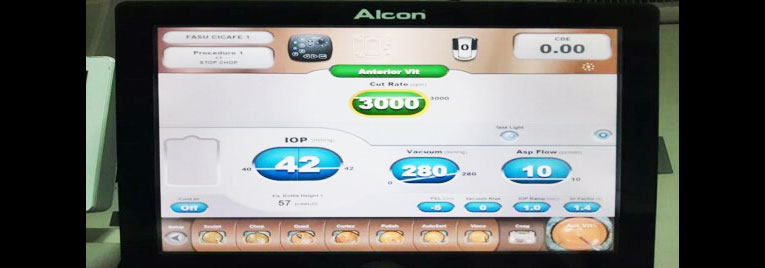 Personal
Personal
En +- 80% de mis cirugías utilizo Cicafe (Cirugía de catarata con Femtosegundo) y el Facoemulsificador Centurion System – Alcon, utilizado el módulo Faco Suave (Facosu) más conocido como Slow Motion Phaco.
En estudio retrospectivos personal de 3.868 cirugías, tuvimos 46 ojos con RCP que equivale a 1.26%, cuando realizamos vitrectomía anterior e implante de Lio monofocal 3 piezas en sulcus ciliaris con los siguientes resultados: EE residual +- 1.0 D = 80.44%, AV c/c ≥ 20/40 = 71.74%, comorbilidad asociada: 26.09%
Prevención de ruptura capsular:
- Cuando la visualización es difícil / limitada de la cápsula por opacidad corneal, catarata total, poca dilatación de pupila!
- Fragilidad zonular
- Técnica quirúrgica “agresiva”
Durante la cirugía
Sospecha / diagnóstico de RCP
- Inyectar VE dispersivo por la incisión auxiliar
- Cancelar irrigación y retirar facoemulsificador
- Evaluación – Vítreo, Restos de núcleo, Resto(s) capsular
- Vitrectomia anterior, bimanual, Slow motion, triancinolona, …..
- Implante de LIO en sulcus ciliaris. Todas mis cirugías tienen una opción para implante en sulcus ciliaris con -1.00 dioptría, Lio de 3 piezas, esférica.
- Núcleo / restos en vítreo, enviar al retinólogo
- Fijación escleral en 2º tiempo
Dra. Bruna Ventura
¿Cuándo se tiene una RCP con prolapso vítreo en cámara anterior durante la facoemulsificación, cuál es la vía de elección para realizar la vitrectomía anterior?
Vía Anterior.- Vía Pars Plana.
Comentarios:
Mi vía de elección es la anterior. Haciéndola de manera optimizada y con la técnica correcta, esta vía es efectiva y no hay por qué tener tracción retiniana.
¿Realiza la vitrectomía anterior en forma bimanual, colocando la irrigación por vía anterior?
Si.
No.
Comentarios:
Sí, en general entro con el vitrector por la incisión principal y posicionar la infusión por la paracentesis. Todavía, antes de posicionar mi infusión en el ojo, hago una vitrectomía en seco, llenando el ojo a penas con viscoelástico y reponer viscoelástico siempre que sea necesario. Después de ya haber logrado remover el vítreo (o grande parte de él) que estaba anteriorizado a través de la RCP, posiciono mi infusión y completo la vitrectomía.
¿Cuál es el seteo habitual que tiene su vitrectomo anterior para realizar la vitrectomía?
- Corte al máximo, Vacío moderado, Asp Flow bajo. Altura de botella baja.
- Corte al máximo, Vacío moderado, Asp Flow moderado. Altura de botella moderada.
- Corte, Vacío y Asp Flow bajos.
Otra:
Comentarios:
Mi seteo habitual consiste de corte iniciando en 2500 y subiendo hasta 5000, vacío moderado y aspiration Flow moderado. Altura de botella moderada. A pesar de la triamcinolona poder ser utilizada para ayudar en la visualización vítrea y guiar la vitrectomía, no veo necesidad de utilizarla de rutina en estos casos de RCP con pérdida vítrea – y es raro que la utilice con esta finalidad. De una manera general, es posible identificar sin dificultades él vítreo que necesita ser removido del ojo. Entretanto, si estás en duda si quitase todo él vitreo efectivamente, puedes lanzar mano de la triamcinolona o utilizar una espátula de iris para confirmar si todavía hay bandas vítreas a ser abordadas. Al final de la cirugía siempre termino cerrando la pupila con miostático, y en estos ojos me gusta dar un punto con Nylon 10-0 para asegurar la estabilidad de la incisión y evitar que cualquier descompresión de la cámara anterior resulte en anteriorización vítrea y él direccionamiento de nuevas bandas vítreas hasta la incisión principal.
Dr. Guido Bregliano
¿Cuándo se tiene una RCP con prolapso vítreo en cámara anterior durante la facoemulsificación, cuál es la vía de elección para realizar la vitrectomía anterior?
Vía Anterior.- VíaPars Plana.
Comentarios:
El objetivo principal en una ruptura capsular posterior, con prolapso vítreo anterior, es remover completamente todo el vítreo en cámara anterior. El manejo correcto de la vitrectomía completa disminuye significativamente la incidencia de complicaciones intra y postoperatorias.
Mi técnica quirúrgica de elección es la vitrectomía por pars plana con un infusor en cámara anterior. Coloco un trocar 23 g a traves de pars plana (a 3.5 mm del limbo), coloco un infusor de cámara anterior a través de una paracentesis corneal, y realizo una vitrectomía completa a nivel del segmento posterior trayendo todo el vítreo en cámara anterior hacia la punta del vitrectomo en el segmento posterior.
Un estudio de Thortnton Snyder Et. Al. analizó 348 ojos con ruptura capsular posterior y pérdida vítrea, y confirmó la eficacia clínica, la seguridad y la fiabilidad del abordaje de la pars plana para la vitrectomía anterior en comparación con los datos históricos de los abordajes de vitrectomía anterior bimanual limbar. Esta gran serie de casos demostró que el abordaje de la pars plana produce una menor incidencia de desprendimiento de retina, edema macular cistoideo, uveítis, hipertensión ocular, inestabilidad de la LIO y endoftalmitis postoperatoria.
Long-term safety and efficacy of single-port pars plana anterior vitrectomy with limbal infusion during anterior segment surgery / Thornton, Ivey L. MD; McMains, Brian K. MS*; Snyder, Michael E. MD / Journal of Cataract & Refractive Surgery 44(7):p 878-883, July 2018
¿Realiza la vitrectomía anterior en forma bimanual, colocando la irrigación por vía anterior?
Si.
No.
Comentarios:
La vitrectomía anterior bimanual la realizó, únicamente, en los casos donde la pérdida vítrea es muy leve, cuando la ruptura capsular posterior es pequeña y hay muy poco prolapso vítreo anterior. En estos casos una vitrectomía anterior bimanual completa suele tener muy buenos resultados, siempre y cuando no se generen maniobras bruscas que puedan generar tracciones vítreo retinales y renovamos completamente todo el vítreo de cámara anterior. La utilización de Triamcinolona (40 mg/ml) es muy útil para la visualización del vítreo.
¿Cuál es el seteo habitual que tiene su vitrectomo anterior para realizar la vitrectomía?
- Corte al máximo, Vacío moderado, Asp Flow bajo. Altura de botella baja.
- Corte al máximo, Vacío moderado, Asp Flow moderado. Altura de botella moderada.
- Corte, Vacío y Asp Flow bajos.
Otra:
Comentarios:
El máximo de cortes por minuto (CPM) que me permita el equipo y su vitrectomo. Solo bajo los CPM cuando necesito aspirar algún fragmento del cristalino.
Bajo los valores de la aspiración y el vacío para disminuir las tracciones vitreorretinianas durante la vitrectomía. Altura de la botella baja a moderada, pero con una irrigación necesaria para que no se descomprima la cámara anterior y se extienda la ruptura capsular con mayor pérdida de vítreo.
Bibliografía:
Naderi K, Allen F, Dowlut S, Karia N, Chandra A. Graefes Arch Clin Exp Ophthalmol. 2020; 258(11):2425-9.
Bregliano G, Emiliozzi N, Nicoli M, Zas M, Alezzandrini A. Disminución de la incidencia de ruptura capsular posterior en la cirugía de catarata luego de implementar un protocolo de entrenamiento para residentes. Revista Sociedad Colombiana de Oftalmología. Vol.53(2):72-78.











