Editorial: Optimizando la Visión: Estrategias Avanzadas para el manejo del Astigmatismo en cirugía de lentes intraoculares (fáquicos y pseudofáquicos)

Luis Izquierdo Jr. MD, PhD1
Gustavo Hernández Sahagún MD1
La optimización de la calidad visual en la cirugía de lentes fáquicos y catarata plantea una pregunta: ¿Cuál es la cirugía más precisa para corregir el astigmatismo?
La cirugía del astigmatismo ha experimentado una evolución marcada durante los últimos años, con dos enfoques predominantes: la corrección en el plano corneal o el implante de lentes intraoculares tóricos. Ambas buscan proporcionar una visión nítida y libre de distorsiones, pero la precisión refractiva es el factor determinante en los resultados visuales postoperatorios.
El astigmatismo corregido mediante la cirugía querato-refractiva por excimer laser o femtosegundo ofrece una precisión micrométrica al abordar directamente la curvatura corneal irregular asociada, alcanzando hasta un 93-95% de pacientes con Agudeza visual sin corrección (AVSC) ≥ 20/20(1). Mostrando resultados mucho más precisos que la corrección tórica con lente intraocular.
No se han encontraron diferencias en el astigmatismo residual promedio entre las incisiones relajantes limbares y las LIO monofocales tóricas en bajas dioptrías (2), se ha observado que entre mayor sea el astigmatismo preoperatorio, el astigmatismo residual de un lente tórico es mayor (3), esto debido a problemas ya descritos , como la inexactitud en el marcado previo, la rotación intra y post-operatoria(4,5), así como problemas logísticos, ya que cuando se quieren usar lentes Fáquicos tóricos o LIOs Tóricas trifocales, o EDOF estas usualmente no se encuentran en stock en nuestras salas quirúrgicas. Por eso surgió la pregunta: ¿Es necesario conformarnos con un astigmatismo residual? En nuestra experiencia los resultados visuales y refractivos se muestran a favor del manejo del astigmatismo en el plano corneal (Fig1)
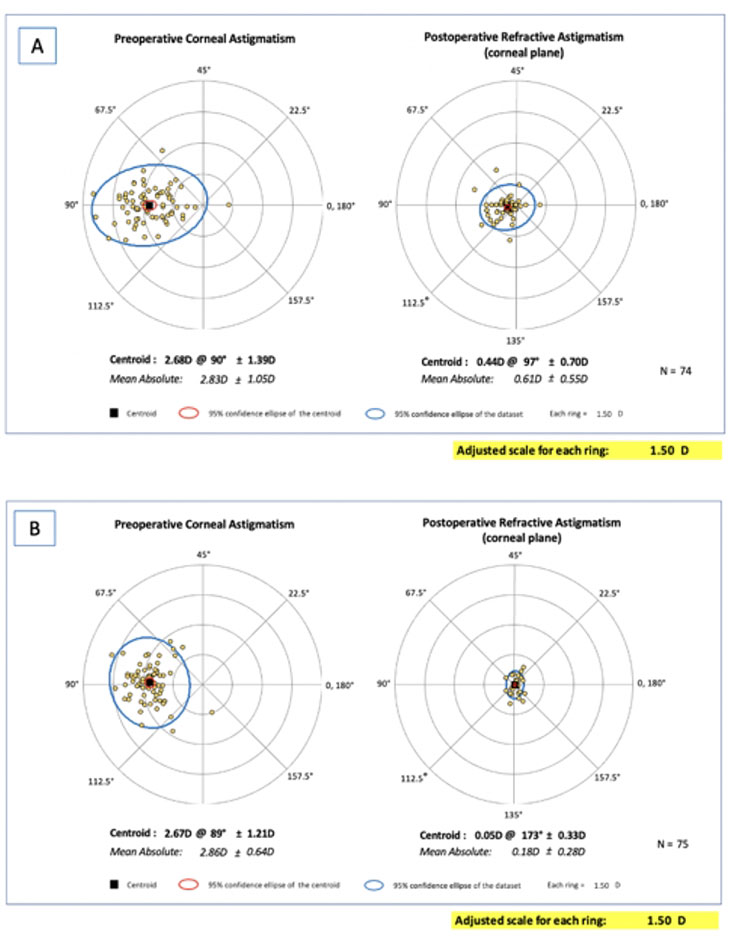 Fig 1. A) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a implante de ICL. B) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a la corrección con LASIK.
Fig 1. A) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a implante de ICL. B) Double angle plot que muestra la distribución pre y post operatoria del astigmatismo refractivo, posterior a la corrección con LASIK.
Este gráfico es parte de un estudio en el cual demostramos estadísticamente mayor precisión de la corrección en el plano corneal usando el excimer láser vs implante de lente fáquicos tórico retro-iridiano.
Debido a esto, describimos un nuevo enfoque bióptico para el manejo del astigmatismo en la cirugía de lentes fáquicos y con posibilidad en pseudofáquicos, que combina la cirugía querato-refractiva (extracción lenticular por láser de femtosegundo o LASIK asistido por femtosegundo) con el implante de lentes intraoculares. Esta técnica se beneficia de la compensación de la ciclotorsión estática y dinámica y elimina el error rotación de las lentes intraoculares tóricas, obteniendo un mejor pronóstico visual y así mismo adecuarlo a los lentes esféricos que tengamos disponibles.
Los procedimientos biópticos combinan técnicas refractivas en dos sitios topográficos (córnea y cristalino) para tratar errores refractivos(6,7).
La cirugía querato-refractiva con implante de lentes intraoculares pseudofáquicos o fáquicos, que llamamos protocolo “LIMA protocol” (Lenticule Intraestromal Management of Astigmatism), es una nueva técnica de cirugía combinada donde se corrige todo el defecto astigmático total mediante cirugía de extracción del lentículo corneal. El resto del error esférico se corrige con una LIO fáquica o pseudofáquica en el mismo acto quirúrgico de acuerdo al caso.
Otra posibilidad si no tuviéramos acceso a una plataforma de Femto con opción lenticular podemos realizar un flap de LASIK asistido por femtosegundo sin levantar por completo el borde (para evitar el riesgo de pliegues o no adherencia de este flap si realizamos un implante de lio, recordemos que el flap se adhiere por el buen funcionamiento de la bomba endotelial es decir al colocar el lente intraocular esta se altera y aumenta ese riesgo: esa es la razón de no realizar el flap con un microqueratomo en este protocolo),
Todo esto con el fin de poder ablacionar el estroma corneal posterior a la colocación del lente intraocular de forma inmediata, eliminando el riesgo de abertura de la incisión corneal provocada por el elevado vacío durante el momento del corte en el LASIK.
Esta opción de técnica no solo evitaría las complicaciones inherentes a la implantación de lentes intraoculares tóricos, sino que también minimizaría la necesidad de procedimientos secundarios.
Estos, como otros, son esfuerzos con el fin de lograr mejores resultados refractivos post operatorios de las cirugías intraoculares; y así acercarnos a los resultados logrados por ablaciones guiadas por láser en la córnea.
“La curiosidad (y la búsqueda de la perfección) nos sigue guiando por nuevos caminos.
Walt Disney
Referencias:
SONG, Jiaxin, et al. Small Incision lenticule extraction (SMILE) versus laser-assisted stromal in situ keratomileusis (LASIK) for astigmatism corrections: a systematic review and meta-analysis. American Journal of Ophthalmology, 2023, vol. 247, p. 181-199.
VISSER, Nienke, et al. Accuracy of toric intraocular lens implantation in cataract and refractive surgery. Journal of Cataract & Refractive Surgery, 2011, vol. 37, no 8, p. 1394-1402.
AL-MOHTASEB, Zaina, et al. Toric Monofocal Intraocular Lenses for the Correction of Astigmatism during Cataract Surgery: A Report by the American Academy of Ophthalmology. Ophthalmology, 2023.
KESHAV, Vinny; HENDERSON, Bonnie An. Astigmatism management with intraocular lens surgery. Ophthalmology, 2021, vol. 128, no 11, p. e153-e163.
VISSER, Nienke, et al. Cataract surgery with toric intraocular lens implantation in patients with high corneal astigmatism. Journal of Cataract & Refractive Surgery, 2011, vol. 37, no 8, p. 1403-1410.
Leccisotti A. Bioptics by angle-supported phakic lenses and photorefractive keratectomy. Eur J Ophthalmol. 2005;15:1-7.
Zaldivar R, Davidorf JM, Oscherow S, Ricur G, Piezzi V. Combined posterior chamber phakic intraocular lens and laser in situ keratomileusis: bioptics for extreme myopia. J Refract Surg. 1999 May-Jun;15(3):299-308. doi: 10.3928/1081-597X-19990501-04.
Kamiya, K. Shimizu, H. Kobashi, A. Igarashi, and M. Komatsu, “Three-year follow-up of posterior chamber Toric phakic intraocular lens implantation for moderate to high myopic astigmatism,” PLoS One, vol. 8, no. 2, Article ID e56453, 2013.






















 Dr. CARLOS PALOMINO BAUTISTA
Dr. CARLOS PALOMINO BAUTISTA


 Por Dr. Omar López Mato
Por Dr. Omar López Mato La Batalla de Alejandro en Issos • Albrecht Altdorfer • 1529
La Batalla de Alejandro en Issos • Albrecht Altdorfer • 1529 Detalle de la obra
Detalle de la obra Batalla de San Romano • Paolo Uccello • 1456 • Museo del Louvre, París, Francia.
Batalla de San Romano • Paolo Uccello • 1456 • Museo del Louvre, París, Francia. David • Donatello • 1408/09 • Museo Nazionale del Bargello,
David • Donatello • 1408/09 • Museo Nazionale del Bargello, 
 Dr. Gerardo Valvecchia
Dr. Gerardo Valvecchia  Dr. Ramiro Medina Boiko.
Dr. Ramiro Medina Boiko. Dr. David Flicker
Dr. David Flicker
 2.¿Cuál de las siguientes no es causa de descentración de la lente intraocular?
2.¿Cuál de las siguientes no es causa de descentración de la lente intraocular? 3. ¿Cuál considera que es la fórmula para el cálculo de lente intraocular que predice con mayor precisión la posición efectiva de la lente?
3. ¿Cuál considera que es la fórmula para el cálculo de lente intraocular que predice con mayor precisión la posición efectiva de la lente?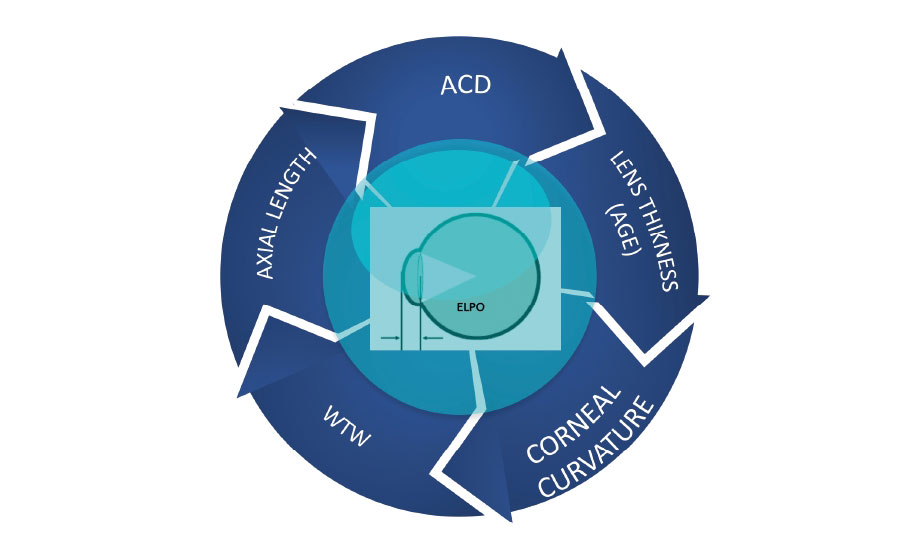

 Dra. Rachel Gómez
Dra. Rachel Gómez Dr. Luis Brenner – Noruega
Dr. Luis Brenner – Noruega Dra. Leila Gouvea – Brasil
Dra. Leila Gouvea – Brasil
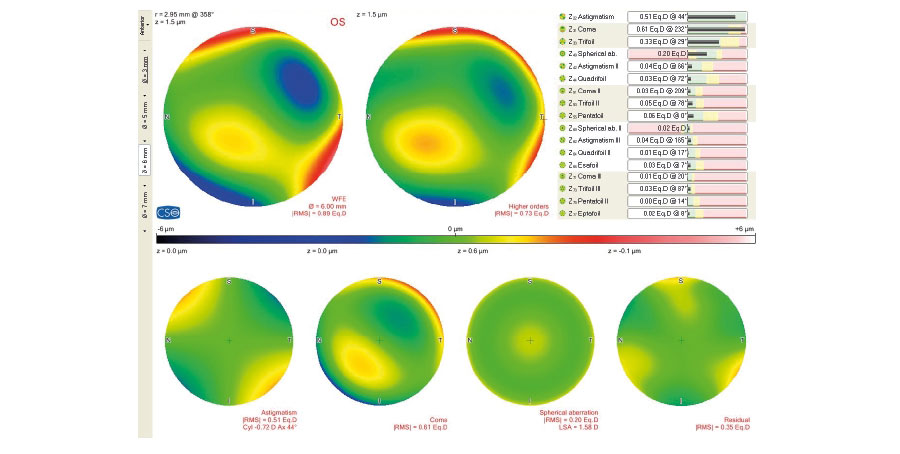 2. ¿Cuál examen preoperatorio es más importante para definir si el implante de lentes trifocales es adecuado o no?
2. ¿Cuál examen preoperatorio es más importante para definir si el implante de lentes trifocales es adecuado o no?


 Adoración del nombre de Jesús (conocido como Alegoría de la Liga Santa y El sueño de Felipe II) • El Greco • 1577 Monasterio de El Escorial, Madrid, España.
Adoración del nombre de Jesús (conocido como Alegoría de la Liga Santa y El sueño de Felipe II) • El Greco • 1577 Monasterio de El Escorial, Madrid, España. Inmaculada de Soult • Bartolomé Esteban Murillo •1678
Inmaculada de Soult • Bartolomé Esteban Murillo •1678 Escena 1: “Eduardo el Confesor da instrucciones a Harold el Sajón” Tapiz de Bayeux • 1066 Museo de La Tapisserie, Bayeux, Normandía., Francia
Escena 1: “Eduardo el Confesor da instrucciones a Harold el Sajón” Tapiz de Bayeux • 1066 Museo de La Tapisserie, Bayeux, Normandía., Francia
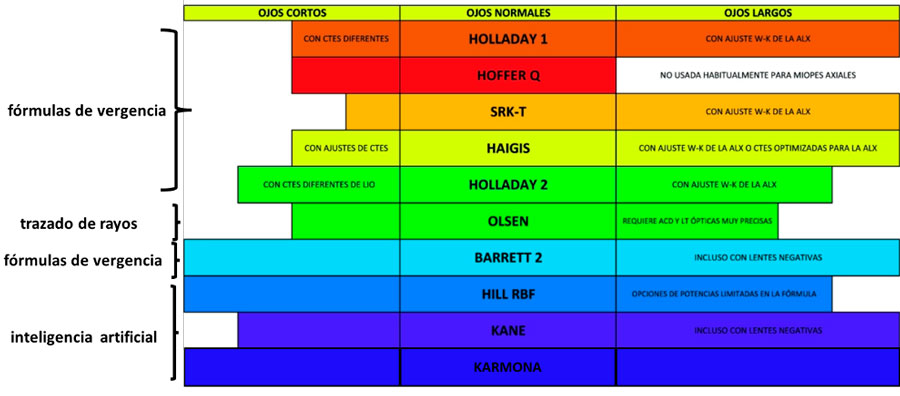
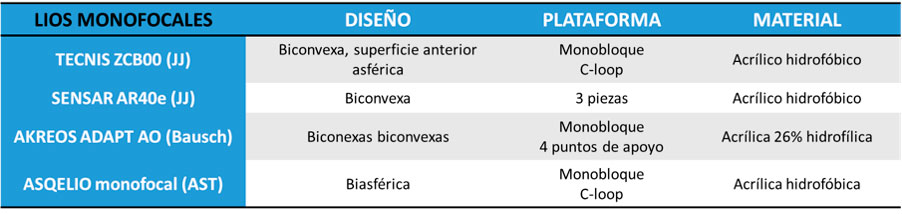
 Tabla 2. Lentes intraoculares monofocales plus y sus principales características
Tabla 2. Lentes intraoculares monofocales plus y sus principales características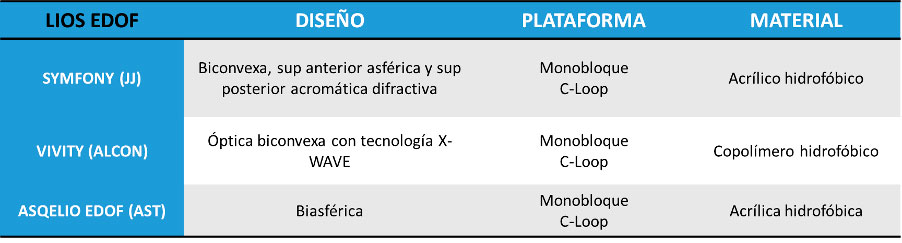 Tabla 3. Lentes intraoculares EDOF y sus principales características
Tabla 3. Lentes intraoculares EDOF y sus principales características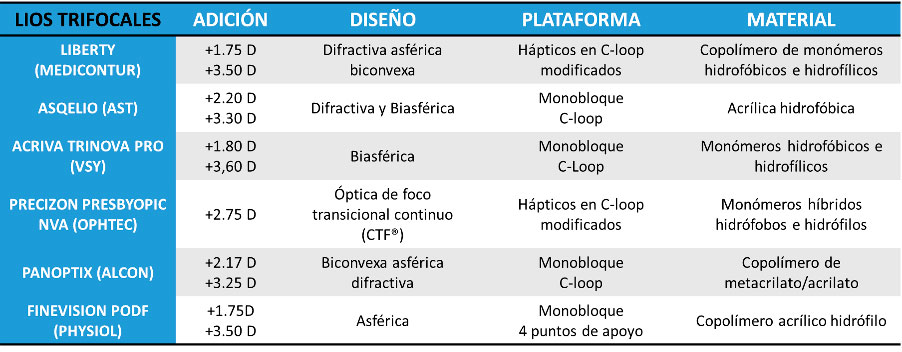 Tabla 4. Lentes intraoculares trifocales y sus principales características
Tabla 4. Lentes intraoculares trifocales y sus principales características