Introducción
El implante de lentes intraoculares (LIO) trifocales en pacientes sometidos a cirugía de cataratas o cristalino ha mejorado los resultados visuales a diferentes distancias, de lejos a cerca, ampliando el rango de visión útil y permitiendo la independencia de las gafas. El beneficio de usar estos lentes en términos de desempeño visual ha sido señalado en varias revisiones sistemáticas y metaanálisis.
La mejora en la agudeza visual a distancia intermedia es considerablemente mejor que la encontrada en pacientes implantados con lentes bifocales [13]. Dada la creciente cantidad de tiempo que las personas mayores de 45 años dedican a actividades que requieren una visión intermedia, como trabajar con la computadora o cocinar, hay un número cada vez mayor de pacientes implantados con estos lentes en todo el mundo que mejoran la visión intermedia mientras mantienen la visión de lejos.
La determinación de la agudeza visual a través del foco a diferentes distancias (curva de desenfoque) es un procedimiento clínico cada vez más común que ha demostrado ser de gran utilidad para la evaluación del desempeño clínico de una LIO en diferentes vergencias, particularmente aquellos diseños destinados a compensar la presbicia. (es decir, LIO bifocales, trifocales o con mayor profundidad de foco) [4–10]. Entre las métricas que se pueden extraer de los datos contenidos dentro de la curva de desenfoque, la profundidad de campo (DOF) que la lente implantada proporciona al paciente es una de las que mejor permite caracterizar el comportamiento clínico de la LIO. DOF se refiere al rango de distancias (vergencias desde la curva de desenfoque) donde se puede ver un estímulo sin una degradación significativa de la imagen retiniana. Por lo tanto, los valores grandes de DOF se correlacionan con el mejor rendimiento visual a diferentes distancias.
Sin embargo, es importante definir el criterio de agudeza visual que se considera como valor de corte. Informes recientes anteriores utilizaron 0,1 logMAR como umbral para definir la tolerancia al desenfoque [8, 10]; sin embargo, se pueden utilizar otros valores de agudeza visual y, por lo tanto, se pueden obtener diferentes valores de DOF en la literatura revisada por pares de LIO para corregir la presbicia.
Otros autores utilizaron un criterio menos restrictivo para definir el DOF absoluto, sugiriendo valores de agudeza visual ≤0,3 logMAR [11] ya que ese valor se considera nominalmente como un estándar adecuado de visión lejana para conducir, o un criterio relativo más restrictivo considerando un decaimiento de 0,04 logMAR de la mejor agudeza visual como punto de referencia para la tolerancia individual.
Por lo tanto, el objetivo principal del presente estudio fue evaluar el desempeño clínico de una nueva LIO trifocal hidrofóbica blanda de una sola pieza, analizando el DOF mediante el análisis de la curva de desenfoque utilizando diferentes criterios de agudeza visual. Además, también se determinaron la refracción posoperatoria, los resultados de agudeza visual a diferentes distancias y la satisfacción del paciente.
Métodos
Este fue un estudio prospectivo que involucró a pacientes a los que se les implantó bilateralmente una LIO trifocal (Asqelio™ Trifocal, AST Products Inc., Billerica, MA, EE. UU.). Estos LIO se implantaron después de la extracción de cataratas o de lentes transparentes con facoemulsificación y estaban destinados a la emetropía. Los criterios de inclusión para la inscripción incluyeron 40 años de edad o más, sin enfermedad ocular activa excepto catarata, Ojo seco no grave, posible agudeza visual a distancia mejor corregida (CDVA) posoperatoria de 0,66 decimales (0,17 logMAR) o mejor, cirugía de cataratas sin incidentes y proceso de curación posoperatorio, cápsula posterior transparente e implante de lente, sin anomalías pupilares, capacidad para leer y comprender el consentimiento informado y los cuestionarios de satisfacción. Los criterios de exclusión fueron astigmatismo corneal irregular, cirugía refractiva corneal o intraocular previa, anomalías corneales, dislocación del LIO, opacificación de la cápsula posterior o cualquier enfermedad vítrea o retiniana.
Los participantes fueron reclutados del Hospital Univer sitario Quirón (Madrid, España), recibieron instrucciones sobre el propósito del estudio y los procedimientos utilizados y firmaron un formulario de consentimiento antes de la inscripción formal. De acuerdo con la Declaración de Helsinki, el protocolo del estudio fue revisado y aprobado por el Comité de Ética Institucional.
Lente intraocular
A todos los pacientes se les implantó la LIO modelo TFLIO130C Asqelio™ Trifocal (AST Products Inc., Billerica, MA, EE. UU.). Esta LIO tiene una geometría biasférica, con un diseño óptico disfractivo posterior (16 anillos dentro de los 4,5mm centrales) en su zona óptica de 6,0 mm de diámetro. Tiene un diámetro total de 13,0 mm y proporciona una adición de +3,30 dioptrías (D) para cerca y +2,20 D para distancias intermedias. El lente está construido en potencias que van desde +5.00 a + 34.00D en incrementos de 0.50D, plataforma CLoop y con una distribución de luz entre sus focos de 50% para lejos, 24% para intermedio y 26% para cerca. Está hecho de material acrílico hidrofóbico SOF (sin brillo) con un índice de refracción de 1,50, un número de Abbe de 50 y una aberración esférica de −0,27 µm.
Procedimientos clínicos
Antes de la cirugía, los pacientes se sometieron a un examen oftalmológico completo que incluía biometría óptica y tomografía óptica de superficie anterior para el cálculo de la potencia de la LIO. La biometría se determinó con el IOLMaster 700 (Carl Zeiss Meditec AG, Alemania). El dispositivo utiliza tecnología de tomografía de coherencia óptica de fuente de barrido , con una longitud de onda de 1050 nm, para determinar la longitud axial, la profundidad de la cámara anterior y el grosor de la córnea y del cristalino. Además, el sistema proporciona lecturas queratométricas mediante el análisis de la morfología de la córnea.
El cálculo de la LIO se realizó utilizando los parámetros biométricos proporcionados por el IOLMaster y aplicando la fórmula Barrett II Universal. En todos los casos se eligió la potencia de la LIO que arrojaba los valores miopes más cercanos a cero. No se aplicaron restricciones con respecto a la longitud axial. Por el contrario, solo aquellos pacientes. Se incluyeron los que necesitaban una potencia de LIO dentro del rango + 13 a + 28 D.
Procedimiento quirúrgico
Los procedimientos quirúrgicos fueron realizados por el mismo cirujano experimentado (CP) bajo anestesia local a través de una microincisión de 2,2 mm. Los procedimientos quirúrgicos con implantación de LIO se realizaron con una diferencia de 7 días en promedio entre ojos. Todos los pacientes fueron sometidos a cirugía de catarata por facoemulsificación según procedimientos de práctica clínica habitual. La cirugía fue realizada por el mismo cirujano experimentado en todos los casos (CPB).
Aunque la presencia de complicaciones quirúrgicas se consideró dentro de los criterios de exclusión, no se observaron complicaciones quirúrgicas en la muestra reclutada.
Evaluación posoperatoria
Se examinó a los pacientes después de la implantación de la LIO según las visitas de seguimiento posoperatorias habituales. Durante estas visitas, se revisa el estado visual y ocular del paciente para descartar la existencia de complicaciones médicas o sorpresas relacionadas con la LIO que puedan afectar los resultados.
La agudeza visual se determinó con y sin la mejor compensación por distancia (UDVA y CDVA). Después de la operación, se realizaron mediciones de UCDVA, CDVA y distancias intermedias (CDIVA, 67 cm) y de cerca (CDNVA, 40 cm) mejor corregidas para la distancia utilizando la tabla de visión retroiluminada ETDRS para distancia con Sloan.
Las curvas de desenfoque se obtuvieron monocularmente de todos los participantes en condiciones fotópicas a los 3 meses de la operación, siguiendo la metodología descrita por los autores en informes anteriores [10]. El tamaño de paso en dioptrías fue de 0,50 D, con un rango de +3,00 a −5,00 D. La AV se midió en escala logMAR y el optotipo utilizado fue ETDRS (Precision Vision, Illinois, EE. UU.) a 4 m. Todos los participantes fueron medidos con la mejor corrección por distancia para compensar cualquier error de refracción residual.
La tolerancia subjetiva al desenfoque se determinó a partir del análisis de las curvas de desenfoque, utilizando valores absolutos y criterio relativo. El criterio absoluto se obtuvo de aquellas vergencias (en D) que proporcionaron valores de agudeza visual ≤ 0,1 logMAR y el criterio relativo se obtuvo considerando aquellas vergencias (en D) que proporcionaron un decaimiento de 0,1 logMAR de la mejor agudeza visual de cada sujeto, tal como se utilizó por los autores en estudios previos [8, 10]. Adicionalmente, se aplicó un segundo criterio menos restrictivo para determinar la GDL absoluta, considerando aquellas vergencias que proporcionaran valores de agudeza visual ≤0.3 log MAR [11], y el criterio relativo más restrictivo considerando aquellas vergencias (en D) que proporcionaran un decaimiento de 0,04 logMAR de la mejor agudeza visual de cada sujeto [4].
Satisfacción
Se pidió a los pacientes que calificaran su nivel de satisfacción en una escala de 0 a 10, siendo 10 completamente satisfecho. En concreto, se les pidió que calificaran su satisfacción con su visión binocular global, su visión de lejos, su visión intermedia y su visión de cerca. Además, se les pidió que calificaran el nivel de percepción y la cantidad de halos después de la implantación de LIO en una escala de 0 a 10, siendo 0 no percibía/le molestaban los halos y 10 estaba muy preocupado por los halos.
Análisis estadístico
El análisis estadístico de los resultados se llevó a cabo utilizando IBM® SPSS® para Mac v.26.0.0 (SPSS Inc., Chicago, IL). Se utilizó el análisis de varianza para evaluar las diferencias en el error de refracción después del procedimiento quirúrgico. Se utilizaron pruebas t de muestras pareadas para evaluar las diferencias en AV. Todas las pruebas estadísticas fueron de 2 colas y los valores de p inferiores a 0,05 se consideraron estadísticamente significativos. Como los cuestionarios de satisfacción no fueron validados, las respuestas no se incluyeron en el análisis estadístico, pero los resultados se informaron como porcentajes.
Resultados
Un total de 25 pacientes de cirugía de cataratas a los que se les implantaría binoculares, la LIO Trifocal Asqelio se inscribieron en el estudio (15 mujeres y 10 hombres). Las estadísticas descriptivas de la muestra se muestran en la Tabla 1.
Refracción postoperatoria
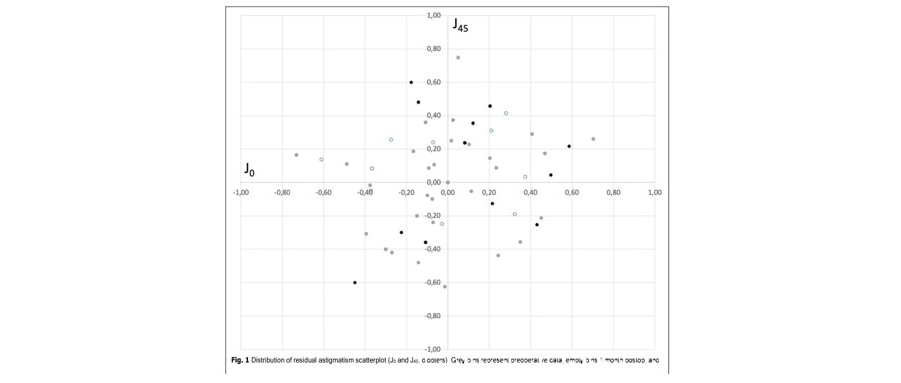
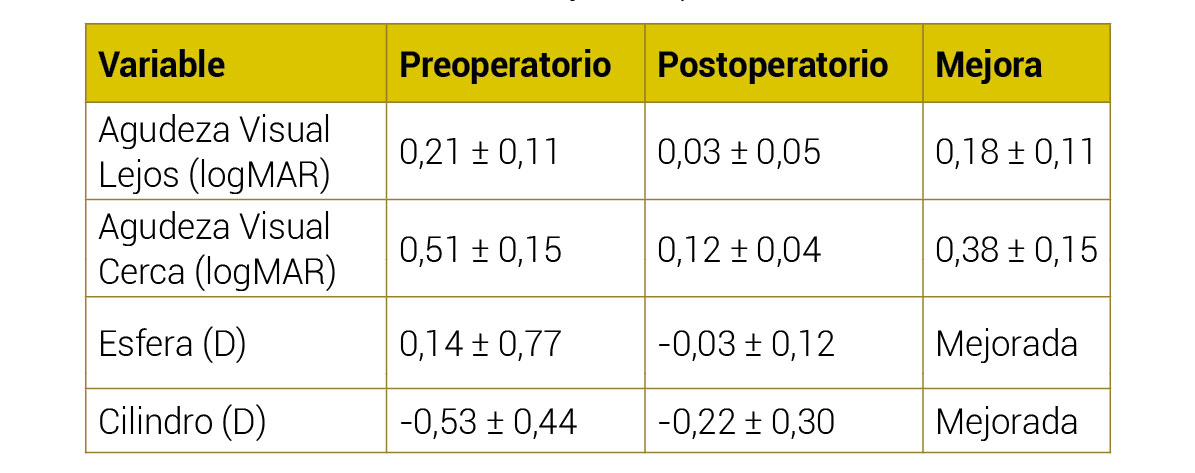
El equivalente esférico promedio fue de 0,08 ± 0,34 D al mes (rango 0,50 a + 0,75 D) y 0,05 ± 0,23 D a los 3 meses (rango 0,50 a + 0,75 D) después de la operación. El cilindro residual promedio fue de 0,44 ± 0,41 D al mes (rango 0 a 1,25 D) y 0,38 ± 0,48 D a los 3 meses (rango 0 a 1,5) después de la cirugía. La Figura 1 muestra la distribución del astigmatismo residual. El análisis de varianza de los componentes astigmáticos J0 y J45 no reveló diferencias estadísticamente significativas en el preoperatorio y postoperatorio (p> 0,05).
Tabla 1 Estadísticos descriptivos de la muestra
| Edad (años) |
Significar |
Dakota del Sur |
Rango |
| 57 |
7 |
46 a 71 |
| Esfera preoperatoria (D) |
0,29 |
1.72 |
+ 2,75 a −5,25 |
| Cilindro preoperatorio (D) |
−0,59 |
0.48 |
0 a −1,5 |
| Plano K (D) |
43.46 |
1.38 |
40,61 a 46,95 |
| Empinada K (D) |
44.18 |
1.37 |
41,13 a 47,67 |
| CDA (mm) |
3.08 |
0.34 |
2.29 a 4.27 |
| AL (mm) |
23.43 |
1,03 |
22.04 a 25.8 |
| Potencia de LIO (D) |
21.47 |
2,65 |
14 a 25 |
 Agudeza visual
Agudeza visual
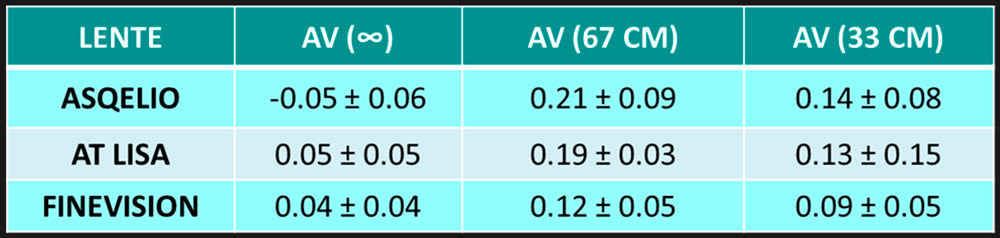
Las agudezas visuales promedio obtenidas para distancias lejanas, intermedias y cercanas antes de la operación, 1 mes y 3 meses después de la cirugía. Las diferencias entre la agudeza visual no corregida preoperatoria y la agudeza visual postoperatoria a los 3 meses fueron estadísticamente significativas (diferencia media 0,28 ± 0,25 unidades LogMAR, p < 0,001), casi 3 líneas, así como entre DCVA antes y 3 meses después de la cirugía (diferencia media 0,18 ± 0,16 unidades LogMAR, p< 0,001), casi 2 líneas. Las diferencias en la agudeza visual no fueron significativamente diferentes entre 1 mes y 3 meses después de la operación (p> 0,05).
Dado que 29 ojos de la muestra fueron sometidos a extracción de cristalino transparente, se realizó un análisis separado para determinar la diferencia entre CDVA preoperatorio (valor medio 0.04±0.08 LogMAR) y 3 meses postoperatorio (−0.07±0.04 LogMAR), encontrando estadísticamente diferencias significativas (p > 0,001).
Al comparar los mejores resultados visuales con corrección de distancia entre los ojos sometidos a extracción de cristalino transparente (29) y los ojos sometidos a cataratas (21) 3 meses después de la cirugía, las diferencias fueron significativas para CDVA (p = 0,027) y 3 meses PostOp CDNVA (0,004) , pero menos de una línea en cualquier caso (las diferencias medias fueron 0,04±0,02 y 0,06±0,02 unidades LogMAR, respectivamente).
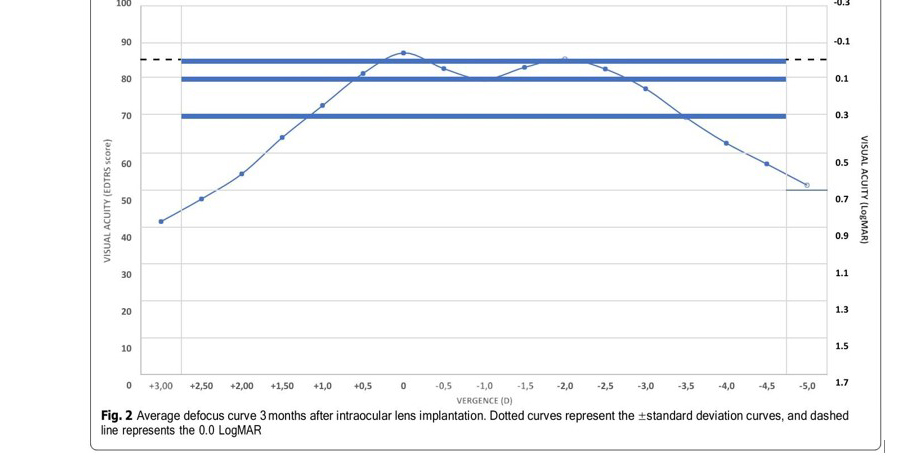
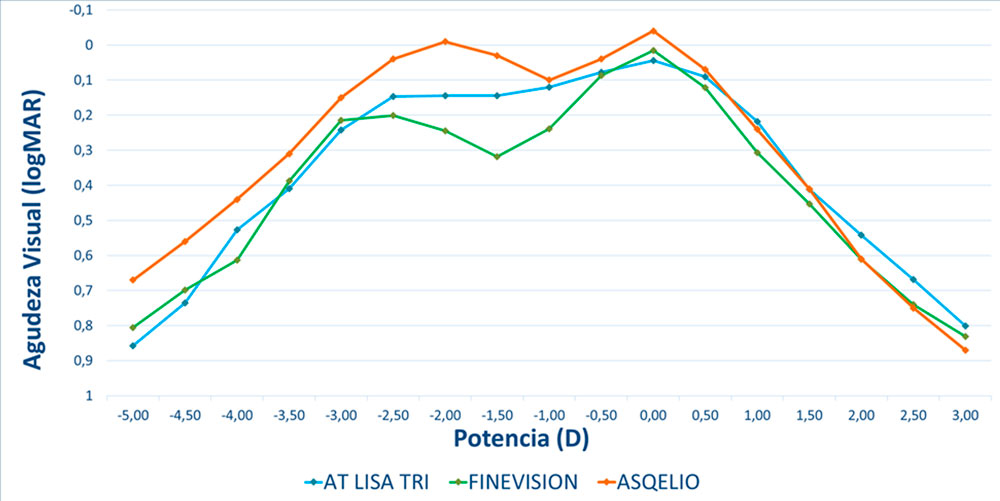
Curva de desenfoque La Figura 2 muestra la curva de desenfoque monocular promedio para toda la muestra 3 meses después de la implantación de la LIO. El rendimiento visual promedio a lo largo de la curva de desenfoque no desciende por debajo de 0,1 LogMAR en ningún punto entre +0,50 D y −2,75 D, lo que arroja un DOF absoluto promedio de 3,35 ±0,80 D (rango de 1,00 a 4,50 D). El DOF relativo medio, es decir, considerando una caída de 0,1 LogMAR desde los mejores valores de agudeza visual, fue de 2,57±0,82 D (rango 0,50 a 5,00).
Considerando los criterios alternativos descritos en la metodología, es decir, el menos restrictivo 0,3 logMAR como valor de corte de agudeza visual para DOF absoluto, y una caída de 0,04 logMAR desde la agudeza visual máxima como criterio más restrictivo para DOF relativo, el promedio valores obtenidos son 4,82±0,69 D (rango 3,50 a 6,50D) y 1,27±0,70 D (rango 0,00 a 3,50D), respectivamente.
Satisfacción
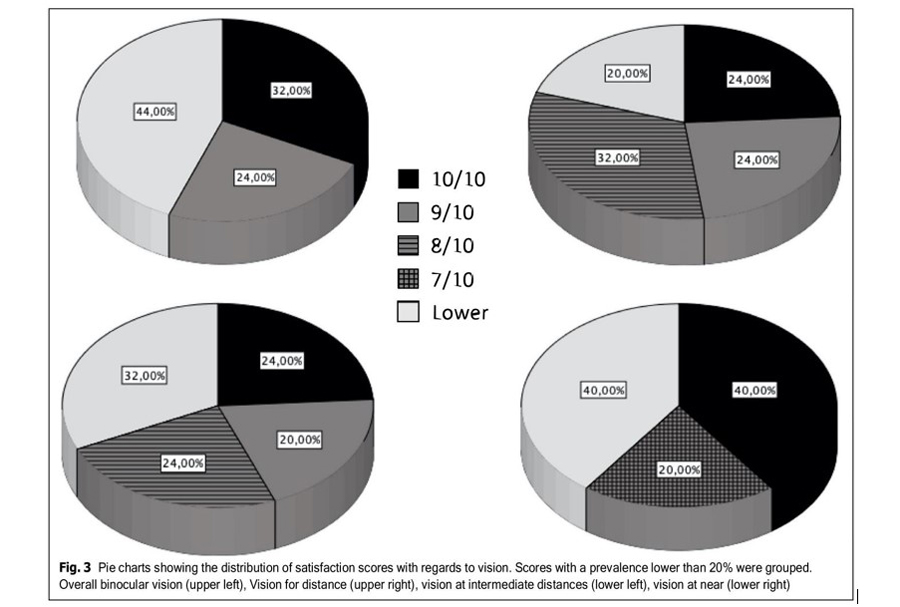
La respuesta media a las consultas de satisfacción fue de 8,32/10 para la satisfacción global con la visión binocular, 8,24/10 para la satisfacción visual a distancia, 8,04/10 para la satisfacción visual a distancias intermedias y 7,88/10 para las distancias cercanas. Cuando se le pidió que calificara como molesto con respecto a los halos, siendo 10 muy molesto y 0 ninguna preocupación, la respuesta promedio fue de 4.36. La Figura 3 muestra gráficos circulares que muestran la distribución de las puntuaciones de satisfacción con respecto a la visión. El 72% de los sujetos puntuaron 8/10 o más en cuanto a satisfacción binocular, y solo 1
sujeto puntuó por debajo de 5/10. Del mismo modo, el 80% puntuó 8/10 o más en visión lejana, el 68% en visión intermedia y el 56% en visión cercana.
Discusión
El objetivo principal del presente estudio fue determinar el DOF mediante el análisis de la curva de desenfoque aplicando diferentes criterios de agudeza visual en pacientes después de una cirugía de cataratas con implante de LIO trifocal Asqelio™. Además, también se informaron las métricas estándar de refracción posoperatoria, la medición de la agudeza visual a diferentes distancias y la satisfacción del paciente.
En relación con la visión y la refracción, los resultados encontrados en la presente serie de pacientes indican que esta lente ofrece una buena agudeza visual de lejos a cerca y excelentes resultados refractivos. Se encontró un equivalente esférico medio inferior a un cuarto de dioptría (0,08D al mes y 0,05D a los 3 meses de la cirugía), y un cilindro postoperatorio medio inferior a un cuarto de dioptría ( −0,03D y 0,01D a 1 y 3 meses después de la cirugía, respectivamente). La figura 1 muestra el vector de potencia del astigmatismo postoperatorio representado por el vector bidimensional (J0 y J45). Se debe considerar que el punto [0,0] representa un ojo sin astigmatismo (centro del gráfico).
El análisis de varianza de estos componentes del astigmatismo no reveló diferencias estadísticamente significativas en el preoperatorio y el postoperatorio (p > 0,05). Los resultados de agudeza visual revelan el buen rendimiento que proporciona esta lente cuando se implanta. Tenga en cuenta que CDVA a 1 y 3 meses después de la cirugía fue mayor que 20/20 (−0,04 y −0,05 logMAR, respectivamente, consulte la Tabla 2). A cerca (40 cm), estos valores fueron de 0,04 (alrededor de 20/22), ya distancia intermedia (67 cm) a 0,03
 Log MAR (alrededor de 20/21) . Hubo una estadísticamente significativa mejoría tras la cirugía (alrededor de 3 líneas de UDVA a los 3 meses, p < 0,001). Durante los 3 meses de seguimiento, la agudeza visual no cambió significativamente (p> 0,05).
Log MAR (alrededor de 20/21) . Hubo una estadísticamente significativa mejoría tras la cirugía (alrededor de 3 líneas de UDVA a los 3 meses, p < 0,001). Durante los 3 meses de seguimiento, la agudeza visual no cambió significativamente (p> 0,05).
La evaluación de la DOF se realizó mediante el análisis de la curva de desenfoque monocular, que se muestra en la Fig.3
 Esta curva, a los 3 meses de la cirugía, muestra un pico de agudeza visual máxima en la vergencia 0 D (visión de lejos). , > 20/20) y una transición suave entre 0 y 2.00D (50 cm) de vergencia. Cabe señalar que el rendimiento medio de la agudeza visual a lo largo de la curva no desciende por debajo de 0,1 logMAR en ningún punto de +0,50 D a −2,75D (unos 35 cm), lo que respalda el buen rendimiento visual obtenido. En el análisis se encontró un DOF absoluto promedio (considerando 0,1 LogMAR como valor de corte) de 3,29±0,91 D, mientras que el DOF relativo promedio (considerando una caída de 0,1 LogMAR) fue de 2,57±0,82 D. Sin embargo, teniendo en cuenta los criterios alternativos (0,3 logMAR como valor de corte de agudeza visual para el DOF absoluto y una caída de 0,04 para los valores del DOF
Esta curva, a los 3 meses de la cirugía, muestra un pico de agudeza visual máxima en la vergencia 0 D (visión de lejos). , > 20/20) y una transición suave entre 0 y 2.00D (50 cm) de vergencia. Cabe señalar que el rendimiento medio de la agudeza visual a lo largo de la curva no desciende por debajo de 0,1 logMAR en ningún punto de +0,50 D a −2,75D (unos 35 cm), lo que respalda el buen rendimiento visual obtenido. En el análisis se encontró un DOF absoluto promedio (considerando 0,1 LogMAR como valor de corte) de 3,29±0,91 D, mientras que el DOF relativo promedio (considerando una caída de 0,1 LogMAR) fue de 2,57±0,82 D. Sin embargo, teniendo en cuenta los criterios alternativos (0,3 logMAR como valor de corte de agudeza visual para el DOF absoluto y una caída de 0,04 para los valores del DOF
relativo), los valores medios obtenidos fueron 4,82 ± 0,69 D y 1,27 ± 0,70 D, respectivamente. mostrando cómo se pueden obtener diferentes resultados según el criterio utilizado para definir los valores de corte. El análisis de los criterios relativos y absolutos es necesario para obtener una visión general completa del rendimiento de cualquier LIO que corrija la presbicia [10].
En ambos casos, los resultados aquí obtenidos revelan la buena evolución reportada por estos pacientes. Sin embargo, debe tenerse en cuenta que las curvas de desenfoque y DOF informados en el presente estudio son monoculares y, por lo tanto, se esperaría una mejora en la métrica binocular, debido a la suma binocular.
Se vuelve difícil comparar estos resultados con los de otros estudios de revisión por pares que analizaron el DOF de varios LIO para corregir la presbicia debido a los diferentes criterios de DOF utilizados en cada estudio. En un estudio anterior realizado por los autores, se analizó la DOF después de la implantación de diferentes LIO bifocales, trifocales y de profundidad de foco extendida utilizando los criterios 0.1 LogMAR, como se usa en el presente estudio [8, 10 ] . Comparando estos resultados con los aquí reportados, se puede observar que los valores de DOF obtenidos en el presente estudio se encuentran dentro del rango superior de los valores de DOF obtenidos por las LIO analizadas en los estudios previos, y con menor variabilidad entre pacientes, lo que hace la LIO implantada en el presente estudio comparable a las que obtuvieron los mejores valores DOF . El estudio realizado por Barisic et al. [12], que estudiaron el DOF subjetivo de la LIO AT LISA TRI, encontraron un valor medio de 2,59 D. Tenga en cuenta que estos autores utilizaron un criterio relativo de pérdida de visibilidad con una agudeza visual de letras de 20/30. Buckhurst et al. [13], que utilizó un criterio absoluto de agudeza visual superior a 0,3 LogMAR, encontró un DOF de aproximadamente 3 D para las LIO bifocales ReZoom y TecnicsZM900. Los valores de DOF encontrados informados en el presente estudio superan considerablemente los informados en esos dos estudios pero, como se indicó anteriormente, las diferencias entre los estudios pueden surgir, al menos en parte, del criterio de agudeza visual establecido en cada estudio. Se ha informado que existe una correlación directa entre la agudeza visual y valores y DOF (es decir, cuanto mayor es la agudeza visual, menor es el DOF) [14]. Hay otras posibles fuentes de diferencias entre los estudios a considerar, como el tiempo posterior a la cirugía cuando se realizaron las mediciones, ya que puede desempeñar un papel, ya que la neuroadaptación en la LIO que corrige la presbicia permite que el sistema visual se adapte a las imágenes creadas en la retina. [15], o el tamaño de paso utilizado para la determinación de la curva de desenfoque, como pasos de 0,5 D como en el presente estudio en comparación con estudios que utilizan pasos de 0,25 D [16].
También se han sugerido valores DOF objetivos utilizando aberrometría de frente de onda en comparación con el DOF subjetivo estándar. Análogamente al criterio de agudeza visual utilizado para la determinación subjetiva del DOF, se utiliza un criterio de degradación de calidad de imagen aceptable para determinar el valor objetivo del DOF. Estudios previos analizaron y
propusieron diferentes niveles de degradación de la calidad de la imagen (del 50 al 90%) para determinar el DOF objetivo [8, 10, 17, 18] y, por lo tanto, se reportan diferentes resultados. Como regla general, un criterio más permisivo en la degradación de la
calidad de la imagen de la retina proporciona una mayor tolerancia y, por lo tanto, un DOF más amplio. Se ha encontrado que las medidas objetivas y subjetivas de DOF no son comparables debido a las amplias diferencias en metodologías y criterios para definir el nivel de aceptación de la degradación tanto en la agudeza visual como en la calidad de la imagen óptica [10] .
Con respecto a la satisfacción del paciente con la visión después de la operación, aunque en el presente estudio se utilizó un cuestionario no validado que consta de cinco preguntas, los resultados se incluyeron porque pueden constituir una referencia útil para la satisfacción del paciente después de la cirugía.
Los pacientes debían puntuar del 1 al 10 su nivel de satisfacción
a las preguntas relacionadas con su visión binocular general de lejos, su visión de lejos, su visión de distancias intermedias y su visión de cerca. La quinta pregunta estuvo relacionada con la incidencia y molestia de los halos tras el implante de LIO, siendo 0 el nivel de satisfacción más alto. El análisis de las respuestas muestra que el nivel de satisfacción global es alto, más de la mitad de los pacientes puntuaron 8/10 o más su nivel de satisfacción en cada una de las distancias, mientras que sólo dos sujetos puntuaron 8/10 o más su nivel de satisfacción. molesto con halos. Aunque estos resultados pueden servir como una referencia de los niveles de satisfacción informados por los pacientes implantados con esta LIO, las métricas de satisfacción necesitarían, sin embargo, un estudio adicional utilizando cuestionarios validados específicos y tamaños de muestra apropiados para permitir extraer conclusiones apropiadas.
En conclusión, los pacientes sometidos a facoemulsificación para cirugía de cataratas e implantados con esta nueva LIO trifocal mostraron una mejora significativa en el rendimiento visual a diferentes distancias. Estos resultados preliminares muestran que la lente es predecible y proporciona amplios valores de DOF relativos y absolutos, lo que permite una buena
agudeza visual a diferentes distancias y buenos índices de satisfacción del paciente.
Agradecimientos No aplicable.
Contribuciones de los autores CPB, RSJ, concepción y diseño del protocolo de estudio. CPB llevó a cabo los procedimientos quirúrgicos. RCS, ACG realizó las evaluaciones de seguimiento postoperatorio y la adquisición de datos. DCG, RSJ realizó los exámenes visuales y la adquisición de datos. CPB, AC, RSJ, RCS, DCG, ACG analizaron e interpretaron los datos. AC, CPB, RSJ redactó el manuscrito. RCS, DCG, ACG
Todos los autores leyeron y aprobaron la versión final del manuscrito.
Referencias
Shen Z, Lin Y, Zhu Y, Liu X, Yan J, Yao K. Comparación clínica de pacientes resultados después de la implantación de lentes intraoculares trifocales o bifocales: una revisión sistemática y metanálisis. Sci Rep. 2017;7:45337.
Jin S, Friedman DS, Cao K, et al. Comparación del rendimiento visual posoperatorio entre lentes intraoculares bifocales y trifocales basada en senderos controlados aleatorios: un metanálisis. BMC Oftalmol. 2019;19(1):78.
Zhong Y, Wang K, Yu X, Liu X. Yao K (2021) comparación de lentes intraoculares trifocales o híbridos multifocales con profundidad de foco extendida : una revisión sistemática y un metanálisis. Sci Rep. 2021;11:6699.
Gupta N, Wolffsohn JS, Naroo SA. Optimización de la medida de la amplitud subjetiva de acomodación con curvas de desenfoque. J Cirugía refractiva de cataratas. 2008;34(8):1329–38.
Alfonso JF, FernándezVega L, Puchades C, MontésMicó R. Función visual intermedia con diferentes modelos de lentes intraoculares multifocales. J Cirugía refractiva de cataratas. 2010;36(5):733–9.
Böhm M, Petermann K, Hemkeppler E, Kohnen T. Curvas de desenfoque de 4 Diseños de LIO que corrigen la presbicia : panfocal difractivo, trifocal difractivo, refractivo segmentario y profundidad de foco extendida. J Cirugía refractiva de cataratas. 2019;45(11):1625–36.
Paik DW, Park JS, Yang CM, Lim DH, Chung TY. Comparando lo visual resultado, calidad visual y satisfacción entre tres tipos de lentes intraoculares multifocales . Sci Rep. 2020;10(1):14832.
Palomino Bautista C, SánchezJean R, CarmonaGonzález D, Piñero DP, MolinaMartín A. Medidas subjetivas y objetivas de profundidad de campo en ojos pseudofáquicos: comparación entre profundidad de foco extendida, lentes intraoculares trifocales y bifocales. Oftalmol Int. 2020;40(2):351–9.
Guo Y, Wang Y, Hao R, Jiang X, Liu Z, Li X. Comparación de paciente viene después de la implantación de lentes intraoculares trifocales y de profundidad de foco extendida: una revisión sistemática y metanálisis. J Oftalmol. 2021;2021:1115076.
Palomino Bautista C, SánchezJean R, CarmonaGonzalez D, Piñero DP, MolinaMartín A. Medidas de profundidad de campo en ojos pseudofáquicos implantados con diferentes tipos de LIO correctoras de presbicia . Sci Rep. 2021;11(1):12081.
Plakitsi A, Charman N. Comparación de las profundidades de foco a simple vista y con tres tipos de corrección de lentes de contacto para la presbicia. Asociación de lentes de contacto J Br. 1995; 18:119–25.
Barisic A, Patel S, Gabric N, Feinbaum CG. La profundidad de campo clínica alcanzable con lentes intraoculares trifocales y monofocales: teoría consideraciones y resultados clínicos de prueba de concepto.
Buckhurst PJ, Wolffsohn JS, Naroo SA, et al. Diferenciación de lentes intraoculares multifocales mediante curvas de desenfoque. Investig Ophthalmol Vis Sci. 2012;53:3920–6.
Sergienko NM, Kondratenko YN, Tutchenko NN. Profundidad de foco en ojos pseudofáquicos. Graefes Arch Clin Exp Ophthalmol. 2008;246:1623–7.
CocoMartin MB, Valenzuela PL, MaldonadoLópez MJ, SantosLozano A, MolinaMartín A, Piñero DP. Potencial de los videojuegos para la promoción de la neuroadaptación a lentes intraoculares multifocales: una revisión narrativa. Int J Ophthalmol. 2019;12(11):1782–7.
Wolffsohn JS, Jinabhai AN, Kingsnorth A. Exploración del tamaño de paso óptimo para las curvas de desenfoque. J Cirugía refractiva de cataratas. 2013;39(6):873–80.
Yi F, Iskander DR, Collins MJ. Estimación de la profundidad de foco de la onda medidas de frente. J Vis. 2010;10(4):1–9.
Leube A, Schilling T, Ohlendorf A. La función de transferencia neuronal individual afecta la predicción de la profundidad de enfoque subjetiva. Sci Rep. 2018;8(1):1919.



 Dr. Carlos Palomino Bautista
Dr. Carlos Palomino Bautista






 Dr. Rogelio Ribes Escudero
Dr. Rogelio Ribes Escudero 
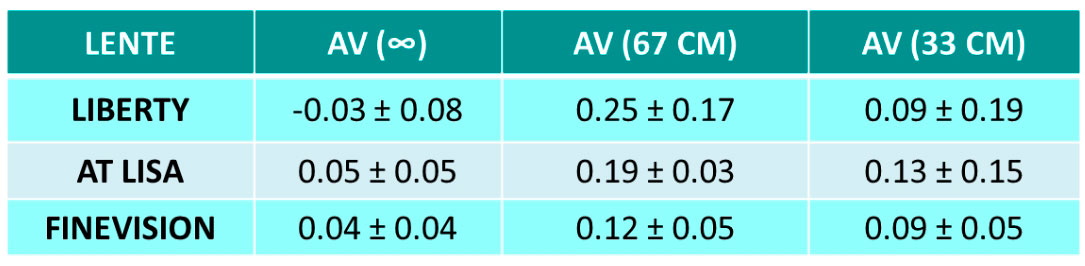
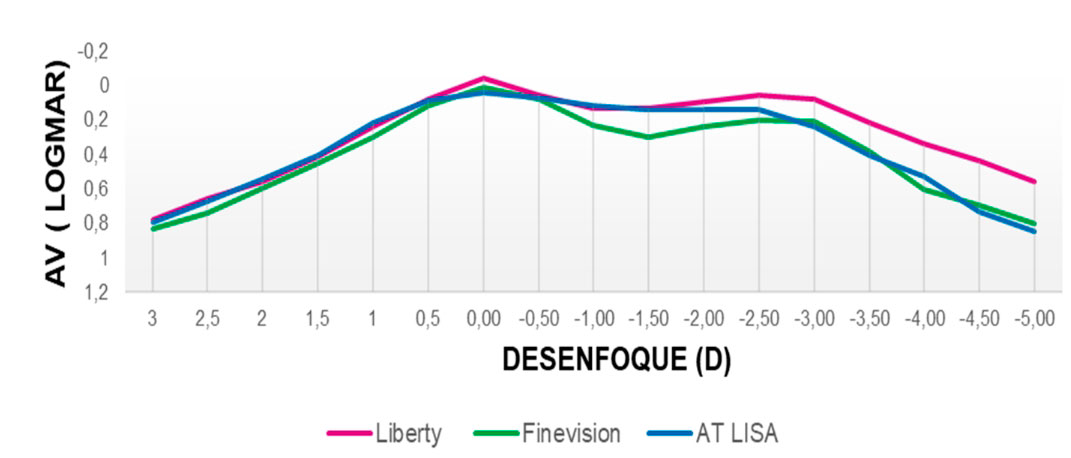
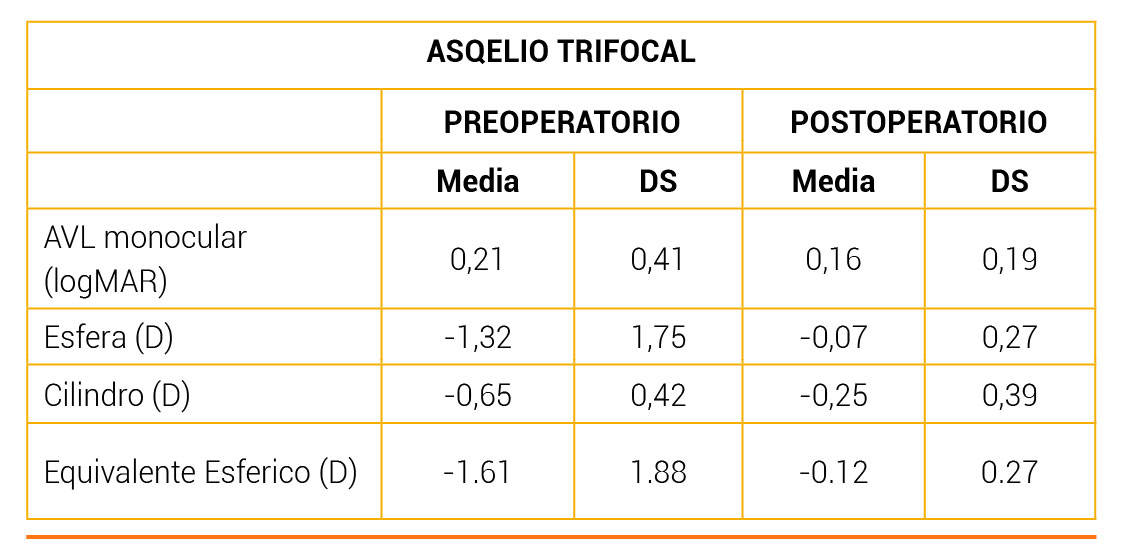


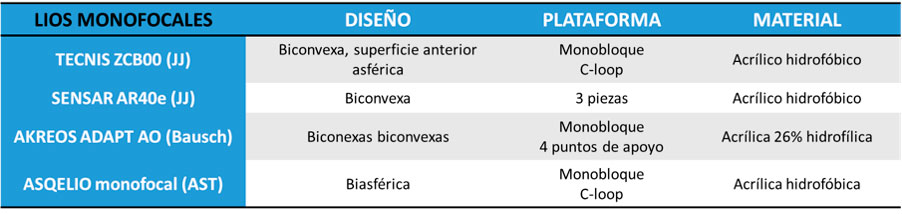
 Tabla 2. Lentes intraoculares monofocales plus y sus principales características
Tabla 2. Lentes intraoculares monofocales plus y sus principales características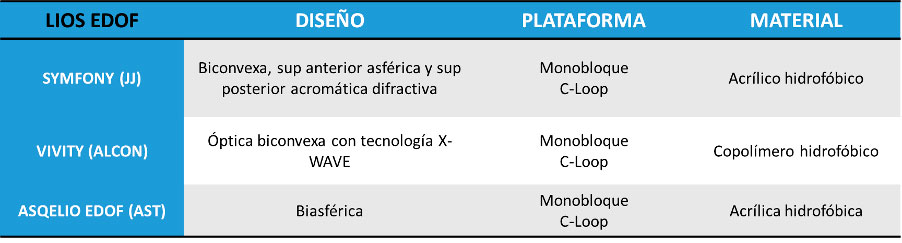 Tabla 3. Lentes intraoculares EDOF y sus principales características
Tabla 3. Lentes intraoculares EDOF y sus principales características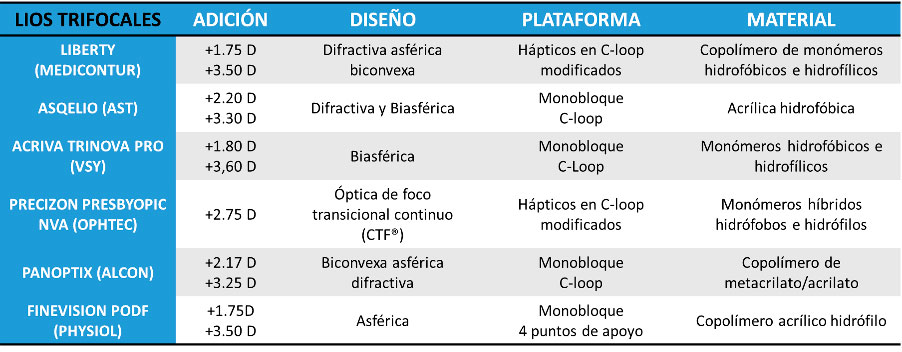 Tabla 4. Lentes intraoculares trifocales y sus principales características
Tabla 4. Lentes intraoculares trifocales y sus principales características

 Agudeza visual
Agudeza visual  Log MAR (alrededor de 20/21) . Hubo una estadísticamente significativa mejoría tras la cirugía (alrededor de 3 líneas de UDVA a los 3 meses, p < 0,001). Durante los 3 meses de seguimiento, la agudeza visual no cambió significativamente (p> 0,05).
Log MAR (alrededor de 20/21) . Hubo una estadísticamente significativa mejoría tras la cirugía (alrededor de 3 líneas de UDVA a los 3 meses, p < 0,001). Durante los 3 meses de seguimiento, la agudeza visual no cambió significativamente (p> 0,05). Esta curva, a los 3 meses de la cirugía, muestra un pico de agudeza visual máxima en la vergencia 0 D (visión de lejos). , > 20/20) y una transición suave entre 0 y 2.00D (50 cm) de vergencia. Cabe señalar que el rendimiento medio de la agudeza visual a lo largo de la curva no desciende por debajo de 0,1 logMAR en ningún punto de +0,50 D a −2,75D (unos 35 cm), lo que respalda el buen rendimiento visual obtenido. En el análisis se encontró un DOF absoluto promedio (considerando 0,1 LogMAR como valor de corte) de 3,29±0,91 D, mientras que el DOF relativo promedio (considerando una caída de 0,1 LogMAR) fue de 2,57±0,82 D. Sin embargo, teniendo en cuenta los criterios alternativos (0,3 logMAR como valor de corte de agudeza visual para el DOF absoluto y una caída de 0,04 para los valores del DOF
Esta curva, a los 3 meses de la cirugía, muestra un pico de agudeza visual máxima en la vergencia 0 D (visión de lejos). , > 20/20) y una transición suave entre 0 y 2.00D (50 cm) de vergencia. Cabe señalar que el rendimiento medio de la agudeza visual a lo largo de la curva no desciende por debajo de 0,1 logMAR en ningún punto de +0,50 D a −2,75D (unos 35 cm), lo que respalda el buen rendimiento visual obtenido. En el análisis se encontró un DOF absoluto promedio (considerando 0,1 LogMAR como valor de corte) de 3,29±0,91 D, mientras que el DOF relativo promedio (considerando una caída de 0,1 LogMAR) fue de 2,57±0,82 D. Sin embargo, teniendo en cuenta los criterios alternativos (0,3 logMAR como valor de corte de agudeza visual para el DOF absoluto y una caída de 0,04 para los valores del DOF