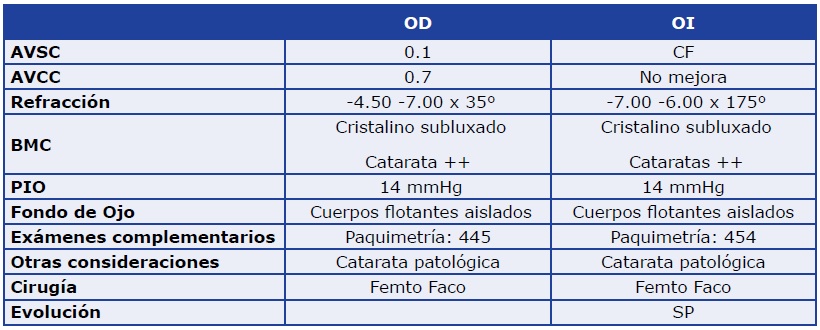
Revisión sobre métodos actuales de tratamiento de pupila pequeña en cirugía del cristalino
Introducción
La pupila estrecha sigue siendo un reto en cirugía de cristalino. La necesidad de una dilatación pupilar suficiente varía en función de la experiencia y destreza del cirujano. Para conseguir una manejo apropiado de la pupila miótica es importante una detallada anamnesis preoperatoria, conocer su etiología además de una buena exploración (características iridianas, dureza de la catarata, debilidad zonular, profundidad de cámara anterior, entre otras), ya que son aspectos que pueden cambiar el abordaje quirúrgico. Hoy en día contamos con numerosas maniobras tanto farmacológicas como quirúrgicas que contribuyen a minimizar la dificultad, los riesgos y complicaciones de la cirugía de cristalino en pupilas estrechas.
Etiología
Las causas más frecuentes de una pupila estrecha las podemos dividir en:
Preoperatoria:
- Miosis senil, por atrofia del músculo dilatador de la pupila.
- Secundaria a medicamentos por uso de los mióticos tópicos (más común en años anteriores provocaban sinequias iridocapsulares) y los antagonistas α-drenérgicos para pacientes afectos de próstata.
- Secundaria a cirugías previas, entre las que destacan la vitrectomía pars plana, la trabeculectomía y la cirugía de lentes fáquicas. Están asociadas al traumatismo directo del iris en la cirugía, compromiso nervioso y formación de sinequias posteriores postoperatorias.
- Asociadas a patologías oculares: anormalidades congénitas del iris como iridosquisis (por atrofia de la capa superior del estroma mesodérmico dividido), pseudoexfoliación (material pseudo-exfoliativo depositado en estroma causa una obstrucción mecánica y atrófica asociada con hipoxia por anormalidades vasculares causan midriasis limitada), traumatismo ocular y uveítis (provocan sinequias posteriores con dilatación irregular por las adherencias entre iris y cápsula anterior del cristalino).
- Asociadas a patologías sistémicas como la diabetes (compromiso nervioso del músculo dilatador inervado por el simpático y anormalidades en el músculo del iris y los vasos sanguíneos).
Intraoperatoria:
- Trauma quirúrgico sobre el iris.
- Síndrome de retropulsión pupilar.
- IFIS.
Consideraciones Preoperatorias
Como ya se citó anteriormente, es muy importante la valoración previa del paciente en la anamnesis, incluyendo existencia de alergias y antecedentes oftalmológicos (cirugías oculares previas o uso de fármacos que causen mala dilatación pupilar).
Por otro lado debemos hacer constar en la historia clínica el tamaño pupilar logrado tras la dilatación, si existen alteraciones pupilares (sinequias, rodetes atróficos o material pseudoexfoliativo) y poner de manifiesto las características iridianas que encontramos en la exploración (iridotomías, iridectomías, pseudoexfoliación, sinequias iridocorneales, atrofia, despigmentación, corectopia, etc.).
Técnicas de Dilatación
1. Fármacos administrados en el preoperatorio.
- Midriáticos tópicos como la tropicamida y el ciclopentolato al 0.5 o’ 1%, parasimpaticolíticos que producen una dilatación pupilar a los 15 y 30 minutos respectivamente. La fenilefrina al 10% es una droga parasimpaticomimética de más rápida acción.
- Inserto oftálmico (Mydriasert), diseñado para ser colocado en la base el saco conjuntival inferior por el mismo paciente antes de la cirugía. En nuestra experiencia tardaba demasiado en hacer efecto, por lo que dejamos de utilizarlo.
- Antiinflamatorios no esteroideos. Utilizados para prevenir la miosis durante la cirugía. Pueden producir irritación local y queratitis punteada.
Nuestra técnica habitual es tropicamida+ fenilefrina al 10%+ AINEs, 1 gota cada 10 minutos empezando 30 minutos antes de la cirugía.
2. Fármacos administrados intraoperatoriamente.
- Fármacos diluidos en suero de irrigación, como la epinefrina diluida ayuda a mantener la dilatación durante la cirugía, pero no la aumenta.
- Midriáticos en cámara anterior. Los más empleados son la lidocaína en combinación con fenilefrina o epinefrina, aunque el problema con esta última es la presencia de bisulfitos. Se utiliza la combinación de lidocaína al 1% y fenilefrina al 1’5%, sobre todo en pacientes con IFIS. La lidocaína al 2% sola tiene poca acción, pero unida a los anteriores mejora la dilatación, por lo que tiene un efecto coadyuvante. Todos estos medicamentos han de ser libres de conservantes y de bisulfitos. En EEUU se comercializa la fenilefrina combinada con AINEs con el nombre de Omidria® aunque aconsejan poner midriáticos previamente. Entre las ventajas sobre los midriáticos tópicos obtenemos una superficie ocular indemne, un menor tiempo de dilatación y un menor número de efectos cardiovasculares. Como inconvenientes de los mismos tenemos una ligera menor dilatación, aunque sí mantenida a lo largo de la cirugía, y la no disponibilidad de preparados comerciales con la necesidad de prepararlos en farmacia. Nosotros hemos comprobado que los pacientes que previamente han sido dilatados adecuadamente con midriáticos tópicos, no se benefician de un gran efecto con los intracamerulares.
3. Maniobras quirúrgicas
- Viscomidriasis. Es el primer recurso utilizado para incrementar y mantener la midriasis, complementando a otras maniobras dilatadoras como la sinequiolisis o estiramientos de iris. Para que se mantenga en cámara anterior y así poder cumplir su función midriática ha de ser dispersivo de alta viscosidad o viscoadaptativo o, en su defecto, combinar cohesivo con dispersivo según describe la técnica del escudo.
- Sinequiolisis. Las sinequias son frecuentes tras uveítis o cirugías previas. La ruptura de éstas se consigue con movimientos tangenciales con espátula roma barriendo de derecha a izquierda por debajo del iris. También puede realizarse con viscolástico y suele asociarse a viscomidriasis. Los movimientos han de ser suaves y hay que tener precaución si hay signos de debilidad zonular ya que las sinequias pueden ser el único modo de anclaje del cristalino.
- Membranectomía pupilar. La inflamación previa puede dar lugar a membranas o a la presencia de un anillo fibrótico en la pupila que es necesario liberar ya que impide la dilatación. Para ello se retira la membrana con una pinza bajo protección con un viscolástico. Esta maniobra suele ser eficaz aunque a veces es necesario cortar el anillo fibrótico con unas microtijeras para poder traccionar del mismo de un modo menos agresivo. Esto puede provocar sangrados para lo cual habría que inyectar viscolástico de alto peso molecular.Si a pesar de estas maniobras no se consigue una dilatación óptima, se recurrirá a las técnicas de dilatación pupilar que se describen a continuación.
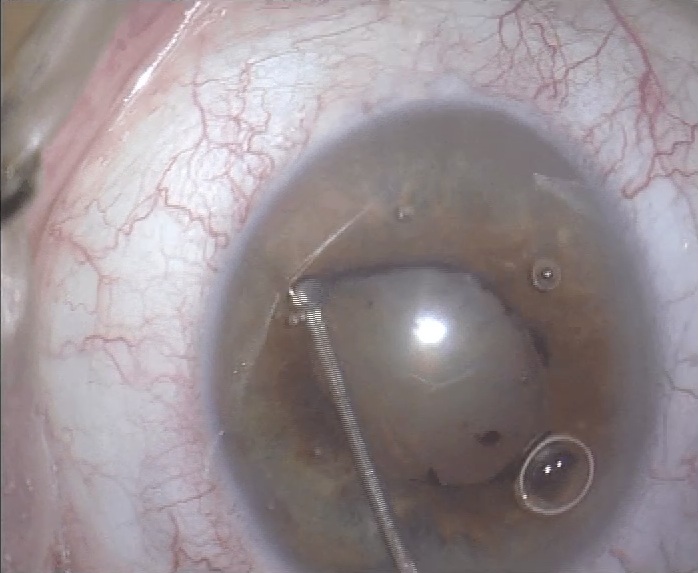
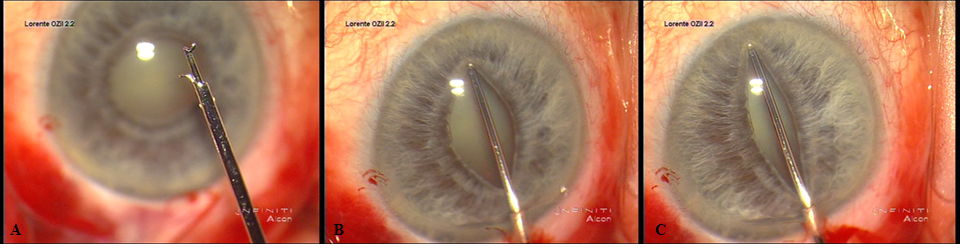
- Estiramientos o “stretching”. Clásicamente se describió como una técnica bimanual utilizando dos manipuladores de iris tipo Kugler o Lester o en “botón de camisa” de Graether. Posteriormente han aparecido otros dispositivos automáticos-mecánicos que permite realizarla con una sola mano. Estos son el de Keuch, con un vástago, y el de Beehler con dos o tres vástagos. La indicación de esta maniobra es cualquier pupila miótica, sin alteraciones iridianas, en la que queramos obtener una midriasis media.
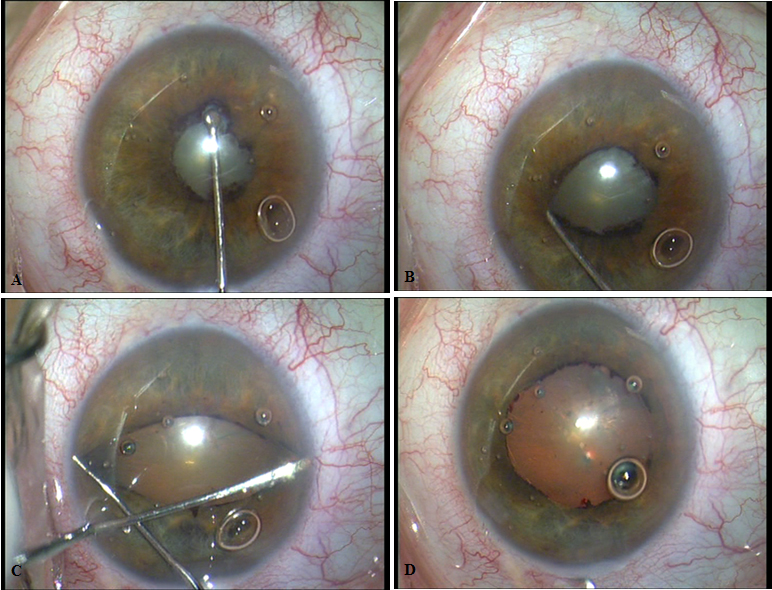


La tecnica bimanual consiste en desplazar ambos manipuladores en sentido centrífugo enfrentándolos durante 5 segundos en el eje del meridiano hasta llegar al ángulo. Es una técnica segura que mantiene la midriasis hasta finalizar la cirugía, indolora y económica. Por contra provoca una menor dilatación que los anillos o ganchos, no se puede predecir el tamaño de la pupila y provoca una atonicidad del iris que puede facilitar el prolapso intraoperatorio.
La técnica unimanual consiste en situar el vástago en la posición correcta enganchando al iris y desplazar el mango provocando un estiramiento en el meridiano situado entre en gancho de iris proximal y el extremo del vástago del iris distal. Entre las desventajas respecto a la técnica bimanual cabe señalar que se precisa un tamaño mínimo de incisión de 2.5 mm a 3 mm para los modelos de 2 y 3 vástagos respectivamente, además de ser más caro y sofisticado que los dos manipuladores.
- Sistemas de retracción-dilatación del iris. Son unos dispositivos que si bien preservan la forma de la pupila y la función del esfínter, tienen en común la necesidad de cierta destreza quirúrgica para su uso (introducción y retirada) ya que pueden causar cierto daño endotelial. Existen dos tipos:
- Ganchos retractores del iris. Son los dispositivos de uso más generalizado ya que son útiles donde hay contraindicación de otras maniobras de dilatación en casos donde ésta haya sido aún insuficiente y son los más económicos. Son flexibles y existen de diversos materiales. Pueden utilizarse simultáneamente 4 o 5 ganchos adoptando la midriasis forma de cuadrado o de rombo respectivamente. Se introducen a través de una paracentesis paralela al limbo (tantas como gancho deseemos introducir) quedando equidistantes entre sí, previa introducción de viscolástico en la cámara anterior para crear espacio. Una vez enganchado el iris se desplaza ligeramente el tope hasta tensar el borde pupilar para facilitar la colocación de los siguientes ganchos evitando roturas del esfínter. Su uso puede ser muy útil en caso de pupilas sinequiadas en miosis aunque también pueden utilizarse para sujeción capsular en caso de subluxación de cristalino mediante fijación en los bordes de la capsulorrexis. Existen unos llamados ganchos de Mackool que tienen la peculiaridad de presentar en el gancho una angulación distal permitiendo una mayor adaptación ergonómica del iris y/o de la cápsula anterior. En resumen es el dispositivo dilatador con menor potencial de daño iridiano y endotelial en caso de cámaras poco profundas ya que al insertarse en cada meridiano de forma independiente aportan mayor control de la dilatación pudiendo además usarse en cualquier momento de la cirugía.
- Anillos expansores del iris. A lo largo de los años ha habido una evolución en ellos, siendo los más modernos, más flexibles y manteniendo su eficacia. Están diseñados para ser introducidos por la incisión principal.
A. Anillo dilatador pupilar Morcher-Type5S.
Es un anillo de PMMA con diámetro total de 7,5 mm proporcionando una dilatación de 5-6 mm. Ofrece una dilatación pupilar circular y estable aunque por otro lado su rigidez dificulta la manipulación y lo hace más lesivo. Además precisa de una incisión de 2,8 mm, una colocación que requiere habilidad y tiempo y una extracción controlada.
b. Perfect- Pupil® inyectable.
Es un anillo de poliuretano de 315° con un brazo que permanece fuera de la incisión evitando la rotación del mismo y facilitando su extracción. Proporciona también una dilatación amplia, circular y estable. No obstante presenta una rigidez que dificulta la manipulación haciéndolo más lesivo. Además también precisa de una amplia incisión y los mismos inconvenientes en cuanto a manipulación y extracción que el anterior.
c. Expansor pupilar de Graether.
Es un anillo de silicona flexible que presenta un rail continuo que debe colocarse en el borde pupilar, lo cual requiere cierta habilidad y tiempo, en todo su diámetro manteniendo una dilatación estable y circular de 6,5 mm. Viene precargado en su inyector y se introduce por la incisión principal sin necesidad de ampliarla. Presenta un bajo potencial lesivo y facilidad para su extracción.
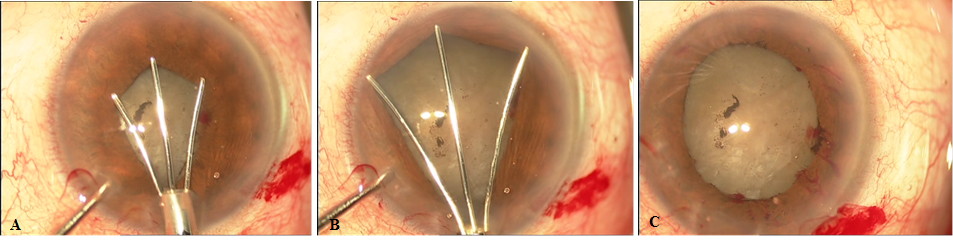
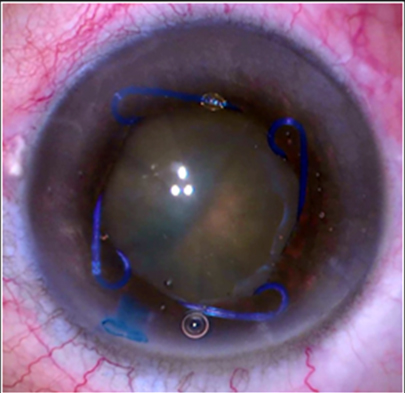
d. Anillo desplegable de Malyugin.
Es un dispositivo de polipropileno de forma cuadrangular con bucles angulares que se anclan en el esfínter pupilar ofreciendo una dilatación circular y amplia sin lesionar la pupila. Viene precargado en su inyector y se introduce por la incisión principal sin necesidad de ampliarla. Su colocación en cuatro puntos (bucles) es más rápida y sencilla que los anillos continuos aunque hay que ser cuidadoso y controlar los estiramientos de la raíz del iris en su colocación. Uno de los inconvenientes más evidentes es el coste económico que supone su uso.
e. Expansor de iris Oasis®.
Es un dispositivo flexible y ligero de polipropileno. Tiene un diámetro de 7 mm y ofrece una dilatación cuadrangular amplia y estable ya que la fijación se realiza en cuatro puntos con rail, sin lesionar la pupila ni el iris. Se implanta sin necesidad de ampliar la incisión aunque precisa un precargado.
- Esfinterotomías. En situaciones en las que exista un iris rígido se pude realizar un corte en zonas simétricas y de corta longitud de forma sencilla con unas tijeras finas de uso intraocular. Aunque con estos cortes se daña permanentemente el iris, generalmente son estética y funcionalmente insignificantes. Pueden provocar sangrados y dispersión de pigmento aunque normalmente desparece con la inyección de viscolástico.

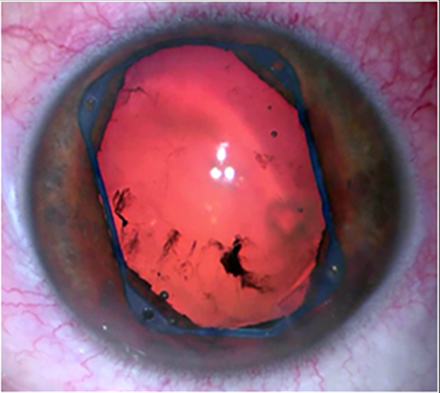

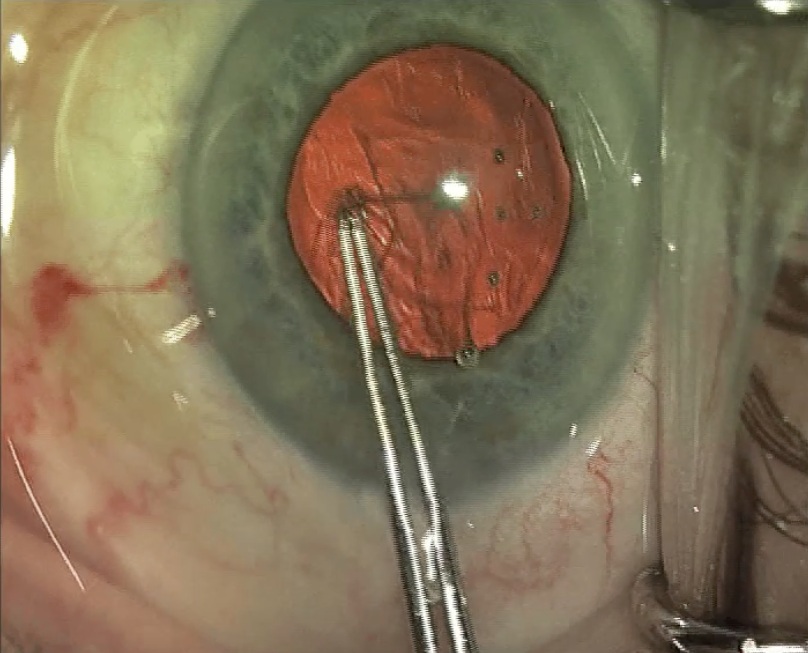
Manejo de la miosis intraoperatoria
Síndrome del iris flácido intraoperatorio
La inyección intracameral de 0,7 ml de fenilefrina al 1,5% es muy eficaz para revertir el IFIS. No sólo resuelve la miosis intraperatoria característica de esta entidad, recuperándose la midriasis preoperatoria, sino que devuelve la tonicidad al iris evitando el prolapso del mismo.
Síndrome de retropulsión
Para recuperar la midriasis basta con colocar un gancho que separe el iris de la cápsula anterior, permitiendo el paso del líquido de cámara anterior al espacio retroiridiano.