Coordinadora
Dra. Bruna Ventura – Brasil
Panelistas
Dr. Fernando Soler – España Dr. Claudio Orlich – Costa Rica
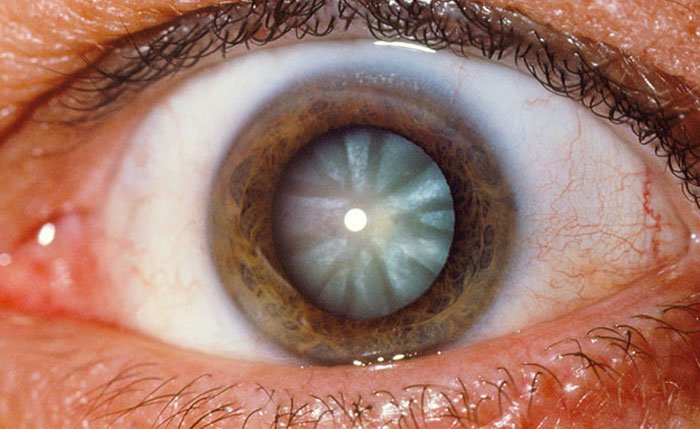
1. ¿Cuándo un paciente, en el cual va a operar catarata, es un buen candidato para lentes intraocula- res (LIOs) que objetivan la multi- focalidad? ¿Cuál es su preferencia actual de lente y por qué? En caso de que tenga más de uno que le guste ¿en qué situaciones utiliza cada uno de ellos?
Dr. Fernando Soler: Se indican LIO MFC en pacientes cataratosos pero con ojos sin patología añadida que condicionen un déficit visual tras la cirugía, como son glaucomas avanzados, retinopatías, etc. Podemos decir que en general se propo-ne a ojos sanos aunque tengan cataratas.
En general, somos partidarios de lentes hidrofóbicas y en diseño C-Loop modi- ficado y monobloques. Las lentes que más usamos son Bifocales de baja adi- ción (Tecnis ZLB) en pacientes con ne- cesidades en visión próxima y menos en intermedia. La segunda alternativa son lentes de Rango Extendido como Symfony, sobre todo para pacientes ac- tivos y con mucho uso de ordenadores.
La tercera opción son Trifocales hidrofó- bicas y en alguna ocasión hidrofílicas. En general este material, al igual que las len- tes de plato, no son habituales nuestras.
Hay que destacar que en muchas oca- siones la indicación viene condicionada por las particularidades socio-económi- cas de los pacientes y sus seguros de asistencia médica.
Dr. Claudio Orlich: No utilizo una única plataforma para todos mis pacientes. Una de las ventajas de tener tantas op- ciones en el mercado es que se puede personalizar el lente dependiendo de las necesidades del paciente. Por ejem- plo, si un paciente es miope requerirá mayor adición para ver de cerca que un hipermétrope, por lo cual en pacientes muy miopes sigo usando bifocales con Add +4,00 de AMO. Si el paciente uti- liza mucho el computador generalmen- te prefiero un lente de rango extendido (Symfony, AMO) que les da excelen- te visión intermedia, pero les advier- to que muchos requerirán de un lente con add baja para visión cercana. Con los trifocales los pacientes ven bien en diferentes distancias, pero su visión in- termedia es útil para actividades como ver los instrumentos del carro o precios en un supermercado, no para trabajar ocho horas frente a un monitor, muchas veces requieren de unas gafas para vi- sión intermedia. Si es un paciente que desea ver cerca para realizar manuali- dades o actividades de cerca y no uti- liza mucho el computador prefiero un trifocal. La lente trifocal que más uti- lizo es FineVision de PhysIOL, utilizo el modelo POD, con cuatro hápticas que le dan gran estabilidad dentro del saco capsular, da preferencia a la visión cercana en el centro de la óptica y dominancia de largo en la periferia, concepto muy similar a otros lentes basados en el reflejo de acomodación (miosis y conver- gencia al ver de cerca). Utilizo AT Lisa ZEISS en cilindros altos (per- mite corregir hasta -12 D) y en pa- cientes que trabajan con poca luz, es un lente trifocal en el centro y bifocal en la periferia por lo que en condiciones de poca luz, penaliza la visión intermedia pero da mejor visión cercana, siendo el lente que da mejor visión de cerca en con- diciones de baja luz. En resumen, aún no hay un lente perfecto en todas las distancias o condiciones de luz, debemos personalizar se- gún necesidades y características propias de cada persona.
2. ¿Cuál(es) es(son) la(s) fórmula(s) biométrica(s) que utiliza en estos casos para de- finir el poder del LIO?
Dr. Fernando Soler: Fórmulas de 3ª y 4ª generación a las que le aplicamos el ajuste biométrico de Aramberri combinando el sumato- rio de ACD y LT (grosor de cristali- no). En casos dudosos y extremos usamos Barrett II. Estamos ini- ciando pruebas con Panacea, pero no podemos opinar aún.
Dr. Claudio Orlich: Todos mis mul- tifocales y tóricos los calculo con el programa Panacea del Dr. David Flikier, considero muy importante tomar en cuenta la cara posterior de la córnea para determinar su poder real.
3. ¿Tiene un valor máximo de astigmatismo corneal en el que, a partir de ahí, ya piensa en contraindicar un LIO para obtener multifocalidad que sea tórica (por ejemplo, un LIO Symfony tórico, AT LISA tri-toric, etc)? ¿O implanta un LIO para multifocalidad tórica, cualquiera que sea el astigmatismo corneal, para que con el LIO para multi- focalidad tórica tenga una previsión de quedarse con un astigmatismo refraccional posoperatorio más pequeño que 0,50 dioptrías?
Dr. Fernando Soler: Si el ojo tiene una ambliopía relativa es muy discutible la indicación de MFC-T. Muchos de esos ojos me- joran con monofocal tórica. Bien es cierto que a veces te llevas sorpresas y esos ojos bien co- rregidos alcanzan luego visiones cercanas a la unidad.
Usamos MFC-T por encima de 1.25 DP de astigmatismo, hasta ese ci- lindro jugamos con las incisiones y en ocasiones ponemos parea- das. No hacemos LRI.
Dr. Claudio Orlich: Coloco tóricos a partir de -0.75 D de cilindro. Solo coloco lentes multifocales o tóricos en cilindros regulares, si el astigmatismo es muy alto (arri- ba de 4 D) pero regular, en ese caso sí implanto un lente tórico. En este momento no marco a los pacientes previo a la cirugía, utili- zo el CALLISTOeye de ZEISS para orientar el lente tórico con resul- tados muy predecibles.
4. Actualmente ¿hace un mix- and-match de algunas LIOs en pacientes que desean obtener la multifocalidad a través de la cirugía de catarata? ¿En cuá- les casos y cuáles lentes utiliza para eso?
Dr. Fernando Soler: Con bastante frecuencia mezclamos una bifocal de baja adición (Tecnis ZLB +2.25 en plano de gafas) con Symfony. Las curvas binoculares son superiores a las de las trifocales del mercado.
Dr. Claudio Orlich: No lo hago de ru- tina, en pacientes sanos creo que es mejor implantar el mismo lente en ambos ojos, pero en casos selectos puede ser una buena opción. Por ejemplo, cuando un paciente tiene alguna patología que compromete el contaste en un ojo (membrana epirretineana con buen potencial vi- sual, glaucoma leve, etc.) y el otro ojo es completamente sano y desea una menor dependencia a las gafas, le implanto un Symfony en el ojo con la patología y un trifocal FineVi- sion PhysIOL en el otro sano.
5. ¿Tiene experiencia en poner algún LIO que objetiva la multifocalidad en casos no usuales (como ojos pos-RK, ojos pos-LASIK/PRK, ojos con ectasia corneal)? En caso de que la tenga ¿cuáles criterios utiliza para indicar esta LIO y cómo planea la cirugía?
Dr. Fernando Soler: En ojos operados de refractiva con cualquier técnica y con buena visión implantamos MFC. No olvidemos que son ojos que se ope- raron para no llevar gafas, por lo que el paciente va a ser más receptivo a la MFC. Implantamos cada vez más Symfony por su capacidad de soportar pequeños defectos residuales. En ojos aberrados y con poca agudeza visual no implantamos MFC.
Dr. Claudio Orlich: En córneas irregula- res utilizo el XtraFocus de la compañía Mörcher, dejando una mini-monovisión, ojo dominante emétrope con un lente esférico, esto les da mayor profundidad de foco que con un asférico, y en el ojo no dominante el target es -0.75 D utili- zando un XtraFocus que es un disposi- tivo similar a un lente intraocular Add- On (Human Optics) o sulcoflex (Rayner), sin poder o graduación, con un agujero estenopeico que aumenta la profundi- dad de foco, colocado en el sulcus en un concepto piggyback por delante de una lente monofocal implantada en el saco. No utilizo multifocales en ectasias, pos operados de QR o en córneas irregulares
6. ¿Cómo cree que serán los próximos avances en lentes intraoculares que objetivan la multifocalidad?
Dr. Fernando Soler: Quedan muchos años de lentes de per- files escalonados con difracción. Prometedoras las lentes que juegan con las aberraciones es- féricas pero no creo que puedan alcanzar corrección de 100% en todas las distancias
Habrá que ver los desarrollos con lentes acomodativas y qué camino marcan.
Dr. Claudio Orlich: Los mul- tifocales distribuyen la luz y generan múltiples focos en la retina, todos producen halos y disminuyen la sensibilidad al contraste, en el futuro los lentes para corregir presbicia deben ser acomodativos, para eliminar los halos y dar bue- na sensibilidad al contraste en todas las distancias. Hasta el momento, los diseños de len- tes acomodativos existentes no han logrado ser efectivos, al menos a largo plazo, pero se encuentran bajo investigación nuevos diseños acomodativos como pueden ser el Fluid Vi- sion, Ocumetics Bionic Lens y el Z Lens IOL, entre otros.