Tecnologías diagnósticas modernas en cirugía de catarata
Coordinador
Dr. Fernando Aguilera – México
Panelistas
Dr. Gerardo Valvecchia – Argentina Dr. Guadalupe Cervantes – México Dr. Luis Escaf – Colombia
Contacto
Dr. Fernando Aguilera – drfaguilera@gmail.com
Dr. Gerardo Valvecchia – gerardovalvecchia@hotmail.com
Dr. Guadalupe Cervantes – gpecervantes@hotmail.com Dr. Luis Escaf – escaff@gmail.com
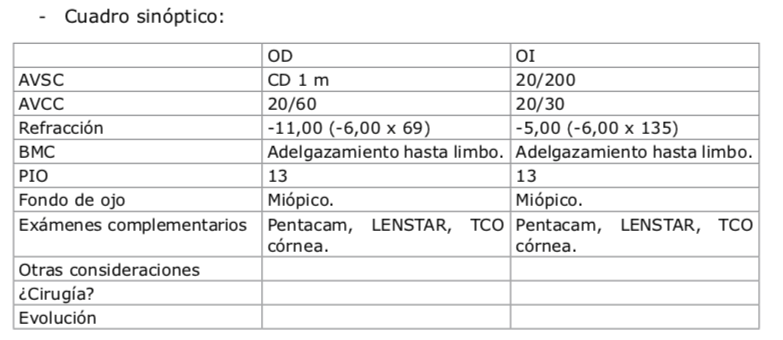
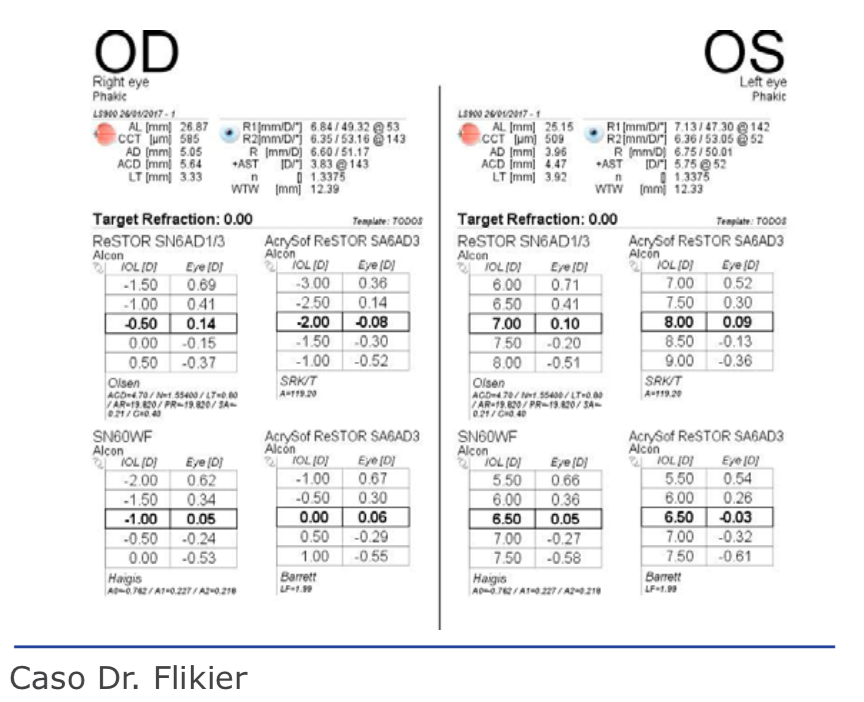
CASO CLÍNICO
Se trata de un paciente masculino de 62 años con antecedentes:• Diabetes tipo II controlada.
• CX catarata OIZQ ─ 2014 «complicada», que ameritó tres operaciones, actualmente en ptisis.
• Ojo derecho AV 20/200 que no mejora con corrección.
• QM43x43,5×175
• Córnea transparente con cuenta endotelial de 2 874.
• Cristalino con opacidad polar posterior avanzada.
• Vítreo transparente.
• Retina sin evidencia clínica de retinopatía diabética.
• OCT macular normal.
PREGUNTAS:
1.¿Qué estudios preoperatorios utilizan en la valoración de estos casos de catarata polar posterior?
Dr. Guadalupe Cervantes:
-Examen oftalmológico completo: biomicroscopía con exploración minuciosa de la cara posterior del cristalino y muy buena revisión de la retina (DM y ojo único).
Cálculo de lente intraocular (incluyendo lente monofocal de una pieza para bolsa y de tres piezas para sulcus).
-UBM (ayudará a diferenciar una opacidad subcapsular posterior vs catarata polar posterior vs lentícono posterior vs hialoides persistentes (“puntos de Mittendorf”) vs vítreo primario hiperplásico persistente).
Dr. Luis Escaf: Estamos al frente de un caso especial de catarata con dos condiciones, aunque independientes entre sí, se entrelazan para ofrecer un panorama que reta aún más al cirujano, como son un ojo único valioso y una catarata polar, que de por sí tiene una alta probabilidad de ruptura capsular posterior (según la literatura, del 7 % al 37 % de RCP), con todas las complicaciones que esto supone.
Es de sospechar que el ojo actualmente en ptisis es producto de una complicación derivada de la cirugía de catarata y que después de tres cirugías [el paciente] terminó con el ojo en esas condiciones de ceguera.
Antes de pasar a considerar el abordaje preoperatorio, es muy importante explicarle al paciente y familiares el riesgo que esta cirugía supone y, por supuesto, el cirujano hacer un autoanálisis y ver si se siente competente para abordar el caso.
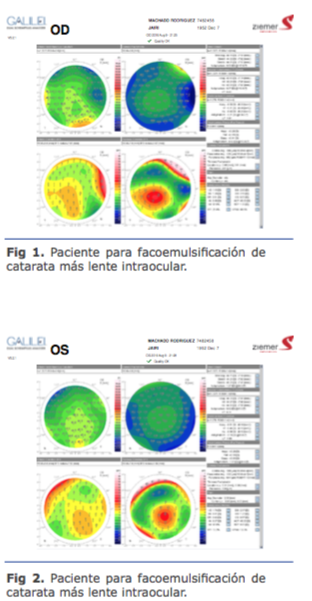
Como toda catarata, debe tener su biometría, ecografía, recuento endotelial y OCT macular. Pero nosotros consideramos de gran utilidad en este tipo de cataratas hacer una UBM, que muestre la catarata polar y su relación con la cápsula posterior, ya que es de pocos conocidos que la catarata polar posterior puede presentarse de diferentes formas en relación con la cápsula posterior (Foto
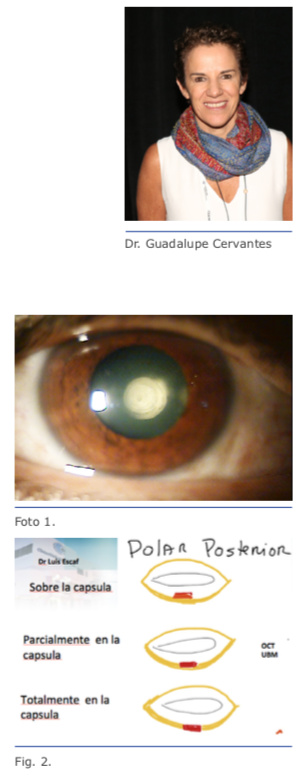 1. Catarata polar posterior por encima de la cápsula posterior (Fig. 2).
1. Catarata polar posterior por encima de la cápsula posterior (Fig. 2).
2. Catarata polar posterior parcialmente incrustada en el espesor de la cápsula posterior.
3. Catarata polar posterior involucrada 100% en la cápsula posterior, lo que supone, de entrada, que hay un riesgo del 100 % de una RCP.
Esto solo lo podemos ver con una UBM o con IOLMaster 700 (comunicación escrita del Dr. Mario de La Torre -Fotos 3, 4, 5.
(Ver video 1)
Dr. Gerardo Valvecchia: Habitualmente utilizo todos los recursos a mi alcance para así poder dar información adecuada a los pacien- tes de cuál podría ser el desarrollo y desenlace de sus cirugías. En los casos como el que se nos plantea es muy difícil vaticinar qué va a pasar durante la misma.
La lámpara de hendidura sigue siendo, a mi cri- terio, irremplazable. Con una buena dilatación y tiempo es posible tener un panorama de con qué nos encontraremos en el quirófano.
También, en estos casos, trato de realizar UBM además de los estudios que pido en forma ru- tinaria antes de ofrecer la cirugía. Si vemos que la cápsula posterior ya está rota, cambia el planteo quirúrgico.
Mi rutina prequirúrgica consta de: topografía corneal, biometría óptica, microscopía endo- telial, iconografía de retina y OCT de mácu- la y córnea.
Por los datos otorgados, no pareciera en prin- cipio, tener alguna patología agregada más allá de la catarata que amerita pedir otro tipo de estudios.
2.¿Qué técnica quirúrgica es la que usan en estos casos?
Dr. Guadalupe Cervantes:
– Incisiones habituales 2,2 y 1 mm. – Tinción con azul de tripano.
-Capsulorrexis central y circular no mayor de 5 mm (útil para captura del LIO).
- – SOLO hidrodelaminación sin rotar el núcleo.
- – Emulsificación del epinúcleo lenta y con parámetros bajos, evitando descompre- sión brusca de la CA.
- – Aspiración lenta de corteza sin causar trac- ción, dejando al final la parte central, pos- terior del cristalino.
- – Implante del LIO en la bolsa o en el sulcus, dependiendo de la presencia o no de RCP.
- – Retiro de viscoelástico, dejando el ojo sin excesiva presurización.- Punto de sutura.
Dr. Luis Escaf: La técnica quirúrgica debe ir encaminada a preservar en lo posible la inte- gridad de la cápsula posterior desde principio hasta el final, inclusive en la inserción del LIO, puesto que si no se toman medidas, puede ocu- rrir una RCP.
Hay que diferenciar si la catarata es una sub- capsular posterior o una verdadera catarata polar, y si esta catarata polar es dura o blan- da, ya que la conducta quirúrgica varía según su presentación.
 Si definitivamente es una catarata polar posterior dura, como se supone en este caso, por la edad del paciente, me voy limitar a describir como no- sotros abordamos este tipo de cataratas.
Si definitivamente es una catarata polar posterior dura, como se supone en este caso, por la edad del paciente, me voy limitar a describir como no- sotros abordamos este tipo de cataratas.
Dependiendo de lo que podamos ver en la UBM, la conducta varía al momento de realizar la hi- drodisección, la rotación y la facoemulsificación de fragmentos.
Los pasos iniciales serían, en su orden:
- Capsulorrexis no mayor de 5,5 mm con el fin de dejar un reborde capsular amplio en caso de RCP y que podamos implantar el LIO en el sulcus.
- No hacer hidrodisección.
- Realizar la técnica antibloqueo (Figuras 6, 7, 8) parcial ─descrita por nosotros─, muy ori- ginal y lógica para abordar este tipo de cata- ratas polares, publicada en el libro Cristalino de las Américas (capítulo 106, Manejo mo- derno de la catarata polar posterior), en la cual, después de realizar la CCC, no realiza- mos hidrodisección, sino que usando el ultra- chopper, realizamos un surco de un 30 % a 40 % del grosor de la catarata y unos 3 mm a 4 mm de longitud (sin tocar el borde de la rexis). Después completamos la fractura en la periferia del extremo distal utilizando un prechopper mecánico (Escaf prechopper ─ ASICO ─ Katena-Epsilon) y así completamos la fractura en el extremo de la catarata, con- servando el centro de ella.
Debemos tener en cuenta que la altura de la botella no exceda 60 cm para evitar producir estrés sobre la cápsula posterior que implique una RCP.
4. Seguidamente realizamos la hidrodisección, y el líquido diseca las áreas circundantes de la placa sin comprometer el sitio donde está la adherencia a la cápsula posterior placa polar. Si por UBM hemos identificado que se presentan las situaciones 1 y 2 mencionadas anteriormente, 1) catarata polar posterior por encima de la cápsula posterior, 2) catarata polar posterior parcialmente incrustada en el espesor de la cápsula posterior, procedemos a:
5. Realizar rotación suave de la catarata y realizar surcos con el ultrachoper hasta obtener de 6 a 8 fragmentos con un centro común intacto.
6. Procedemos a facoemulsificar los fragmentos tangencialmente sin tratar de desenclavarlos donde están unidos por el centro, adelgazándolos lo más posible.
Tratar de remover el área distal de un fragmento y por ahí introducir viscoelástico dispersivo con el fin de levantar la placa posterior no adherida a la cápsula y así poder facoemulsificar sin el riesgo de RCP. Recordar que seguimos trabajando con alturas bajas, vacíos bajos y poder torsional bajo.
7. Eliminados los fragmentos, procedemos a aspirar la corteza con la cánula de I/A, procurando no sacar la punta del faco sin que simultáneamente introduzcamos viscoelástico por la paracentesis y evitar la herniación de la cápsula posterior y la fractura de ella.
8. Eliminados los restos corticales, debemos tener mucho cuidado en la inserción del LIO, ya que en este paso se puede producir RCP si no rellenamos el saco con viscoelástico suficiente.
Si lo rellenamos mucho, lo podemos hacer explotar y si lo rellenamos a media, la háptica puede arrastrar el saco y producir una RCP. Tratar
que la háptica sobrepase en el centro de la cápsula posterior cuando entra y se despliegue suavemente, tratar de no ro- tarla y, en lo posible, no retirar el vis- coelástico detrás del LIO.
Si la catarata polar presenta la condi- ción 3 (catarata polar posterior involu- crada 100 % en la cápsula posterior, lo que supone de entrada que hay riesgo del 100 % de una RCP), la técnica es la misma que la anteriormente descrita. Lo único que varía es que no rotamos la catarata, ya que se haría un efec- to de trepanación sobre la cápsula posterior; lo que hacemos es dividir- la in situ con el ultrachopper y posterior- mente ir emulsificando el centro (sin lle- gar a la placa) y posteriormente atacar la periferia.
Cuando se haya adelgazado lo suficien- te, levantamos lo que queda con vis- coelástico y emulsificamos lejos de la placa y de la RCP que se haya produci- do.SihayunafranjadeRCP,queusual- mente es redonda y definida, se puede colocar el LIO en el saco y después am- pliarla (ver video 2).
Dr. Gerardo Valvecchia: Asumo a priori que la cápsula posterior está rota o va a romperse, si tenemos la suer- te de que permanezca intacta bienveni- do sea; pero comienzo la cirugía como si estuviera rota. Algo similar hago con los
pacientes que debo operar de cataratas y están previamente vitrectomizados.
INCISIONES: No varío mi técnica. Dos incisio- nes. Córnea clara de 2,4 mm la principal y 0,75 mm la accesoria.
CAPSULORREXIS: Prefiero que sea un poco más pequeña que la habitual. De 5 mm de diá- metro con microfórceps. En caso de no poder colocar el LIO en el bag, tendría mejor sopor- te para colocarlo en el sulcus, y en caso de ser necesario, facilitaría una eventual captura de la óptica.
HIDRODISECCIÓN: Casi NUNCA. El “casi” es porque en algunos casos realizo miniolas de hi- drodisección que voy controlando y me asegu- ro que no lleguen nunca a tocar la catarata po- lar posterior. Igualmente el concepto que debe quedar en claro es NUNCA realizar hidrodisec- ción en estos casos.
HIDRODELAMINACIÓN: SIEMPRE. Es un paso fundamental y lo realizo muy lentamen- te y sin inyectar grandes volúmenes de líquido.
FACOEMULSIFICACIÓN: De rutina trato de luxar con un Drysdale o Pusher el núcleo a cá- mara anterior con maniobras suaves. Actúo como si la cápsula posterior estuviera rota y prefiero un poco más de edema corneal al día siguiente que tener fragmentos flotando en el vítreo. El mismo proceder realizo en los pacien- tes vitrectomizados. La mayoría de los casos que he operado son facoaspiraciones y de ser núcleos más duros, con los nuevos facoemulsi- ficadores, tampoco se observan grandes cam- bios en el posquirúrgico con respecto a la técni- ca de facoemulsificación endosacular.
ASPIRACIÓN DE CORTEZA: Unimanual y siempre comenzando a aspirar los restos por debajo de la capsulorrexis anterior con el ori- ficio de aspiración visible a nuestros ojos, con cuidado y tratando de no acercarme a la catara- ta polar.
COLOCACIÓN DEL LIO: De preferencia en el bag. Monopieza acrílico hidrofílico o hidrofóbi- co. Si la cápsula posterior está rota, tras realicapsulorrexis posterior y colocación del LIO en el bag. De no tener sustento suficiente, coloco LIO de tres piezas en el sulcus.
3. En caso de RCP, ¿qué manejo quirúrgico realizan?
Dr. Guadalupe Cervantes: Al evidenciar la RCP realizo un taponamiento del vítreo con viscoelástico y emulsifico el material remanente en la cámara anterior. En cuanto a la cápsula posterior rota, intento convertir la ruptura a una capsulorrexis circular continua “posterior”, que me pueda servir para abotonar la óptica del LIO. Además, antes de implantar el LIO, realizo una vitrectomía.
Dr. Luis Escaf: En caso de RCP, hay que tener en cuenta si esta se produce al inicio (hidrodisección), durante la faco, durante la remoción de fragmentos o al implantar el lente intraocular. Según el momento, requiere un abordaje diferente, que va desde una conversión a una extracapsular o la asistencia de un retinólogo.
Dr. Gerardo Valvecchia: Depende del momento de la cirugía en el que esté. Habitualmente, al menos en mi experiencia, constato que está rota luego de haber sacado el núcleo.
De no existir vítreo, puedo intentar aspirar las masas remanentes con I/A pero realizando la misma con la pieza de mano del vitréctomo 23 G sin activar el corte. La irrigación la realizo por punción lateral. Es muy controlable y todo pasa más lento en cámara anterior.
Si el vítreo aparece en la ruptura capsular, realizo vitrectomía por pars plana con trocar valvulado 23 G.
4.¿Qué tipo de LIO implantarían en un caso de RCP?
Dr. Guadalupe Cervantes: Si el tamaño de la ruptura no es tan grande, que me pueda poner en riesgo la luxación del LIO hacia cámara posterior, implanto un LIO de
una pieza en bolsa, con captura de la zona óptica en la capsulorrexis.
En caso que esto no sea posible, implanto un LIO de tres piezas en el sulcus, con captura de la óptica en la capsulorrexis anterior.
 Dr. Luis Escaf: De antemano a la cirugía uno debe planear qué tipo de LIO va implantar. Puede ser un multifocal, un monofocal o un tórico, pero tener a la mano un monofocal de tres piezas o de una sola pieza. En caso de que no se pueda implantar el LIO premium, se decide por monofocal y, dependiendo de la RCP, se implanta en sulcus o saco, pudiéndose abotonar ya sea por delante o por detrás de la rexis o, en algunos casos, en la capsulorrexis posterior (ver video de Ike Ahmed).
Dr. Luis Escaf: De antemano a la cirugía uno debe planear qué tipo de LIO va implantar. Puede ser un multifocal, un monofocal o un tórico, pero tener a la mano un monofocal de tres piezas o de una sola pieza. En caso de que no se pueda implantar el LIO premium, se decide por monofocal y, dependiendo de la RCP, se implanta en sulcus o saco, pudiéndose abotonar ya sea por delante o por detrás de la rexis o, en algunos casos, en la capsulorrexis posterior (ver video de Ike Ahmed).
Dr. Gerardo Valvecchia: Si el bag está indemne, LIO monopieza acrílico hidrofílico o hidrofóbico. En cápsula posterior rota con sostén, coloco el mismo LIO en el bag. Previo capsulorrexis posterior y vitrectomía. En cápsula rota sin sostén, coloco LIO de tres piezas en el sulcus.
5.¿En qué casos de RCP con paso de material cristaliniano a vítreo realizarían vitrectomía posterior vía pars plana?
Dr. Guadalupe Cervantes: Se sabe que la manera en que se hace menor tracción del vítreo durante una vitrectomía es realizándola vía pars plana, (regresando el vítreo “a casa”). Sin embargo, cuando el cirujano de catarata que está realizando la faco no domina esta técnica, se puede realizar dicha vitrectomía vía anterior, intentando siempre usar triamcinolona que ayuda a teñir el vítreo y a evitar dejar bandas de tracción hacia la incisión.
Dr. Luis Escaf: Personalmente pien- so que estas maniobras de vitrectomía vía pars plana deben ser ejecutadas por un re- tinólogo y más aún por tratarse de un ojo valioso ya que es ojo único.
Comentarios y conclusiones:
En nuestro servicio realizamos una recopi- lación de todas las cirugías de cataratas he- chas desde el 2011 hasta el 2014 (4 años) y consolidamos 13.328 videos de los cuales 129 (0,99%) eran cataratas polares posteriores (no publicado). La literatura mundial dice que su prevalencia es de 0,44 %. Posiblemente sobrediagnosticamos estas cataratas, y creo que es cierto, ya que des- de que incluimos la UBM como método diag- nóstico (como lo comenta el Dr. Mario de la Torre), la frecuencia de ellas ha bajado en un número apreciable.
Recomiendo utilizar la UBM o el IOLMaster 700 para apreciar si la polar compromete parcial o totalmente el espesor de la cápsu- la posterior.
Realizando la técnica antibloqueo en todas estas 129 cataratas diagnosticadas en la lámpara de hendidura, el número de RCP fue de cuatro cataratas (3,1 %), muy por debajo de la literatura mundial (del 7 al 36 %).
Se trata de un caso de difícil manejo por ser ojo único y catarata polar dura y que debe ser manejada por un oftalmólogo experto con todo el apoyo tecnológico prequirúrgi- co e intraquirúrgico y soporte de retinólogo.
Por último, el Dr. Vasavada hace una revisión de la literatura sobre el tema, la cual incluyo con fines académicos (Fig. 9).
Dr. Gerardo Valvecchia: En la actua- lidad, cuando necesito hacer vitrectomía du- rante una cirugía de catarata, siempre la realizo por pars plana con trocares valvula- dos 23 G con o sin fragmentos de cristalino en el vítreo. Los cirujanos de segmento an- terior debemos manejar trocares y la pars plana.
 Cualquier vitréctomo neumático que trai- ga el equipo de facoemulsificación de más de 1.200 cortes sirve. A todos los facoemul- sificadores se les pueden adaptar piezas de mano de vitréctomos 23 G, solo debemos asesorarnos a cuantos PSI trabaja nuestro equipo para comprar las piezas adecuadas.
Cualquier vitréctomo neumático que trai- ga el equipo de facoemulsificación de más de 1.200 cortes sirve. A todos los facoemul- sificadores se les pueden adaptar piezas de mano de vitréctomos 23 G, solo debemos asesorarnos a cuantos PSI trabaja nuestro equipo para comprar las piezas adecuadas.
La entrada posterior es menos traumáti- ca para el ojo y produce menos movimien- to del humor vítreo, menos surge y menor tracción. El índice de complicaciones vitreo- rretinales es significativamente menor. Los
trabajos publicados muestran menor chan- ce de desprendimiento de retina pseudo- fáquico, glaucoma inflamatorio por restos, uveítis facoanafiláctica, edema macular cistoide y menor índice de bridas vítreas a la incisión. La posibilidad de DR pseudofá- quico es del 9 % cuando se realiza vitrec- tomía por pars plana y entre el 10 al 26 % cuando se realiza por cámara anterior.
La técnica básica consiste en un solo trocar a 3,0 mm del limbo e irrigación con cánula 23 G colocada en la punción lateral en cór- nea clara. Se realiza vitrectomía central ge- nerosa y lentamente nos acercamos desde pars plana a la zona de la ruptura capsular.
Cuanto mayor número de cortes pueda de- sarrollar el vitréctomo, más controlado será todo, pudiéndonos acercar a menos de 1 mm de la cápsula del cristalino sin produ- cir tracciones.
Conclusiones del Caso por el Dr. Fernando Aguilera
La frecuencia de ruptura de cápsula poste- rior en catarata polar varía según la rela- ción de ésta con la cápsula. Esto se pue- de evaluar en el preoperatorio con el uso de OCT y ha sido descrito por tres tipos de ca- tarata polar posterior y su relación con RCP durante la facoemulsificación.
En conclusión, la catarata polar posterior implica un riesgo de ruptura capsular aun con todas las técnicas preventivas antes mencionadas, por lo que siempre debere- mos estar preparados para manejar ade- cuadamente esta probable complicación.
Esto se puede evaluar en el preoperatorio con el uso de OCT y ha sido descrito por Chan Emmy (JCRS) (Imagen 1 y Foto 2) o mediante el uso de Swept Source OCT- IOLMASTER 700 (Foto 3).
¡Gracias a los doctores Cervantes, Escaf y Valvecchia por su excelente participación!



 El párpado es una estructura anexa que nos puede dar más de un dolor de cabeza en el pre y posoperatorio sino le damos la importancia que se merece. Los párpados deben estar completamente sanos para proceder a una eventual cirugía intraocular y para ello su análisis debe ser minucioso y obligatorio. Foto 3.
El párpado es una estructura anexa que nos puede dar más de un dolor de cabeza en el pre y posoperatorio sino le damos la importancia que se merece. Los párpados deben estar completamente sanos para proceder a una eventual cirugía intraocular y para ello su análisis debe ser minucioso y obligatorio. Foto 3.
 En la figura 10 podemos ver la in- tegridad de los anillos mientras que en la figura 11 se aprecia ya un des- vanecimiento de los anillos.
En la figura 10 podemos ver la in- tegridad de los anillos mientras que en la figura 11 se aprecia ya un des- vanecimiento de los anillos.
 La biometría óptica o interferometría de coherencia parcial utiliza una fuente de luz con coherencia parcial que funciona como un interferómetro de Michelson (Figura 1). Los biómetros ópticos miden de la córnea al EPR, en cambio los biómetros ultrasónicos miden de la córnea a la membrana limitante interna. Los primeros permiten realizar mediciones de no contacto, rápidas y precisas, a diferencia de la biometría ultrasónica.
La biometría óptica o interferometría de coherencia parcial utiliza una fuente de luz con coherencia parcial que funciona como un interferómetro de Michelson (Figura 1). Los biómetros ópticos miden de la córnea al EPR, en cambio los biómetros ultrasónicos miden de la córnea a la membrana limitante interna. Los primeros permiten realizar mediciones de no contacto, rápidas y precisas, a diferencia de la biometría ultrasónica. El biómetro OA-2000 (Tomey), utiliza una tomografía de coherencia de fuente de barrido o espectral, que permite una mayor penetración a los tejidos (Fig. 5):
El biómetro OA-2000 (Tomey), utiliza una tomografía de coherencia de fuente de barrido o espectral, que permite una mayor penetración a los tejidos (Fig. 5):
 En 2012 Holladay5 estudió las DN provocadas en un globo ocular simulado, diseñado con un programa especial, considerando un LIO de acrílico, de 6 mm de diámetro y 20 D, pupila de 2,5 mm y observó que, al incidir un haz luminoso, se producían dos anillos completos, de 360° que al sobreimprimirlos
En 2012 Holladay5 estudió las DN provocadas en un globo ocular simulado, diseñado con un programa especial, considerando un LIO de acrílico, de 6 mm de diámetro y 20 D, pupila de 2,5 mm y observó que, al incidir un haz luminoso, se producían dos anillos completos, de 360° que al sobreimprimirlos
 El día de hoy, les doy mis top 10 de los signos que se deben tener en cuenta al enfrentarnos a una córnea sospechosa.
El día de hoy, les doy mis top 10 de los signos que se deben tener en cuenta al enfrentarnos a una córnea sospechosa.

 Dr. César Carriazo: Estamos usando PALK solamente en querato- conos grado IV (presencia de estrías, leucomas, y/o hidrops no agudo).
Dr. César Carriazo: Estamos usando PALK solamente en querato- conos grado IV (presencia de estrías, leucomas, y/o hidrops no agudo).

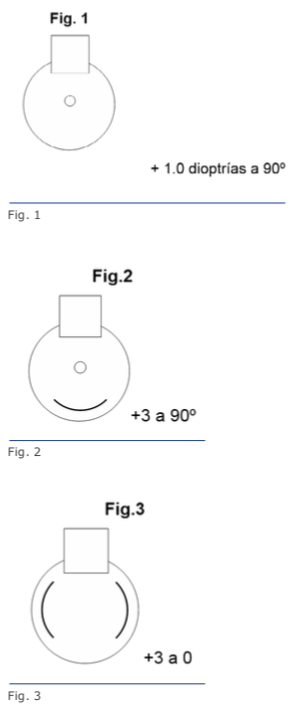
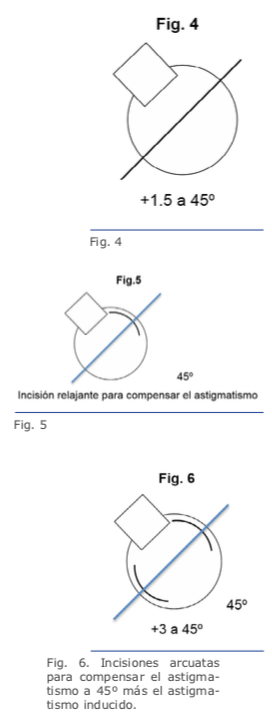 Para astigmatismo entre 1 y 7 dioptrías también se pueden usar las lentes tóricas, que son indispensables si se planea corregir más de 3 dioptrías. En los valores menores de 3 dioptrías, la elección dependerá del gusto del cirujano y las posibilidades del paciente, pues el costo de las lentes tóricas aumenta significativamente el valor de la cirugía.
Para astigmatismo entre 1 y 7 dioptrías también se pueden usar las lentes tóricas, que son indispensables si se planea corregir más de 3 dioptrías. En los valores menores de 3 dioptrías, la elección dependerá del gusto del cirujano y las posibilidades del paciente, pues el costo de las lentes tóricas aumenta significativamente el valor de la cirugía.