Noticiero ALACSA – R :: Abril 2013
Editor General
Editores
REFRACTIVA Y CÓRNEA – María José Cosentino – Argentina
Coeditores de Cirugía Refractiva y Córnea
Arturo Chayet (México)
Cesar Carriazo (Colombia)
Daniel Scorsetti (Argentina)
David Flikier (Costa Rica)
Luis Izquierdo Jr. (Perú)
Mauro Campos (Brasil)
Miguel Srur (Chile)
Renato Ambrósio (Brasil)
Roberto Albertazzi (Argentina)
Sérgio Kwitko (Brasil)
Coeditores de Catarata
Armando Crema (Brasil)
Carlos Nicoli (Argentina)
Claudia Palacio Pastrana (México)
Claudio Orlich (Costa Rica)
Daniel Badoza (Argentina)
Edgardo Carreño (Chile)
Eduardo Chávez (México)
Enrique Suárez (Venezuela)
José Luis Rincón (Venezuela)
Luis Lu (USA)
Miguel Padilha (Brasil)
Editor de Vídeo
Luis Escaf (Colombia)
Editores
REFRACTIVA Y CÓRNEA – Heriberto Mario Marotta (Argentina)
Coeditores de Cirugía Refractiva y Córnea
Alberto Habert (México)
Arturo Kantor (Chile)
Carlos Ferroni (Argentina)
Carlos Palomino (España)
David Flikier (Costa Rica)
Edna Almodin (Brasil)
Luis A. Rodríguez Torres (Venezuela)
Luis Izquierdo (Perú)
Pablo Suarez (Ecuador)
Coeditores de Catarata
Claudio Orlich (Costa Rica)
Daniel Badoza (Argentina)
Eduardo Viteri (Ecuador)
Fernando Aguilera (México)
Jorge Jaramillo (Venezuela)
Juan Carlos Corbera (Perú)
Milton Yogi (Brasil)
Ramón Lorente (España)
Director Ejecutivo
Traducción cortesía de

Servicio Internet cortesía de

Editorial
Evolución de las plataformas de faco-femtosegundo en Europa
Dr. Juan Carlos Palomino Bautista – España
Editorial
Oh nooooo … sorpresa refractiva … ¿qué pasó?
Dr. David Flikier – Costa Rica
Foro Refractiva
Manejo actual de la Presbicia
Coordinador: Dr. Miguel Srur – Chile
Panelistas: Dr. Cesar Carriazo – Colombia, Dra. Maria José Cosentino – Argentina
Refractiva: Ciencia – Arte – Experiencia
Noticiero ALACCSA-R pregunta (colaboración de la Dra. Maria José Cosentino):
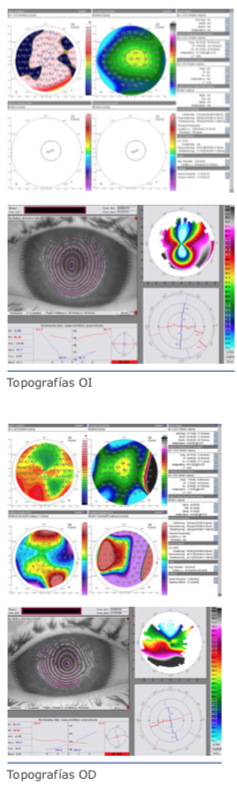
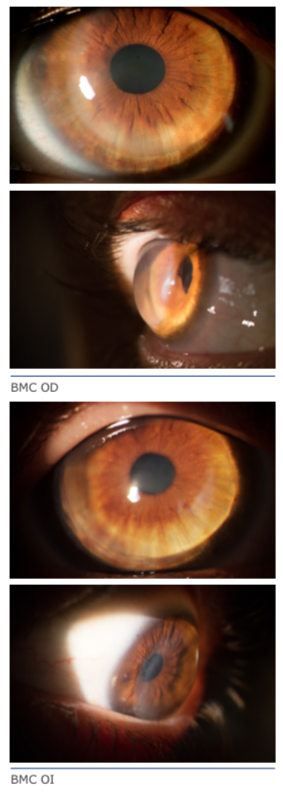
Paciente varón, de 48 años, operado de LASIK en 2009 en AO. En OD el resultado es óptimo: AVSC 20/25. En OI presenta AVSC 20/200 mejora con +1 a 20/80. Con adición de +2 D la AV cercana es normal. Presenta cristalino transparente. Se adjunta topografía corneal y aberrometria de OI. El fondo de ojo es normal. Cuál es la conducta terapéutica que sugiere para el OI?
Dr. Pedro Paulo Fabri – Brasil
Dr. Waldir Portellinha – Brasil
SBAO – Sociedade Brasileira de Administração em Oftalmologia
Ciclo de servicios en las clínicas oftalmológicas – Marketing en salud
Alice Selles – Brasil
Noticia
Nuestra experiencia con la lente LISA Tri 839 MP
Dr. Juan Carlos Palomino Bautista, Dr. Pedro Tañá Ribero – España
ALACCSA-R / LASCRS in ASCRS – San Francisco, April 19 – 23, 2013
ALACCSA-R / LASCRS in Pan American & Brazilian Cong. of Ophthal., Rio de Janeiro, Aug. 07 – 10, 2013
Avisos
- noticiero@alaccsa-r.info: Puede enviar sus comentario que en el próximo número iremos publicarlo.
- Las opiniones o manifestaciones aquí divulgadas son de exclusiva responsabilidad de los autores.
- Si no deseas recibir Noticiero ALACCSA-R, clique aquí.
Evolución de las plataformas de faco-femtosegundo en Europa
Dr. Juan Carlos Palomino Bautista – España
E-mail: cpalomino@oftalmos.es // cpalomino.mad@quiron.es
El primer láser de femtosegundo para la investigación clínica data del año 2009 en Budapest (Hungría) comandado por el Dr. Zoltan Enagy siendo la plataforma empleada de diseño LenSX. Se conseguía con esta plataforma reducir la potencia de facoemulsificación en un 43% y el tiempo de uso del facoemulsificador, incluida la irrigación-aspiración, en un 51%, siendo más preciso en el tamaño y la forma de la capsulotomía en relación con la capsulorrexis manual continua.
El láser de femtosegundo en estado sólido fue desarrollado a partir de la plataforma Intralase con una interface curva de contacto corneal que, visualiza las estructuras oculares a través de una OCT unidimensional que, se podían fijar mediante cursores verticales en la pantalla con la capacidad de realizar capsulotomía anterior, fragmentación del núcleo e incisiones corneales, principal y accesoria, para facilitar la cirugía del cristalino.
En Septiembre del año 2012 Technolas Perfect Vision, activa la primera unidad de su plataforma de femtosegundo VICTUS para la cirugía de cataratas. Este prototipo fue llevado por el Prof. Gerd Auffarth en Heidelberg (Alemania). Esta plataforma reconocía las estructuras oculares mediante una OCT con interface curva de contacto corneal.
En Diciembre del año 2011 se instala la primera unidad láser de femtosegundo CATALYS de Optimedica (Santa Clara, USA) en Europa a cargo del Prof. Burkhard Dick en Bochum (Alemania). Este aparato incorpora como novedades un dispositivo de acoplamiento sin contacto corneal (Liquid Optics Interface) y un sistema guiado mediante OCT Fourier Domain tridimensional con detección automática de estructuras corneales y cristalinianas.
En Septiembre del 2012 se realiza la primera instalación de la plataforma LenSAR en Europa en Kiel, Alemania, clínica dirigida por el Prof. Uthoff con un diseño que incluye una interface líquida para el paciente.
Valorando la diferencia entre el acoplamiento de contacto corneal y de no contacto corneal, las primeras producen pliegues en la cara posterior de la córnea que pueden acarrear imprecisiones en la realización de la capsulotomía anterior mejorándose de forma significativa en las plataformas con interface líquida.
Los sistemas de imagen utilizados en las diferentes plataformas son las siguientes: CATALYS, posee una plataforma 3D Fourier Domain, VICTUS posee una OCT con captación de imágenes en dos planos diferentes de 0º y 90º para realizar una correcta fragmentación y que permite visualizar los 360º de la cápsula anterior. LenSX detecta las estructuras corneales mediante una OCT unidimensional en tiempo real. La plataforma LenSAR reconoce las estructuras mediante un sistema 3D – CSI de tecnología SCHEIMPFLUG.
En cuanto a la duración del pulso láser CATALYS lo hace con menos de 600 Fs., LenSX entre 600 y 800 Fs., y LenSAR EN 1.500 Fs. Siendo este dato importante ya que, a mayor duración del pulso láser se libera una mayor energía que a la vez produce una mayor cantidad de gas que genera una menor precisión en el tratamiento. Actualmente en Europa están instaladas más de 50 unidades en funcionamiento en 17 países europeos. La planificación quirúrgica estima que se realizaran 35.000 cirugías de catarata con esta tecnología cada año. Este procedimiento conseguirá que el uso de energía y tiempo de ultrasonido disminuya significativamente. Los facoemulsificadores estarán incluidos dentro de las plataformas y pasarán a ser simples módulos de irrigación –aspiración. Es probable que esta técnica extienda a todos sus usuarios la cirugía microincisional bimanual. También se incorporarán modernos microscopios con ayudas para incorporación de soluciones aberrométricas y de posicionamiento de las lentes intraoculares.
Con la plataforma CATALYS han sido tratados a fecha de Junio del año 2012, 900 pacientes con un 99% de capsulotomías libres y un 96% de reducción de la energía de facoemulsificación en cataratas de grado II a grado IV Plus en la clínica del Prof. Dick, encontrando como única contraindicación los pacientes con opacidad corneal severa, presencia de anillos intracorneales o de implantes intraestromales para la presbicia.
En resumen, y como ya es histórico en nuestra especialidad, la industria nos aporta instrumentos de un elevadísimo coste y con un básico desarrollo, trasladándonos una gran presión comercial y dejándonos a nuestro cargo el desarrollo de la tecnología.
Sin embargo, no hay que olvidar que esta tecnología ha venido para quedarse y que es la última evolución en nuestras manos que tenemos para mejorar la eficacia de la cirugía de cataratas.
Pensamos no perdernos la oportunidad de participar en la evolución y desarrollo tecnológico de esta técnica.
Damos la bienvenida a esta tecnología y debemos abrirnos a ella y no preocuparnos de forma excesiva por la diferencia entre las diferentes plataformas, ya que todas ellas van a evolucionar y a llegar a un excelente punto de desarrollo.
Damos la bienvenida al faco-femtosegundo para la realización de la cirugía del cristalino.
Oh nooooo … sorpresa refractiva … ¿qué pasó?
Dr. David Flikier – Costa Rica
E-mail: david@flikier.com
A pesar que la impresión subjetiva de todos nosotros es que las sorpresas refractivas se presentan en un pequeño número de pacientes, la realidad es que los diferentes estudios evidencian que solo un 6% de los cirujanos tienen resultados excelentes de +0.50D en más de un 80% de los casos y solo 1% de cirujanos resultados de + 0.5D en el 90% de casos (Warren Hill 2012). Esto quiere decir que la mayoría de los cirujanos tenemos resultados no óptimos (esfera y/o cilindro), en más de un 20 % de nuestros pacientes. Si a estos datos le sumamos el hecho que con los lentes Premium, se requieren resultados óptimos para que los pacientes se sientan contentos (20/happy), nos falta aún mucho camino por recorrer. Es posible que el Benchmark standard del Reino Unido del 2007 (VKNH 85% de casos +1 D y 55% casos +0.5D), que en algún momento se consideró como ridículamente sencillo de alcanzar, muchos de nosotros no lo hallamos sobrepasado.
Nos encanta hacernos ilusiones, pensando en soluciones fáciles, como cuando aparecieron los primeros aberrómetros con determinación de aberraciones de alto orden y pensábamos que con esta tecnología teníamos conquistado el resultado ideal, pero todavía no éramos capaces de corregir en cirugía de catarata, el astigmatismo o esferas en forma adecuada y constante (aberraciones de bajo orden). O actualmente dejándonos influenciar por las compañías con la idea de mejorar los resultados refractivos con cirugías con femtosecond, cuando se calcula que lo que mejorará la esfera (mejorando la predicción en la posición efectiva del LIO) será aproximadamente en + 0.18 D. (Sin descartar que el femto es la tecnología que marcará la pauta en la cirugía del cristalino y aceptando que es un cambio para bien en cuanto a facilitar ciertos pasos de la cirugía, volviéndolos más universales y más seguros para la comunidad oftalmológica).
Si queremos no tener que dar mucha “palmoterapia” o esperar la “neuroresignación”, seamos realistas y centrémonos en lo importante, que aunque para muchos es una ciencia oculta (la óptica), el entender ciertas bases de óptica, nos permitirán evitar muchos de estos errores. (para más detalle ver artículo Buscando resultados ópticos óptimos en la cirugía de cristalino. Noticiero ALACCSA-R Febrero 2011).
¿Sabían ustedes que según las últimas encuestas de Eyeworld de marzo del 2012, el 48% de los oftalmólogos utilizan SRK/T como fórmula principal para el cálculo de los LIOs, y fórmulas de cuarta o quinta generación solo en un 29% de los casos? Y de los cirujanos que respondieron, solo un 44% lleva un control estadístico de sus resultados.
¿Por qué esto es importante? Porque si usted está utilizando una fórmula de III generación como SRK/T, en la cual introduce solo dos variables, longitud axil y keratometría, todo aquél ojo que se salga de la norma (una cámara anterior y cristalino que se asocien a la longitud axil, y una asfericidad corneal normal, Q -0.27 con una relación entre la cara anterior y posterior de la córnea normal de +- 82.2%), tendrá una alta posibilidad de resultados inesperados. Señores, abramos los ojos, esto (ojos con características “normales”) sucede en menos de un 70% de los casos. Además se debe tomar en cuenta la relación entre curvatura corneal y profundidad de cámara anterior. SRK/T, supone que una córnea curva tiene una cámara profunda y una córnea plana una cámara estrecha. En los ojos donde esto no se presenta deberá utilizarse una variación de la fórmula con Doble K o utilizar una fórmula de última generación.
Entonces cómo obtener mejores resultados:
- 1. Biometría óptica, que incluya cámara anterior y espesor del cristalino
- 2. En todo paciente que va a ser operado de catarata o facorrefractiva debe realizarse un estudio tomográfico de la córnea (Pentacam, Galilei), para obtener datos como asfericidad y relación antero-posterior para poder determinar el poder real de la córnea y no suponer una keratometría con un poder errado. Además permitirá descartar cono o ectasias corneales y aberraciones de alto orden que puedan dar un resultado visual malo o inesperado.
- 3. Si el ojo es un ojo normal de longitud media, con una cámara anterior media y un cristalino de espesor normal, con una asfericidad normal y una relación PA cercana a la normal de 82.2%, puede utilizar cualquier fórmula. (SRK/T en ojos medios y medios grandes, en ojos pequeños, HofferQ, Haigis, Holladay 2).
- 4. Si el ojo es un ojo pequeño, pero con una cámara amplia, o un espesor de cristalino grande, con una fórmula de tercera generación tenderá a un resultado hipermetrópico, por lo que en estos ojos utilice una fórmula que tome en cuenta estos factores, como Holladay II u Olsen.
- 5. Si la asfericidad cornal tiende a ser más positiva Q > -0.10 o positiva, o la relación PA < 80%, el resultado va a tender a ser el de una hipermetropía residual. (utilice fórmulas Doble K).
- 6. Si los radios LA/r (longitud en mm sobre radio corneal en mm) están por fuera de los 3,2 + 0,2 mm para los miopes y de 2,8 + 0,1 mm para los hipermétropes, requerirán cálculos con fórmulas de cuarta o quinta generación como Haigis, Holladay II u Olsen, de lo contrario se presentarán sorpresas refractivas significativas.
- 7. Recomendación para el uso de fórmulas con doble K, que nos hace Aramberri en aquellos casos donde no podemos estimar la K preoperatoria, es la de sumar el valor de la profundidad de la cámara anterior (ACD) con el espesor del cristalino (LT) para elegir cuál será la Keratometría preoperatoria a colocar en la fórmula: Si la suma < 7,5mm, K pre = 42,0;
Si entre 7,5 y 8,10mm, K pre = 43,5 y
Si > 8,10mm, K pre = 45,0D - 8. Tener un componente perfecto NO asegura un buen resultado. Tener 1 componente malo ASEGURA un mal resultado.
- 9. En ojos grandes, miopes altos. Corrección de Long Axil JCRS 2011, vol. 37, p. 2020-24. Laxilcorreg = (0.8981 X laxil) + 2.5637
- 10. Con mucha más razón en aquellos ojos post cirugía refractiva corneal utilizar en forma adecuada las fórmulas y los web-sites, como usar el ASCRS Calculator, y dándole prioridad a las fórmulas
– Haigis L
– Modified Masked
– Besst
– Wang-Koch-Maloney
Conclusiones
Si queremos mejorar nuestros resultados, necesitamos crear un sistema tipo ISO 9000-20/20, en el cual tomemos en consideración los diferentes factores que nos pueden llevar a un resultado refractivo no óptimo, mejorando la precisión en la toma de las medidas preoperatorias (más datos con equipos más sofisticados, no sólo biometría óptica, sino en características propias de los ojos a operar como tomografía, Pentacam, Galilei), detectar ojos de mayor riesgo a sorpresas refractivas para poder informar a los pacientes en cuanto a posibilidades reales. Debemos tener la capacidad de utilizar diferentes fórmulas de acuerdo a las características del ojo.
El futuro: Un solo equipo que en un solo paso, mida la biometría completa, que además tendrá posibilidad de tomografía corneal, que mejore el cálculo de la posición efectiva del LIO, que incluya poder real del poder corneal, tomando en cuenta la asfericidad corneal y la relación P/A, que sirva no solo para córneas vírgenes, sino para aquellas operadas de cirugía refractiva o post-queratoplastia y que incluyan un sistema de cálculo de LIO posiblemente por ray tracing.
Mientras tanto, dos opciones, tener un 20 % de pacientes con algún grado de molestia, y el subsecuente dolor de cabeza para el oftalmólogo en el manejo postoperatorio, o gastar un poco más de tiempo y cabeza en el cálculo del lente intraocular de nuestros pacientes y dormir un poco más tranquilos. Usted decide.
Manejo actual de la Presbicia
Coordinador: Dr. Miguel Srur – Chile
Panelistas: Dr. Cesar Carriazo – Colombia, Dra. Maria José Cosentino – Argentina
Dr. Srur: 1. ¿TRATA USTED PACIENTES PRéSBITAS EMéTROPES? SI SU RESPUESTA ES NEGATIVA POR FAVOR EXPLIQUE SUS RAZONES.
Dr. Carriazo:
Sí, pero con poca frecuencia. Sólo en casos donde el paciente consulta motivado y tiene claro que sacrificará calidad de visión lejana por obtener la multifocalidad o la monovisión.
Dra. Cosentino:
Habitualmente trato pacientes présbitas emétropes. Considero emétropes a aquellos pacientes que presentan un equivalente esférico en su refracción de ±0.50 dioptrías. Es una población muy interesante y agradecida para corregir pues se trata de personas que han visto muy bien toda su vida y ahora se encuentran con imposibilidad de enfocar sin anteojos para la lectura y escritura cercanas. Esto les genera una gran frustración y están muy motivadas para alguna alternativa de corrección que les permita recuperar independencia en sus actividades cotidianas. Este tipo de cirugías están muy relacionadas con recuperar y mejorar la calidad de vida de los pacientes.
Dr. Srur: 2. ¿CUáL ES SU TéCNICA DE ELECCIóN HOY?
Dr. Carriazo:
Monovisión con láser en menores de 46 años con defectos bajos. Facorrefractiva con lente multifocal en pacientes hipermétropes y en mayores de 46 años.
Dra. Cosentino:
Si los pacientes tienen el cristalino transparente, realizo tallado corneal con excimer láser. Utilizo el programa SupraCOR™ (Technolas, Bausch & Lomb) Al contrario de lo que ocurre con la monovisión, el SupraCOR™ presenta la ventaja de que el ojo tratado gana visión cercana no corregida sin presentar disminución consistente de la visión no corregida de lejos. En pacientes emétropes suelo realizarlo solamente en el ojo no dominante, lo cual es suficiente para lograr un nivel elevado de independencia a los anteojos, a la vez que, al no operarse el ojo dominante, el paciente emétrope no pone en riesgo su visión lejana sin corrección.
Si presentan algún tipo de esclerosis del cristalino, con reducción de la agudeza visual lejana sin corrección o en el test de visión de contraste, no dudo en colocar un LIO multifocal. También tenemos pacientes emétropes pseudofáquicos, que desean multifocalidad para sus quehaceres, en los cuales he realizado corrección corneal con SupraCOR™ y el resultado ha sido muy satisfactorio.
Dr. Srur: 3. ¿CUáLES CREE QUE SON LOS PACIENTES IDEALES PARA UNA CIRUGíA DE PRESBICIA Y EN QUIENES LA CONTRAINDICA?
Dr. Carriazo:
Los ideales son los hipermétropes présbitas. Contraindico en personalidades perfeccionistas, ojos ambliopes, o con las alteraciones patológicas descritas en la literatura (diabetes, lesiones de retina, retinopatías etc.).
Dra. Cosentino:
Los pacientes ideales para la cirugía de presbicia son aquellos que están muy motivados a reducir su dependencia a los anteojos de cerca, que se encuentran en etapa laboral activa y que no desarrollan actividades deportivas nocturnas o cuyos hobbies no demandan una visión cercana exquisita y detallista. Es mejor si manejan poco de noche, y si realizan una marcada actividad de lecto-escritura.
En mi experiencia, con la tecnología disponible al momento, no es recomendable la cirugía de presbicia con excimer en pacientes con astigmatismo mayor a 1.25 dioptrías, ni en pacientes miopes. En el caso de las lentes multifocales, las restricciones son muchas, pero las más importantes a resaltar son los pacientes con excesivas expectativas, con trastornos de ansiedad o depresión, con necesidad de conducción nocturna, y con sequedad ocular moderada o severa, asimetrías corneales, trastornos retinales y ambliopía.
Dr. Srur: 4. ¿CUáL ES SU IMPRESIóN O EXPERIENCIA CON LIOS ACOMODATIVOS?
Dr. Carriazo:
Que funcionan aceptablemente por un tiempo y luego disminuyen sustancialmente su funcionamiento. Algunos de ellos son pseudoacomodativos ya que tienen talla progresiva.
Dra. Cosentino:
No tengo experiencia personal directa con este tipo de lentes.
Dr. Srur: 5. ¿CUáL CREE USTED QUE ES EL FUTURO DE LA CIRUGíA REFRACTIVA EN PRéSBITAS?
Dr. Carriazo:
En el futuro esperamos contar con lentes acomodativos reales que puedan mantener su funcionamiento ya sea que podamos controlar la contracción capsular o que continúen funcionando a pesar de esta.
Dra. Cosentino:
Las plataformas de tallado con excimer láser representan una alternativa poco invasiva y directa para los présbitas más jóvenes. Asimismo cuando el paciente es pseudofáquico con un LIO monofocal y uno desea otorgarle una visión multifocal. Creo que estas plataformas, perfectibles aun, son y serán una buena alternativa para estos casos.
Cuando el paciente es mayor de 57-60 años la alternativa del LIO multifocal es muy buena. La tecnología de los LIOs multifocales actuales da resultados satisfactorios y seguirá perfeccionándose en los próximos años.
Datos de Contacto de los Doctores
Dr. Miguel Srur, e-mail: msrura@gmail.com
Dra. Maria Jose Cosentino, e-mail: majocosentino@fibertel.com.ar
Dr. Cesar Carriazo, e-mail: ccarriazo@carriazo.com
Noticiero ALACCSA-R pregunta (colaboración de la Dra. Maria José Cosentino, e-mail: majocosentino@fibertel.com.ar):
Paciente varón, de 48 años, operado de LASIK en 2009 en AO. En OD el resultado es óptimo: AVSC 20/25. En OI presenta AVSC 20/200 mejora con +1 a 20/80. Con adición de +2 D la AV cercana es normal. Presenta cristalino transparente. Se adjunta topografía corneal y aberrometria de OI. El fondo de ojo es normal. Cuál es la conducta terapéutica que sugiere para el OI?


Dr. Pedro Paulo Fabri – Brasil
E-mail: fabri@certto.com.br
Caso de hipercorrección y descentración de la ablación. Dos exámenes son necesarios:
1- medición de la agudeza visual para lejos con agujero estenopeico para confirmar ausencia de patologías y para disminuir la interferencia de las aberraciones que están comprometiendo la visión. Probablemente mostrará una buena mejora de la agudeza visual y,
2- medición de la agudeza visual para lejos con adaptación de lente de contacto rígida, que en caso consiga buena agudeza visual, confirmará que la dificultad visual está relacionada con la superficie de la córnea (descentración de la ablación).
La agudeza visual para lejos con +1 está limitada a 20/80 probablemente debido al aumento del diámetro pupilar cuando fija para lejos (que aumenta las aberraciones de alto y bajo orden). La miosis determinada por el estimulo de convergencia para lectura, y la adicción de +2 D explican la buena agudeza visual para cerca.
Como no hay referencias sobre el examen de biomicroscopía con lámpara de hendidura, asumimos que no hay problemas con la interface, disco y epitelio.
La solución está en realizar fotoablación personalizada para corrección de la ametropía residual, pero más importante aún para la corrección de la descentración.
La fotoablación personalizada puede ser guiada por la aberración total o por la topografía corneal y realizada tanto en el estroma con levantamiento del disco como en la superficie (PRK con aplicación de mitomicina) dependiendo de la preferencia del cirujano y también para economizar tejido corneal.
Dr. Waldir Portellinha – Brasil
E-mail: portellinha@uol.com.br
Es un caso difícil de discutir. Lo ideal sería tener la refracción preoperatoria, tipo de microqueratomo, diámetro y grosor del anillo usado y excimer láser. Como la mejor agudeza visual con corrección es sólo 20/80, debe hacer la agudeza visual con agujero estenopeico (Pinhole) y evaluación de la retina con OCT de mácula.
Eliminada cualquier lesión en la retina y si la agudeza visual con estenopeico mejora, podemos evaluar la posibilidad de nueva cirugía.
El espesor más delgado por el Orbscan es de 425 micras. Como después de la cirugía refractiva el Orbscan proporciona una córnea mucho más delgada, lo ideal es repetir la paquimetría con paquímetro ultrasónico o Pentacam. En caso de que el espesor confirme 425 micras, lo ideal es no realizar otra cirugía con láser. Si el espesor es mayor que 450 micras, podemos programar una cirugía de PRK personalizada para corregir tanto la aberración trefoil como el error refractivo. Como es PRK post lasik, lo ideal es realizar TRANSPRK con el uso de mitomicina durante al menos 1 minuto.
DESENLACE DEL CASO
El paciente fue re-operado levantando el flap previo, a pesar de no tener los antecedentes de las características intraoperatorias del primer cirujano, la biomicroscopia reflejaba que había sido una cirugía sin complicaciones mecánicas. Debajo del flap se tallaron las aberraciones de bajo y alto orden, de acuerdo a los resultados que se observan en el mapa topográfico y aberrométrico. Es decir, se realizó un tratamiento personalizado.
Luego de seis meses, la agudeza visual sin corrección y con la mejor corrección postoperatoria fue de 20/50!
Ciclo de servicios en las clínicas oftalmológicas – Marketing en salud
Alice Selles – Brasil
Directora de Comunicación de la SBAO, Maestra en Administración y Desarrollo Empresarial, especialista en Marketing y socia de la Selles & Henning Comunicação Integrada.
E-mail: aselles@terra.com.br
Los avances en la tecnología, el aumento de la competencia / competición y los cambios del perfil de los pacientes hacen que las clínicas necesiten mantenerse más atentas en relación al mercado. El reconocimiento de esta necesidad tiene como resultado la valorización del marketing de relación, la vertiente del marketing enfocada en la creación y manutención de relaciones más sólidas con el público de la clínica (sean ellos clientes o no). Adoptar el marketing de relación significa valorizar los aspectos de atención que se expresan en la forma de confianza y credibilidad y que se traducen en la percepción de la calidad de los servicios.
Si la cuestión principal es la percepción de valor, entonces, es necesario invertir en la construcción de la imagen de la clínica, una imagen que sea capaz de transmitir confianza y que establezca las expectativas que se desea para los servicios. También hay que tener en cuenta que la construcción de esta imagen no es un trabajo aislado, que puede estar basada exclusivamente en la atención médica. Es esencial asegurarse de que todos los contactos del cliente con la clínica sean de excelencia. Para que la excelencia deseada sea lograda, se debe mapear el ciclo de servicio, también llamado de “momentos de la verdad”, presentes en todas las etapas del contacto entre el paciente y la clínica, sean estos contactos presenciales o no.
Berk (1997) afirma que la calidad es un concepto abstracto, pues la mayoría de las personas no son capaces de definirla, pero apunta su presencia o ausencia. Si esto es cierto para los productos, es aún más con respecto a los servicios, ya que ellos son esencialmente intangibles. Al recibir un servicio, vivimos una experiencia. Por lo tanto, quien define lo que es calidad no es la clínica y sí el cliente a quien el servicio es prestado.
En la prestación de servicios, la calidad asume dos dimensiones: calidad técnica (lo que el cliente recibe) y calidad funcional (como el cliente recibe). La calidad técnica en los servicios médicos se relaciona principalmente con la consulta, el examen, lo que motivó la búsqueda. Ya la calidad funcional, se refiere a la atención, al ambiente, al nivel de la información proporcionada. De la unión de la calidad técnica con la calidad funcional se forma la calidad percibida, la etapa final de la construcción de la imagen.

Observe el gráfico: es el ciclo de servicios en una consulta oftalmológica completa. Note que los momentos en los cuales el paciente evalúa la calidad de los servicios de una clínica comienzan antes de su llegada al consultorio: al buscar informaciones (hoy, cada vez más, por medio de internet), él ya inicia su evaluación y continua haciéndola al llegar a la puerta de la clínica, al entrar (las evidencias físicas “hablan” acerca de lo que puede esperar del servicio) y al hacer su primer contacto con el equipo. En la sala de espera, observa buena parte del manejo de la clínica y tiene tiempo para observar los procesos y la atención prestada a los otros pacientes. Al llegar al consultorio, hará el juicio más importante y decisivo: evaluará el médico, no en cuanto a la calidad técnica (pues el paciente no tiene recursos para hacer este tipo de evaluación), pero sí en cuanto a la calidad funcional, la atención que recibirá, las explicaciones que serán ofrecidas sobre su salud y los cuidados a los cuales será sometido.
Note que la calificación profesional de los que trabajan directamente con los clientes es un punto muy relevante. Ella hace toda la diferencia. Pero se engaña quien cree que mapear el ciclo de servicios y establecer procesos es suficiente para asegurar la calidad. Los servicios tienen una esencia humana, por lo tanto, reflejan cuestiones humanas, de dimensiones mucho más grandes que la mecanización de las actividades. La calidad de la atención refleja cómo los colaboradores se sienten tratados por la clínica. Por eso, antes de “mirar hacia fuera”, es preciso mirar los procesos internos, la manera como los colaboradores ven la clínica y cómo son vistos. Después, corregir las discrepancias que se encuentran, para entonces sí, dar los pasos necesarios para proyectar externamente la imagen deseada.
¡Después de todo, la satisfacción del cliente no es una opción, es una cuestión de supervivencia!
Nuestra experiencia con la lente LISA Tri 839 MP
Dr. Juan Carlos Palomino Bautista, Dr. Pedro Tañá Ribero – España
E-mail: cpalomino@oftalmos.es // pedrotana@mediterraneaoftalmologica.es
Venimos de implantar en nuestras cirugías lentes monofocales, que tienen solamente un enfoque para conseguir una correcta visión de lejos, necesitando una gafa para visión cercana y a veces otra para visión intermedia o una gafa multifocal a la que algunos pacientes no se acostumbran.
Más tarde aparecen las lentes refractivas y difractivas bifocales con una capacidad de visión lejana y otro punto de enfoque para visión cercana.
Ahora podemos decir que tenemos la oportunidad de poder implantar la primera lente trifocal precargada, para obtener también una visión intermedia real.
La AT LISA tri 839 MP (Carl Zeiss Meditec) con la que conseguimos:
- Corregir la presbicia en pacientes con o sin cataratas.
- Basada en la conocida plataforma de alto rendimiento LISA.
- Con una alta resolución bajo todas las condiciones de luz.
- Máxima independencia del tamaño pupilar.
- Con posibilidad para usarla en procedimientos MICS.
- Precargada.
Es una lente hidrofílica acrílica al 25% con superficie hidrofóbica con una cara anterior trifocal. Una lente de una sola pieza con 360º de barrera anti PCO. Se puede implantar por 1.8 mm.
Sus adiciones son de + 3.33 dioptrías en distancia cercana y de +1.66 dioptrías de distancia intermedia. La zona trifocal tiene un tamaño óptico de 4.34 mm siendo el resto la zona bifocal.
NUESTRO ESTUDIO
Selección del paciente, fueron excluidos:
- Pacientes con glaucomas
- Alteraciones maculares o lesiones que pudieran desencadenar una maculopatía.
- Alteraciones no tratadas de la superficie ocular con las que no podamos conseguir una buena calidad visual.
- Enfermedades inflamatorias oculares que impidan conseguir una buena agudeza visual.
- Astigmatismos corneales por encima de 1.25
- Malas expectativas visuales en la consulta previa con el paciente (conductores nocturnos, cazadores, etc.)
- En resumen, cualquier alteración ocular que pudiera frenarnos en el hecho de conseguir una buena calidad visual.
Técnica
- El cálculo de la potencia se realizó con el Iol Master (Carl Zeiss Meditec)
- Topografía de elevación Pentacam (Oculus) ratificado con topógrafo de Plácido y queratometría.
- Fotografía para incisión posterior por eje más curvo (método F. Soler).
- Incisión principal por eje más curvo de 2.2 mm con cuchillete de diamante.
- Capsulorrexis entre 5 y 5.5 mm
- En todos los casos se implantaron anillos capsulares
Resultados
- 67 ojos operados
- Edad media 60.25 + 8.02 años (56/80)
- A.V.sc: 0.89 (0.7/1)
- A.V cc: 0.98 + 0.04 (0.75/1)
- Error refractivo E E : -0.29+0.20 diop. (0-0.875 diop)
- El 88.06% de los ojos están entre + 0.5 diop. El 97.01% se encuentran entre + 0.75 diop. Y el 100% están entre + 1 diop.
Conclusiones
- Esta lente aporta una buena calidad visual en distancia lejana, intermedia y cercana
- Se puede realizar el implante por microincisión entre 1.6 y 1.9 mm.
- Posee una buena barrera anti PCO
- Aporta una buena sensibilidad al contraste
- Las encuestas de satisfacción son altamente positivas.
- Creemos que es una magnífica plataforma y esperamos que nos darán la razón los estudios que estamos realizando en profundidad donde, avalados por datos científicos y con un tiempo de implantación suficiente, podremos apoyar las teorías basadas en las primeras impresiones de este trabajo.
Dr. Juan Carlos Palomino Bautista
Jefe de Servicio Hospital Universitario Quirón Madrid
Profesor de Oftalmología de la Universidad Europea de Madrid
Dr. Pedro Tañá Rivero
Director Grupo Oftalvist
- ASCRS/ASOA Symposium & Congress
April 19 – 23, San Francisco, CA – USA
Informaciones: www.ascrs.org - Jornadas Nacionales de Oftalmología
Mayo 16 – 18, Buenos Aires – Argentina
Informaciones: www.oftalmologos.org.ar/index.php/formacion-presencial/jornadas - 28 Congreso de la SECOIR
Mayo 22 – 25, Barcelona – España
Informaciones: www.oftalmo.com/secoir - VII Congreso Internacional de Oftalmología – XV Congreso Cubano de Oftalmología
Mayo 29 – 31, La Habana – Cuba
Informaciones: Dr. Marcelino Río Torres – E-mail: oftalmologia2013@horpf.sld.cu – Tel.: (537) 265-4800 - VII Congresso Brasileiro de Catarata e Cir. Refrativa
Mayo 29 – Junio 01, Praia do Forte, Bahía – Brasil
Informaciones: www.catarata-refrativa.com.br - XXVIII Congresso Pan-Americano de Oftalmologia;
XXXVII Congresso Brasileiro de Oftalmologia
Agosto 07 – 10, Rio de Janeiro – Brasil
Informaciones: www.cbo.com.br | www.paao.org - XXXI Congress of the ESCRS
Octubre 05 – 09, Netherlands – Amsterdam
Informaciones: www.escrs.org - AAO Annual Meeting
Noviembre 16 – 19, New Orleans, LA – USA
Informaciones: www.aao.org - Joint Meeting Bascom Palmer Eye Institute
& Fundación Oftalmológica los Andes
Diciembre 05 – 07, Santiago de Chile
Informaciones: www.oftalandes.cl



ALACCSA-R / LASCRS in ASCRS – San Francisco, April 19 – 23, 2013
Aviso: informaciones retiradas del sitio de ASCRS http://13am.ascrs.org/program, podrá tener modificaciones.
¡Marque en su agenda!
SATURDAY, APRIL 20, 2013
20-306. ASCRS Course 20-306: Lens Surgery After Refractive Surgery (Presented in Spanish)
1:00 PM – 2:30 PM; Room 306 (Moscone)
Virgilio Centurión; Eduardo Chávez Mondragón; Harold Freydell; Cecilio F. Velasco; Luis Escaf; Claudia Palacio; Marcelo V. Netto
S-5. ASCRS Symposium S-5: Management of Complicated Cases in Cataract and Refractive Surgery (Presented in Spanish)
3:00 PM – 5:00 PM; Room 134 (Moscone)
William C. De La Peña; Miguel A. Padilha; José A. Cristóbal; José A. Claros Bernal ; Virgilio Centurión; Luis W. Lu; Carlos L. Nicoli; Claudia Palacio; Marcelo C. Ventura; Leticia Arroyo-Muñoz; Alfonso Arias-Puente; Eduardo Chavez Mondragon; Carlos Palomino; Luis Escaf; Néstor Gullo; Enrique Súarez; Cesar C. Carriazo; Miguel Srur; Roberto Zaldivar; María José Cosentino; José L. Güell; Sergio Kwitko; Raúl S. Súarez; Enrique Graue-Wiechers; Angela M. Gutierrez; Luis Izquierdo; Arturo L. Kantor; Tito Ramirez-Luquin; Félix Pérez; Marcelo Sterzovsky
5:00 PM; Room 134 (Moscone)
Recepción y Coctel de Bienvenida – ALACCSA-R
SUNDAY, APRIL 21, 2013
S-6. ASCRS Symposium S-6: Combined Symposia of Cataract and Refractive Societies – Presbyopia Correction: Where? When? How?
8:00 AM – 9:30 AM; Room 134 (Moscone)
Roger F. Steinert; Edward J. Holland; Graham D. Barrett; Peter J. Barry; William C. De La Peña
21-204. ASCRS Course 21-204: Newest Concepts on Diagnosis and Treatment of Corneal Ectasia
(Sponsored by ALACCSA-R; Presented in Spanish)
10:00 AM – 11:30 AM; Room 304 (Moscone)
Mauro Campos; Marcelo Sterzovsky; Rene Moreno; Angela M. Gutierrez; Renato Ambrósio; Tito Ramirez-Luquin
Program:
New diagnostic tools – Renato Ambrosio, MD
Crosslinking: when, how and why – Marcelo Sterzovsky, MD
Crosslinking: results – Mauro Campos, MD
Crosslinking: Complications – Tito Ramírez Luquin, MD
Lamelar Transplant, when, how and why – Felix Pérez, MD
Penetrating Graft, when, how and why – Angela María Gutierrez, MD
Intracorneal Rings, when how and why – René Moreno, MD
21-206. ASCRS Course 21-206: Actual Surgical and Refractive Management of Congenital Cataract
(Presented in Spanish)
10:00 AM – 11:30 AM; Room 306 (Moscone)
Leticia Arroyo-Muñoz; Marcelo C. Ventura; Liana O. Ventura; Claudia Palacio; Santiago Garcia Arroyo; Sergio Ruiz-Esmenjaud; Carlos Palomino; José A. Cristóbal; Adan Tapia
21-406. ASCRS Course 21-406: Learning From Our Mistakes 2013: International Video Symposium of Complication Management in Cataract and Anterior Segment Surgery (Presented in Spanish)
3:00 PM – 4:30 PM; Room 306 (Moscone)
Guadalupe Cervantes-Coste; Abhay R. Vasavada; Virgilio Centurión; Arturo S. Chayet; Everardo Barojas; Claudio Orlich; Renato Ambrósio; Erick Mendoza Schuster; Miguel Srur; Robert H. Osher; Fernando Aguilera-Zarate; Fernando L. Soler
MONDAY, APRIL 22, 2013
22-207. ASCRS Course 22-207: Astigmatism Correction in 2013 (Sponsored by ALACCSA-R; Presented in Spanish)
10:00 AM – 11:30 AM; Room 307 (Moscone)
Miguel Srur; Luis Izquierdo; Guadalupe Cervantes-Coste; María José Cosentino; Fernando L. Soler; Virgilio Centurión; Mauro Campos; Cesar C. Carriazo
The Astigmatic correction with:
Femptosecond Laser – Luis Izquierdo, MD
Lasik – PRK – María José Cosentino, MD
Toric Monofocals IOLs – Fernando Soler, MD
Multifocal Toric IOLs – Virgilio Centurion, MD
Phakic Toric IOLas – Miguel Srur, MD
Corneal Rings – Mauro Campos, MD
Bioptic – Cesar Carriazo, MD
22-306. ASCRS Course 22-306: Presbyopia: Options of Surgical Treatment (Sponsored by ALACCSA-R; Presented in Spanish)
1:00 PM – 2:30 PM; Room 306 (Moscone)
María José Cosentino; Tito Ramirez-Luquin; Angela M. Gutierrez; Jose M. Vargas; Enrique Suarez; Mauro Campos; Ivan L. Ossma
Program:
Femptosecond Laser – Angela Maria Gutierrez, MD
Presbymax – Tito Ramirez Luquin, MD
Monovision – María José Cosentino, MD
SupraCOR – Virgilio Centurion, MD
KAMRA – Jose Manuel Vargas, MD
Intracorneal Lens Flexivue-Presbia – Waldir Portelinha, MD
Accommodative IOL Crystalens – Mauro Campos, MD
Accommodative IOL Synchrony – Ivan Ossma, MD
Multifocal diffractive IOL – Enrique Suárez, MD
Final Remarks – María José Cosentino, MD – Tito Ramirez Luquin, MD
TUESDAY, APRIL 23, 2013 23-107. ASCRS Course 23-107: Laser-Assisted Cataract Surgery – Where Are We Today?
(Sponsored by ALACCSA-R; Presented in Spanish)
8:00 AM – 9:30 AM; Room 307 (Moscone)
Jose L. Rincon; Carlos Palomino; Claudio Orlich; Edgardo Carreño; Arnaldo Espaillat
23-206. ASCRS Course 23-206: Surgical Management of Challenging Cases (Presented in Spanish)
10:00 AM – 11:30 AM; Room 306 (Moscone)
Claudia Palacio; Oscar Guerrero-Berger; Virgilio Centurión; Luis Escaf; Leticia Arroyo-Muñoz; Ana Beatriz Medina Pérez; Arnaldo Espaillat; Santiago Garcia Arroyo; Evangelia Stangogiannis-Druya
S-21. ASCRS Symposium S-21: The Best of the ASCRS (Presented in Spanish)
1:00 PM – 2:30 PM; Room 132-133 (Moscone)
Carlos L. Nicoli; Virgilio Centurión; Jaime Macías Martínez; Rafael Castañeda; Arturo Maldonado-Junyent; Santiago Garcia Arroyo; Oscar Guerrero-Berger; Edgardo Carreño; Narlly Ruiz-Quintero; Sábastian Onnis; Crisanti Stagogiannis; Enrique O. Graue-Hernandez; Valeria Sánchez-Huerta; Bruna V. Ventura; Evangelia Stangogiannis-Druya; Fernando L. Soler; Oscar V. Asís
ALACCSA-R / LASCRS in Pan American & Brazilian Congress of Ophthalmology, Rio de Janeiro, August 07 – 10, 2013
ALACCSA-R Program
“The Best of Cataract and Refractive Surgery in 2013” ALACCSA-R (120 min)
OS
Moderadores: William De La Peña, Virgilio Centurión, Armando Crema
Panel de Discusión: Paulo Cesar Fontes, Nestor Gullo, José Luís Rincon, Marcos Rey, José Antonio Claros
Faco Tip – Chop – Cesar Carriazo
Cirugía de catarata asistida con Láser de Femtosegundo – Edgardo Carreño
Iris suture fixation, my experience – Newton Andrade Jr.
Cirurgia da catarata em nanoftalmia – Fernando Trindade
Facoemulsificación en córneas patológicas – Miguel Angelo Padilha
Lentes Rayner M-flex near y far: experiencia personal – Marcelo Ventura
Utilidad de la Vitrectomía Anterior por Pars Plana en cirugía de catarata – Arnaldo Espaillat
II – Refractive Surgery
Moderadores: María José Cosentino, Mauro Campos, Miguel Srur
Panel de Discusión: Sergio Kwitko, Luís Izquierdo, Carmen Barraquer
The role of epithelial thickness in refractive surgery – Marcelo Netto
Complicaciones limbicas del cross linking corneal – Ramon Naranjo
LASIK for Presbyopia in emmetropic patients – María José Cosentino.
Corneal Inlay for presbyopia: is it safe? – Marcony Santhiago
Lasik em casos especiais – Waldir Portelinha
Lamellar endothelium transplant and multifocal IOL – Walton Nosé
“Casos Dificiles en Cirugía de Catarata y Refractiva” (90 min)
Moderadores: Luís Escaf, Enrique Suarez, César Carriazo
Panel de Discusión: Ronaldo Cavalcanti, Werner Zacharias, Ana Luisa Hoffing Lima
Caso 1 Leticia Arroyo
Caso 2 Leonardo Akaishi
Caso 3 José Manuel Vargas
Caso 4 Eduardo Chávez M
Caso 5 Edna Almodin
Caso 6 Pablo Suarez
Caso 7 Crisanti Stangogiannis
Caso 8 Arnaldo Espaillat




































 Si bien hay varias sustancias a las que se le atribuyen propiedades neuroprotectoras, como la cúrcuma, el ginkgo biloba, la brimonidina, etc., aún no hay trabajos concluyentes sobre los beneficios a largo plazo.
Si bien hay varias sustancias a las que se le atribuyen propiedades neuroprotectoras, como la cúrcuma, el ginkgo biloba, la brimonidina, etc., aún no hay trabajos concluyentes sobre los beneficios a largo plazo.









 Al ser los resultados quirúrgicos de las diferen- tes técnicas (arcuatas, puntos de tracción so- bre el meridiano plano, ICRS, resecciones en cuña, queratoplastias lamelares tectónicas sectoriales, etc.) bastante poco predecibles y estables en el tiempo, preferimos ser conser- vadores en un principio y tratar el defecto re- fractivo mediante diferentes tipos de lentes de contacto (rígidas, gas permeables, piggyback, híbridas, apoyo escleral), así como mejorar la superficie ocular con los tratamientos anterior- mente descritos.
Al ser los resultados quirúrgicos de las diferen- tes técnicas (arcuatas, puntos de tracción so- bre el meridiano plano, ICRS, resecciones en cuña, queratoplastias lamelares tectónicas sectoriales, etc.) bastante poco predecibles y estables en el tiempo, preferimos ser conser- vadores en un principio y tratar el defecto re- fractivo mediante diferentes tipos de lentes de contacto (rígidas, gas permeables, piggyback, híbridas, apoyo escleral), así como mejorar la superficie ocular con los tratamientos anterior- mente descritos.