Graduado de médico-cirujano en La Universidad de los Andes (1971-1977).
Internado Rotatorio Hospital Militar (1977-1979) Caracas.
Curso Básico Panamericano Oftalmología (1980) Puerto Rico.
Residencia Postgrado Oftalmología (1979-1982) Caracas.
Fellowship Córnea, External Diseases Refractive Surgery (1983-1985) LSU Eye Cen- ter. New Orleans.
Jefe del Servicio de Oftalmología Centro Médico Docente La Trinidad (1995-2005) Caracas.
Jefe del Departamento de Segmento Anterior y Cirugía Refractiva CMDLT (1995-2014) Caracas.
Senior Academic Consultant KKESH, (2014-2017) Riyadh, Saudi Arabia. Director Médico Grupo Médico Alterna, República Dominicana (2017-actual). 50+ artículos y capítulos publicados.
40.000+ Cirugías QueratoRefractivas.
30.000+ Cirugías Catarata y Facorefractivas.
Dr. Arnaldo Espaillat: En tu amplia experiencia en cirugía de catarata y facorefractiva, ¿Cómo abordas las expectativas de los pacientes al momento de plantearle un lente intraocular corrector de presbicia?
Dr. Enrique Suárez: Debo aclarar que lo que expresaré en esta entrevista son mis criterios personales en cuanto a selección de pacientes para este tipo de lentes de alta tecnología, basado en más de 16 años de experiencia y continuo aprendizaje con más de 5.000 lentes multi o trifocales implantados.
Antes de plantearle al paciente un LIO corrector de presbicia (LIO-M), sigo mi regla de “La triada” (a. Personalidad, b. Antecedentes médicos generales y c. Patologías oculares) para saber si califica para un lente multifocal o no. Ahora más que nunca, el “Chair Time” tiene una relevancia fundamental en la decisión del tipo de LIO a ofrecer. a.) Inicio conversando con él/ella para tratar de descifrar su personalidad, conocer sus expectativas visuales, exigencias laborales o en actividades cotidianas, aceptación de alguna corrección suplementaria después de la operación. b.) Paralelamente investigo sobre el historial médico buscando patologías sistémicas (Diabetes Mellitus, Enfermedad tiroidea: graves), Colagenopatías (Artritis Reumatoidea, Lupus, etc.), Infecciosas (Toxoplasmosis), Síndrome de Inmuno Deficiencias, entre otras. c.) Sigo con una exhaustiva evaluación oftalmológica que consta del examen en el área del consultorio, complementado por evaluación con especialista en retina y exámenes del área técnica (Topografía-Tomografía Corneal, Biomicroscopía especular, OCT de retina, Biometría, etc.).
Descarto a todos aquellos pacientes con alguna afección ocular como enfermedad de superficie-ojo seco, alteraciones como cicatrices, distrofias o degeneraciones corneales, ectasias, cirugías refractivas o de otro tipo previas, Pterigion moderado o avanzado, glaucoma o hipertensión ocular, retinopatías de cualquier tipo, etc. Incluyo únicamente a pacientes sin antecedentes sistémicos ni oculares como potenciales candidatos a estos implantes. Si algo contraindica un LIO-M, únicamente ofrezco aquellos lentes que juzgo puedan brindarle una visión satisfactoria y le explico por qué no es conveniente un multifocal.
De calificar, presento entonces todas las alternativas de implantes disponibles en el mercado con los pros y contras de cada uno de ellos, enfatizo en los efectos colaterales y molestias referidas por pacientes anteriormente operados, explico visión binocular de lejos o cerca (según la profesión u oficio del paciente), monovisión, multifocalidad o de profundidad de foco extendido. Dejo que el paciente decida el tipo de LIO, sin influir en su decisión. Que escoja el LIO en pleno entendimiento de las advertencias hechas sobre efectos colaterales y complicaciones.
Dr.ArnaldoEspaillat: Hoyendía tenemos disponibles los lentes intraoculares multifocales (que en realidad son bifocales), los de foco extendido y los trifocales. ¿Personalizas la indicación del lente a las características del paciente o prefieres alguno en específico? En caso de que personalices, ¿cuáles son tus criterios para cada tipo de lente intraocular? En caso de que siempre prefieras un solo tipo, ¿Cuál es la razón de ello?
Dr. Enrique Suárez: Obviamente el LIO Monofocal adolece de los efectos colaterales (Disfotopsias positivas o negativas), así como sacrificio de la sensibilidad de contraste que tienen en mayor o menor grado los LIO-M, trifocales o multifocales de profundidad de foco extendido.
Pacientes candidatos ideales para LIO Pseudoacomodativos (multi, trifocales o EDOF):
• Hipermétropes présbitas con catarata.
• Sin patología ocular o sistémica que comprometa el resultado visual.
• Pacientes jóvenes con catarata.
• Candidatos a implante bilateral del mismo lente.
• Muy motivado a reducir el uso de lentes, pero dispuesto a usar corrección ocasional.
• Que acepte los efectos colaterales explicados en la consulta preoperatoria.
Pacientes no elegibles para LIO-M:
• Pacientes con personalidad tipo A, sobre exigentes.
• Miopes bajos o moderados con cristalino claro buscando cirugía facorefractiva.
• Pacientes usuarios satisfechos de monovisión con lentes de contacto.
• Con patología sistémica que comprometa el funcionamiento ocular.
• Con enfermedad o cirugías oculares (ya mencionadas).
• Que no acepten los efectos colaterales detalladamente expuestos en el “Chair Time”.
Hoy día contamos con LIO monofocales de foco extendido que minimizan los efectos colaterales de los equivalentes multifocales y ofrecen una visión lejana e intermedia bastante satisfactoria. Esta alternativa es viable para muchos de aquellos pacientes que no califican para un LIO-M, que acepten la necesidad de una corrección para lectura de letras pequeñas, es decir, dispuestos a reducir la necesidad del uso de anteojos, aunque no eliminarlos del todo.
Dr. Arnaldo Espaillat: Hasta hace muy poco tiempo estuviste ejerciendo en el Hospital King Khaled Eye Specialists, Hospital de Arabia Saudita, por 3 años. ¿Qué tipo de patología ocular del segmento anterior tuviste que enfrentar con más frecuencia que fuera propia de dicha área geográfica y que no veías en tu práctica en Venezuela o ahora en la República Dominicana?
Dr. Enrique Suárez: La experiencia profesional, cultural y personal en esos años fue extraordinariamente gratificante. De los aprendizajes más completos que haya vivido.
KKESH es un hospital oftalmológico de referencia terciaria donde únicamente se reciben casos complicados o de alta complejidad que no puedan ser resueltos en los Centros Primarios o Secundarios. Se llegaban a atender hasta 1.000 pacientes y operar 100 casos diariamente.
Tracoma. Climate Droplet Keratopathy (abrasiones corneales importantes por el trauma del desierto, tormentas de arena, temperaturas de hasta 50 grados). Ectasias avanzadas. Leucomas por infecciones (bacterianas, virales o micóticas), heridas de guerra. Patología genética frecuente (explicadas por el cruce entre las familias árabes), etc., son entidades casi exclusivas del Oriente Medio las cuales nosotros, especialmente en prácticas privadas, nunca llegamos a atender.
Dr.ArnaldoEspaillat: Hassidounprofesional muy exitoso tanto en el mundo académico como en el de la práctica privada de la oftalmología, ¿Cuál sería un consejo que le pudieras dar a los oftalmólogos jóvenes que ejercen en estas condiciones tan especiales de pandemia del Coronavirus que enfrenta el mundo?
Dr. Enrique Suárez: Los esquemas de vida y práctica profesional cambiaron para siempre. Por ahora no sabremos si habrá inmunización efectiva y permanente al COVID-19, por lo que es mandatorio suponer a toda persona como un vector.
La presencia de máscaras, el distanciamiento físico y barreras protectoras nos resta un elemento fundamental en la comunicación y ganancia de la confianza del paciente.
Debemos recurrir a nuestros principios más humanos para trasmitir esa confianza.







 Dr. Arnaldo Espaillat – Rep. Dominicana arnaldo@espaillatcabral.com
Dr. Arnaldo Espaillat – Rep. Dominicana arnaldo@espaillatcabral.com



 Dr. Arturo Ramírez Miranda – México
Dr. Arturo Ramírez Miranda – México Dra. Norma Morales Flores –México
Dra. Norma Morales Flores –México Dr. Julio Hernández Camarena – México
Dr. Julio Hernández Camarena – México
 Dr. Antonio Méndez Noble – México
Dr. Antonio Méndez Noble – México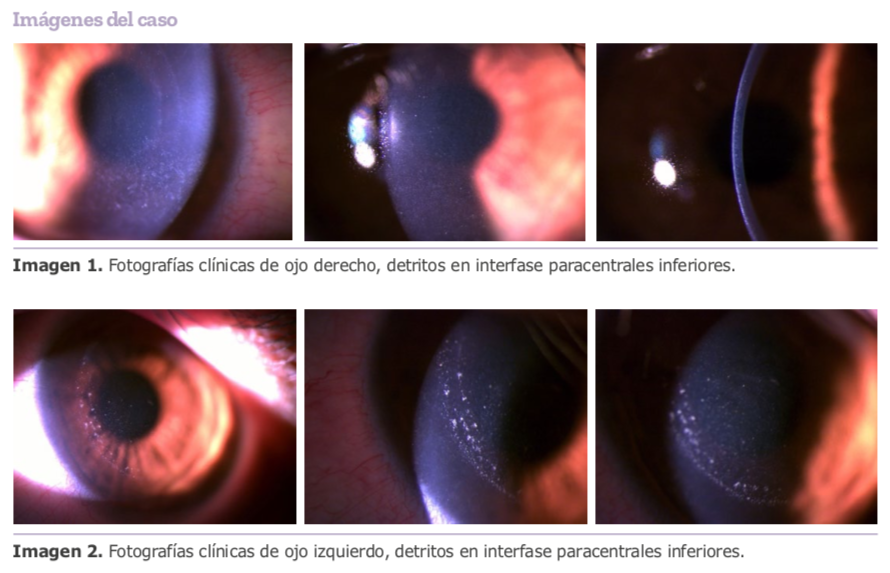
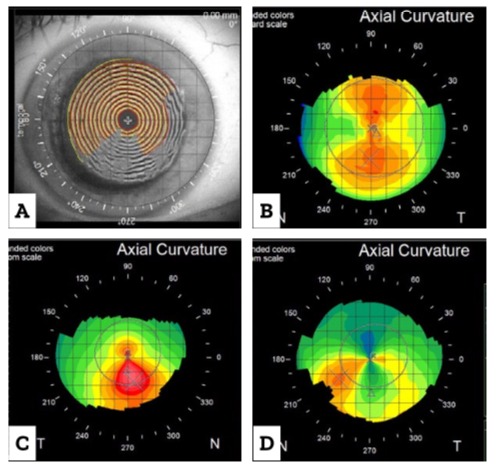
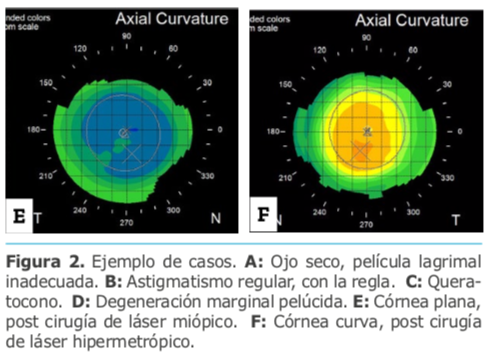
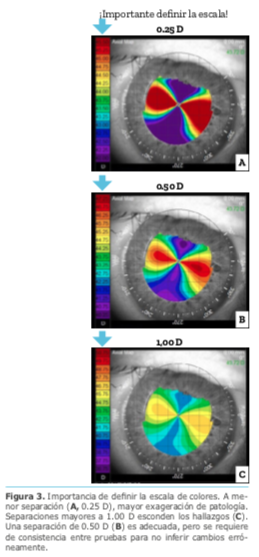
 En candidatos para LASIK o PRK que han pasado las pruebas fenotípicas hay estudios retrospectivos que sugieren límites para establecer riesgos de ectasia. Un ejemplo de ellos es el PTA (Percentage of Tissue Altered) de Santhiago y cols., donde establecen que sobrepasar aquel índice aumenta el riesgo de ectasia. (Más de 100:1, observación de casuística personal).
En candidatos para LASIK o PRK que han pasado las pruebas fenotípicas hay estudios retrospectivos que sugieren límites para establecer riesgos de ectasia. Un ejemplo de ellos es el PTA (Percentage of Tissue Altered) de Santhiago y cols., donde establecen que sobrepasar aquel índice aumenta el riesgo de ectasia. (Más de 100:1, observación de casuística personal).
 Dr. Juan J. Mura – Chile
Dr. Juan J. Mura – Chile Dr. Alex León – Chile
Dr. Alex León – Chile Dr. Víctor L Pérez – EE.UU.
Dr. Víctor L Pérez – EE.UU. Dr. Matías Soifer – EE. UU.
Dr. Matías Soifer – EE. UU.