Siempre agradecidas por la oportunidad de trabajar juntas y de ser parte del Noticiero ALACCSA-R. En esta edición de “Lo mejor”, les presentaremos aquellos papers publicados durante el último cuatrimestre del 2022 que nos parecieron más interesantes para conversar y traer cosas nuevas a la mesa para nuestra profesión.
¿Qué hay de nuevo en cirugía de catarata?
Comenzamos con un artículo que demuestra que la posibilidad de operar cataratas con nueva tecnología refractiva, es posible y abre las puertas para que sigamos en la búsqueda de ese lente acomodativo que todos estamos esperando. Les hablo del artículo publicado en Journal of Cataract and Refractive Surgery en octubre del 2022, por el grupo de Chayet et al1, con un seguimiento por 12 meses a pacientes a quienes se les realizó cirugía para el tratamiento de presbicia y afaquia con lente Juvene (JIOL). Los resultados iniciales son prometedores, se evaluaron 51 ojos de los cuales 16 fueron cirugías bilaterales, encontrando en este grupo mejores resultados. Las agudezas visuales (log MAR) lejanas, intermedias y cercanas corregidas fueron 0,01, 0,08 y 0,24 respectivamente, con una curva de desenfoque entre +1,00 y -2,00 dioptrías. Se trata de un lente modular compuesto por dos piezas (Figura 1): un lente de base monocular (BL), que funciona como el soporte y las hápticas en donde se le inserta un “lente fluídico” (FL) que está compuesto por aceite de silicón y tiene la capacidad de cambiar la curvatura anterior según el estado de acomodación que ejerza la zónula sobre el saco capsular.
 Figura 1. Lente intraocular Juvene
Figura 1. Lente intraocular Juvene
Aunque aún se encuentra en investigación, asumen que, este es el mecanismo de acción del lente, y mencionan que los resultados después de 12 meses se mantienen, con mejoría de aspectos muy relevantes como: disfotopsias, sensibilidad al contraste y la ausencia de opacidad de la cápsula anterior y posterior lo cual disminuye la fibrosis del saco capsular y en consecuencia, prolonga la vida útil del efecto acomodativo de las zónulas. Es importante resaltar que se requiere una buena dilatación (mínimo 6 mm) y el implante del lente se debe hacer minuciosamente, siguiendo todas las recomendaciones para asegurar los resultados. En lo que respecta a la seguridad del lente, se presentó una complicación intraquirúrgica por la no inserción del lente fluídico en una de las 3 pestañas que hacen parte de la base o de las hápticas, 6 pacientes tuvieron inflamación postquirúrgica que requirió prolongación del esquema de corticoides, edema macular cistoide en 4 pacientes, “complicaciones asociadas a diabetes mellitus e hipertensión” en 8 pacientes. Mencionan que 2 pacientes fueron excluidos del estudio por: “severas complicaciones asociadas a la diabetes” y por una membrana epirretiniana no visualizada previa a cirugía por catarata densa.
Los lentes acomodativos con el concepto de “lentes de saco expandido o abierto” sin duda alguna serán muy importantes en nuestro futuro mediato como cirujanos refractivos, ya que representan una solución más acertada fisiológicamente en términos de anatomía y función del segmento anterior.
Otro artículo en tendencia fue el publicado por Al-Ani et al.2 en el American Journal of Ophthalmology en diciembre 2022, donde exponen los resultados encontrados en una cohorte amplia y retrospectiva de 471 ojos de 372 pacientes con diagnóstico previo de uveítis que fueron operados de catarata entre 2008 y 2020 reportando los hallazgos intraoperatorios y postoperatorios. La mayoría de los pacientes tenían diagnóstico de uveítis, anterior (62.3%) y de origen idiopático (25.1%), aunque se incluyeron otras etiologías como HLAB27 (13.6%), sarcoidosis (9.6%), entre otras. La mediana del tiempo desde el diagnóstico de uveítis hasta la cirugía fue de 3 años (1.4-6.6 años) y la mediana del tiempo de inactividad antes de someterse al procedimiento fue de 1 año (0.5-2 años). Hablando sobre la cirugía de catarata per se, se describe la necesidad de maniobras adicionales como liberación de sinequias posteriores (32.3%) y maniobras para mejorar la dilatación pupilar como ganchos de iris (24%); así mismo, la tasa de complicaciones intraoperatorias reportada de sólo de un 6.8%, reportándose como factor de riesgo por análisis univariado con la presencia de sinequias posteriores y cámara anterior estrecha (<2.5 mm) con p<0.5. Finalmente, reportan una incidencia de complicaciones postoperatorias presentada en la tabla 1, donde lo que más llama la atención es la reactivación de la uveítis (56.5%). Dicha reactivación se presentó dentro de los primeros 6 meses en el 23.8%, dentro del primer año en el 32.5% y dentro del los primeros 2 años en el 41.4% de los casos, sugiriendo y enfatizando la importancia de un seguimiento cercano y a largo plazo en estos pacientes incluso después del periodo de los primeros 6 meses postoperatorios. El tiempo de latencia o inactividad presentó un cociente de riesgo (hazard ratio) de 0.794 con una P=0.003, esto respalda la evidencia de esperar al menos 3 meses de inactividad antes de realizar cirugía de catarata en estos pacientes.
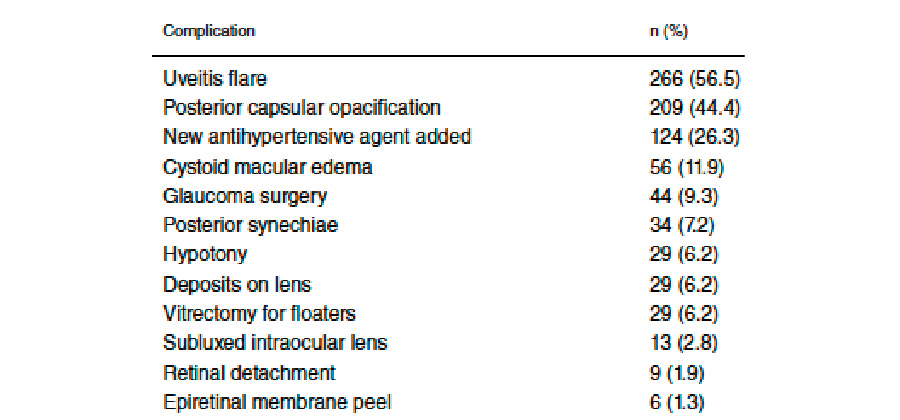 Tabla 1. Complicaciones postoperatorias presentadas en 471 pacientes con previo diagnóstico de uveítis que fueron operados de cirugía de catarata.
Tabla 1. Complicaciones postoperatorias presentadas en 471 pacientes con previo diagnóstico de uveítis que fueron operados de cirugía de catarata.
El término “dropless cataract surgery” o cirugía de catarata libre de gotas sigue siendo una idea muy llamativa para aquellos pacientes mayores, con dificultades físicas o con mal apego a tratamiento. Es por esto, que se siguen estudiando diferentes estrategias para evitar o disminuir la dependencia de gotas y así facilitar el postoperatorio en estos pacientes. El artículo recientemente publicado por el grupo de Lu et al.3 de la Universidad de Pennsylvania en JCRS, nos presenta los resultados de su estudio de casos retrospectivo comparando 262 ojos tratados con acetato de prednisolona 1 mg/1 ml vía tópica y 131 ojos tratados con un implante de dexametasona 0.4 mg insertado intracanalicular (Dextenza®) posterior a cirugía de catarata de rutina con un seguimiento postoperatorio durante 16 semanas. Según lo reportado, ambos grupos tuvieron un comportamiento similar en cuanto a dolor reportado, reacción inflamatoria en cámara anterior, presencia de complicaciones como endoftalmitis y presión intraocular sin diferencias estadísticamente significativas. Se reportó la presencia de rebote inflamatorio en el 6.9% de los pacientes con tratamiento tópico y 9.2% de los pacientes con el implante intracanalicular, con una P=0.5. Además, sólo se reportaron 3 casos de hipertensión ocular (2 y 1 pacientes, respectivamente). Este artículo nos invita a analizar la posibilidad de este implante como una opción segura y eficaz a analizar una vez disponible en nuestros países y analizando la relación costo/beneficio de nuestra propia población y sistema de salud.
Hablemos sobre ángulos…
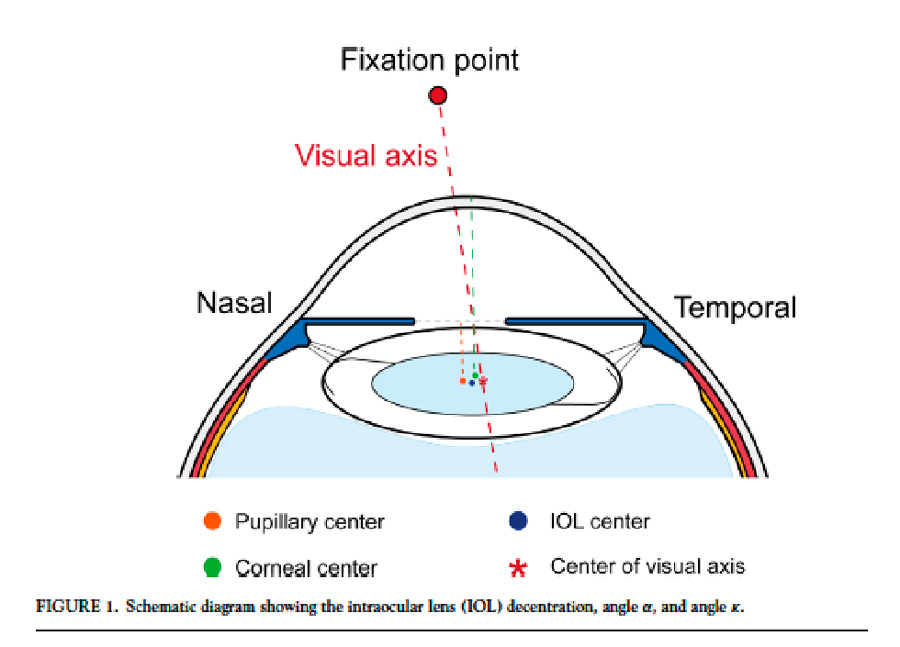
Existen opiniones encontradas respecto al peso que tiene el ángulo kappa y alpha en la toma de decisiones dentro del algoritmo de una cirugía refractiva corneal o intraocular y cada vez más contamos con tecnología que nos lleva a un mejor entendimiento de cada uno de los factores que son cruciales para un excelente resultado refractivo.
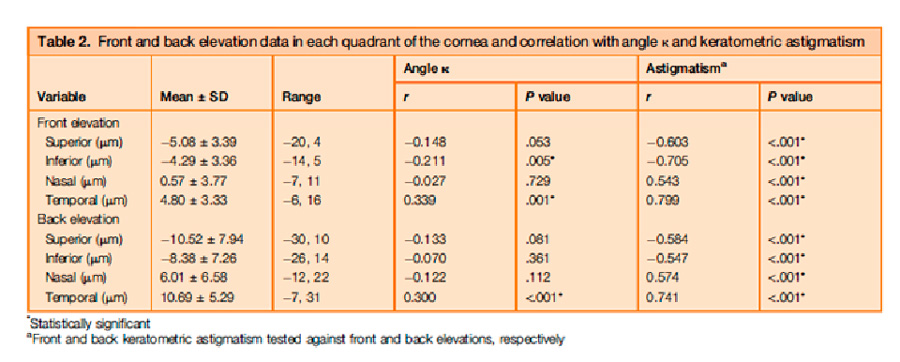
Salouti et al, publicaron en octubre/2022 en Journal of cataract and Refractive Surgery4 un estudio retrospectivo, observacional, donde analizan cuál es el efecto del ángulo kappa en las mediciones de los mapas de elevación anterior y posterior de dos topógrafos: Orbscan y Pentacam. Inicialmente nos recuerdan que tipo de tecnología usa cada uno y por lo tanto cómo obtienen los datos que arrojan: Orbscam es un topógrafo de hendidura con anillos de plácido, por lo cual mide el ángulo que se genera entre el eje pupilar y el centro de reflexión los anillos de plácido sobre la córnea y Pentacam lo hace a través de una cámara Scheimpflug, arrojando datos como: descentramiento del punto más delgado o vértice de la córnea y el eje pupilar, sin dar un dato específico sobre el ángulo kappa. Dicho esto, el objetivo del estudio era demostrar que un ángulo kappa elevado, podría causar un error en la interpretación de las lecturas de los mapas de elevación del Pentacam, que están basados en la esfera de mejor ajuste apical y así clasificar erróneamente una córnea normal como una córnea ectásica.
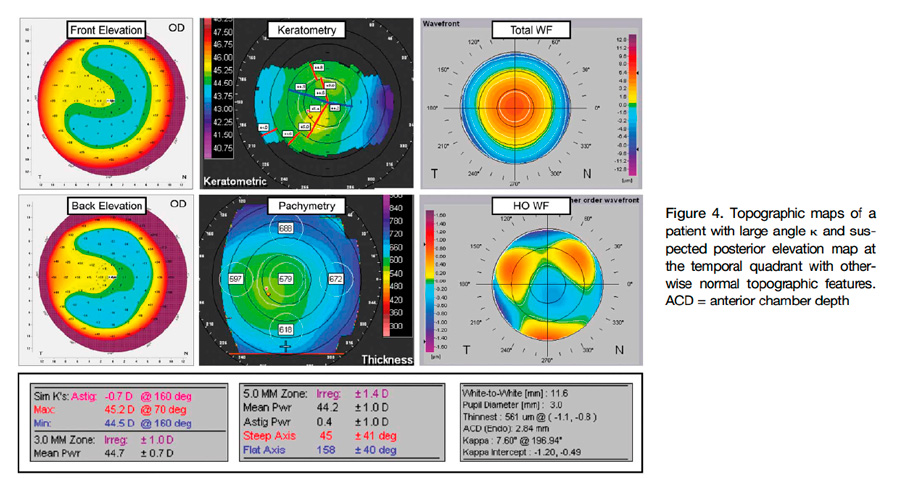 Un ángulo kappa elevado puede resultar en una ablación descentrada y aún más relevante es la correlación encontrada entre un ángulo kappa elevado y queratometrías más altas en elevación anterior y posterior en los 4 mm centrales en los cuadrantes temporales todo esto por el descentramiento en la lectura del estudio en córneas sanas usando la esfera de mejor ajuste. Este efecto se contrarresta si se usa la elipsoide tórica de mejor ajuste, ya que de esta forma se elimina el efecto que tiene el astigmatismo corneal sobre los mapas de elevación.
Un ángulo kappa elevado puede resultar en una ablación descentrada y aún más relevante es la correlación encontrada entre un ángulo kappa elevado y queratometrías más altas en elevación anterior y posterior en los 4 mm centrales en los cuadrantes temporales todo esto por el descentramiento en la lectura del estudio en córneas sanas usando la esfera de mejor ajuste. Este efecto se contrarresta si se usa la elipsoide tórica de mejor ajuste, ya que de esta forma se elimina el efecto que tiene el astigmatismo corneal sobre los mapas de elevación.
 En conclusión, lo que los autores nos recomiendan es que sí estamos frente a una elevación anterior o posterior (temporales) dudosas, con ángulos kappa elevados y con topografías en su mayoría dentro de parámetros normales, se debe cambiar la esfera de mejor ajuste (BFS) por la elipsoide tórica de mejor ajuste (BFTE) y volver a verificar datos; si después de correlacionar datos, seguimos encontrando alteraciones, se debe hacer un mejor estudio de esa córnea para verificar la viabilidad de un procedimiento quirúrgico como: mapas epiteliales/estromales, histéresis corneal, entre otros.
En conclusión, lo que los autores nos recomiendan es que sí estamos frente a una elevación anterior o posterior (temporales) dudosas, con ángulos kappa elevados y con topografías en su mayoría dentro de parámetros normales, se debe cambiar la esfera de mejor ajuste (BFS) por la elipsoide tórica de mejor ajuste (BFTE) y volver a verificar datos; si después de correlacionar datos, seguimos encontrando alteraciones, se debe hacer un mejor estudio de esa córnea para verificar la viabilidad de un procedimiento quirúrgico como: mapas epiteliales/estromales, histéresis corneal, entre otros.
 Si bien es cierto que la medida del ángulo kappa es importante en cirugía refractiva corneal, hoy día se ha vuelto un dato de gran relevancia a la hora de planear una facoemulsificación de catarata, en especial si se colocará un lente premium. Jie Xu et al5 realiza una cohorte prospectiva con 143 ojos y publica en octubre 2022 en el American Journal of Ophthalmology; una serie de variables estadísticamente significativas y determinantes como factores de riesgo para el descentramiento del lente, el cual, cuando supera los 0.4 mm genera cambios importantes en el confort visual.
Si bien es cierto que la medida del ángulo kappa es importante en cirugía refractiva corneal, hoy día se ha vuelto un dato de gran relevancia a la hora de planear una facoemulsificación de catarata, en especial si se colocará un lente premium. Jie Xu et al5 realiza una cohorte prospectiva con 143 ojos y publica en octubre 2022 en el American Journal of Ophthalmology; una serie de variables estadísticamente significativas y determinantes como factores de riesgo para el descentramiento del lente, el cual, cuando supera los 0.4 mm genera cambios importantes en el confort visual.
 Este grupo define variables de predicción para descentramiento horizontal y vertical, siendo los más relevantes el White-to-White > a 12 mm y ángulo alpha > 0.50 mm; adicionalmente, ángulos kappa y alpha elevados horizontal y verticalmente también tienen importancia y favorecen el descentramiento, lo cual se puede explicar por la simetría rotacional del globo ocular, en el cual, el centro de la pupila es cercano al centro del saco capsular. Por el contrario de otros estudios, no se encontró la longitud axial elevada como factor de riesgo, aunque una cámara anterior amplia y un ángulo kappa vertical elevado favorecen el descentramiento vertical.
Este grupo define variables de predicción para descentramiento horizontal y vertical, siendo los más relevantes el White-to-White > a 12 mm y ángulo alpha > 0.50 mm; adicionalmente, ángulos kappa y alpha elevados horizontal y verticalmente también tienen importancia y favorecen el descentramiento, lo cual se puede explicar por la simetría rotacional del globo ocular, en el cual, el centro de la pupila es cercano al centro del saco capsular. Por el contrario de otros estudios, no se encontró la longitud axial elevada como factor de riesgo, aunque una cámara anterior amplia y un ángulo kappa vertical elevado favorecen el descentramiento vertical.
El beneficio de esta información radica en la interpretación acertada de los estudios que realizamos en el planeamiento de las cirugías refractivas y la identificación de dichos factores de riesgo para la toma de decisiones pre-quirúrgicas óptimas.
Técnicas novedosas en superficie ocular
Siempre es interesante descubrir técnicas nuevas que se realizan a nivel internacional para mejorar el pronóstico y manejo de patologías oculares comunes y no tan comunes que siguen siendo objeto de discusión. Presentaremos 2 de estas técnicas publicadas recientemente en la última edición de International Ophthalmology que nos parecen pueden ser de interés para el público del Noticiero ALACCSA-R.
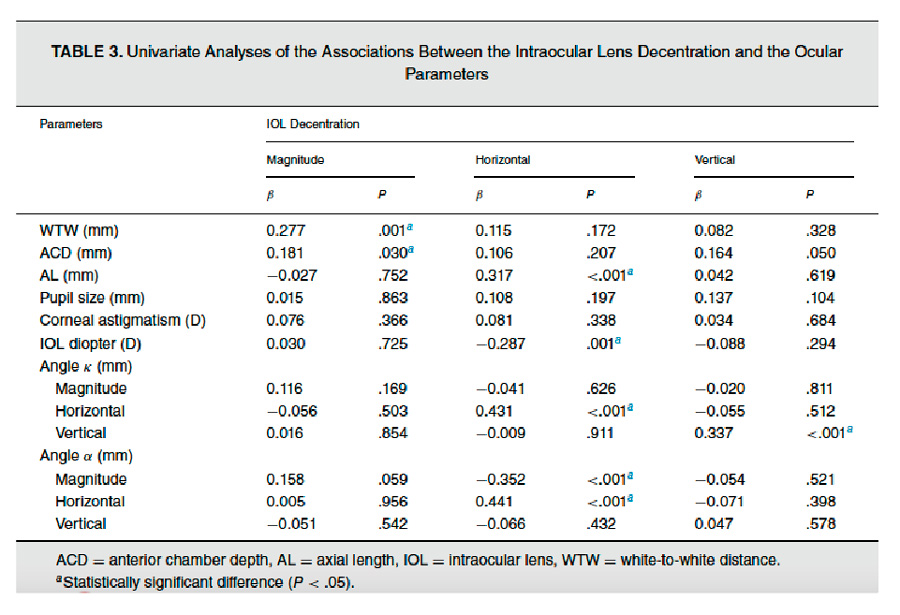
El primer artículo a presentar es el publicado por Pedrotti y colaboradores, quienes presentan una técnica inspirada en el ya conocido y popularizado SLET (simple limbal epithelial transplantation) desarrollado por el Dr. Sayan Basu hace poco menos de una década. Pedrotti6 describe el SCET (simple conjunctival epithelial transplantation) para cubrir el lecho escleral posterior a excisión de pterigion. Este grupo presenta 6 casos con un seguimiento de 12 meses, donde se realiza vigilancia clínica y con microscopía confocal para valorar la diferenciación de las células implantadas con resultados que aparentan prometedores con claras ventajas involucrando mínimo tejido conjuntival donante y aprovechando las propiedades antiinflamatorias y reepitelizantes de la membrana amniótica. La principal diferencia en este procedimiento, además de la toma de tejido conjuntival y no limbal, es que no hay uso de lente de contacto terapéutico, sino que el paciente permanente con el ojo cerrado durante los primeros 2-3 días para aprovechar la nutrición e hidratación de la conjuntiva tarsal. En la figura 2 se pueden observar las imágenes seriadas de la técnica de SCET en este contexto.
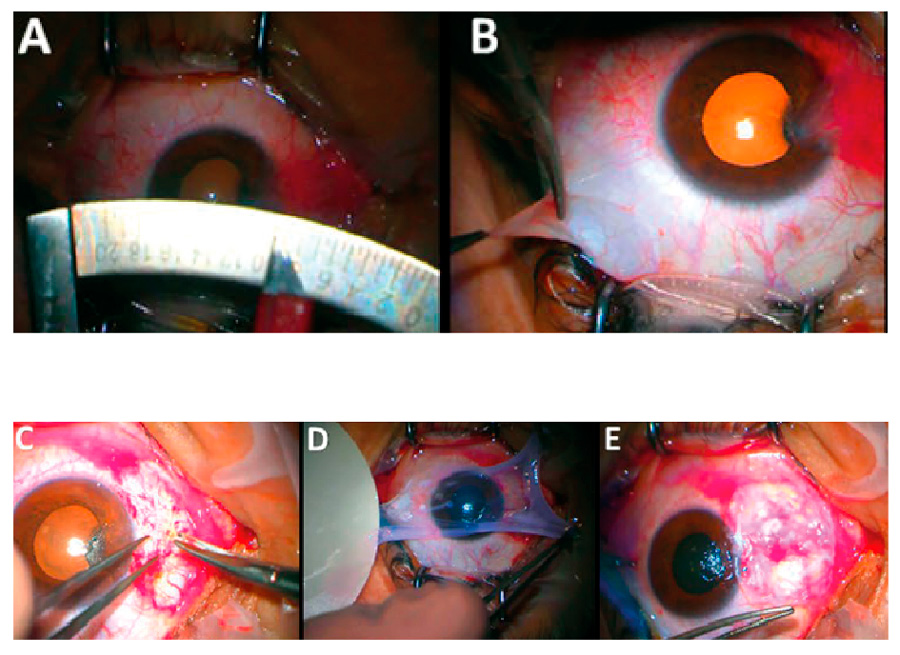 Figura 2. Imágenes intraoperatorias de SCET (simple conjunctival epithelial transplantation): A) Medición del área escleral comprometida por el pterigion. B) Toma de biopsia del tejido conjuntival del área superotemporal. C) Excisión de pterigion y exceso de tenon para dejar lecho escleral desnudo. D) El injerto de SCET (previamente procesado por técnico quien divide el tejido entre 8-10 fragmentos y los fija con adhesivo tisular a la membrana amniótica criopreservada) se coloca con adhesivo tisular sobre el lecho escleral. E) Se pueden notar los fragmentos de conjuntiva sobre el lecho escleral.
Figura 2. Imágenes intraoperatorias de SCET (simple conjunctival epithelial transplantation): A) Medición del área escleral comprometida por el pterigion. B) Toma de biopsia del tejido conjuntival del área superotemporal. C) Excisión de pterigion y exceso de tenon para dejar lecho escleral desnudo. D) El injerto de SCET (previamente procesado por técnico quien divide el tejido entre 8-10 fragmentos y los fija con adhesivo tisular a la membrana amniótica criopreservada) se coloca con adhesivo tisular sobre el lecho escleral. E) Se pueden notar los fragmentos de conjuntiva sobre el lecho escleral.
Para finalizar pero no menos importante, presentaremos la técnica ALT (allogenic limbal transplantation), una técnica publicada en diciembre de 2022 por Viestenz et al.7 para casos de deficiencia de células del limbo. Esta técnica (figura 3) permite realizar una queratoplastia penetrante y rehabilitar la superficie ocular en un mismo acto quirúrgico con buenos resultados funcionales tomando 1-8 fragmentos de limbo del tejido donante y colocándolos debajo de las suturas (interrumpidas o continuas) entre el tejido receptor y donante. Este grupo de investigadores reporta resultados favorables en 14 casos con deficiencia de células del limbo (5 por quemadura química y 9 por infección) con un seguimiento de 12 meses (figura X), donde esta técnica permitió acortar el tiempo de rehabilitación visual (a diferencia de realizar las 2 técnicas de manera diferida) con importante mejoría de la agudeza visual, mantenimiento de la transparencia corneal y ausencia de vascularización en el botón donante. El grupo de estudio en su artículo menciona que no queda claro el mecanismo exacto a través del cual las piezas de ALT se integran al tejido, o si las células limbares alogénicas migran hacia el limbo donante o si más bien crean un nuevo limbo. A pesar de lo limitado de la muestra y de que por supuesto amerita mayor estudio y vigilancia, esta técnica resulta prometedora sobre todo para aquellos casos de deficiencia de células del limbo bilateral.
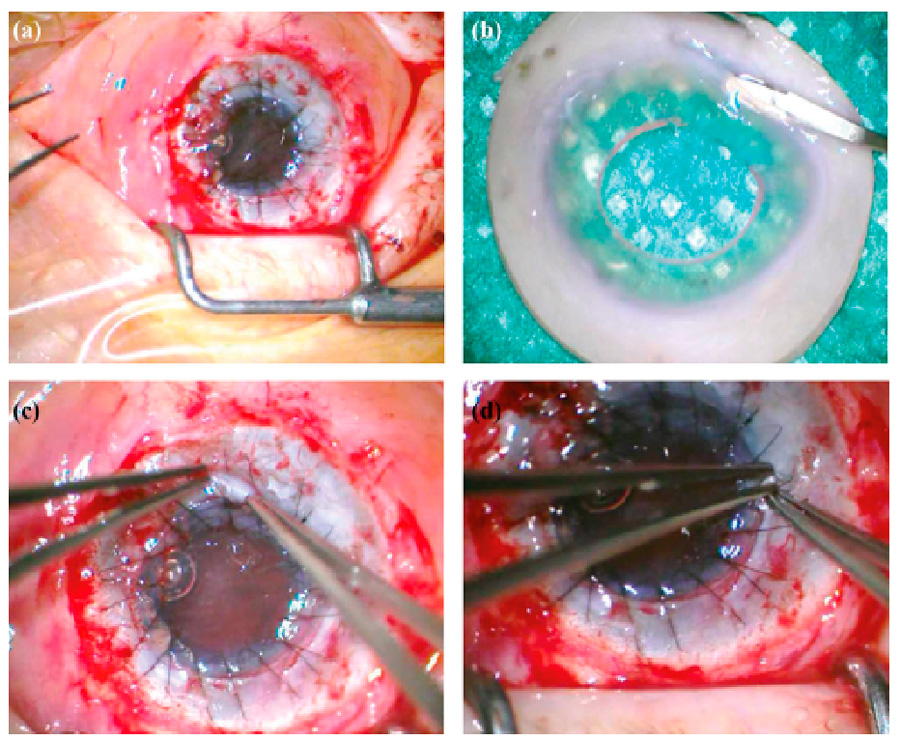 Figura 3. Fotografías intraoperatorias de cirugía ALT. A) Finalización de queratoplastia penetrante. B) Preparación de fragmentos de ALT. C y D) Colocación de los fragmentos de ALT debajo de las suturas.
Figura 3. Fotografías intraoperatorias de cirugía ALT. A) Finalización de queratoplastia penetrante. B) Preparación de fragmentos de ALT. C y D) Colocación de los fragmentos de ALT debajo de las suturas.
 Figura 4. Fotografías clínicas de uno de los casos presentados con antecedente de quemadura química. A) Foto prequirúrgica. B) Postoperatorio a los 2 meses. C) Postoperatorio a los 12 meses. D) Postoperatorio a los 18 meses. La flecha indica un fragmento de ALT.
Figura 4. Fotografías clínicas de uno de los casos presentados con antecedente de quemadura química. A) Foto prequirúrgica. B) Postoperatorio a los 2 meses. C) Postoperatorio a los 12 meses. D) Postoperatorio a los 18 meses. La flecha indica un fragmento de ALT.
Bibliografía:
Sumit Garg, Melinda T de Jesus, Laura M Fletcher, Arturo Chayet, Enrique Barragán, Patrick Casey; Twelve-month clinical outcomes after implantation of a new, modular, anterior shape-changing fluid optic intraocular lens. J Cataract Refract Surg 2022; 48:1134–1140
Al-Ani HH, Sims JL, Niederer RL. Cataract Surgery in Uveitis: Risk Factors, Outcomes, and Complications. Am J Ophthalmol. 2022 Dec;244:117-124
Lu, Amy Q. MD, PhD; Rizk, Monica BS; O’Rourke, Tara OD; Goodling, Kristin OD; Lehman, Erik MS; Scott, Ingrid U. MD, MPH; Pantanelli, Seth M. MD, MS. Safety and efficacy of topical vs intracanalicular corticosteroids for the prevention of postoperative inflammation after cataract surgery. Journal of Cataract & Refractive Surgery 48(11):p 1242-1247, November 2022.
Ramin Salouti, MD, M. Hossein Nowroozzadeh, MD, Ali Azizi, MD, Kia Salouti, BD, Maryam Ghoreyshi, MD,Reza Oboodi, MD, Zahra Tajbakhsh, MSc; Angle k and its effect on corneal elevation maps in refractive surgery candidates. J Cataract Refract Surg 2022; 48:1148–1154
JIE XU A , PEIMIN LIN A , SHAOHUA ZHANG, YI LU, AND TIANYU ZHENG, Risk Factors Associated With Intraocular Lens Decentration After Cataract Surgery, Am JOphthalmol 2022;242: 88–95
Pedrotti E, Bertolin M, Fasolo A, Bonacci E, Bosello F, Ponzin D, Marchini G. Autologous simple conjunctival epithelial transplantation for primary pterygium. Int Ophthalmol. 2022 Dec;42(12):3673-3680.
Viestenz A, Kesper C, Hammer T, Heinzelmann J, Foja S, Viestenz A. ALT (allogeneic limbal transplantation): a new surgical technique for limbal stem cell deficiency. Int Ophthalmol. 2022 Dec;42(12):3749-3762.
 Por Dr. Omar López Mato
Por Dr. Omar López Mato El Juicio Final • Hans Memling • 1473 • Museo Nacional de Gdansk, Polonia.
El Juicio Final • Hans Memling • 1473 • Museo Nacional de Gdansk, Polonia. El Jardín de las Delicias • El Bosco • 1490 • Museo del Prado, Madrid, España
El Jardín de las Delicias • El Bosco • 1490 • Museo del Prado, Madrid, España



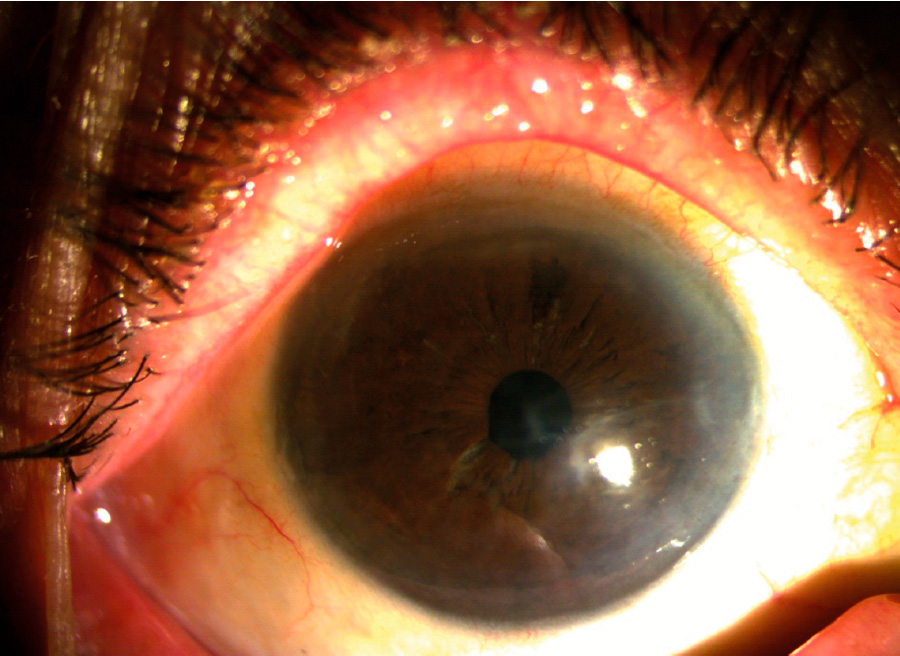 Figura 1. Disfunción endotelial (Foto de registro interno de Clínica Quesada)
Figura 1. Disfunción endotelial (Foto de registro interno de Clínica Quesada)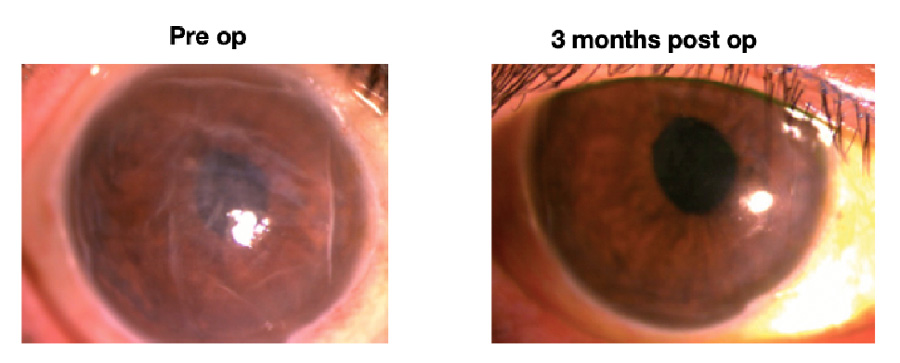 Figura 2. Seguimiento de 3 meses de un sujeto de IOTA (Foto de lámpara de hendidura de Clínica Quesada)
Figura 2. Seguimiento de 3 meses de un sujeto de IOTA (Foto de lámpara de hendidura de Clínica Quesada)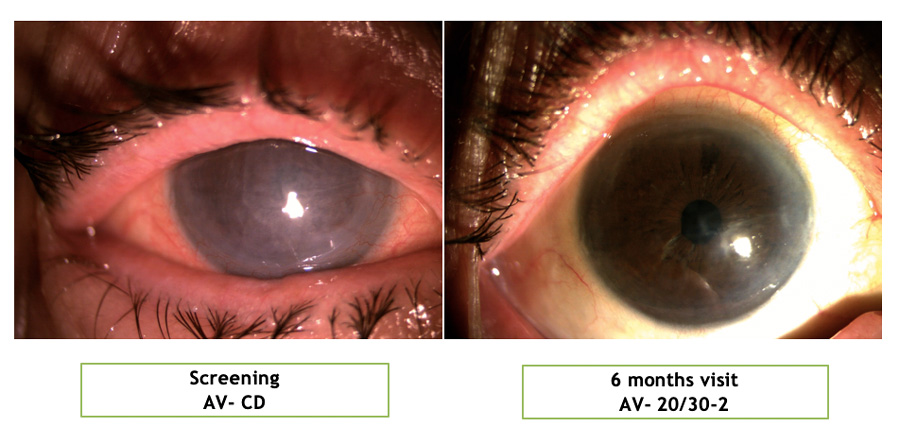 Figura 3. Comparación de Agudeza visual de Screening y 6 Meses de un sujeto de IOTA (Foto de lámpara de hendidura de Clínica Quesada)
Figura 3. Comparación de Agudeza visual de Screening y 6 Meses de un sujeto de IOTA (Foto de lámpara de hendidura de Clínica Quesada)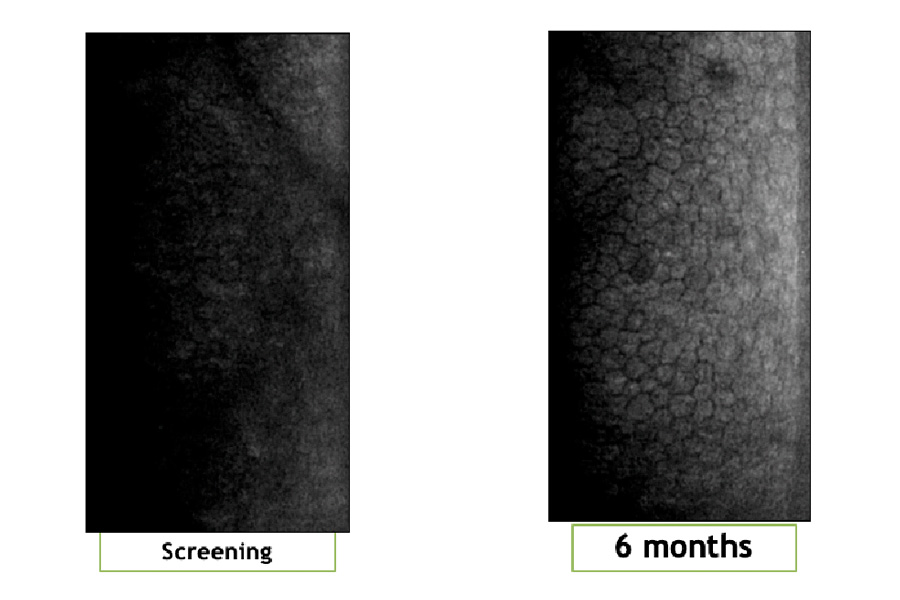 Figura 4. Comparación de células endoteliales de Screening y 6 Meses de un sujeto de IOTA (Exámenes tomados en Clinica Quesada)
Figura 4. Comparación de células endoteliales de Screening y 6 Meses de un sujeto de IOTA (Exámenes tomados en Clinica Quesada)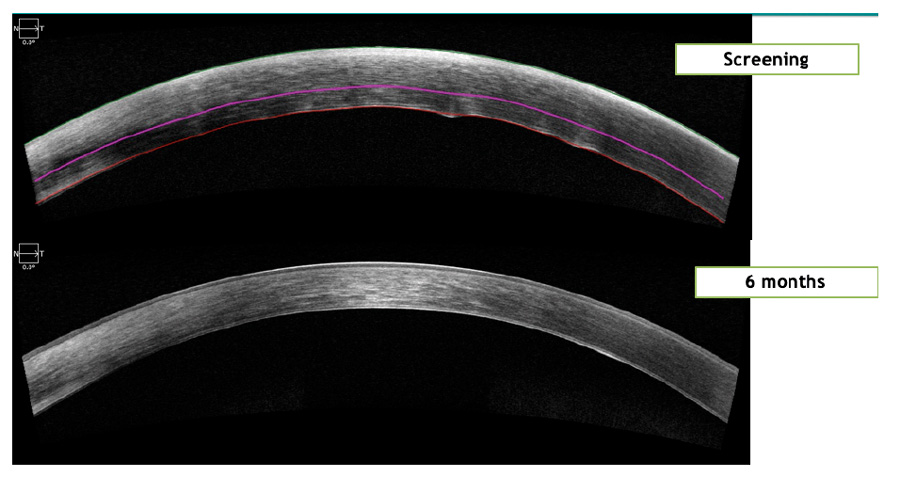
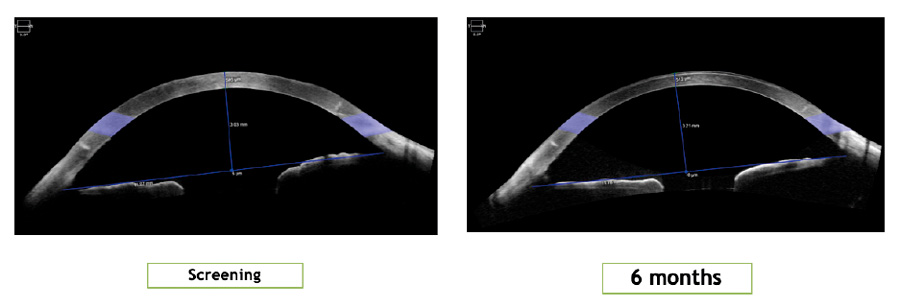 Figura 6. Comparación de un OCT de segmento anterior de Screening y 6 Meses de un sujeto de IOTA (Exámenes tomados en Clínica Quesada)
Figura 6. Comparación de un OCT de segmento anterior de Screening y 6 Meses de un sujeto de IOTA (Exámenes tomados en Clínica Quesada)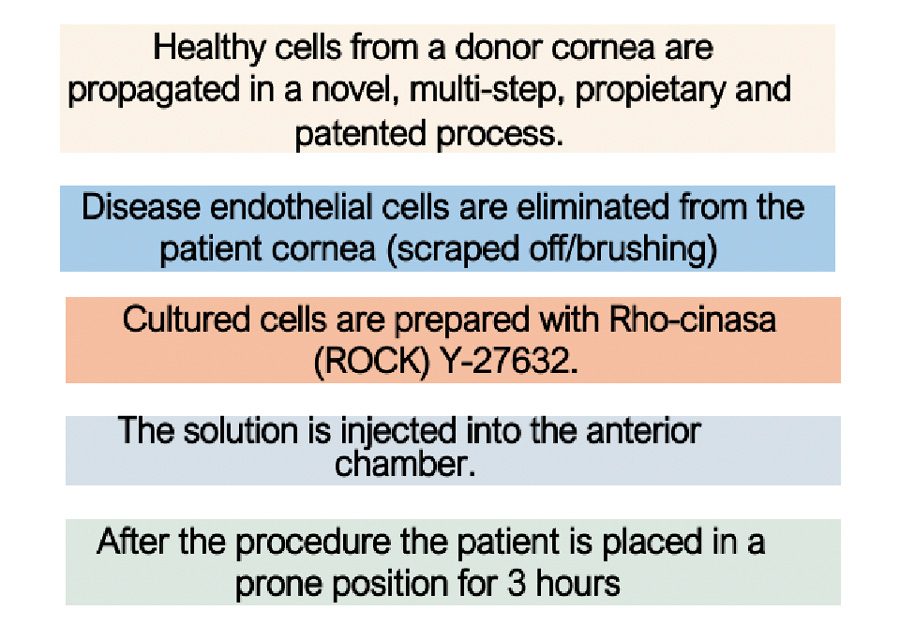 Figura 7. Metodología (7)
Figura 7. Metodología (7)


 Dra. Ana Silvia Serrano – Colombia
Dra. Ana Silvia Serrano – Colombia Dra. Luisa Anaya – México
Dra. Luisa Anaya – México Figura 1. Lente intraocular Juvene
Figura 1. Lente intraocular Juvene Tabla 1. Complicaciones postoperatorias presentadas en 471 pacientes con previo diagnóstico de uveítis que fueron operados de cirugía de catarata.
Tabla 1. Complicaciones postoperatorias presentadas en 471 pacientes con previo diagnóstico de uveítis que fueron operados de cirugía de catarata. Un ángulo kappa elevado puede resultar en una ablación descentrada y aún más relevante es la correlación encontrada entre un ángulo kappa elevado y queratometrías más altas en elevación anterior y posterior en los 4 mm centrales en los cuadrantes temporales todo esto por el descentramiento en la lectura del estudio en córneas sanas usando la esfera de mejor ajuste. Este efecto se contrarresta si se usa la elipsoide tórica de mejor ajuste, ya que de esta forma se elimina el efecto que tiene el astigmatismo corneal sobre los mapas de elevación.
Un ángulo kappa elevado puede resultar en una ablación descentrada y aún más relevante es la correlación encontrada entre un ángulo kappa elevado y queratometrías más altas en elevación anterior y posterior en los 4 mm centrales en los cuadrantes temporales todo esto por el descentramiento en la lectura del estudio en córneas sanas usando la esfera de mejor ajuste. Este efecto se contrarresta si se usa la elipsoide tórica de mejor ajuste, ya que de esta forma se elimina el efecto que tiene el astigmatismo corneal sobre los mapas de elevación. En conclusión, lo que los autores nos recomiendan es que sí estamos frente a una elevación anterior o posterior (temporales) dudosas, con ángulos kappa elevados y con topografías en su mayoría dentro de parámetros normales, se debe cambiar la esfera de mejor ajuste (BFS) por la elipsoide tórica de mejor ajuste (BFTE) y volver a verificar datos; si después de correlacionar datos, seguimos encontrando alteraciones, se debe hacer un mejor estudio de esa córnea para verificar la viabilidad de un procedimiento quirúrgico como: mapas epiteliales/estromales, histéresis corneal, entre otros.
En conclusión, lo que los autores nos recomiendan es que sí estamos frente a una elevación anterior o posterior (temporales) dudosas, con ángulos kappa elevados y con topografías en su mayoría dentro de parámetros normales, se debe cambiar la esfera de mejor ajuste (BFS) por la elipsoide tórica de mejor ajuste (BFTE) y volver a verificar datos; si después de correlacionar datos, seguimos encontrando alteraciones, se debe hacer un mejor estudio de esa córnea para verificar la viabilidad de un procedimiento quirúrgico como: mapas epiteliales/estromales, histéresis corneal, entre otros. Si bien es cierto que la medida del ángulo kappa es importante en cirugía refractiva corneal, hoy día se ha vuelto un dato de gran relevancia a la hora de planear una facoemulsificación de catarata, en especial si se colocará un lente premium. Jie Xu et al5 realiza una cohorte prospectiva con 143 ojos y publica en octubre 2022 en el American Journal of Ophthalmology; una serie de variables estadísticamente significativas y determinantes como factores de riesgo para el descentramiento del lente, el cual, cuando supera los 0.4 mm genera cambios importantes en el confort visual.
Si bien es cierto que la medida del ángulo kappa es importante en cirugía refractiva corneal, hoy día se ha vuelto un dato de gran relevancia a la hora de planear una facoemulsificación de catarata, en especial si se colocará un lente premium. Jie Xu et al5 realiza una cohorte prospectiva con 143 ojos y publica en octubre 2022 en el American Journal of Ophthalmology; una serie de variables estadísticamente significativas y determinantes como factores de riesgo para el descentramiento del lente, el cual, cuando supera los 0.4 mm genera cambios importantes en el confort visual. Este grupo define variables de predicción para descentramiento horizontal y vertical, siendo los más relevantes el White-to-White > a 12 mm y ángulo alpha > 0.50 mm; adicionalmente, ángulos kappa y alpha elevados horizontal y verticalmente también tienen importancia y favorecen el descentramiento, lo cual se puede explicar por la simetría rotacional del globo ocular, en el cual, el centro de la pupila es cercano al centro del saco capsular. Por el contrario de otros estudios, no se encontró la longitud axial elevada como factor de riesgo, aunque una cámara anterior amplia y un ángulo kappa vertical elevado favorecen el descentramiento vertical.
Este grupo define variables de predicción para descentramiento horizontal y vertical, siendo los más relevantes el White-to-White > a 12 mm y ángulo alpha > 0.50 mm; adicionalmente, ángulos kappa y alpha elevados horizontal y verticalmente también tienen importancia y favorecen el descentramiento, lo cual se puede explicar por la simetría rotacional del globo ocular, en el cual, el centro de la pupila es cercano al centro del saco capsular. Por el contrario de otros estudios, no se encontró la longitud axial elevada como factor de riesgo, aunque una cámara anterior amplia y un ángulo kappa vertical elevado favorecen el descentramiento vertical. Figura 2. Imágenes intraoperatorias de SCET (simple conjunctival epithelial transplantation): A) Medición del área escleral comprometida por el pterigion. B) Toma de biopsia del tejido conjuntival del área superotemporal. C) Excisión de pterigion y exceso de tenon para dejar lecho escleral desnudo. D) El injerto de SCET (previamente procesado por técnico quien divide el tejido entre 8-10 fragmentos y los fija con adhesivo tisular a la membrana amniótica criopreservada) se coloca con adhesivo tisular sobre el lecho escleral. E) Se pueden notar los fragmentos de conjuntiva sobre el lecho escleral.
Figura 2. Imágenes intraoperatorias de SCET (simple conjunctival epithelial transplantation): A) Medición del área escleral comprometida por el pterigion. B) Toma de biopsia del tejido conjuntival del área superotemporal. C) Excisión de pterigion y exceso de tenon para dejar lecho escleral desnudo. D) El injerto de SCET (previamente procesado por técnico quien divide el tejido entre 8-10 fragmentos y los fija con adhesivo tisular a la membrana amniótica criopreservada) se coloca con adhesivo tisular sobre el lecho escleral. E) Se pueden notar los fragmentos de conjuntiva sobre el lecho escleral. Figura 3. Fotografías intraoperatorias de cirugía ALT. A) Finalización de queratoplastia penetrante. B) Preparación de fragmentos de ALT. C y D) Colocación de los fragmentos de ALT debajo de las suturas.
Figura 3. Fotografías intraoperatorias de cirugía ALT. A) Finalización de queratoplastia penetrante. B) Preparación de fragmentos de ALT. C y D) Colocación de los fragmentos de ALT debajo de las suturas. Figura 4. Fotografías clínicas de uno de los casos presentados con antecedente de quemadura química. A) Foto prequirúrgica. B) Postoperatorio a los 2 meses. C) Postoperatorio a los 12 meses. D) Postoperatorio a los 18 meses. La flecha indica un fragmento de ALT.
Figura 4. Fotografías clínicas de uno de los casos presentados con antecedente de quemadura química. A) Foto prequirúrgica. B) Postoperatorio a los 2 meses. C) Postoperatorio a los 12 meses. D) Postoperatorio a los 18 meses. La flecha indica un fragmento de ALT.


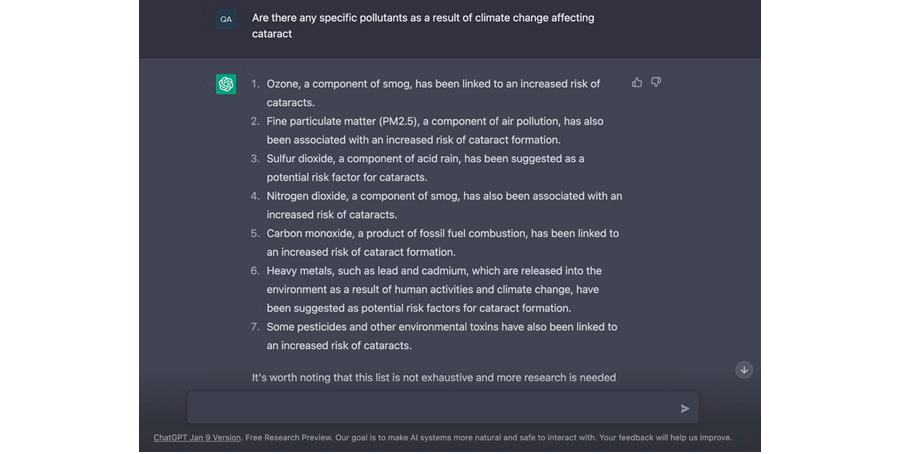 Figura 1. Captura de pantalla del ChatGPT con la respuesta más aceptada sobre la formación de cataratas secundarias al cambio climático y los contaminantes del aire.
Figura 1. Captura de pantalla del ChatGPT con la respuesta más aceptada sobre la formación de cataratas secundarias al cambio climático y los contaminantes del aire.
 El Juicio final • Miguel Ángel • 1541 – Capilla Sixtina, Vaticano, Italia.
El Juicio final • Miguel Ángel • 1541 – Capilla Sixtina, Vaticano, Italia. Paulo III con Alejandro y Octavio Farnesio • Tiziano • 1545 – Museo di Capodimonte, Nápoles, Italia.
Paulo III con Alejandro y Octavio Farnesio • Tiziano • 1545 – Museo di Capodimonte, Nápoles, Italia.


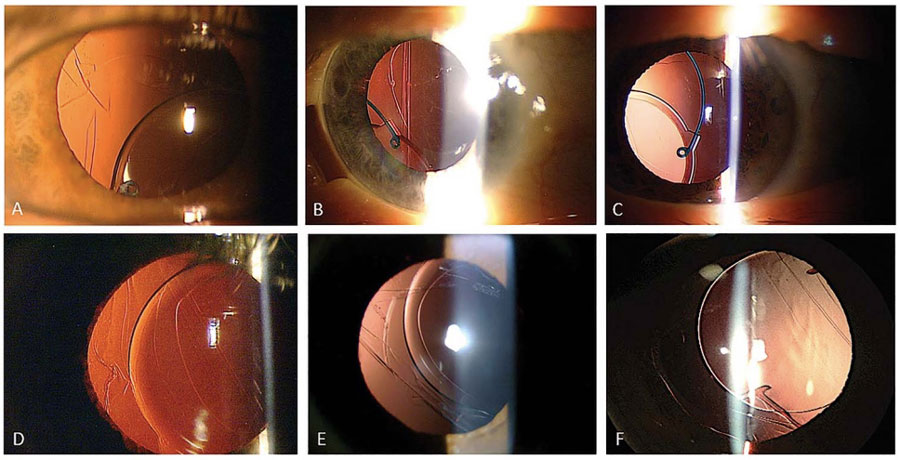 Figura 1. Fotografías de lámpara de hendidura de casos con sospecha de “dead bag syndrome” mostrando sacos capsulares particularmente limpios o transparentes. En algunos casos, el LIO se encuentra descentrado dentro del saco (A, B, C y F), y en algunos otros el saco capsular parece estar descentrado junto con el LIO (D, E).
Figura 1. Fotografías de lámpara de hendidura de casos con sospecha de “dead bag syndrome” mostrando sacos capsulares particularmente limpios o transparentes. En algunos casos, el LIO se encuentra descentrado dentro del saco (A, B, C y F), y en algunos otros el saco capsular parece estar descentrado junto con el LIO (D, E).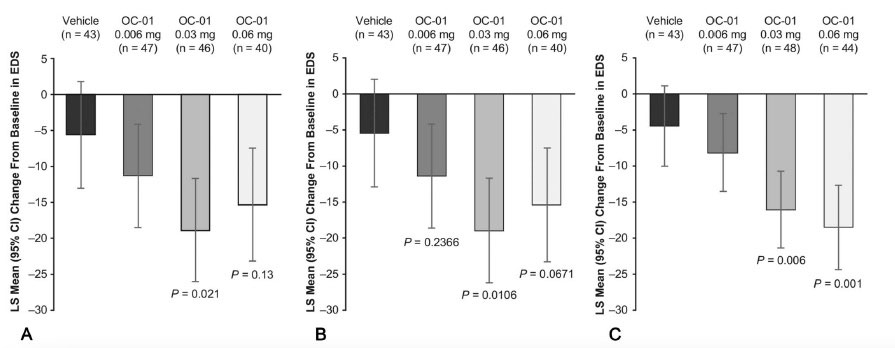 Tabla 1. A) Reducción de la escala EDS desde el punto de basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 días con los datos faltantes. C) Reducción promedio de los mínimos cuadrados a los 21 días en un ambiente controlado. Todas las comparaciones se hicieron con el grupo control (vehículo), con una diferencia estadísticamente significativa con la concentración 0.03 y 0.06 mg.
Tabla 1. A) Reducción de la escala EDS desde el punto de basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 días con los datos faltantes. C) Reducción promedio de los mínimos cuadrados a los 21 días en un ambiente controlado. Todas las comparaciones se hicieron con el grupo control (vehículo), con una diferencia estadísticamente significativa con la concentración 0.03 y 0.06 mg.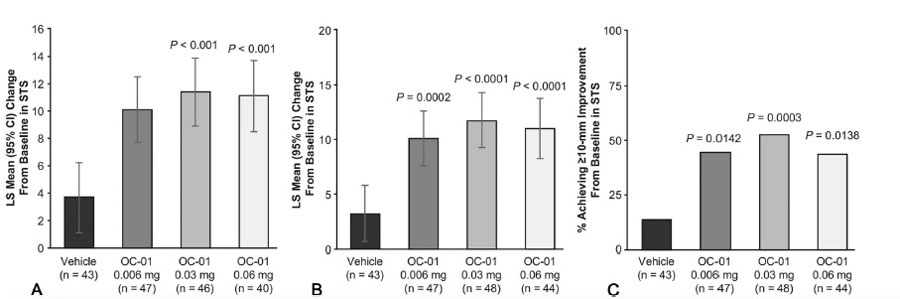 Tabla 2. A) Cambio promedio de mínimos cuadrados del basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 años con los datos faltantes. C) El porcentaje de pacientes que tuvieron al menos 10 mm de cambio en el test de Schirmer comparado con el grupo control. Estas tablas muestran una mejoría estadísticamente significativa en la producción de lágrima con OC-01 0.03 y 0.06, aumentando de ~5 mm a ~11 mm después de 28 días.
Tabla 2. A) Cambio promedio de mínimos cuadrados del basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 años con los datos faltantes. C) El porcentaje de pacientes que tuvieron al menos 10 mm de cambio en el test de Schirmer comparado con el grupo control. Estas tablas muestran una mejoría estadísticamente significativa en la producción de lágrima con OC-01 0.03 y 0.06, aumentando de ~5 mm a ~11 mm después de 28 días.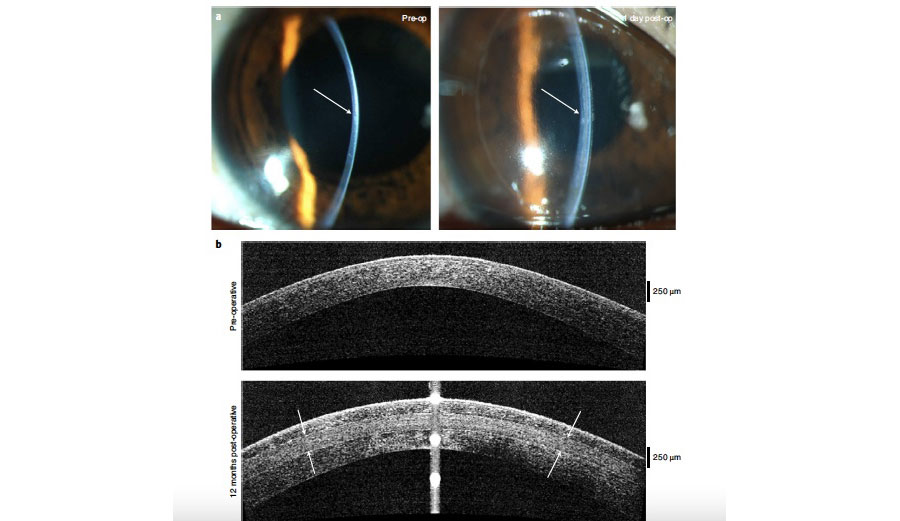 Figura 2. Datos clínicos de uno de los pacientes de india que recibieron BPCDX. A) Imágenes en lámpara de hendidura pre y postoperatorias. B) OCT pre y postquirúrgico donde se observa el BPCDX de 280 um de grosor, que muestra un engrosamiento y regularización de la superficie ocular. C) Mapas topográficos, de elevación anterior y paquimétricos que muestran un aplanamiento queratométrico central y un aumento en la paquimetría a los 12 meses.
Figura 2. Datos clínicos de uno de los pacientes de india que recibieron BPCDX. A) Imágenes en lámpara de hendidura pre y postoperatorias. B) OCT pre y postquirúrgico donde se observa el BPCDX de 280 um de grosor, que muestra un engrosamiento y regularización de la superficie ocular. C) Mapas topográficos, de elevación anterior y paquimétricos que muestran un aplanamiento queratométrico central y un aumento en la paquimetría a los 12 meses.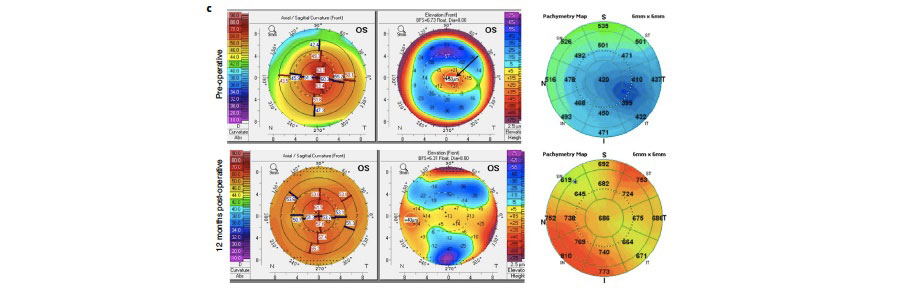
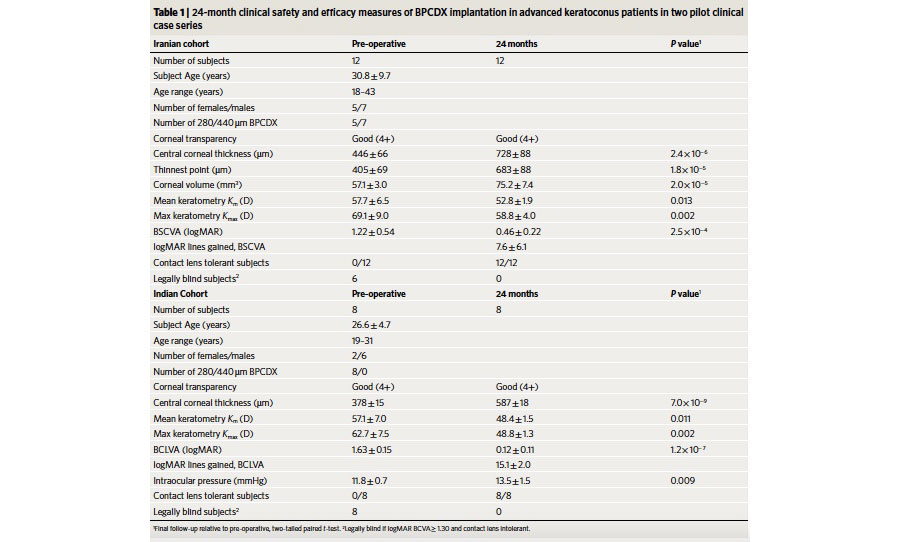 Tabla 3. Resultados de las variables medidas en la serie de casos del implante BPCDX.
Tabla 3. Resultados de las variables medidas en la serie de casos del implante BPCDX.



 La Virgen del canciller Rolin
La Virgen del canciller Rolin Izquierda:
Izquierda:  Izquierda:
Izquierda: