Los mejores papers del segundo cuatrimestre del 2022
 Dra. Ana Silvia Serrano – México/Colombia
Dra. Ana Silvia Serrano – México/Colombia
cornea@oftalmologosmozo.com
Resumen
Durante este cuatrimestre han sido tantas las publicaciones de interés para nuestra práctica diaria como oftalmólogos en revistas indexadas, que realmente no ha sido una tarea sencilla el seleccionar los papers más relevantes. Sin embargo, en el siguiente artículo les presento aquellos me parecieron más interesantes y que proponen planteamientos novedosos ante situaciones que se nos presentan en el día a día. Espero sea de su agrado.
Cirugía de catarata
Empecemos hablando sobre lo más nuevo y relevante que ha sido publicado sobre aspectos esenciales y a tener en cuenta por todo cirujano de segmento anterior.
En Mayo 2022 fue publicado un artículo escrito en el JCRS sobre el ya conocido término “dead bag syndrome”, que podría ser traducido como “síndrome del saco vacío” o “síndrome del saco muerto”. Dicho término fue acuñado por el Dr. Samuel Masket, refiriéndose a una dislocación tardía de un lente intraocular (LIO) dentro del saco capsular asociado a un saco capsular limpio sin cambios fibróticos o material proliferativo dentro del mismo incluso años posterior a la cirugía de catarata (ver figura 1).
El artículo hace alusión a una publicación de Culp y colaboradores1, quienes estudiaron 10 pacientes con sospecha de dicho síndrome, donde en 7 casos fueron explantados el saco capsular y el LIO para su análisis histopatológico, encontrando separación de las fibras capsulares en 6 especímenes y adelgazamiento sin separación en el otro. Además reportan una ausencia total de células epiteliales cristalineanas (LECs) en 4 especímenes y LECs anormales en la superficie interna de la cápsula en el resto de los casos. Lo comparan con un grupo control de casos de exfoliación y pseudoexfoliación donde la dislocación se asocia a debilidad zonular y presencia abundante de LECs, haciéndola una entidad distinta a tener en cuenta. Así mismo, se abre la interrogante si la presencia de LECs es necesaria para una saco capsular con integridad estructural, haciendo que maniobras como el pulido excesivo de la cápsula puedan predisponer a la presencia de dicha entidad.
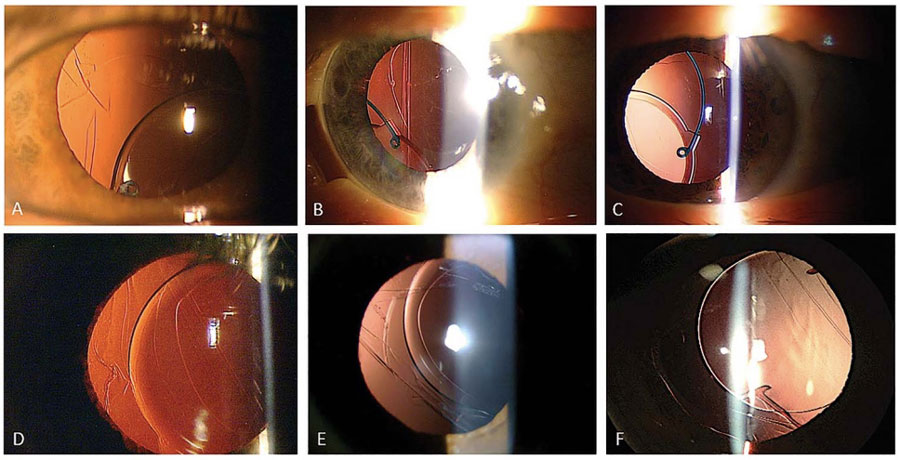 Figura 1. Fotografías de lámpara de hendidura de casos con sospecha de “dead bag syndrome” mostrando sacos capsulares particularmente limpios o transparentes. En algunos casos, el LIO se encuentra descentrado dentro del saco (A, B, C y F), y en algunos otros el saco capsular parece estar descentrado junto con el LIO (D, E).
Figura 1. Fotografías de lámpara de hendidura de casos con sospecha de “dead bag syndrome” mostrando sacos capsulares particularmente limpios o transparentes. En algunos casos, el LIO se encuentra descentrado dentro del saco (A, B, C y F), y en algunos otros el saco capsular parece estar descentrado junto con el LIO (D, E).
Sobre cálculo de LIO en la cirugía de catarata, en este cuatrimestre fueron publicados 2 papers que vale la pena destacar, ambos publicados por Shammas et al. El primero de ellos2, comparó el cálculo de LIO tórico de 122 ojos, usando las queratometrías (K) tomadas por un biómetro SS-OCT (Argos) y usando la fórmula Barrett Toric con el astigmatismo corneal posterior (PCA) predicho a través de un modelo teórico basado en los parámetros medidos vs. el PCA medido, el cual fue obtenido a través de un topógrafo de Scheimpflug (Pentacam); así mismo, se comparó el cálculo realizado con las SimK y el PCA medido, ambas medidas obtenidas con el topógrafo de Scheimpflug. Los resultados muestran que el número de ojos dentro del error absoluto promedio (MAE) entre ±0.5 y ±0.75 D fue mayor en el grupo calculado con Barrett Toric con Ks tomadas con el biómetro SS-OCT y PCA predicho (74% y 99%) con una diferencia estadísticamente significativa comparado con los otros grupos.
En segunda instancia, el grupo del Dr.
Shammas3 también se tomó el trabajo de analizar la precisión de fórmulas nuevas para cálculo de LIO en casos con longitud axial (LA) corta y larga usando un biómetro Argos con “suma de segmentos” (S-O-S) en 595 pacientes sometidos a cirugía de catarata. Las 13 nuevas fórmulas estudiadas son fórmulas que se han vuelto sumamente populares y algunas incluso se basan en inteligencia artificial y, en su mayoría, se encuentran disponibles en línea. Dichas fórmulas analizadas fueron: Barrett Universal II (B II), Barret True Axial Length (BTAL), Emetropia Verifying Optical (EVO), Hill-RBF, Hoffer QST, Holladay 2, Holladay 2-NLR, K6, Kane, Olsen, PEARL-DGS, T2 y VRF. Los resultados obtenidos con el cálculo de las nuevas fórmulas que integran la S-O-S fueron comparados con los cálculos realizados con las fórmulas tradicionales: Haigis, Hoffer Q, Holladay 1 y SRK/T. Se incluyeron 595 pacientes, de los cuales 78 eran ojos cortos (LA promedio 22.0±0.38 m) y 102 eran ojos largos (LA promedio 25.27±0.76). Los resultados nos indican que todas las nuevas fórmulas tuvieron en MAE entre ±0.5 en el 76% de los casos (452/595). Mientras que los casos de ojos con ojo cortos u ojos largos tuvieron mejores resultados las fórmulas BTAL, EVO, Hoffer QST, K6, Olsen y PEARL-DGS, seguido de BII y Kane.
Así mismo, en el reporte publicado en Ophthalmology por Lin et al4, analizan una serie 12 artículos publicados de 33 revisados que cumplían sus criterios para evaluar a través de ensayos controlados aleatorizados (RCT) las diferencias de la cirugía de catarata tradicional realizada por facoemulsificación (PCS) vs. cirugía de catarata asistida por láser de femtosegundo (FLACS). Según los resultados de 3 RCTs especialmente enfocados en analizar los resultados refractivos, no hubo diferencia estadísticamente significativa entre ambos grupos en la AVSC a distancia en el periodo postoperatorios de 1 mes a 1 año (0.12 a 0.17 LogMAR), así como un equivalente esférico postoperatorio similar entre ambos grupos. Aunque existe evidencia temprana de que FLACS puede reducir la cantidad de energía de facoemulsificación y por lo tanto, producir menor pérdida de células endoteliales, 6 de 8 RCTs que estudiaron esto mostraron que no había diferencia entre los 1-6 meses postoperatorios, presentando una pérdida desde 6.4%-11.2% en FLACS comparado con 6.33%-9.85% en PCS
Superficie ocular y ojo seco
Sabemos que el ojo seco sigue siendo uno de los principales motivos de consulta de nuestros pacientes y conforme más se estudia, más se observa cuánto es que realmente impacta la calidad de vida de nuestros pacientes, su trabajo y su estilo de vida. Es por eso que se siguen estudiando diferentes alternativas para mejorar la sintomatología indeseable de esta enfermedad como la opción mencionada a continuación.
Los resultados de la fase 2b del estudio ONSET-15, un ensayo aleatorizado para evaluar la seguridad y eficacia del OC-01 (solución de varenicilina 0.03 mg, nombre comercial TRYVAYA). Este medicamento es un spray nasal que actúa como un agonista altamente selectivo de los receptores nicotínicos de acetilcolina (nAChR). La varenicilina fue aprobada desde el 2006 por la FDA como medicamento para detener el tabaquismo, sin embargo, recientemente se ha estudiado su efecto en la vía parasimpática trigeminal (TPP) que inerva la glándula lagrimal (específicamente las células mioepiteliales y acinares secretoras), encargándose del 34% de la producción de lágrima basal. El principio activo estimula los nAChRs presentes en el nervio trigeminal dentro de la cavidad nasal a través de la mucosa. Se incluyeron 182 pacientes de los cuales fueron aleatorizados hacia 4 grupos: Vehículo (43 casos), OC-01 dosis baja 0.006 mg (47 casos), OC-01 dosis intermedia 0.03 mg (46 casos), OC-01 dosis alta 0.06 mg (40 casos). Se compararon los resultados al iniciar el estudio y a los 28 días, comparando test de Schirmer bajo anestesia y el Eye Dryness Score (EDS) Los resultados demuestran que la Varencilina durante un periodo de 28 días y en cualquiera de sus 3 concentraciones, tuvo mejoría de los síntomas de ojo seco (evidenciado por el EDS) (ver Tabla 1) y presentó cambios estadísticamente significativos en el test de Schirmer bajo anestesia (ver Tabla 2). Así mismo, fue bien tolerado, con presencia de síntomas leves y transitorios posterior a la aplicación, especialmente estornudos y tos. Se convierte en una alternativa importante, especialmente para aquellos pacientes con múltiples tratamientos tópicos o con dolor neuropático de la superficie ocular, además de brindar una vía de acción diferente a las vías aferentes corneales y conjuntivales, que pueden estar alteradas en diferentes patologías de la superficie ocular.
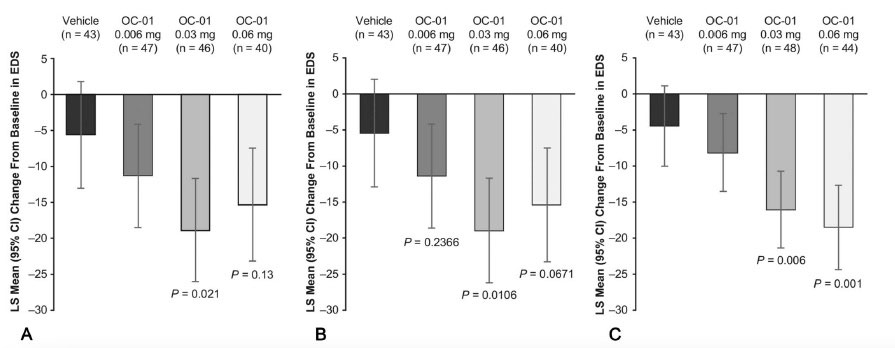 Tabla 1. A) Reducción de la escala EDS desde el punto de basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 días con los datos faltantes. C) Reducción promedio de los mínimos cuadrados a los 21 días en un ambiente controlado. Todas las comparaciones se hicieron con el grupo control (vehículo), con una diferencia estadísticamente significativa con la concentración 0.03 y 0.06 mg.
Tabla 1. A) Reducción de la escala EDS desde el punto de basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 días con los datos faltantes. C) Reducción promedio de los mínimos cuadrados a los 21 días en un ambiente controlado. Todas las comparaciones se hicieron con el grupo control (vehículo), con una diferencia estadísticamente significativa con la concentración 0.03 y 0.06 mg.
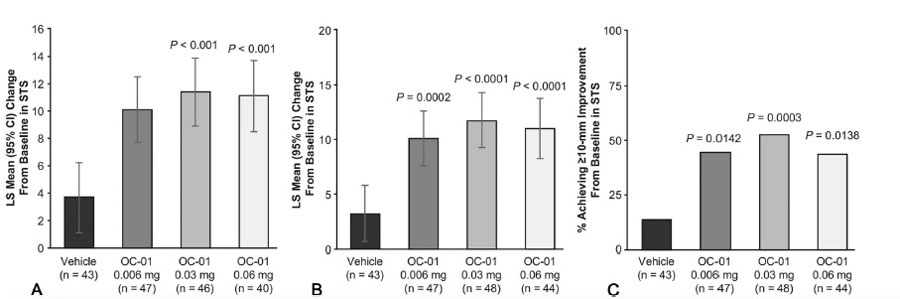 Tabla 2. A) Cambio promedio de mínimos cuadrados del basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 años con los datos faltantes. C) El porcentaje de pacientes que tuvieron al menos 10 mm de cambio en el test de Schirmer comparado con el grupo control. Estas tablas muestran una mejoría estadísticamente significativa en la producción de lágrima con OC-01 0.03 y 0.06, aumentando de ~5 mm a ~11 mm después de 28 días.
Tabla 2. A) Cambio promedio de mínimos cuadrados del basal hasta el día 28. B) Reducción promedio de los mínimos cuadrados a los 28 años con los datos faltantes. C) El porcentaje de pacientes que tuvieron al menos 10 mm de cambio en el test de Schirmer comparado con el grupo control. Estas tablas muestran una mejoría estadísticamente significativa en la producción de lágrima con OC-01 0.03 y 0.06, aumentando de ~5 mm a ~11 mm después de 28 días.
Córnea y cirugía refractiva
Siguiendo con los artículos referentes a córnea, uno de mis favoritos fue el presentado por Rafat et al6, cuyo grupo de trabajo en Irán e India presentan una opción novedosa como tratamiento de pacientes con queratocono avanzado y que puede llegar a ser una solución a la escasez de tejidos disponibles para donación a nivel mundial. En su publicación presentan un tejido corneal creado por bioingeniería donde toman colágeno dérmico porcino (actualmente aprobado para su uso en vendaje de heridas y cirugía de glaucoma), y lo someten a un método de doble crosslinking para mejorar su fuerza y estabilidad (Bioegineered porcine construct double crosslinked – BPCDX) y lo implantan en la córnea humana a través de un bolsillo que requiere una incisión mínima (ver figura 2). Fue previamente estudiado en modelos de mini puercos, y en este artículo presentan sus primeros 20 casos en humanos, con un seguimiento de 2 años (ver tabla 3). En dicho periodo de seguimiento, no se presentaron efectos adversos o complicaciones. Así mismo, reportan un aumento promedio del grosor corneal de 209±18 um en India y 285±99 um en Irán, así como una disminución de las Kmax (13.9±7.9 D India y 11.2±8.9 Irán), con su consecuente mejoría en la superficie corneal y mejor tolerancia de lente de contacto con mejoría en la AVMC.
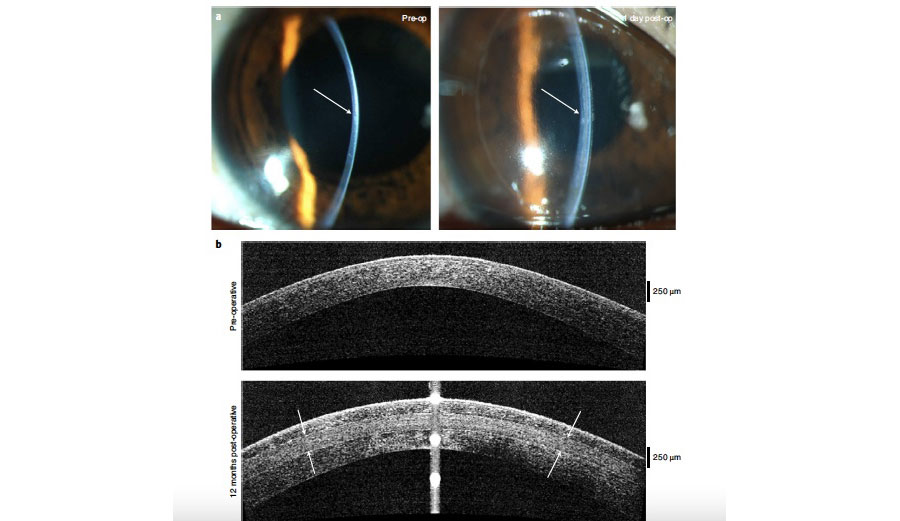 Figura 2. Datos clínicos de uno de los pacientes de india que recibieron BPCDX. A) Imágenes en lámpara de hendidura pre y postoperatorias. B) OCT pre y postquirúrgico donde se observa el BPCDX de 280 um de grosor, que muestra un engrosamiento y regularización de la superficie ocular. C) Mapas topográficos, de elevación anterior y paquimétricos que muestran un aplanamiento queratométrico central y un aumento en la paquimetría a los 12 meses.
Figura 2. Datos clínicos de uno de los pacientes de india que recibieron BPCDX. A) Imágenes en lámpara de hendidura pre y postoperatorias. B) OCT pre y postquirúrgico donde se observa el BPCDX de 280 um de grosor, que muestra un engrosamiento y regularización de la superficie ocular. C) Mapas topográficos, de elevación anterior y paquimétricos que muestran un aplanamiento queratométrico central y un aumento en la paquimetría a los 12 meses.
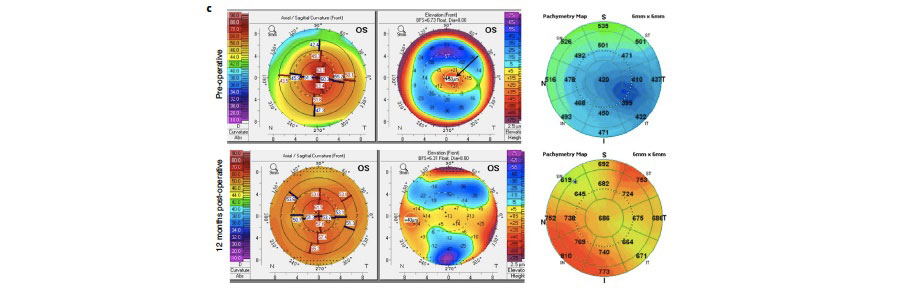
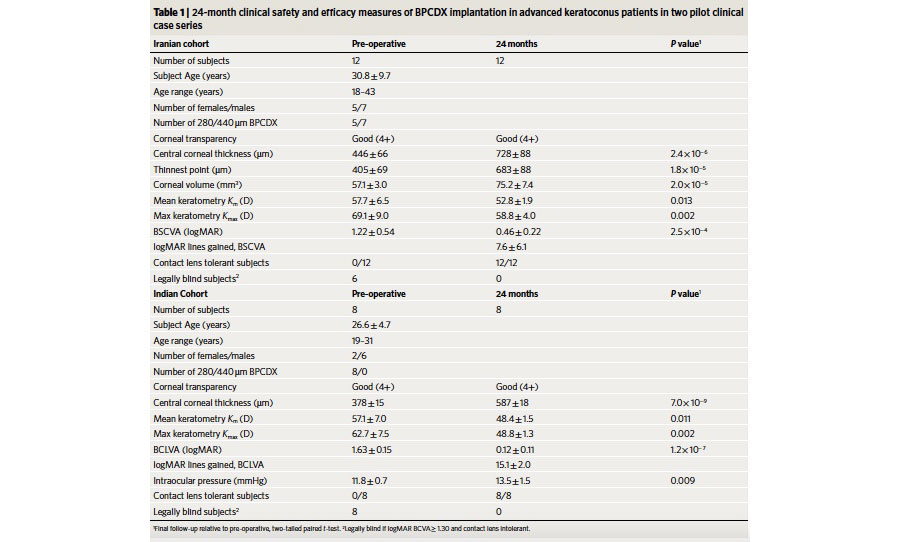 Tabla 3. Resultados de las variables medidas en la serie de casos del implante BPCDX.
Tabla 3. Resultados de las variables medidas en la serie de casos del implante BPCDX.
Y para finalizar y cerrar con broche de oro, vale la pena destacar el artículo más reciente del grupo de estudio de los doctores Zaldivar7 quienes describen el uso del OCT intraoperatorio (iOCT) para medir el vault posterior al implante de ICL y en caso de encontrarse >750 um, realizar una rotación a una posición vertical u oblicua. Esta se maniobra se realizó en 25 ojos de 25 pacientes, obteniendo una disminución significativa de vault intraoperatorio de 1147.88 ± 188.36 um previo a 739.76 ± 194.97 um posterior a la rotación vertical (76%) u oblicua (24%). Describiendo esta maniobra como efectiva y segura para, con el uso de la tecnología del iOCT, minimizar sorpresas posquirúrgicas que puedan requerir una reintervención.
Referencias
Culp, Catherine MD; Qu, Phillip MD; Jones, Jason MD; Fram, Nicole MD; Ogawa, Gregory MD; Masket, Samuel MD; Mamalis, Nick MD; Werner, Liliana MD, PhD. Clinical and histopathological findings in the dead bag syndrome. Journal of Cataract & Refractive Surgery: February 2022 – Volume 48 – Issue 2 – p 177-184
Shammas, H. John MD; Yu, Fei PhD; Shammas, Maya C MD; Jivrajka, Renu MD; Hakimeh, Christine MD. Predicted vs measured posterior corneal astigmatism for toric intraocular lens calculations. Journal of Cataract & Refractive Surgery: June 2022 – Volume 48 – Issue 6 – p 690-696
Shammas, H. John MD; Taroni, Leonardo MD; Pellegrini, Marco MD; Shammas, Maya C. MD; Jivrajka, Renu V. MD. Accuracy of newer intraocular lens power formulas in short and long eyes using sum-of-segments biometry. Journal of Cataract & Refractive Surgery: October 2022 – Volume 48 – Issue 10 – p 1113-1120
Lin CC, Rose-Nussbaumer JR, Al-Mohtaseb ZN, Pantanelli SM, Steigleman WA 3rd, Hatch KM, Santhiago MR, Kim SJ, Schallhorn JM. Femtosecond Laser-Assisted Cataract Surgery: A Report by the American Academy of Ophthalmology. Ophthalmology. 2022 Aug;129(8):946-954.
Wirta D, Torkildsen GL, Boehmer B, Hollander DA, Bendert E, Zeng L, Ackermann M, Nau J. ONSET-1 Phase 2b Randomized Trial to Evaluate the Safety and Efficacy of OC-01 (Varenicline Solution) Nasal Spray on Signs and Symptoms of Dry Eye Disease. Cornea. 2022 Oct 1;41(10):1207-1216.
Rafat M, Jabbarvand M, Sharma N, Xeroudaki M, Tabe S, Omrani R, Thangavelu M, Mukwaya A, Fagerholm P, Lennikov A, Askarizadeh F, Lagali N. Bioengineered corneal tissue for minimally invasive vision restoration in advanced keratoconus in two clinical cohorts. Nat Biotechnol. 2022 Aug 11.
Zaldivar, Roberto MD; Zaldivar, Roger MD; Adamek, Pablo MD; Cerviño, Alejandro PhD. Intraoperative adjustment of implantable collamer lens vault by lens rotation aided by intraoperative OCT. Journal of Cataract & Refractive Surgery: September 2022 – Volume 48 – Issue 9 – p 999-1003

