Dr. Juan Batlle

Entrevistado
Dr. Juan Batlle – Republica Dominicana
Coordinador
Dr. Virgilio Centurión – Brasil
Contacto
Dr. Juan Batlle – jbatlle55@gmail.com
Dr. Virgilio Centurión – centurion@imo.com.br

Entrevistado
Dr. Juan Batlle – Republica Dominicana
Coordinador
Dr. Virgilio Centurión – Brasil
Contacto
Dr. Juan Batlle – jbatlle55@gmail.com
Dr. Virgilio Centurión – centurion@imo.com.br
Dr. Eduardo Viteri – Ecuador
Contacto
eviteri@humanavision.com
El manejo del astigmatismo en cirugía de Catarata es un aspecto que tiene cada vez mayor importancia en la práctica oftalmológica, pero que todavía no alcanza los niveles de predictibilidad y exactitud ideales. Se requiere criterio, experiencia y sentido común para obtener resultados satisfactorios. A continuación algunos de las aspectos que considero más importantes en corrección astigmática con lentes tóricos.
* Debe haber congruencia entre SimK, Astigmatismo Corneal Total y Astigmatismo Total WFA en zona de 4 mm, tanto en magnitud como en meridiano.
5. Minimizo influencia de Astigmatismo inducido por la incisión, operando siempre por incisiones menores a 2.50 mm ubicadas en meridiano temporal. Debido a que el efecto de estas incisiones es mínimo y poco predecible, tanto en magnitud como en el meridiano de acción, considero que no modifica el efecto de implante de un lente tórico.
– Para calcular cuánto Astigmatismo está induciendo usted en sus casos le sugiero el vínculo http://www.doctor-hill.com/physicians/sia_calculator.htm que ofrece en forma gratuita el Dr. Warren Hill. Puede obtener tanto el aritmético como el Polar, este último requerido en la fórmula del Dr. Barret
6. Para calcular el poder del lente tórico utilizo una fórmula de última generación, como la del Dr. Barrett. Es de acceso gratuito en http://www.ascrs.org/barrett-toric-calculator y, entre otras, ofrece las siguientes ventajas:
– Permite calcular tanto el poder esférico como el cilíndrico del lente intraocular.
– Permite calcular lentes de diferentes fabricantes.
– Se puede utilizar Queratometrías diferentes para el cálculo del poder poder esférico y del cilíndrico. Por ejemplo, puede utilizar el valor K de la regla biométrica para determinar el poder esférico y el SimK del Topógrafo o Pentacam para el poder y meridiano tórico.
– Minimiza efecto de Astigmatismo Inducido por Incisión (debe utilizar Astigmatismo polar o 0.10 D)
Realiza ajuste para la cara posterior de la córnea (no es individualizado en este sentido).
– Ajusta el poder tórico para diferentes poderes esféricos, en razón de que el poder esférico del lente influye directamente en el efecto de corrección astigmática.
– Considera la posición efectiva estimada del lente para recomendar el poder tórico del lente, debido a que este factor afecta tanto la corrección esférica como la astigmática.
7. En la evaluación preoperatoria tomo una fotografía digital de segmento anterior, sobre la que se sobrepone una rejilla con el programa Goniotrans (que puede obtenerse gratuitamente enhttp://www.goniotrans.com/ ).Ya en quirófano ubico en esta imagen la orientación de referencias anatómicas (vasos sanguíneos o elementos pigmentados) para identificar el meridiano de implantación del lente.
8. En el postoperatorio realizo una evaluación de la refracción manifiesta y de la posición del lente entre la 2da y la 4ta semana. En este período ya tenemos una refracción confiable y, por otro lado, el saco capsular puede abrirse con facilidad para rotar o cambiar el lente intraocular, en caso de ser necesario.
9. Si considero que se requiere rotar el lente, consulto los siguientes recursos en Internet para establecer la dirección y extensión de la corrección.
– Toric Recalculator en http://www.recalculatortoric.com/
– Toric Result Analyzer en http://ascrs.org/toric_results_analyzer
10. Continuamente analizo mis resultados de astigmatismo total inducido utilizando análisis vectorial. Una Aplicación de mucha utilidad es EyePro, que incluye la opción de generar gráficos polares que permite tener la imagen global de poder y eje, tanto del Astigmatismo pre como del post operatorio, así como del Astigmatismo Inducido. Puede descargarse en www.edmondoborasio.com y sirve tanto para estudiar casos individuales como para obtener resultados agrupados en series.

Moderadora
Dra. María José Cosentino – Argentina
Panelistas
Dra. Ángela María Gutiérrez – Colombia
Dr. César Carriazo – Colombia
Esta Charla de Café, fue realizada en el marco de la Academia Americana de Oftalmología 2015, en la ciudad de Las Vegas.
Contacto
Dra. María José Cosentino – majose.cosentino@icloud.com
Dra. Ángela María Gutiérrez – anggutie@gmail.com
Dr. César Carriazo – ccarriazo@carriazo.com


Dr. José Miguel Varas – Ecuador
Contacto
Dr. José Miguel Varas – jm@varas.com
A continuación quiero compartir este caso de infrecuente presentación en nuestra práctica. Se trata de una paciente de 64 años de edad, con historia conocida de más de 35 años de retinosis pigmentosa. En la valoración inicial de 1981 se encontró AV mejor corregida en ambos ojos de bultos en ambos ojos. Fondo de ojo característico con presencia masiva de espículas pigmentarias, palidez de los nervios ópticos y vasos filiformes. Sus medios ópticos trasparentes, PIO dentro de límites normales.
Se presentó a la consulta en 2016 con cuadro de más de 15 días de dolor intenso en el ojo izquierdo. Había recibido tratamiento médico en otra institución con antihipertensivos tópicos (combinación de timolol + dorzolamida 1 vez al día aunque el paciente refiere uso de más de 3 veces al día en los últimos días). Tiene antecedentes de múltiples traumatismos orbitarios durante muchos años que atribuye a su falta de buena visión, sin que se conozca de ninguno relevante en los últimos años.
Al examen encontramos visión de PL y NLP respectivamente, presión 14 y 80 mmHg. En el OD, el segmento anterior tenía un examen dentro de límites normales excepto por una catarata madura, cámara anterior ¾ y el ángulo abierto. Fondo no valorable.
El OS tenía la córnea con transparencia limítrofe, luxación del cristalino en la cámara anterior acompañado de bloqueo pupilar, midriasis y cierre angular; como se describió previamente presión en 80 mm Hg.
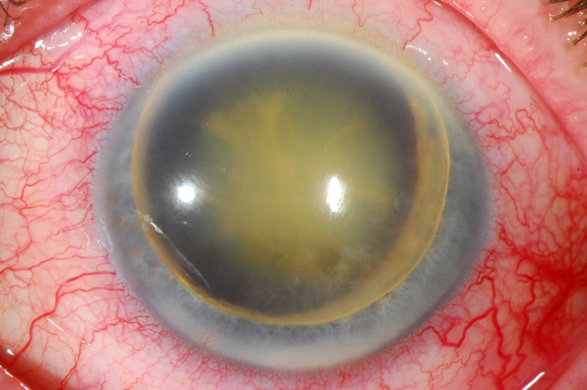
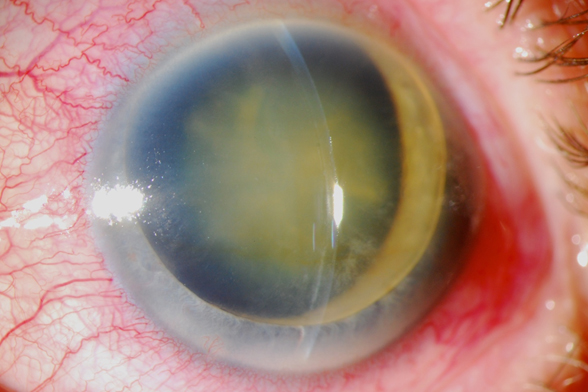
El manejo de este caso fue inicialmente aumentar el tratamiento tópico a una triple combinación (timolol+brimonidina+dorzolamida tid) y acetazolamida (250 mg tid). Reevaluación en 24 horas y programar EICC (extracción intracapsular del cristalino).
Al día siguiente con la terapia médica la presión había descendido a 55 mm Hg y se decidió programar para EICC, inicialmente se pensó en usar manitol IV, pero tras anestesia retrobulbar y balón de Honan, la PIO descendió a cerca de 40 mm Hg.
Ante esta situación no se usó manitol y se consideró eventual punción y vitrectomía mínima por la pars plana.
Inicialmente se hizo una peritomía de 10 a 2, hemostasia y túnel escleral largo hasta llegar a aproximadamente 2 mm en la córnea (se puede observar cierta tinción hemática corneal del túnel en la foto).
Al terminar la maniobra de extracción del cristalino ayudado por asa, se pudo reformar la cámara anterior fácilmente con aire y solución salina balanceada. Al tratarse de un túnel autosellante se podía palpar la normalización inmediata de la presión intraocular y la integridad de la hialoides.
Cierre con tres puntos de nylon 10-0, cierre de la conjuntiva asimismo con nylon 10-0 y se decidió postergar una iridectomía periférica ya que el túnel corneal largo dificulta la maniobra de sujeción del iris periférico para hacer la iridectomía. Por ese motivo se decidió observar cuidadosamente la potencialidad de un nuevo bloqueo pupilar.
En el postoperatorio del primer día, y tras retirar el apósito, se evidencia cámara anterior 4/4, burbuja de aire de 1 hora de menisco superior, edema corneal marcado especialmente en la porción media y superior, pupila discretamente ascendida a pesar de ausencia de vítreo en la CA y presión intraocular de 9 mmHg sin medicación tópica.
Se suspende toda la medicación antihertensiva y se continúa combinación de tobramicina + dexametasona.
Nota:
Aunque no tengo fotos aún del postoperatorio de 7d ni edición del video, lo que se trata de demostrar es que aún es posible que en casos especiales una extracción intracapsular del cristalino es una operación viable que alivia el padecimiento del paciente.
En estos casos aunque sea factible quirúrgicamente la facoemulsificación podría no ser la mejor opción, sino todo lo contrario una fuente de complicaciones de más difícil manejo como una descompensación corneal, difícil manejo de la pupila y hialoides.
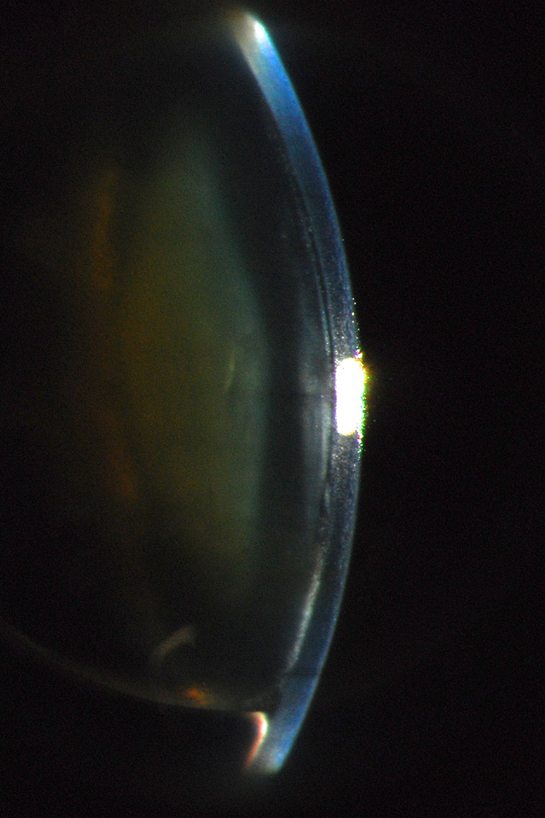
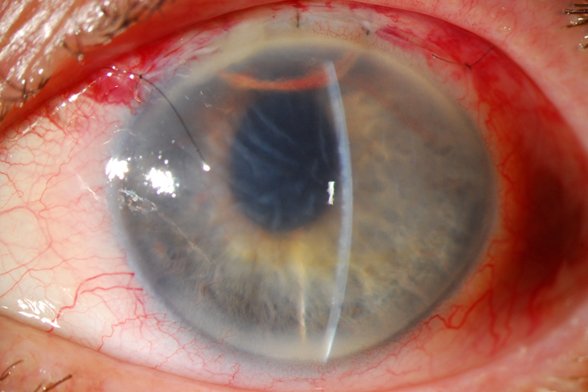
Coordinadora
Dra. Claudia Palacio Pastrana –México
Panelistas
Dra. Guadalupe Cervantes – México
Dr. Claudio Orlich – Costa Rica
Datos de contacto
Dra. Claudia Palacio Pastrana – drapalpas@hotmail.com
Dra. Guadalupe Cervantes – gpecervantes@hotmail.com
Dr. Claudio Orlich – orlichclaudio@hotmail.com
Nota: Las respuestas de la Dra. Guadalupe Cervantes, se realizaron en un equipo de tres personas, que integran el Hospital de la Ceguera (APEC). Los integrantes de este grupo son Dr. Guadalupe Cervantes, Dr. Cecilio Velasco B. y el Dr. Erick Mendoza Schuster.
PREGUNTAS
Dra. Claudia Palacio Pastrana: Mencione que método utiliza para determinar el poder corneal en un paciente al que le piensa implantar un lente tórico.
Dra. Guadalupe Cervantes: Medición de queratometrías con auto-querato-refractómetro (3 mediciones reproducibles), comparándolo además con interferometría óptica. En casos especiales agregamos topografía corneal, para valorar regularidad.
Dr. Claudio Orlich: Es indispensable realizar una topografía corneal que muestre tanto la superficie anterior de la córnea como la posterior en todo paciente que requiere cirugía de catarata. La incidencia de una ectasia posterior es baja, cerca del 0.09% de las cirugías de catarata (1) presentan un queratocono posterior, el cual puede observarse únicamente por medio de una topografìa que muestre la cara posterior o un OCT de la córnea. Un caso para un lente tórico debe tener un astigmatismo lo más regular posible, debemos descartar tanto una ectasia, como un astigmatismo irregular, ojo seco u otras anormalidades que comprometan el resultado final de la cirugía. Si la cara posterior de la topografía es normal, generalmente hacemos el cálculo de un lente tórico tomando en cuenta las queratometrías de la topografía, el IOL Master y la queratometrías del autorrefractor, que deben ser similares, si hay variaciones importantes en el eje, personalmente prefiero el eje del autorrefractor-queratómetro o de la topografía, dejando por último el dato proporcionado por el IOL Master.
Dra. Claudia Palacio Pastrana: ¿Qué importancia tiene en su práctica la curvatura posterior de la córnea y que instrumento utiliza para su medición?
Dra. Guadalupe Cervantes: Actualmente se reconoce su gran importancia, ya que puede ser un factor determinante en el LIO que será implantado.
Utilizamos topografía corneal con Orbscan o Pentacam.
Sabemos además que existen en la actualidad, nuevas tecnologías como el Cassini para medición de poder anterior, posterior y total de la córnea, pendientes de validar.
Dr. Claudio Orlich: Ante una ectasia posterior es necesario adecuar el cálculo del LIO para evitar un resultado hipermetrópico, en estos casos los valores queratométricos son sobreestimados, es decir la cara posterior tiene un poder más negativo del esperado. La relación anterior posterior (A/P ratio) normal debe ser menor a 1.19 (1), valores por encima de esto son indicativos de una ectasia posterior. Diferentes autores han descrito la importancia de la cara posterior en el astigmatismo total del paciente, Koch y colaboradores (2) encontraron en un grupo de 715 córneas de 435 pacientes que la magnitud del astigmatismo posterior en promedio es de 0.3 D. En este estudio se concluyó que los pacientes con astigmatismo con la regla pueden quedar ligeramente hipercorregidos si se toma en cuenta sólo el astigmatismo anterior de la córnea e hipocorregidos en ojos con astigmatismo contra la regla, esto generó lo que se conoce como nomograma de Baylor (3). Básicamente este estudio demostró que el astigmatismo con la regla esta sobreestimado en promedio 0.5 D y con el lente seleccionado sólo con los datos del astigmatismo anterior quedarán hipercorregidos, al contrario los casos con astigmatismo contra la regla el astigmatismo está subestimado en 0.25 D y el paciente queda hipocorregido. Por esto hay quienes le restan 0.5 D al cilindro cuando está con la regla y le agregan 0.25 D al cilindro cuando está contra la regla. En general el impacto de la cara posterior en la gran mayoría de los pacientes con córneas sanas será poco significativo
desde el punto de vista clínico, son los casos anormales con datos de ectasia posterior los que realmente tienen un impacto en el cálculo del LIO y son a estos a los que debemos prestarles mayor atención. Es importante en estos casos introducir el poder total de la córnea dentro de la fórmula utilizada para calcular el LIO y no utilizar sólo los datos queratométricos de la cara anterior.
Dra. Claudia Palacio Pastrana: En el caso de pacientes con queratocono y catarata ¿Qué criterios considera para tener el mejor resultado visual y en qué casos implanta un lente con toricidad?
Dra. Guadalupe Cervantes: Que la córnea sea transparente, que no presente queratometrías extremas, que se demuestre estabilidad y que exista concordancia en las mediciones entre las diferentes tecnologías usadas.
Implantaría LIO tórico en aquellos casos que NO haya irregularidad extrema, sabiendo que los resultados postoperatorios pueden presentar sorpresas refractivas.


Dr. Claudio Orlich: En queratocono y catarata, si el paciente ve bien con un anteojo (el astigmatismo se corrige bien con el cilindro del lente), es posible colocarle un lente tórico, algunos conos tienen un astigmatismo muy simétrico y podrían ser candidatos a un lente tórico, sin embargo si el paciente presenta un astigmatismo irregular, no ve bien con gafas, que son la mayoría de los queratoconos, el lente tórico está contraindicado. Recordemos que un paciente con queratocono al cual le colocamos un lente tórico y luego requiere de un lente gas permeable para corregir el astigmatismo corneal, se le manifiesta el cilindro del lente intraocular al usar el lente de contacto, haciendo muy difícil corregir la refracción del paciente, es preferible en un queratocono con catarata con astisgmatismo irregular utilizar un lente monofocal no tórico.
Dra. Claudia Palacio Pastrana: En un paciente que se someterá a cirugía de catarata y presenta un astigmatismo regular de 6.5 dioptrías con queratometrías de 41.00×0° y 46.50×90° ¿Cuál sería su propuesta quirúrgica? Y explique la razón de su elección
a. Facoemulsificación con implante de lente tórico
b. Femtoláser+Facoemulsificación + implante de lente tórico
c. Femtoláser+Facoemulsificación + incisiones relajantes + lente monofocal
d. Femtoláser+ Facoemulsificación + incisiones relajantes + lente tórico
e. otro
Dra. Guadalupe Cervantes: Si es regular, central y estable, haría femto- faco y LIOtórico, sabiendo que en la actualidad tenemos disponibilidad de LIOs tóricos, con correcciones astigmáticas de esa magnitud. (Zeiss)
Dr. Claudio Orlich: Un lente tórico es mucho más predecible y estable a largo plazo que unas incisiones relajantes, en este caso con 6.5 D de cilindro regular le implantaría un lente intraocular AT TORBI 709M/MP de Carl Zeiss, con una óptica bitórica que corrige cilindros de hasta 12 D en incrementos de 0,5 D.
Presentado Por
Juliana Atabe Administradora, postgrado en gestión de proyectos, con MBA en Gestión Estratégica y coordinadora administrativa de Lanna Oftalmología Especializada en Cirúrgica.
Contacto
juliana.atabe@clinicalanna.com.br
¿Ha observado si todo está funcionando perfectamente en su empresa (consultorio, clínica, hospital)? ¿Cree que todo está como le gustaría? Si su respuesta fue no, ha llegado el momento de revisar sus procesos.
En general, decidimos cambiar cuando algo sale mal. Pero, ¿es este el momento adecuado para cambiar? ¿Podemos ver todas las fallas posibles que existan en aquella actividad?
La reingeniería de procesos es una herramienta para repensar los procesos de una empresa y obtener mejor rendimiento y eficacia. En este contexto, presentamos una manera sencilla de promover cambios.
La idea es dividir en cinco pasos para alcanzar mayor eficiencia en sus rutinas diarias.
Paso 1: Estructurar
En este paso, estructuramos las acciones futuras que deben realizarse y las prioridades. Definir cómo y por dónde empezar.
Para enumerar las prioridades, trate de formular preguntas como: ¿Con qué no estoy satisfecho? ¿Qué podría mejorarse?
Paso 2: Identificar cómo está
Después de establecer las prioridades, se analizará la situación actual, cómo se llevan a cabo las actividades, identificar errores, riesgos, gaps y posibles oportunidades de mejora. Para ello, se debe involucrar a los empleados. El conocimiento y la participación de los empleados son fundamentales, ya que son ellos quienes realizan las actividades.
Paso 3: Planificar cómo será
Una vez conocido el escenario, se deben planificar los cambios y establecer cómo deben realizarse las tareas.
En esta etapa es importante definir cuándo y cómo se aplicará la forma de difusión de la información a los involucrados y las herramientas de registro de las nuevas rutinas.
La elaboración del diagrama de flujo ayuda a visualizar el futuro de las actividades y las posibles desviaciones antes de ponerlas en marcha, buscando la simplificación del trabajo. Crear documentos y normas que contengan la información de las acciones realizadas.
Paso 4: Implementar
Se refiere a la implementación de los nuevos procesos, normas y actividades. Siempre tratando de monitorear la ejecución para posibles ajustes y mejoras. En esta etapa, es de suma importancia la comunicación y la formación de todas las partes involucradas para adaptarse a los nuevos procedimientos.
Paso 5: Cuantificar los resultados
Lo importante de esta etapa es analizar si efectivamente el plan ha dado resultado. Evaluar el desempeño final comparándolo con el escenario anterior. Buscar la retroalimentación de los empleados y confirmar la observancia de los involucrados. El seguimiento debe ser continuo para ajustar y asegurar que toda acción no sea en vano.
Con esto, podemos concluir que la reingeniería de procesos nos permite rediseñar nuestra forma de trabajar para lograr un gran progreso, ya que facilita el control de las rutinas operacionales, la eliminación de etapas innecesarias, la mitigación de errores, la estandarización de la información e inclusive la reducción de los costos. Además, podemos proporcionar satisfacción al cliente, que hoy en día es una ventaja competitiva en el mercado de la salud.
Es hora de poner en práctica.
Moderadora
Dra. María José Cosentino – Argentina
Panelistas
Dra. Ximena Nuñez – Colombia
Dr. Marcony Santhiago – Brasil
Datos de contacto
Dra. María José Cosentino – majose.cosentino@icloud.com
Dra. Ximena Nuñez – ximena@visionsana.com
Dr. Marcony Santhiago – marconysanthiago@hotmail.com


Entrevistado
Mr. John Marshall PhD – Speaker Avellino Laboratory
Entrevistador
Dra. María José Cosentino – ALACCSA-R
El Prof. Dr. John Marshall y la Dra. María Jose Cosentino discuten un avance tecnológico sin precedentes en la medicina personalizada para la seguridad de la cirugía refractiva. En esta entrevista, el profesor Marshall explica por qué cree que todo paciente que planea someterse a la cirugía refractiva corneal, debe ser avalado con la Prueba Universal de Avellino.
Los primeros signos de distrofia corneal pueden ser sutiles y es fácil perderse durante la evaluación de aceptación para la cirugía refractiva. Sin embargo, los pacientes con ciertas formas de distrofia corneal no deben
someterse a la cirugía refractiva corneal electiva, por que acelera la progresión de estos trastornos. La prueba universal Avellino es una prueba de ADN simple y no invasiva que utiliza material genético obtenido de un hisopo bucal para detectar cinco distrofias corneales autosómicas asociadas a TGFBI dominante. Estas distrofias incluyen la Distrofia Granular Corneal Tipo 1, Distrofia Granular Corneal Tipo 2 (Distrofia de Avellino), clásico enrejado de Distrofia Corneal Clásica de Lattice ó reticulado, Distrofia Corneal de Thiel-Behnke y Distrofia Corneal de Reis-Buckler. En los ensayos clínicos,se ha demostrado que la prueba es 100% sensible y 100% específica. La entrevista también se orienta hacia la posibilidad de detectar previamente la incidencia de haze en un paciente o la posibilidad de desarrollar alguna alteración bioestructural previo a la cirugía propiamente dicha.

Presentado por:
Dr. Arnaldo Espaillat Matos
Contacto
arnaldo@espaillatcabral.com
7. El uso de antibióticos inyectados en la cámara anterior al finalizar la cirugía de catarata, como una medida de profilaxis para la endoftalmitis, comenzó a tener gran debate en la comunidad científica internacional luego del estudio publicado por la Sociedad Europea de Cirugía de Catarata y Refractiva en el año 2007. 12 Ese estudio reportaba una reducción de 5 veces en la posibilidad de que ocurra una endoftalmitis postquirúrgica al usar la cefuroxima en la cámara anterior. Otro gran estudio realizado en los Estados Unidos en 16,264 cirugías de catarata en donde se usó cefuroxima, moxifloxacina o vancomicina, también demostró una reducción importante en la incidencia de endoftalmitis postquirúrgica. 13 Este mismo estudio recomienda no utilizar la vancomicina como medicamento de primera línea para evitar el riesgo de desarrollo de resistencia bacteriana. 13
8. Al mismo tiempo, también existen estudios que no encuentran diferencias estadísticamente significativas en cuanto a la incidencia de endoftalmitis entre casos tratados y no tratados con antibióticos inyectados en la cámara anterior al momento de finalizar la cirugía. 14,15
9. Hay que mencionar que existen algunas ventajas potenciales de inyectar antibióticos en la cámara anterior para prevenir la endoftalmitis: 1) se consiguen mayores niveles de concentración del medicamento en el sitio diana, 2) se disminuyen los problemas que pueden existir en algunos pacientes para cumplir con la aplicación correcta de las gotas y su frecuencia adecuada. La literatura científica publicada apoya la seguridad del uso intracameral de vancomicina, moxifloxacina y varias cefalosporinas en cuanto a no producir inflamación y/o toxicidad, siempre que sean usadas en las concentraciones correctas. 16 En todo caso, aunque el cirujano decida usar antibióticos intracamerales al final de la cirugía de catarata, esto siempre debe estar acompañado de la aplicación de Povidona Yodada previo al inicio de la cirugía, debido a la evidencia existente a su favor. La aplicación de la Povidona Yodada no diluida debe ser en los tejidos perioculares, así como una copiosa irrigación en una concentración diluida al 5 o’ 10% sobre la superficie ocular y en los fondos de sacos conjuntivales. 1,6
10. Igualmente, resultan de importancia tratar infecciones o alteraciones previas presentes en los párpados como blefaritis, además de cubrir el borde de los mismos con los campos quirúrgicos de plástico para aislarlos lo más posible del contacto con las zonas de entrada a la cámara anterior. Así mismo, si se tiene duda de la completa hermeticidad de una incisión corneal es mejor colocar un punto de sutura que la selle definitivamente.

Coordinadora
Dra. Guadalupe Cervantes – México
Contacto
gpecervantes@hotmail.com
Alaccsa-R lo invita a participar del siguiente caso de catarata y a enviar sus respuestas al correo jrodriguez@clatinmedia.com. En nuestra próxima edición tendremos algunas respuestas publicadas en nuestro Noticiero Interactivo y nuestra página web.
Entidad poco frecuente, caracterizada por un marcado adelgazamiento de la cápsula posterior en su parte central. Las fibras cristalinianas, como consecuencia, protruyen hacia atrás, se desorganizan y se opacifican, dando por consiguiente, una catarata central, habitualmente no mayor de 3 mm. Los pacientes cursan con alteraciones visuales, y aberraciones de alto orden (pérdida asfericidad) y tendencia a miopización y astigmatismo irregular. Generalmente se trata, cuando la opacidad es mayor de 3mm en forma bilateral, o más pequeña en forma uniocular, para evitar la deprivación por ambliopía. El manejo quirúrgico representa un reto, especialmente durante las maniobras de hidrodisección, aspiración de la catarata y restos corticales. El diagnóstico se realiza entre los 3 y los 15 años. Son signos característicos el patrón en ¨gota de aceite¨ durante retroiluminación cristaliniana y las sombres en ¨tijera¨ del reflejo de fondo durante la esquiascopia. El pronóstico visual es satisfactorio si se trata en forma temprana.
PREGUNTAS
Conociendo las alteraciones que presenta esta patología a nivel cristaliniana,
(cápsula posterior):
¿Cómo realiza la separación de la corteza cristaliniana de la bolsa capsular (hidrodelaminación vs hidrodisección) y la aspiración de la corteza?
¿Qué técnica utiliza para efectuar la capsulorrexis posterior?
¿Realiza algún otro ajuste en su técnica quirúrgica en estos casos?
Resolución
Dra. Guadalupe Cervantes
Técnica quirugica: es importante usar Azul de Tripan para buena visualización y para lograr cambios estructurales de cápsula, permitiendo desgarro de la misma en forma adecuada.
Proscrita la hidrodiseccion por la delgadez capsular posterior en zona afectada. Se debe hidrodelaminar, para evitar estallamiento capsular con luxación del núcleo a cavidad vítrea.

La aspiración cortical debe realizarse en forma equatorial sin acercarse a la zona de adelgazamiento.
Realizar un ojal capsular posterior en zona de grosor normal, inyectando viscoelastico dispersivo en espacio de Berger, rechazando la hialoides anterior. La capsulorrexis circular continua efectuarse por fuera del borde limítrofe, entre la cápsula normal y la adelgazada.