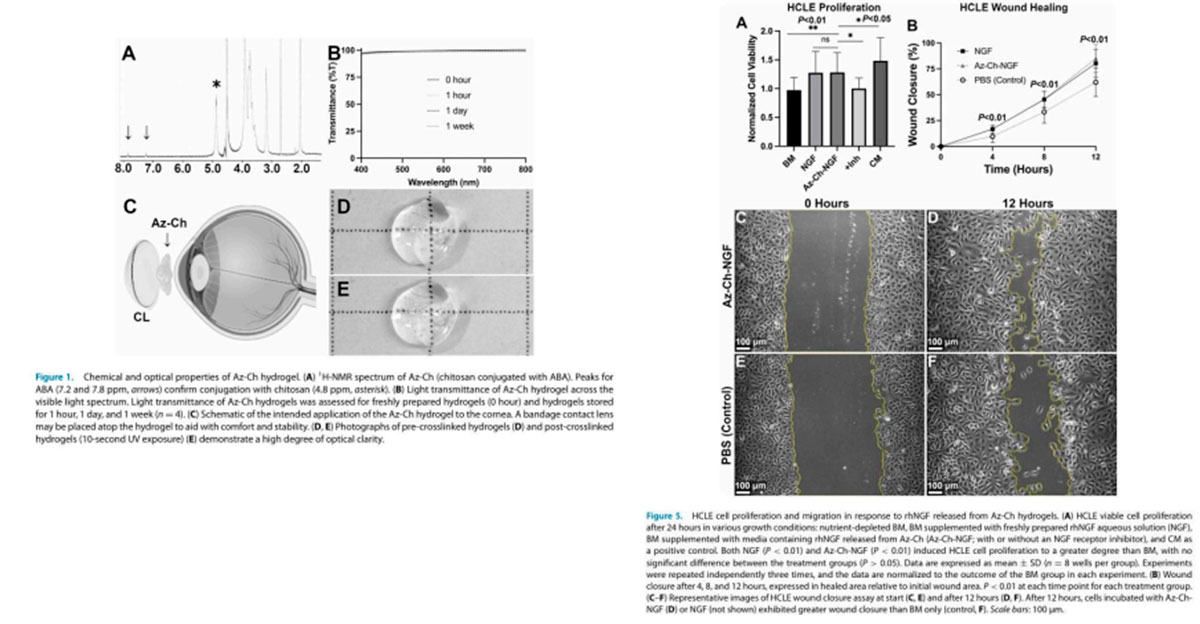
escribimos consejos útiles y prácticos para la cirugía de pterigión, cómo utilizar el pegamento de fibrina y la técnica de burbujas de aire.
Consejos para la cirugía de pterigión
Anestesia y marcaje
Antes de la cirugía, se puede instilar un colirio de tartrato de brimonidina de 1 mg/ml para reducir la hiperemia conjuntival. Sugerencia: cirugía, con sedación, bajo anestesia tópica utilizando: clorhidrato de proximetacaína 5mg/ml, y gel de xilocaína 2% (el gel ayuda mucho en la anestesia de la mucosa conjuntival y un poco en los párpados, para que el paciente sienta el blefarostato menos incómodo). La elección del blefarostato es importante en esta cirugía, ya que una exposición adecuada facilita la cirugía. Tenemos preferencia por instrumentos que no están articulados, pero que promueven una buena exposición. (Figura 5A-D)
Figura 5A y B – 2 estilos de marcado, uno en la cabeza del pterigión y el otro rectangular; 5C y 5D: inyección subconjuntival de anestésico con vasoconstrictor

Escisión de pterigión
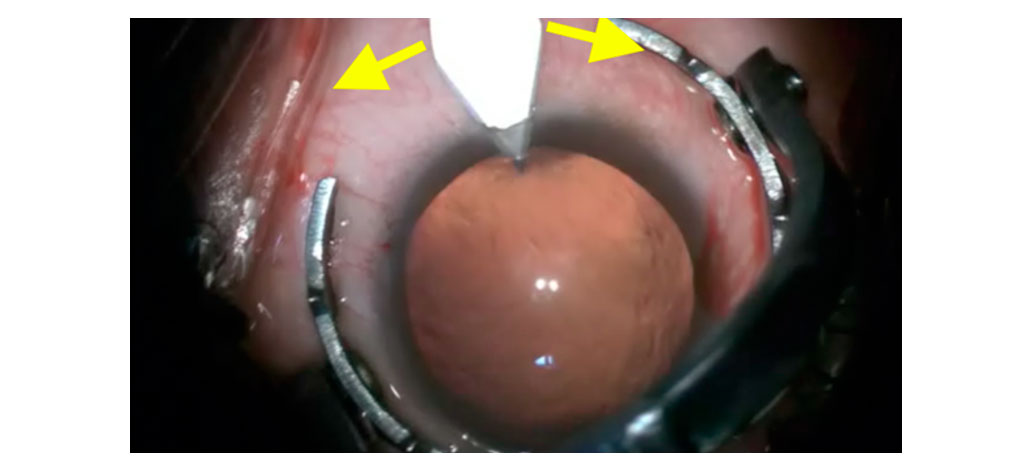
Se puede realizar según la técnica del cirujano, pero nuestra técnica de elección consiste en extirpar la cabeza del pterigión tirando, introduciendo las tijeras por debajo de la cabeza del pterigión y traspasando completamente la cabeza del pterigión, luego con el movimiento de rotación de las tijeras (cerradas), realizamos la extracción del pterigión.

Figura 6 – Desgarro de la cabeza del pterigión
Los residuos fibróticos se pueden eliminar con una hoja de bisturí nº 15, o utilizó una solución salina al 0,9% para hinchar la región y eliminarla al final, con la misma cuchilla corneal o cepillo.
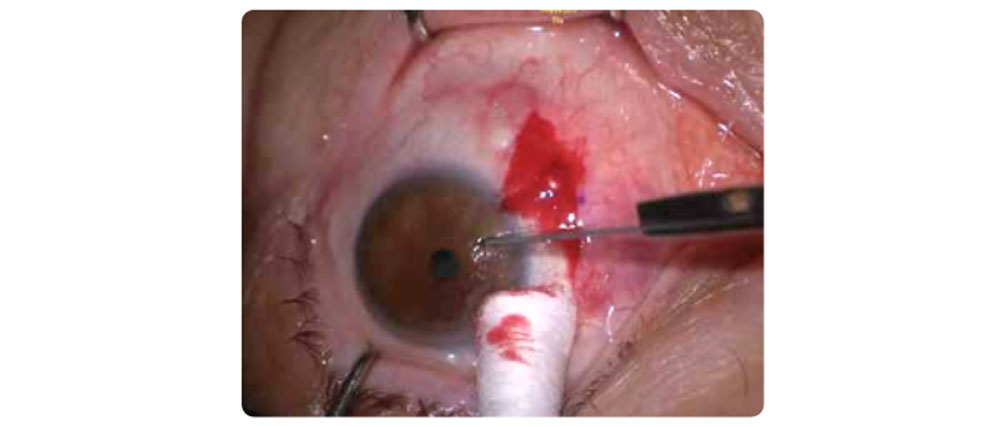
Figura 7 – Extirpación de la fibrosis corneal
En algunos casos podemos optar por la extirpación en “semirrexis”; Tirando de la cabeza del pterigión en un movimiento similar al de una rhexis, para un desprendimiento total.

Figura 8 – Plumaje de semirrexis
En casos de pterigión recurrente, presencia de obstrucción del Lasik, cicatrices de queratotomía radial, sugerimos realizar delaminación (en algunos casos se puede aplicar alcohol al 20% en la región para facilitar la desepitelización). Nos gusta desepitelizar un poco antes del final de la cabeza del pterigoideo para facilitar el plano de corte, siempre con la hoja lo más paralela posible a la córnea, manteniendo el mismo plano (sin profundizar) para evitar daño corneal.
Figura 9 – Desepitelización antes de la cabeza del pterigión
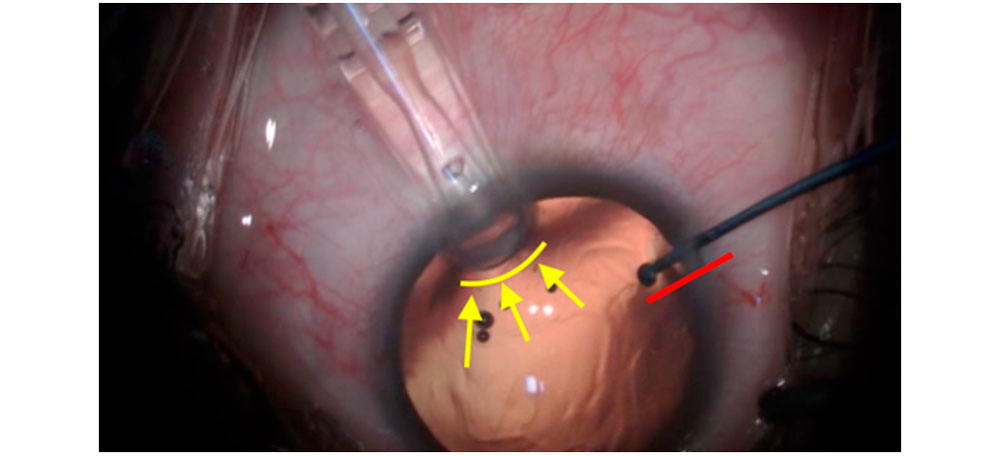
Fibrosis y espiga engrosada sugerimos retirar con cuidado, evitando vasos grandes, músculo recto medial y posibles grasas, siempre con tijeras y colibríes en un plano alejado de estas estructuras, teniendo especial cuidado con la región cercana al limbo, porque si la fibrosis permanece en esta región, la posibilidad de recurrencia aumenta
Figura 10 – Tenga cuidado con la región cercana al limbo y evite siempre la proximidad a grandes vasos, grasa y músculo recto medial. Cotonete para ayudar con la disección.
La disección se puede realizar con un bastoncillo de algodón para facilitar la separación de la fibrosis y la espiga. Tras este paso, podemos dejar un trozo de bastoncillo de algodón humedecido con anestésico con vasoconstrictor debajo de la conjuntiva para ayudar en el proceso hemostático, sin olvidar retirarlo antes de la adherencia del injerto conjuntival.

Figura 11 – El injerto conjuntival es siempre lo más delgado posible. Ideal siempre para marcar (con cola de fibrina 2 mm más)
Técnica de burbuja de aire: utilizando una jeringa de 1 ml, con una aguja de insulina del calibre más pequeño posible, tire del émbolo para acumular aire dentro de la jeringa. Coloque el ojo hacia abajo para obtener un campo más grande de la conjuntiva superior, use con cuidado unas pinzas en una mano e inserte la aguja cerca del limbo, dirigida hacia arriba lo más superficialmente posible, con el bisel hacia arriba. Evite hacer otros agujeros y perforar la conjuntiva en otros lugares. Aspire el émbolo para comprobar que no está aspirando sangre y, con moderación, inyecte 0,1 ml de aire. Sugiero que la dirección de la aguja sea temporal superior o 90 grados o posición “mediodía”, de esta manera diseccionará todo el sitio del injerto. Aparecerá enfisema subcutáneo separando la conjuntiva de la espiga. Si tienen agujeros, inserte la jeringa en otro lugar; En caso de enfisema severo, se puede aspirar el exceso de aire.

Figura 12 – Técnica de burbujas de aire paso a paso
Uso de Cola de Fibrina
TÉCNICA DE COLA DE FIBRINA
Sugerimos utilizar jeringas separadas para cada componente, y, si es posible, agujas de insulina en lugar de las cánulas de los productos, así tenemos un mayor control de la aplicación del pegamento. Tenga cuidado al aplicar el pegamento, también le sugerimos que tire del émbolo para evitar una presión excesiva, y solo unas gotas son suficientes.
Las técnicas de adherencia del injerto son el deslizamiento o el volteo. Sugerimos pinzas más delicadas en este paso
Inclinar
Dejamos la hace estromal del injerto para cima y hace epitelial para bajo
Limbo del injerto cerca del limbo del lecho escleral, colocando un componente en el lecho estromal del injerto y otro en el lecho escleral.
Hacemos rebotar el estroma boca abajo, dejándolo en contacto con el lecho escleral, con la cara epitelial hacia arriba, por lo que el pegamento empieza a hacer efecto cuando los 2 componentes entran en contacto. Tenga cuidado con el movimiento de la mano, no puede ser demasiado ancha (alta) de lo contrario, el injerto puede doblarse.
Deslizamiento
Dejamos la cara estromal del injerto hacia abajo y el epitelial hacia arriba
Limbo del injerto alejado del limbo del lecho escleral, colocando ambos componentes de la cola sobre el lecho escleral
Deslizamos el injerto, colocándolo correctamente.

Figura 13. Figura esquemática de las 2 técnicas
A – Listado
B – Deslizamiento
Figura 13 – Técnicas de vuelco y deslizamiento
En ambas técnicas, el posicionamiento es cuidadoso, utilizando un instrumento para posicionar y otro para presionar el injerto, evitando desplazamientos.
Podemos presionar (“alisar”) el injerto para eliminar el exceso de líquido y facilitar la adherencia.
Figura 14 – Técnicas de vuelco y deslizamiento
Figura 15 – Presionando el injerto y colocándolo con otro instrumento, se debe tener especial cuidado con los ángulos cercanos al limbo
También podemos hacer un orificio central en el injerto para evitar la acumulación de sangre y líquido seroso.
Figura 16 – Orificio central en el injerto
Por último, comprobamos que el injerto no avanzaba sobre la córnea, y eliminamos el posible exceso de injerto y cola de fibrina.
Figura 17 – Evitar el avance del injerto corneal
Finalmente podemos:
Figura 18 – Conjuntiva superior aproximada para evitar granuloma piógeno
Utilizar los 2 componentes del pegamento sobre la herida quirúrgica, con el fin de reducir el dolor postoperatorio, funcionando como una lente de contacto terapéutica según el trabajo de Feltrin el at.
Figura 19 – Ambos componentes de cola na córnea
En las primeras cirugías con cola de fibrina, sugerimos suturas epiesclerales por seguridad.
Figura 20 – Suturas epiesclerales en las primeras cirugías

Referencias
Faria, F.: Pinguécula, Pterígio e Conjuntivite lenhosa. In: Manual de biomicroscopia da conjuntiva. 1. ed, São Paulo: Santos, pp. 141-144, 1989.
Cameron M. Pterygium through the world. Baltimore: Charles C. Thomas, 1965.
Dushku N, Reid TW. Immunohistochemical evidence that human pterygia originate from an invasion of vimentin-expressing altered limbar epithelial basal cells. Curr Eye Res, 1994; 13:473-81.
Dushku N, Mollykutty KSGRT. Pterygium pathogenesis: corneal invasion by matrix metalloproteinase expressing altered limbal epithelial basal cells. Arch Ophthalmol, 2001; 119:695-9.
Elliott R H. The etiology and pathology of pterygium. Trans Ophthalmol Soc Aust, 1966; 25:71-5.
Li DQ, Lee SB, Gunja-Smith Z. Overexpression of collagenase (MMP-1) and stromalysin (MMP-3) by pterygium head fibroblasts. Arch Ophthalmol, 2001; 119:71-4.
Hilgers JHC. Pterygium: its incidence, hereditary and etiology. Am J Ophthalmol, 1960; 50:635-43.
Jacklin HN. Familial predisposition to pterygium formation: a report of a family. Am J Ophthalmol, 1964; 54:481-2.
Tranjan Neto A; Alves MR; José, NK. Alterações topográficas corneanas desencadeadas pelo pterígio. Arq Bras Oftalmol, 1996; 59:443-7.
Oldenburg JB; Garbus J; McDonnell JM; McDonell PJ Conjunctival pterygia. Mechanism of corneal topographic changes. Cornea, 1990; 9:200-4.
Alves MR. Pterígio. In Gomes JAP, Alves (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica 2011, p. 115-21.
Cunha R. Transplante autólogo de conjuntiva com ou sem limbo. In Gomes JAP, Alves (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica 2011, p. 127-30.
Felberg S. Adesivos biológicos na cirurgia de pterígio. In. In Gomes JAP, Alves (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica 2011, p. 133-137.
Alves MR, Potério MB. Uso intraoperatório de Mitomicina C. In Gomes JAP, Alves MR (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica, 2011. p.124-26.
Pires RTF, Pires JLTF, Tseng SCG. Transplante de membrana amniótica. In Gomes JAP, Alves MR (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica, 2011. p.131-33.
Alves MR. tratamento cirúrgico do pterígio. In Alves MR, Kara-José N (eds). Conjuntiva cirúrgica. São Paulo. Roca. 1999. p. 69.
Alves MR. Esclera exposta, fechamento conjuntival simples e por rotação de retalho conjuntival. In Gomes JAP, Alves MR (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica, 2011. p.119-121.
Tananuvat N, Martin T. The results of amniotic membrane transplantation for primary pterygium compared with conjunctival autograft. Cornea 2004; 23: 458-63.
Alves MR Mitomicina C. In Gomes JAP, Alves MR (eds), Superfície Ocular, Rio de Janeiro. Cultura Médica, 2011. p.123-24.
Tan DT, Chee SP, Dear KB, Lim AS. Effect of pterygium morphology on pterygium recurrence in a controlled trial comparing conjunctival autografting with bare sclera excision. Arch Ophthalmol 1997;115:1235-4
Feltrin de Barros G, Susanna BN, Brito L, Lima VL, Moscovici BK. Results of Fibrin Glue Applied Over the Corneal Surface Immediately After Pterygium Surgery: A Novel Pain Relief Technique. Cornea. 2023 Oct 1;42(10):1327-1331.
Moscovici BK, Rodrigues PF, Freitas MMS, E Silva FB, Felberg S, Dantas PEC. Donor graft harvesting with air in pterygium surgery. Eur J Ophthalmol. 2022 Sep;32(5):3103-3109.
Moreno CB, Cruz JCG, Soares PVB dos S, Barboza GNC, Barboza LRC, Barboza MNC, et al.. Analysis of the thickness of conjunctival autograft in pterygium surgery with the Moscovici dissection technique compared with manual dissection. Rev brasoftalmol [Internet]. 2023;82:e0042. Available from: https://doi.org/10.37039/1982.8551.20230042








 Coordinador:
Coordinador:




 Dr. Carlos Palomino Bautista
Dr. Carlos Palomino Bautista

 Dr. Luis Real
Dr. Luis Real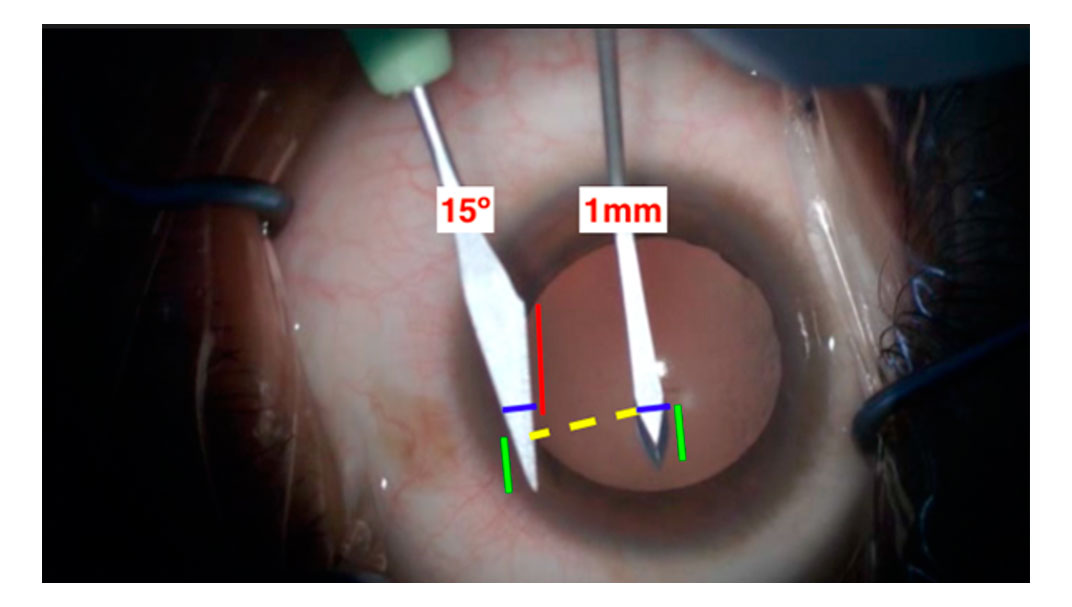
 Dr. Bernardo Kaplan Moscovicil
Dr. Bernardo Kaplan Moscovicil