Los resultados refractivos después de cirugía de catarata han mejorado enormemente. Avances tecnológicos en la evaluación pre-operatoria como la biometría óptica para determinar la longitud axil, los topógrafos, tomógrafos y queratómetros para determinar el poder corneal y las fórmulas de última generación han mejorado los resultados considerablemente.
En una presentación magistral en la reunión del ASCRS del 2017 en Los Angeles, CA, Warren Hill mostró los resultados refractivos después de cirugía de catarata en ojos normales de los registros de Inglaterra, Alemania, Suecia y de Estados Unidos encontrando un resultado de +/- 0.50 dioptría (D) entre el 55-80% de +/- 1.0 D entre el 85-98%. Tabla1.
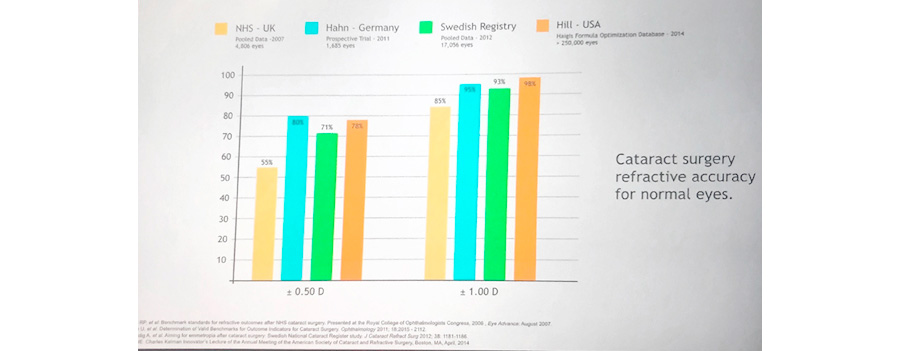 Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)
Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)
Sin embargo, con el advenimiento de los lentes “premium”, la necesidad de resultados precisos son esenciales para permitir un correcto funcionamiento de estos lentes. Por lo tanto la “sorpresa refractiva” es un reto para todo cirujano de cataratas.
Con base en esto formulamos 3 preguntas imprescindibles en el manejo de las sorpresas refractivas.
Preguntas
Dr. José Miguel Varas
¿Debo modificar la fórmula dependiendo del tipo de lente que voy a implantar?
- Si
No
Comentarios:
Salvo que se trate de un fáquico o el cálculo de un caso de polipseudofaquia el cirujano no debería cambiar la fórmula.
Sería más adecuado que el cirujano se decante por una única fórmula que haya demostrado un buen desempeño a lo largo del espectro según la longitud axil. Si el cirujano cambiase la fórmula sin aplicar un método sólo recordará los casos que se ajusten a sus decisiones (sesgo cognoscitivo).
Existen publicaciones que respaldan el desempeño amplio de ciertas fórmulas de ojos con longitud axil menor de 22 mm y mayor de 25 mm. (Barrett Universal II, Olsen, HillRBF, Kane, etc.) Sin embargo, el usuario no siempre usa la metodología del estudio publicado; es decir, si el estudio se hizo usando las variables obtenidas de un biómetro x (queratometría, profundidad de la cámara anterior, espesor del cristalino, longitud axil), resulta que la variabilidad de la magnitud y astigmatismo leído por diferentes fuentes (especialmente las queratométricas) podría resultar en resultados equívocos o desempeño diferente de las fórmulas.
Cada cirujano debe auditar cuidadosamente el método biométrico y adaptarlo a la fórmula que mejores resultados obtenga a lo largo del espectro fenotípico.
Hay que recordar que la mayoría de los casos que enfrentamos a diario están dentro de la zona de mayor predicción (ojos de 22-25 mm de longitud axil, queratometrías de 42 a 46), a medida que nos alejamos de la media debemos esperar mayor variabilidad.
Dr. David Flikier
1)¿Debo modificar la fórmula dependiendo
del tipo de lente que voy a implantar?
- Si
No
Comentarios:
La respuesta general es NO, con ciertas excepciones. Las fórmulas no funcionan mejor o peor de acuerdo al lente que están calculando (en realidad esto no lo hacen, varían la constante A, o sea la estimación de la posición de la posición efectiva del LIO), si no a las variables biométricas que le introducimos, y por lo tanto algunas fórmulas funcionan mejor o peor en ciertos tipos de ojos, más largos, más cortos, con cámaras más grandes o más estrechas, con cristalinos más grandes o más pequeños, o con combinaciones de todas estas variables, pero en general no es el lente intraocular en sí el que define si la fórmula funcionará mejor o peor. Ahora, hay lentes que usamos en ojos más pequeños, ojos hipermétropes, como los multifocales, porque van mejor que en ojos miopes, por lo que las fórmulas para estos ojos van un poco mejor, que para ojos muy miopes. Pero no es el lente en sí, sino por las características de los ojos. El otro punto que influye indirectamente es que la constante A que utilizamos, idealmente debe estar optimizada para la fórmula que utilizamos, para mejorar nuestros resultados con la población que trabajamos y con la fórmula específica.
Dr. José Miguel Varas
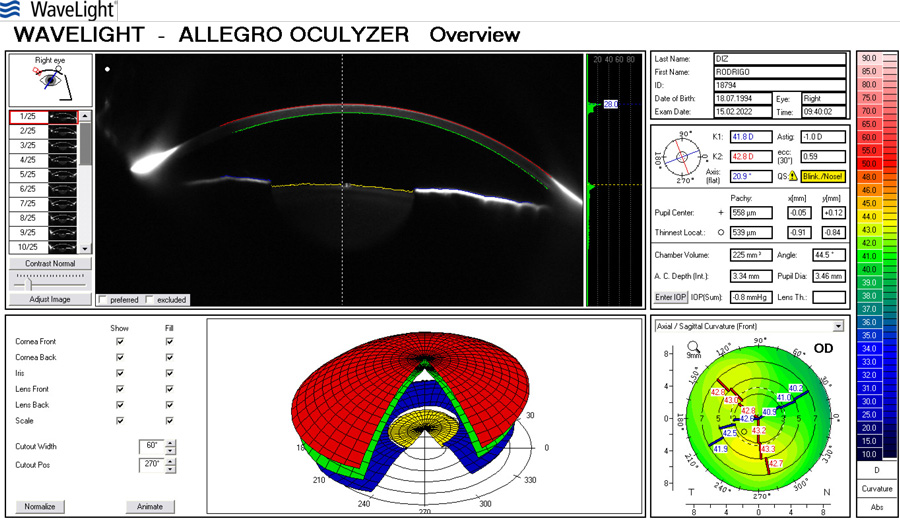
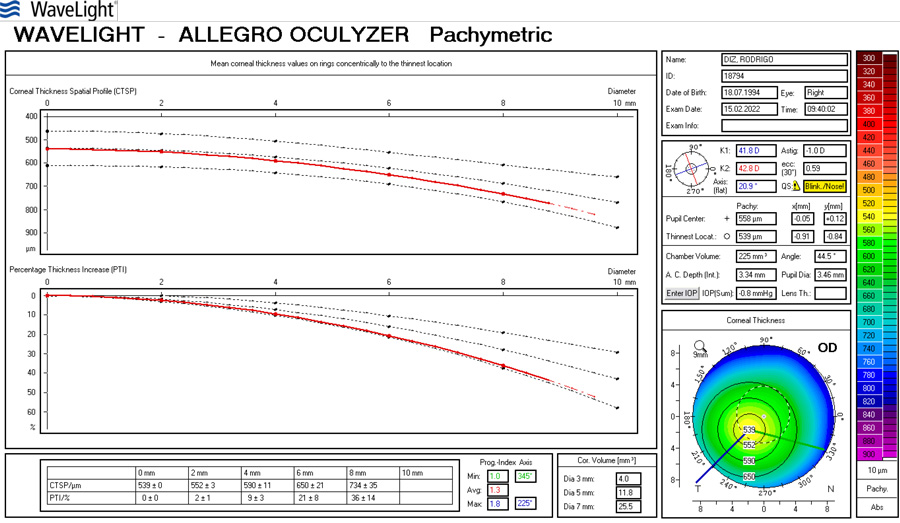
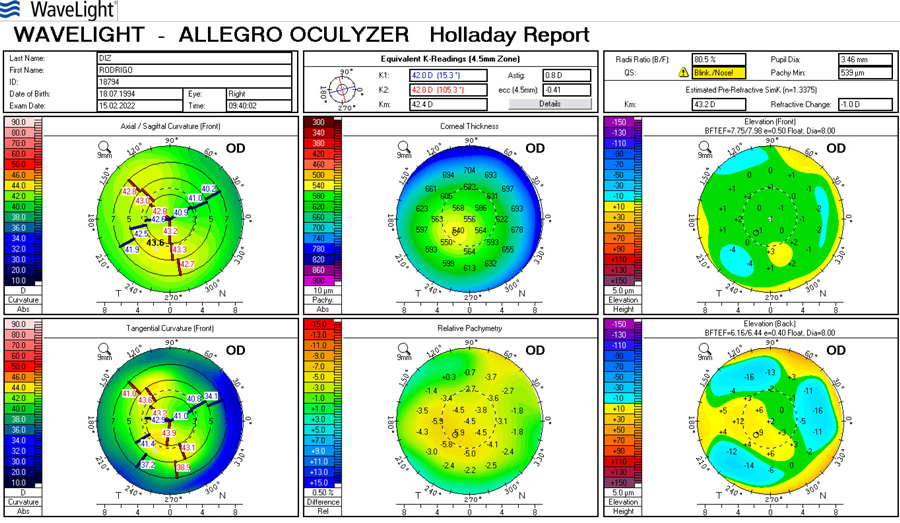
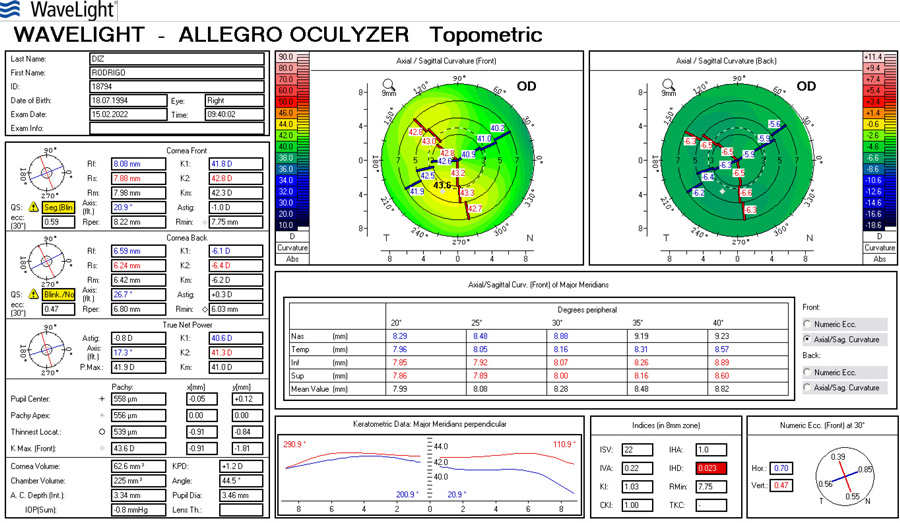
Paciente de 65 años con implante de lente multifocal esférica. Su queratometría preoperatoria era esférica. Llega en el post-operatorio con un astigmatismo refractivo y queratometrico residual de 1.25 D (plano -1.25x 180) corrigiendo a 1.00 con anteojos. A esta paciente:
- Le cambio la lente por un lente tórico:
- Le hago unas incisiones relajantes (queratotomía astigmática) en el eje más curvo:
- Le hago Lasik/PRK:
Merece explicación especial
Comentarios:
It does not compute. Es la respuesta que algunos computadores dan cuando hay un error por algo inusual. Habitualmente cuando la diferencia queratométrica entre el meridiano plano y el meridiano curvo es cero (queratometría esférica), el paciente se refracta con un astigmatismo contra la regla de aproximadamente 2/3 a ¾ de dioptría.
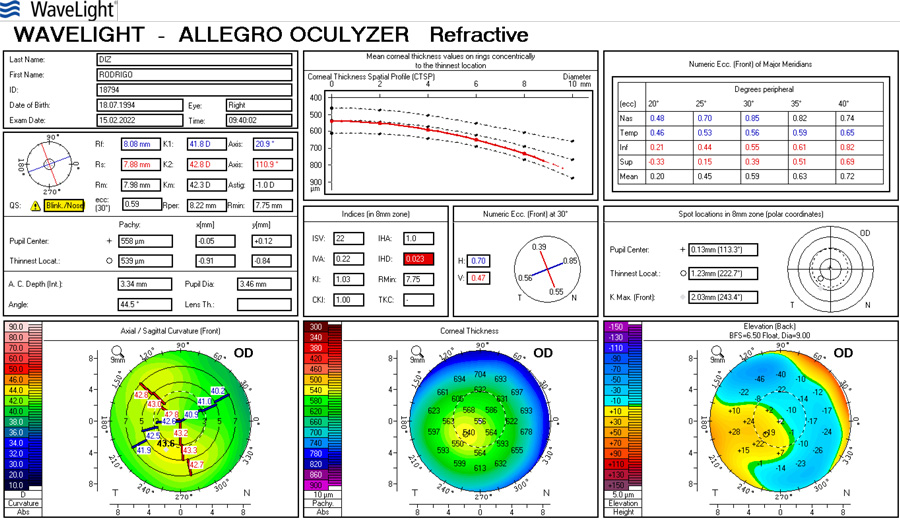
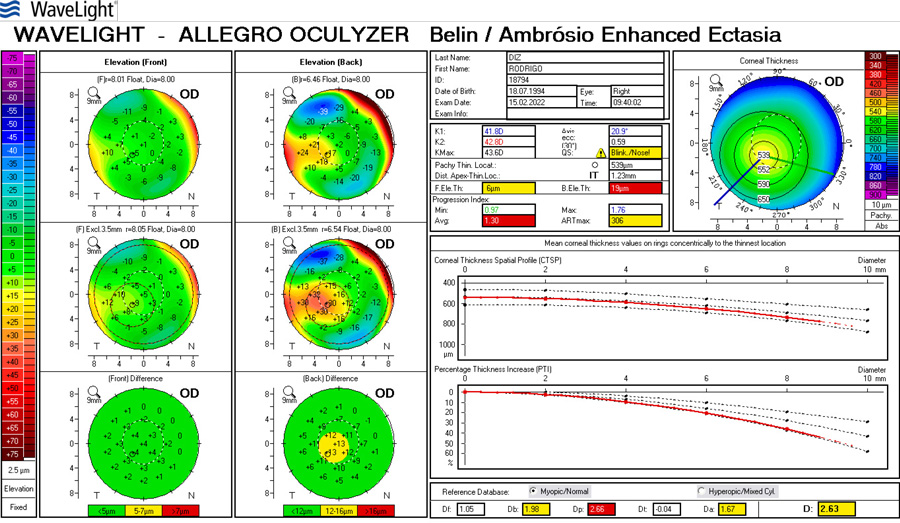
Si la queratometría de este caso fuese p.e. 45.00 @ 0˚ x 45.00 @ 90˚ y el resultado arroja -1.25 x 180˚ se debe sospechar lo siguiente:
- La queratometría preop es incorrecta
- El paciente tiene una cara posterior inusual (como en las ectasias)
- El Lente Intraocular está implantado de manera asimétrica (complicación quirúrgica, un háptica en el saco y otra el el sulcus, un LIO tórico implantado por error -muy raro pero teóricamente plausible-)
Si se trata del caso 1, se puede arreglar fácilmente con cirugía refractiva corneal sea PRK o LASIK. No recomendaría arqueadas ya que el equivalente esférico es -0.67 y se cambiaría por una ametropía por otra.
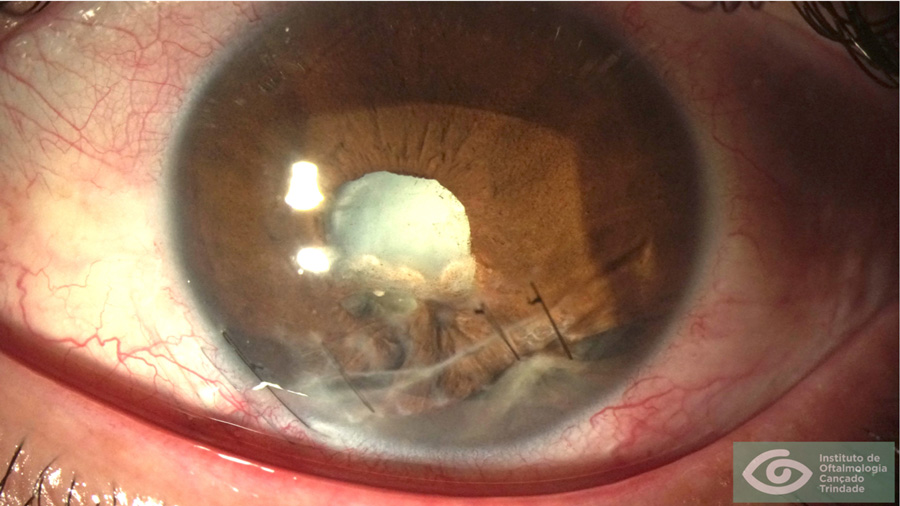
En el caso 2 se trataría de una ectasia o algo en su espectro (trauma corneal, infecciones antiguas, inclusive distrofias endoteliales, etc.). Esos casos no son adecuados ni para cirugía con excimer láser, ni arqueadas y el cambio de un LIO no solucionaría el problema subyacente.
En el caso 3, corregir la posición del LIO en el saco, verificar el poder y características del lente en caso de tratarse de un error del implante. En estos casos sí tendría sentido arreglar el problema de manera intraocular, sea con el posicionamiento correcto o cambio de la LIO.
Dr. David Flikier
- Paciente de 65 años con implante de lente multifocal esférica. Su queratometría preoperatoria era esférica. Llega en el post-operatorio con un astigmatismo refractivo y queratometrico residual de 1.25 D (plano -1.25x 180) corrigiendo a 1.00 con anteojos. A esta paciente:
- Le cambio la lente por un lente tórico
- Le hago unas incisiones relajantes (queratotomía astigmática) en el eje más curvo:
- Le hago Lasik/PRK:
Merece explicación especial
Comentarios:
Interesante caso que permite hacer una serie de comentarios.
Ante una córnea esférica, generalmente se puede esperar una cara posterior con un astigmatismo contra la regla de 0.3 D contra la regla, y la inducción de un astigmatismo interno del LIO contra la regla de aproximadamente 0.2 D por tilt del saco capsular. Dependiendo del sitio de la incisión (SIA), si se realizó superior, se esperaría la inducción de un astigmatismo adicional contra la regla de otros 0.2-0.3 D, llevando a un astigmatismo contra la regla de 0.75 D contra la regla. En su defecto, si se realizó una incisión a 180 grados, y se indujo un poco de astigmatismo con la regla, reduciría el astigmatismo contra la regla descrito, y el esperado sería en el mejor de los casos cercano a 0.
Siempre verificar el estado de la superficie corneal y con tomografía la posible existencia de edema residual en la incisión principal que podría estar alterando la toricidad residual, para dar más tiempo a la mejoría.
SIEMPRE plantear al paciente en su cita preoperatoria, sobre todo en lentes Premium, la posibilidad de requerir una cirugía de retoque, si queda algún defecto residual. Recordad que el +_ 0.50 D se obtiene solo en el 85-93%.
Las tres opciones terapéuticas son viables. Si la toricidad residual es real, y la estabilidad se ha demostrado, siendo un defecto relativamente pequeño:
Si la incisión principal fue a 180 grados, se puede evaluar la realización de incisiones relajantes en el meridiano más curvo. Aunque no son tan predecibles, y el efecto se puede reducir en el tiempo, son muy sencillas de realizar. Y debido a la edad, y por la tendencia con la edad, es mejor que quede un pequeño cilindro con la regla, debido a que con la edad, la tendencia será que cada 10 años, el meridiano horizontal se incurve 0.25-0.50 D, y vire hacia un astigmatismo contra la regla. Esta opción se evalúa en casos de defectos generalmente menores de 1 D y con equivalentes esféricos cercanos al neutro.
De acuerdo a características de superficie ocular, realizar cirugía refractiva LASIK/TRANS-PRK, con el riesgo de comprometer la lubricación en una persona de esta edad. Intentando sub-corregir dejando defecto de -0.25 x 180. La opción de refractiva Láser se evalúa en casos residuales entre +2,00 y -4.00 D.
Se podría evaluar el intercambio por un LIO tórico, previa verificación que el LIO actual se encuentre adecuadamente en la bolsa sin ningún tipo de tilt anormal. Tocaría aumentar la esfera en una dioptría y con toricidad de 1.50 D @ 90 º. En general si el defecto es muy pequeño (< 1.00 D) la opción de cambio de LIO se deja como última opción.
Dr. José Miguel Varas
En los ojos con cirugía refractiva previa, mi formula de preferencia es:
Haigis- Barret Universal II
- SRK/T:
- Panacea
Comentarios:
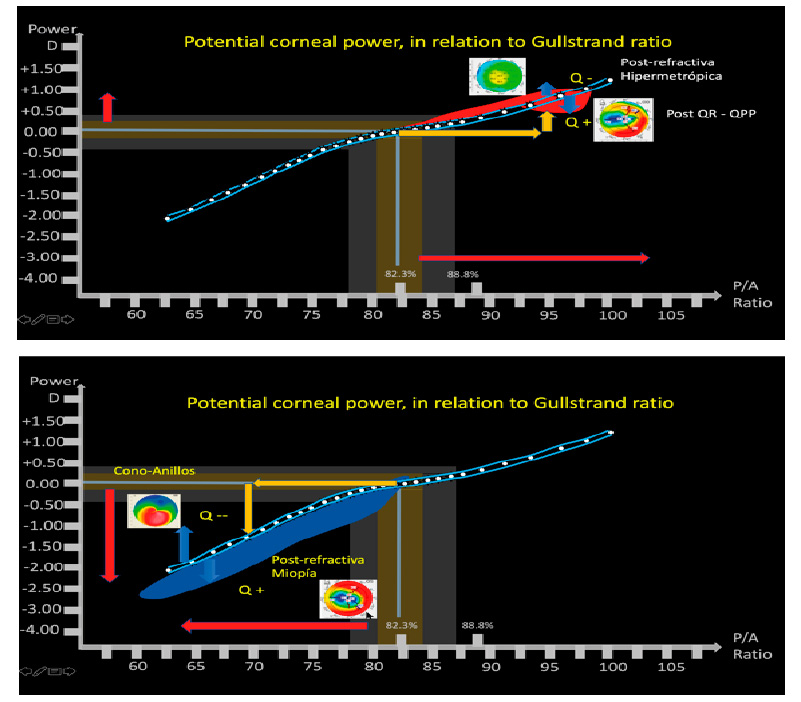
En las córneas oblatas es relativamente fácil usar el mismo programa y usar la estrategia de Haigis para modificar el poder de la queratometría (Haigis-L) en la miopía. De esta manera el valor de la queratometría se modifica internamente. De esta manera se logra disminuir el error final de manera muy significativa.
En las córneas prolatas o la queratotomía radial, uso la estrategia directa del calculador (con estrategia de ELP de Haigis).
La explicación general es que la relación de curvatura de las caras anterior y posterior se ven más alteradas en las oblatas (Relación de Gullstrand menor de lo normal) y que en las prolatas y aún menos en la QR, la relación de Gullstrand es apenas discretamente menor y además esa relación menor tiene menos peso en la predicción que cuando es el caso de las oblatas.
Dr. David Flikier
3) En los ojos con cirugía refractiva previa, mi formula de preferencia es:
Haigis:- Barret Universal II:
- SRK/T:
- Panacea:
Comentarios:
Para poder realizar un cálculo adecuado en pacientes con cirugía refractiva previa se requieren varios factores:
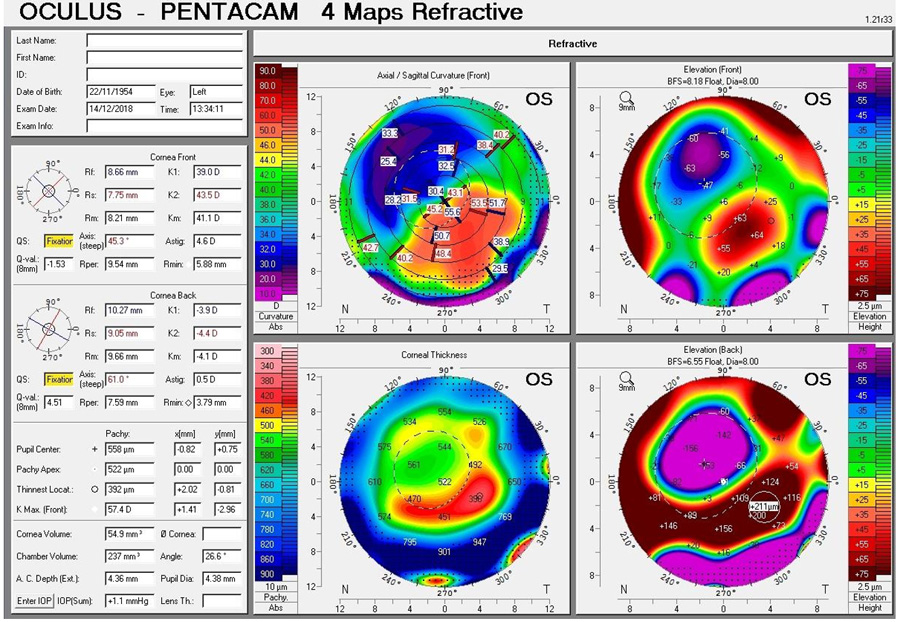
Poder calcular o estimar el poder real de la córnea. Cuando se ha realizado cirugía sobre la córnea hemos cambiado una o ambas caras y hemos modificado sus poderes. Los instrumentos que utilizamos para medir sus curvaturas y poderes, no logran estimarlos adecuadamente, y requerimos de métodos alternos para ayudarnos a hacer estas estimaciones. Una de estas ayudas es el evaluar cuál es la relación que existe entre la cara anterior y posterior de la córnea y cuál es la asfericidad actual de la córnea, con estas dos variables, podemos estimar el cambio que ha sufrido la córnea en las diferentes circunstancias, como refractiva miópica, hipermetrópica, post QR, post-queratoplastia y queratocono, y así estimar el poder de estas córneas.
El problema del poder corneal está siendo estimado y corregido con fórmulas que utilizan directamente valores de poder corneal total (Barrett-Haigis-L), o índices con relación de cara posterior/anterior y asfericidad (Panacea)
2- Corrección de factores para longitudes axiles extremas, que incluye no solo el agregar factores de corrección de tipo Wang-Koch a fórmulas para ojos grandes, si no corrección de segmentos, para adecuar medición de las estructuras intraoculares de acuerdo a corrección de velocidad de transmisión de longitud de onda de la luz en cada segmento (humor acuoso-lente-vítreo), corrección de espesor retineano (no utilizar constante de acuerdo a longitud axil, corrección para lentes menisco negativo.
3 – Estimar la posición efectiva de la LIO, en casos donde la curvatura corneal ha variado. Uno de los factores que utilizan los programas para calcular la ELPo es la curvatura corneal, mientras más curvo, estiman la LIO, más atrás, y mientas más plana, estiman la posición más adelante. El problema está, que en post-refractiva miópica, cuando la córnea se aplana, el programa estima que la LIO irá más adelante, cuando la LIO debería estimarse en el mismo lugar. A esto se le llama el problema de la doble K de Aramberri. Este problema debe estar solucionado en los programas que lo requieran.
Debido a que Panacea cuenta con los factores antes descritos, personalmente utilizo en forma rutinaria Panacea en todos mis pacientes, y en todos los casos que los colegas y amigos que me envían para que se los calcule, con los valores objetivos biométricos del Lenstar y Pentacam, utilizando el Gullstrand ratio, relación P/A, y la Asfericidad Q.
Los resultados obtenidos con Panacea en 2021, por el Dr, Valvecchia y su grupo en post-refractiva eran +_ 0.50 77.08%, +_ 0.75 D 91.67%, +_ 1.00 D 95.83%.






 Coordinador:
Coordinador: Claudio Orlich
Claudio Orlich Roger Zaldivar
Roger Zaldivar 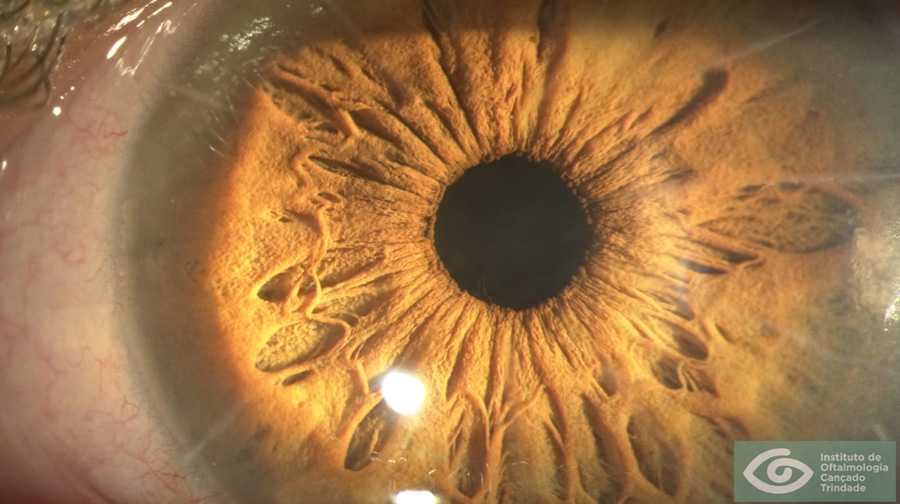









 José Miguel Varas, MD – Ecuador
José Miguel Varas, MD – Ecuador Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)
Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)




 Dr.
Dr.  Dr.
Dr.  Dr.
Dr. 




 Después de un largo tiempo pudimos reencontrarnos en el congreso de la Sociedad Americana de Catarata y Cirugía refractiva. La pandemia fue una época de renacimiento tecnológico y con ella tuvimos que buscar soluciones para realizar nuestras actividades del día a día de forma remota, con esto empezamos a usar cada vez más la telemedicina. En el Glaucoma day, el Dr. Jacob Brubaker habló de la importancia de la telemedicina y que esta tecnología llegó para quedarse. Sin embargo, esta no fue la única innovación presentada en el congreso que tenía como fin hacer un seguimiento remoto a los pacientes, el Eyetelligence presentado por Bausch+Lomb es una plataforma que funciona por inteligencia artificial, su función es interpretar los resultados de los exámenes de los pacientes y detectar progresión, enviándoles una alerta que indica que es hora de regresar al control. Este año también fue lanzado oficialmente el iCare 2 que es un tonómetro para usar en casa, el paciente puede tomar su presión intraocular de forma fácil y la curva de presiones queda directamente guardada en su historia clínica gracias a la app que viene integrada, llamada Patient2.
Después de un largo tiempo pudimos reencontrarnos en el congreso de la Sociedad Americana de Catarata y Cirugía refractiva. La pandemia fue una época de renacimiento tecnológico y con ella tuvimos que buscar soluciones para realizar nuestras actividades del día a día de forma remota, con esto empezamos a usar cada vez más la telemedicina. En el Glaucoma day, el Dr. Jacob Brubaker habló de la importancia de la telemedicina y que esta tecnología llegó para quedarse. Sin embargo, esta no fue la única innovación presentada en el congreso que tenía como fin hacer un seguimiento remoto a los pacientes, el Eyetelligence presentado por Bausch+Lomb es una plataforma que funciona por inteligencia artificial, su función es interpretar los resultados de los exámenes de los pacientes y detectar progresión, enviándoles una alerta que indica que es hora de regresar al control. Este año también fue lanzado oficialmente el iCare 2 que es un tonómetro para usar en casa, el paciente puede tomar su presión intraocular de forma fácil y la curva de presiones queda directamente guardada en su historia clínica gracias a la app que viene integrada, llamada Patient2.