Editorial Córnea: Las complicaciones en la cirugía corneal refractiva
Coordinador:
Dr. José Luis Rincón – Venezuela
Expertos invitados
Dr. Juan Guillermo Ortega – Colombia Dr. Eduardo Viteri – Ecuador
Dr. Ángel Pineda – Venezuela
Uno de los mayores desafíos en la cirugía de catarata actual es tratar de resolver la mayor cantidad de ametropias y defectos en los pa- cientes en el mismo acto quirúrgico. Sin em- bargo, a pesar de contar con equipos muy sofisticados y fórmulas de cálculo que inclu- yen cada vez más factores de corrección, ob- servamos que todavía nos enfrentamos a “sorpresas refractivas”. En esta sección in- cluimos la opinión y consideraciones de tres grandes amigos y expertos en el tema.
1. En su opinión ¿cuáles son los mejo- res equipos de medición y las fór- mulas más adecuadas para evitar una sorpresa refractiva después de una cirugía de catarata?
Dr. Juan Guillermo Ortega: Utilizo de ru- tina Pentacam, especialmente las gráficas de Holladay y las de análisis queratométrico. Biometrías con IOLMaster o Lenstar, porque dan una gran precisión en medidas y la se- gunda que me aporta el grosor del cristalino.
Habitualmente utilizo la presentación de mul- tifórmula en el IOLMaster, y escojo el poder del lente apoyado en las fórmulas de cuar- ta generación: Haigis optimizada y Barrett con más frecuencia, pero igual miro SRK/T en miopes y Hoffer Q en hipermétropes.
Utilizo el OPD de NIDEK para análisis de as- tigmatismo y aberrometria.
Dr. Eduardo Viteri: En mayor o menor me- dida todas las fórmulas y equipos dan re- sultados adecuados en ojos saludables con
características biométricas que se encuentren en el ran- go normal de +/-2 desvia- ciones estándar. Son los ojos atípicos los que dan resulta- dos inesperados, por lo que debemos estar atentos a de- tectar estos casos y advertir al paciente por anticipado de la posibilidad de un defecto residual significativo.
Longitud axil: aunque puede ser medida con mucha pre- cisión con biometría óptica o ultrasonido de inmersión, los ojos extremadamente cortos (LA <21 mm) o muy largos (LA >26 mm) son más pre- dispuestos a sorpresas re- fractivas. Mi experiencia ha sido mejor con la fórmula de Haigis, aunque actualmen- te estoy evaluando la apli- cación Panacea y el método RBF de Warren Hill, sin po- der todavía precisar superio- ridad significativa.
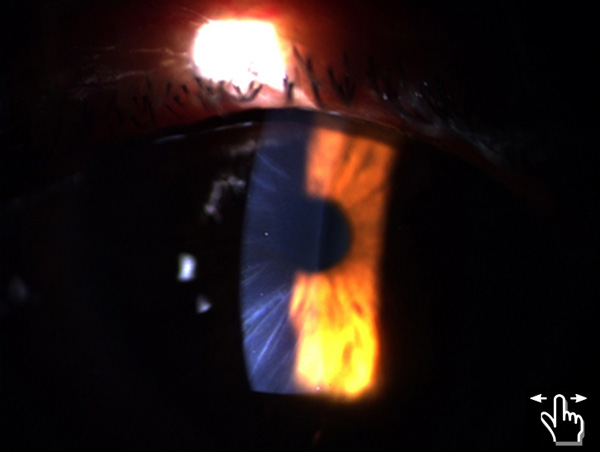
Córnea: en mi opinión la principal fuente de erro- res biométricos tiene su ori- gen en la córnea y debe ser estudiada tanto cuantitativa como cualitativamen- te. El Pentacam permite detectar fácilmente altera- ciones de asfericidad, regu- laridad y concordancia en- tre caras anterior y posterior de la córnea con su módulo Preoperatorio de Catarata. La presencia de anomalías nos anticipa una posible sor- presa refractiva, especial- mente con lentes intraocula- res tóricos o multifocales.
Dr. Ángel Pineda: En el cálculo del lente intraocu- lar en cirugía de catarata existen diferentes medicio- nes que son fundamentales para el uso de las diferen- tes fórmulas para cada caso en particular. Clásicamente se ha utilizado la biometría ocular, que usa una onda acústica producida por una oscilación de partículas den- tro de un medio. Estas on- das son ultrasónicas, con una frecuencia entre 8 a 20 MHz. Estas ondas acús- ticas sufren una reflexión al incidir sobre las interfaces intraoculares. Las ondas que regresan (ecos) son capta- das por la sonda e interpre- tadas por el equipo. El equi- po emite una onda acústica unidimensional (modo A) y es el llamado biómetro ul- trasónico. Además, el equi- po, cuando también emite una onda acústica bidimen- sional (modo A/B), es lla- mado ultrasonido conven- cional y se utiliza para diagnóstico ocular. El modo A, o biómetro ultrasónico, usa una frecuencia de onda de 8 a 12 MHz. Con ambos se obtienen medidas de la
profundidad de la cámara anterior, espesor del cristali- no, longitud de la cavidad ví- trea y longitud axial. Se ha descrito que su resolución es de150a200μm.
Existen dos métodos para realizar la biometría ultra- sónica: el método de con- tacto, el cual está en des- uso actualmente debido a que produce mucha varia- ción en los resultados entre diferentes médicos que rea- lizan la medición. El moti- vo es la indentación variable ejercida en la córnea del pa- ciente, produciendo errores de hasta 0,3 mm en la me- dición de la longitud axial. El segundo método, por in- mersión, utiliza una interfa- ce líquida viscosa colocada en un pequeño reservorio que entra en contacto con el ojo, y la cánula del biómetro entra en contacto con esta interface líquido viscosa para realizar la medición.
Es un método muy confiable y preciso, comparable a los métodos ópticos que existen actualmente para realizar las mediciones de longitud axial, profundidad de cá- mara anterior y espesor del cristalino. La ventaja es que, en casos de cataratas muy densas, en los que no se ob- tienen mediciones con los métodos ópticos por imposi- bilidad de la luz en atravesar medios tan opacos, con el biómetro ultrasónico por in- mersión sí se obtienen me- didas muy confiables.
En años recientes, aparecie- ron los equipos ópticos para realizar mediciones. El bió- metro óptico utiliza el méto- do de interferometría de co- herencia parcial. Utiliza dos haces de luz coaxiales que inciden sobre la superficie anterior de la córnea y sobre el epitelio pigmentario de la retina, eliminando la in- fluencia de los movimientos longitudinales del ojo, reali- zando la medición de la lon- gitud axial.
También se obtienen las me-
didas de la profundidad de
la cámara anterior, querato-
metrías y distancia de blan-
co a blanco (limbo a limbo).
Sin embargo no realizan la
medición del espesor del
cristalino. La curvatura cor-
neal es determinada por la
medida de las distancias en-
tre las imágenes de luz re-
flejadas sobre la córnea,
semejantes al queratóme-
tro convencional, usando
seis puntos sobre la super-
ficie corneal. Los más cono-
cidos son el IOLMaster y el
Lenstar. Existen otras tecno-
logíasmásrecientesconlas
cuales podemos obtener in-
formación del poder corneal,
profundidad y volumen de
la cámara anterior, medida
de blanco a blanco (limbo a
limbo) y espesor del cristali-
no. Las mismas se basan en
la imagen de Scheimpflug
(Pentacam y Galilei) y tam-
bién son consideradas mé-
todos ópticos de medición al
igual que los OCT (Visante,
Optovue). Combinando to-
das estas tecnologías con
sus diferentes programas
conseguimos obtener medi- das bien precisas para ob- tener una probabilidad de error en el cálculo del len- te intraocular menor del 2 % en la mayoría de los casos.
En mi práctica médica yo uso de rutina el IOLMaster para la medición de la longitud axial, profundidad de la cámara anterior y distancia de blanco a blanco. Se ha visto que la medición del poder corneal no es tan preciso con el IOLMaster, por lo tanto utilizo las medidas que me ofrece el Pentacam HR (“High Resolution”) para el poder corneal y el espesor del cristalino (el cual es indispensable en la fórmula de cálculo de Holladay II). En casos en donde no se pueden obtener medidas con el IOLMaster, como en cataratas muy densas, la opción es realizar biome- tría ultrasónica por inmer- sión para obtener la longi- tud axial, profundidad de la cámara anterior y espesor del cristalino.
y Haigis. Para ojos largos, longitud axial mayor que 26 mm, SRK/T o Haigis.
2. ¿Cuál es su conducta ante una sorpresa re- fractiva hipermetrópi- ca de 0,75 a 1,50 D y de 1,50 D en adelante?
Dr. Juan Guillermo
Ortega: En hipermetropías bajas, considero corrección mediante excimer y trato de corregir astigmatismos coexis- tentes. En más altas, conside- roquedebenmanejarsecon recambio de LIO o incluso en las muy altas, un piggyback. El tratamiento con láser es im- predecible en ocasiones, tien- de a perder su efecto con el tiempo y aumenta las aberra- ciones corneales.
Dr. Eduardo Viteri: Si el defecto residual afecta la ca- lidad de vida del paciente, en una hipermetropía me- nor que 1,50 D, realizo ciru- gía corneal refractiva (LASIK o PRK). En defectos mayores
que 1,50 D, prefiero cambio Existen posibles complicaciones cuando se
del lente intraocular.
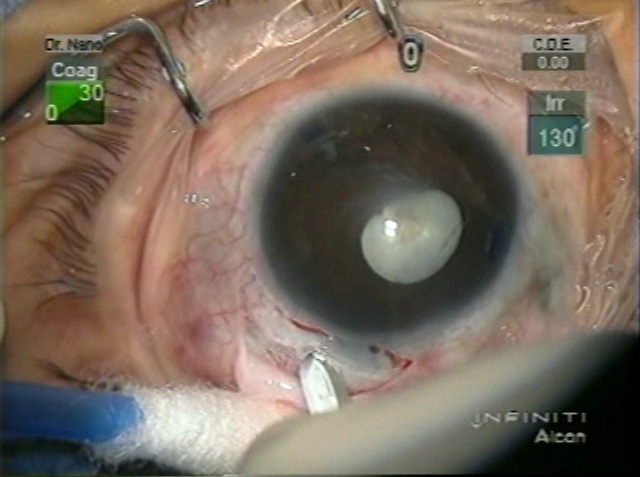
Dr. Ángel Pineda: Con los avances en las técnicas de microcirugía de los últi- mos años, los cirujanos bus- camos cada día con mayor empeño el objetivo final de emetropía después de la ci- rugía de catarata. A pesar de las fórmulas de última ge- neración para el cálculo del lente intraocular (LIO), los errores en el cálculo del LIO representan una de las cau- sas más importantes para recambio del LIO después de la cirugía de catarata.
Las estrategias disponibles para solucionar estos erro- res en el cálculo del LIO que conllevan a ametropías resi- duales después de la cirugía de catarata o sorpresas re- fractivas incluyen: cirugía re- fractiva corneal con excimer láser, extracción y recambio del LIO, e implante de un se- gundo LIO (piggyback). La extracción y recambio del LIO puede ser traumática, especialmente si ha habido ruptura de cápsula posterior. Podría producir también in- flamación del segmento an- terior, ruptura de la cápsula posterior, lesión del endote- lio corneal, ciclodiálisis, ede- ma macular quístico y hasta complicaciones retinianas. La técnica de piggyback per- mite la corrección refracti- va en estos casos. Fue desa- rrollada originalmente para proporcionar un adecuado poder del LIO en ojos extre- madamente ametrópicos y para la corrección de errores refractivos pseudofáquicos.
realiza un implante secundario (piggyback).
Se ha reportado la presencia de opacifica- ción interlenticular (OIL), comprometiendo las superficies de los LIO que están conti- nuas. Una forma de prevenir esta compli- cación es colocar el primer LIO en el bolsi- llo capsular y el segundo LIO en el sulcus. También se han reportado resultados re- fractivos impredecibles debido a distur- bios ópticos producidos por el contacto de las dos superficies ópticas de los LIO, des- centrado de los LIO por contracción y fibro- sis del bolsillo capsular, irritación del iris e inflamación intraocular crónica, dispersión pigmentaria y glaucoma. No todos los LIO son adecuados para colocarlos en el sulcus. Un LIO para ser implantado en el sulcus con la técnica de piggyback debería estar hecho de un material suave y biocompatible, con una zona óptica relativamente grande (para evitar captura de la misma por la pupila), un diámetro total mayor que los LIO para el bolsillo capsular (para ubicarse y centrarse bien en el sulcus) y con bordes suaves y re- dondeados de la zona óptica y las hápticas (para evitar irritación crónica del iris y del cuerpo ciliar). Además, el diseño del mismo debería ofrecer una distancia adecuada en- tre el mismo y los tejidos uveales y con el LIO que está en el bolsillo capsular.
En el año 2010, Kahraman y Amon reporta- ron un nuevo LIO especialmente diseñado para colocarse en el sulcus como piggyback. Este LIO fue diseñado por Amon y fabrica- do por el laboratorio Rayner. El LIO Sulcoflex (modelo 653L, Rayner Intraocular Lenses Ltd.) es un LIO de una sola pieza, de acrílico hidrofílico, con una zona óptica de 6,5 mm y un diámetro total de 14 mm. La óptica tie- ne bordes redondeados y una configuración convexa-cóncava. Las hápticas son de lar- go diámetro, suaves, con bordes ondulados y redondeados, y con una angulación pos- terior de 10 grados en relación a la óptica. Este LIO viene en tres versiones con la mis- ma plataforma: Sulcoflex asférico, Sulcoflex tórico y Sulcoflex multifocal, de forma que tenemos la posibilidad de corregir diferentes
errores refractivos después de ciru- gía de catarata (miopía, hipermetro- pía, astigmatismo y presbicia). Las principales indicaciones son la correc- ción de ametropías residuales pseudo- fáquicas, ametropías residuales tras queratoplastias penetrantes (QPP) y/o lamelares pseudofáquicas, y para la corrección de la presbicia en pacientes pseudofáquicos con LIO monofocal.
Para el cálculo del LIO Sulcoflex son necesarios los siguientes datos: re- fracción preoperatoria, longitud axial medida idealmente con el equipo IOLMaster o por biometría de inmer- sión, profundidad de la cámara ante- rior, queratometrías, astigmatismo quirúrgicamente inducido por el ciru- jano y diámetro y localización de la incisión corneal por donde será im- plantado el LIO. Todos estos datos se introducen en la hoja de cálculos del laboratorio por internet.
De acuerdo a lo expuesto anteriormen- te, cuando tengo una sorpresa refrac- tiva hipermetrópica de +0,75 a +1,50 prefiero corregirla con excimer láser. Entre las técnicas de ablación superficial (PRK) y ablación intraestromal (LASIK), generalmente prefiero PRK si se trata de pacientes mayores de 60 años, por la menor incidencia en producción de ojo seco en comparación al LASIK. En pacientes menores de 60 años con ma- yor actividad física e intelectual, prefie- ro LASIK por la mayor rapidez en la re- cuperación visual. Me siento muy bien corrigiendo hasta +2,0 D de hiperme- tropía con excimer láser. En sorpresas refractivas mayores de +2,0 D conside- ro el recambio del LIO si el paciente ne- cesita una recuperación visual rápida, con buen contaje endotelial y sin ningu- na complicación intraoperatoria, como ruptura de la cápsula posterior. En pa- cientes con bajo contaje endotelial, rup- tura de la cápsula posterior y pacientes de la tercera edad, considero el uso de piggyback con el LIO Sulcoflex.
3. ¿Cuál es su conducta ante una sorpresa re- fractiva miópica de 0,75 a 1,50 D y de 1,50 D en adelante?
Dr. Juan Guillermo Ortega:
Intento corregir las sorpresas miópicas con excimer mien- tras tenga una córnea adecua- da. En caso contrario, hago re- cambio del lente. Uno de los inconvenientes del recambio del lente es que, al hacer inci- siones más largas, se puede in- ducir astigmatismos que ha- bría que corregir más adelante con excimer.
Dr. Eduardo Viteri: En gene- ral, en defectos miópicos rea- lizo LASIK o PRK, salvo que la condición corneal no lo per- mita, en cuyo caso procedo al cambio del lente.
Dr. Ángel Pineda: En pre- sencia de una sorpresa refrac- tiva miópica, el manejo es más sencillo, ya que podemos co- rregir hasta +/- 6,0 D de mio- pía con excimer láser (PRK o LASIK), dependiendo del es- pesor corneal. En presencia de miopías mayores que 6,0 D, to- davía considero la posibilidad de excimer láser, pero PRK + mi- tomicina, lo cual ha demostra- do producir excelentes resulta- dos visuales posoperatorios. Sin embargo, también podría consi- derar en esta situación extrema el recambio del LIO o implante de un segundo LIO (piggyback).
4. ¿Cuál es su conducta ante una sorpresa refractiva as- tigmática de 0,75 a 1,50 D y de 1,50 D en adelante?
Dr. Juan Guillermo
Ortega: Hay dos escena- rios: astigmatismos induci- dos en cirugía que pueden corregirse con láser o inci- siones. En mi opinión, las in- cisiones son más impredeci- bles e inestables. Otro caso son los astigmatismos “sor- presa” después de lentes tóricos. En estos casos me ayudo del OPD que es exce- lente para el análisis. Y utili- zo los cálculos de José Miguel Varas o calculadores en línea para rotar los lentes.
Dr. Eduardo Viteri: En sorpresas refractivas astig- máticas de cualquier magni- tud empiezo por analizar si el lente intraocular se encuen- tra en el eje adecuado y si una rotación del mismo pue- de mejorar el estado refracti- vo. Si el lente está en el eje correcto y es un astigmatis- mo miópico significativo, mi preferencia es cirugía corneal refractiva. En astigmatismos elevados, especialmente si son mixtos o hipermetrópi- cos compuestos, considero el cambio de lente intraocular.
Dr. Ángel Pineda: Si el pa- ciente fue operado con un LIO tórico, confirmo bajo di- latación pupilar que el LIO esté orientado de acuerdo a la programación preopera- toria en el cálculo del mis- mo. Si hay un error en el eje, es decir que no coincide la orientación del LIO con lo programado, roto el LIO a la posición adecuada en quiró- fano, siempre dentro de los primeros días de la cirugía para evitar que las hápticas
se adhieran y formen fibras con el complejo capsular, im- pidiendo posteriormente su rotación. Si la orientación del LIO está correcta a lo progra- mado, evidentemente hubo un error en la medición del poder corneal. En ese caso, considero la corrección con excimer láser en el momen- to en que el error refractivo residual esté estable, usual- mente entre seis a ocho se- manas después de la cirugía. Puedo corregir de forma se- gura hasta 3 D de astigma- tismo, de igual forma usando PRK o LASIK, dependiendo de lo expuesto anteriormen- te. En pacientes que fueron operados con LIO no tóri- co, tengo la misma conduc- ta hasta 3 D de astigmatis- mo. En correcciones mayores de 3 D de cilindro, conside- ro la colocación de un LIO Sulcoflex tórico.
5. ¿Cuáles son sus consi- deraciones especiales en caso de cirugía de catarata pos cirugía re- fractiva: KR y LASIK?
Dr. Juan Guillermo
Ortega: El cálculo de lentes después de cirugía refractiva lo hago a partir de la gráfica del poder queratométrico total del Pentacam y la fórmula de Haigis optimizada. Otra herra- mienta es la fórmula de Haigis L miópica o hipermetrópica, que me parece muy útil en los casos de hipermetropía.
Dr. Eduardo Viteri: En este caso depende de la condi- ción de la córnea. Si se trata de una corrección refractiva
previa baja y la córnea es regu- lar, el pronóstico es bueno uti- lizando Haigis L para casos de LASIK previo y las utilidades de la página de ASCRS para KR pre- via. Si el paciente evidencia una ablación elevada, descentrada, una córnea irregular o manifies- ta fluctuaciones diarias en la vi- sión, evito implantar lentes mul- tifocales y se advierte al paciente sobre la posibilidad de un defec- to visual refractivo o una correc- ción complementaria.
Dr. Ángel Pineda: La ma- yor dificultad para el cálculo del LIO pos cirugía refractiva cor- neal (queratotomía radial, PRK, LASIK) es la medición del poder corneal real. El error en el cál- culo del LIO en estos casos se debe principalmente a: 1) la di- ficultad en la determinación de la verdadera curvatura ante- rior corneal por la queratome- tría tradicional y la topografía corneal; 2) el cálculo incorrecto del poder dióptrico corneal ba- sado en el índice de refracción de 1,3375, el cual cambia en función de la remoción de tejido corneal por los procedimientos de fotoablación; y 3) la imper- fección de las fórmulas biomé- tricas para determinar la posi- ción real del LIO, ya que usan modelos de ojos normales sin cirugía corneal previa. Se des- criben varios métodos usados en años anteriores para tratar de disminuir la posibilidad de error en la estimación del po- der corneal: método de la histo- ria clínica, método de la quera- tometría derivada y método del lente de contacto rígido.
Más recientemente hemos utiliza- do la topografía corneal compu- tarizada (OPD-Scan) colocando
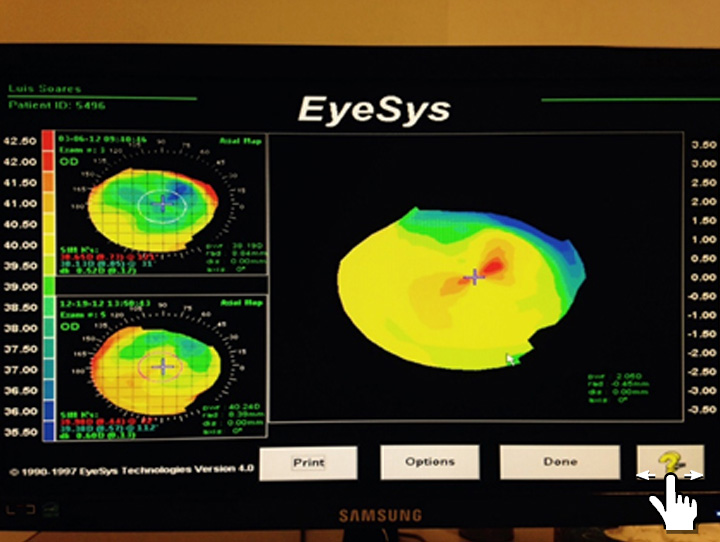
el cursor en los 3 mm cen- trales para buscar el punto más plano (en casos de ci- rugía refractiva de miopía) o el punto más curvo (en casos de cirugía de hiper- metropía), y se utilizan es- tas medidas en las respecti- vas fórmulas de cálculo del LIO. Sin embargo, todavía existe fuente de error. El to- pógrafo corneal EyeSys tie- ne el “Holladay Diagnostic Summary” para calcular el poder refractivo corneal efectivo (“effective refracti- ve power”). Este es un va- lor estimado del poder cor- neal central, en los 3 mm centrales, con el cual se ob- tienen mejores resultados.
Finalmente, en los últi- mos años hemos esta- do utilizando el Pentacam, el cual tiene el progra- ma también desarrolla- do por Holladay, llamado “Holladay EKR detail re- port”. El EKR (“Equivalent Keratometer Readings” o medidas queratométricas equivalentes) nos informa de forma gráfica y tabu- lada unas “K” posquirúr- gicas ajustadas a diferen- tes tamaños pupilares (de 1 mm a 7 mm). El progra- ma nos informa el diáme- tro pupilar del paciente y, de esta forma, escogemos el poder refractivo repor- tado para ese tamaño pu- pilar en la topografía cor- neal. Este es el método que actualmente usamos para el cálculo del LIO pos cirugía refractiva corneal.
Referencias:
- Centurion V. Excelência em Biometria. Rio de Janeiro. Cultura Médica, 2006.
- Belin MW, Khachikian SS, Ambrósio R. Elevation Based Corneal Tomography. Second Edition. Jaypee – Highlights Medical Publishers, Inc, 2012.
- Centurion V, Nicoli C, Chavez E. El Cristalino de Las Américas. Segunda Edición. Jaypee – Highlights Medical Publishers, Inc, 2015.
- Centurion V, Espaillat A, Orlich C. CICAFE. Cirugía de la Catarata con Láser de Femtosegundo. Jaypee – Highlights Medical Publishers, Inc, 2015.