Introducción
La era digital trae consigo numerosas transformaciones sociológicas que cambian costumbres de siempre e incorporan nuevas y novedosas metodologías. La formación médica se ve muy afectada por estos cambios de manera que ya diferenciamos la tradicional o “académica” frente a una formación basada en medios digitales que podemos llamar “no académica”.
La característica de esta nueva formación digital es la rapidez en la transmisión del conocimiento, el cual se realiza de una forma muy directa y práctica. Al mismo tiempo, esa facilidad de acceso hace que la transmisión se realice de manera muy fluida y continua, por lo que el saber va impregnando al receptor de esa información docente de manera muy seguida y a veces de forma imperceptible.
Tiene como inconveniente que, pese a poder ser una formación incluso reglada, no es generada y emitida la mayor parte de las veces por instituciones acreditadas, por lo que no genera méritos baremables a efectos curriculares. Pero en ese inconveniente se basa la grandeza de la formación digital no académica: es la búsqueda del Saber por el Saber mismo, que es la base innata de la génesis del conocimiento humano.
Sistemas digitales
A efectos didácticos podríamos dividirlos en tres grandes categorías:
Sistemas pasivos
Sistemas activos
Sistemas mixtos
Ambos sistemas conviven y se complementan en el mundo digital.
1. Sistemas digitales pasivos
En los sistemas pasivos incluimos aquellos en el que la persona en busca de formación es espectadora de la misma con nula o mínima interacción con el proveedor del servicio y con sus pares. Es el caso de la mayoría de las páginas web y de numerosos blogs. Incluimos éstos pues, aunque tienen una sección de comentarios activos en la mayor parte de las ocasiones, son reducidos y limitados por el autor del blog.
1.1. Páginas web
Una página web es un escaparate o catálogo de una persona (web personal) o de una empresa o asociación (web corporativa) donde se muestra las cosas que se quieren enseñar públicamente de esa persona o grupo. En la actualidad cualquier institución sanitaria o científica cuenta con una página web donde en muchos casos se incluyen aspectos formativos, diferenciando los dirigidos a profesionales y al público general.
Las webs de clínicas, y en muchos casos de instituciones, su información complementaria va dirigida sobre todo a pacientes y usuarios. Por contra, las grandes asociaciones (AAO, ASCRS, SEO, etc.) cuentan con numerosos apartados dirigidos a sus asociados profesionales donde se incluyen para su consulta, e inclusive descarga, de las presentaciones y grabaciones de congresos pasados (ASCRS/ESCRS On Demand), de sus revistas científicas y de divulgación, etc. Su acceso se restringe a sus asociados, pero en algunas ocasiones es libre, como es el caso de un ejemplo local, como https://www.facoelche.com/ que cuelga la grabación de todas las sesiones de su evento anual de forma abierta y gratuita para poder ser revisadas posteriormente.
1.2. Blog
Un blog es una página web en la que se publican artículos con periodicidad y en orden cronológico. El blog suele ir asociado a una página web, corporativa o personal, y en otras ocasiones es singular y no asociado. Puede ser de acceso abierto o cerrado y dirigido a divulgación general o profesional. Ejemplos de esto son el blog “Ocularis.es” con un nivel técnico accesible pero dirigido a la divulgación general. También abierto, pero dirigido a profesionales, es el caso del FacoBlog alojado en la página de facoelche.com.
Asimismo, y con una capacidad formativa de alto nivel hay blogs muy técnicos y especializados, como los desarrollados por Joaquín Fernández y QVision. http://www.qvision.es/ blogs/joaquin-fernandez/
El blog permite cierta interacción al poder incluir preguntas y comentarios que son moderados y respondidos por el autor.
2. Sistemas digitales activos
En los sistemas activos incluimos todo el mundo de las denominadas Redes Sociales, las que se entienden como todas las aplicaciones de Internet donde podemos interactuar con terceros de forma activa y continuada. Abarca este concepto desde sistemas de mensajería, generalistas relacionales, grupos de discusión por mail, foros web, etc.
A efectos prácticos vamos a dividir las redes sociales en tres grupos según el tipo de plataforma que usan:
• Redes sociales generalistas
• Redessocialesdemensajería • Foros y grupos de discusión
2.1. Redes sociales generalistas
Este flujo informativo puede viralizar muy rápidamente pudiendo al final alcanzar por interacciones transversales mucha más gente de la prevista en el grupo original, lo que contribuye a difundir el conocimiento.
Tiene, no obstante, dos inconvenientes muy importantes. Por un lado, no permite el archivo ordenado e histórico de temas tratados. Teóricamente todo está almacenado, pero salvo que se disponga de mucho tiempo y paciencia es muy difícil encontrar un tema o un hilo tratado varios meses atrás. Esto perjudica el concepto docente y hace que estas Redes Sociales sean de formación instantánea, pero sin perdurabilidad.
Siendo ése un gran inconveniente, aún mayor lo es el hecho de que sus contenidos no son propiedad de sus usuarios sino de los dueños de las Redes Sociales, quienes con criterios propios pueden hacer desaparecer un grupo sin mayores explicaciones. La página en Facebook de una conocida sociedad científica oftalmológica Iberoamericana con más de 3.000 miembros y años de trayectoria desapareció de la noche a la mañana con todo su contenido y sin derecho ni a réplica y, lo que es peor, ni a recuperar dichos contenidos.
Por todo ello insistimos que la formación no académica en redes sociales se debe tomar como la difusión del momento, de la foto, del artículo, pero pensando en el difícil archivado y en la posibilidad de una arbitraria evanescencia.
Incluimos en este apartado a las bien conocidas Facebook, Twitter, Instagram, LinkedIn, YouTube, etc. Las redes sociales a nivel formativo tienen varias ventajas, pero a su vez inconvenientes importantes. Entre sus ventajas principales figura el tener una gran accesibilidad, lo que permite publicar información muy rápidamente. Asimismo, mediante notificaciones se puede estar informado al insson WhatsApp, Line, Telegram y otros.
2.2. Redes sociales de mensajería
La mensajería instantánea es uno de los grandes avances de la era digital, ya que permite de forma rápida y gratuita comunicar mediante mensajes escritos y de voz con personas y grupos de gente. Varios son los sistemas de mensajería disponibles, como
El más popular en nuestro medio es WhatsApp, el cual tiene a su vez una gran facilidad para generar grupos por intereses muy variados. Generalmente a alguien por el motivo que sea decide agrupar a una serie de personas, amigos o colegas con un interés común en un evento, una asociación, una afición compartida, etc. Esa persona pone nombre e imagen al grupo y automáticamente pasa a ser su administrador, gestionando las altas y bajas del mismo. Los miembros son invitados a participar, son incorporados por el administrador y permanecerán en el mismo hasta que salgan por su propia decisión o por la del mismo administrador que los incluyó.
Los grupos de WhatsApp son un verdadero fenómeno social en todos los órdenes de la vida y son un vehículo muy importante de transmisión de conocimiento y, por ende, de formación no académica. Aunque comparten con las redes sociales generalistas algunas de sus ventajas e inconvenientes, los grupos de WhatsApp tienen algunas singularidades muy interesantes.
Por un lado, son tal vez la forma más rápida y directa de compartir conocimiento por el sistema en sí de mensajería instantánea. Por otro lado, lo forman comunidades no muy grandes en las que la mayoría o bien son conocidos directos o bien son sus pares equivalentes con lo cual muchos se sienten más cómodos compartiendo con ellos sus problemas, trucos, archivos, etc. frente a foros, redes o grupos de discusión que son comunidades mucho más grandes y lejanas.
Tiene los mismos inconvenientes que las redes sociales generalistas en cuanto a posibilidad de archivo y búsqueda posterior y puede que no sean sus temas tan viralizables como cuando se hacen en sistemas más extendidos. Al mismo tiempo, los hilos se entremezclan con asuntos de otro tipo, con lo que el seguimiento de los temas a veces se hace incómodo.
Y por supuesto el grupo no es propiedad de sus miembros y administradores, sino de los dueños de la empresa de mensajería que en cualquier momento y circunstancia pueden dar de baja una cuenta perdiendo todos sus contenidos.
2.3. Foros web y grupos de discusión
Dentro de los “sistemas digitales activos de formación no académica” llegamos a un apartado basado en los pilares institucionales de Internet: la página web y el correo electrónico, que a su vez son los que apoyan a los foros y los grupos de discusión respectivamente
2.3.1. Foros web
Un foro web es similar a una página convencional de Internet donde se puede realizar discusiones en línea de forma asincrónica, es decir de manera diferida en el tiempo, sin coincidencia temporal. Un ejemplo de comunicación asincrónica es el envío de una carta por correo ordinario: la escribes, la envías y ya la verán y la responderán.
Los foros web tienen uno o varios moderadores y para poder participar se debe estar registrado como miembro, aunque alguno permite hojear contenido sin registro, pero sin poder opinar.
Aquí las personas publican mensajes alrededor de un tema, creando de esta forma un hilo de conversación jerárquico (thread en inglés). Los temas e hilos van clasificados y ordenados, lo cual es misión de los moderadores para poder mantener el orden y controlar los contenidos adecuados al espíritu del foro.
Existen foros de todo tipo, clase y condición, siendo muy populares a nivel general. Entre sus ventajas se destaca que todo va muy ordenado y archivado con motores de búsqueda potentes para encontrar temas, casos, autores, etc. En este sentido, podrían ser vehículo ideal para cierta formación no académica, pero es ahí donde un gran inconveniente se interpone: los foros son de accesibilidad más lenta que los sistemas comentados anteriormente, lo que impone barreras sicológicas a los potenciales usuarios. Mientras muchos sitios de mensajería prácticamente te saltan solos, en los foros web tienes que ir a buscarlos, registrarte y entrar. Cuenta con notificaciones vía mail, pero eso no limita la lentitud de acceso. Este inconveniente hace que los foros queden para personas muy motivadas con el contenido del foro web.
2.3.2. Grupos de discusión de Internet
Los grupos de discusión en Internet son el origen del inicio de todos los sistemas de foro web y similares. Se fundamentan en la utilización directa del correo electrónico, con el que los participantes opinan y responden vía e-mail. Cada integrante del grupo lee y responde a los mensajes de correo, los cuales son enviados de forma automática a todos los miembros restantes.
Los grupos de discusión pueden ser moderados o no. En este caso, los correos enviados entran automáticamente al sistema siendo distribuidos sin interferencias a todos los miembros del grupo. En el caso de ser moderados, los mensajes pasan por el administrador, quien puede cambiar cosas y ordenar los mensajes. Un ejemplo de grupo moderado es el antiguo KMSG-Group y de no moderado, el Foro FacoElche.
Los temas se organizan por hilos que van marcados en el “asunto” del mensaje. En los grupos no moderados es muy importante mantener cierta disciplina para cumplir con los hilos en marcha o para completar el tema en el “asunto” y poder tener un archivado correcto del mismo.
Los grupos de discusión tienen algunos inconvenientes, como basarse en el uso de correo electrónico, lo que, frente a sistemas tipo WhatsApp, no le da tanta inmediatez, pero al ser un sistema asincrónico, te aparece siempre al abrir el correo electrónico y que lo puedes consultar directamente en cualquier momento.
Los grupos de discusión, por el contrario, tienen la facilidad de archivado, lo que permite consultas históricas por temas o autores y, además, y muy importante, son propiedad del grupo, de todos y cada uno de sus miembros, que disponen siempre del archivo histórico (si lo han guardado) a su disposición.
Prueba de ello es que en oftalmología después de más de veinte años siguen funcionando con este sistema dos de los grupos de discusión más importantes del mundo: KERA-NET, perteneciente a la Cornea Society, y EYE-MAIL, de la ASCRS.
3. Sistemas digitales mixtos: educación virtual
Dentro de la formación no académica llamamos “sistemas digitales mixtos” a aquellos en los que se recibe información de forma pasiva, pero al mismo tiempo obliga a interactuar al sujeto que se está formando. Entramos así de lleno en el concepto de educación virtual, el cual puede entenderse y aplicarse de diferentes maneras. Se le aplican distintos nombres, tales como eLearning, educación a distancia o educación virtual. En su acepción más amplia, puede considerarse al uso de tecnología para formar o educar, abarcando cualquier utilización de medios electrónicos o internet (texto, audio o videos), en cuyo caso prácticamente todo oftalmólogo estaría aplicando casi a diario alguna forma de educación virtual cada vez que lee un artículo médico o revisa un video de una presentación o cirugía.
El espectro de la educación virtual es por lo tanto muy extenso y de gran utilidad para todos los oftalmólogos, tanto para quienes están en etapa de formación como para quienes llevan años de ejercicio de la especialidad. Se puede aprovechar de forma estructurada o puntual, aisladamente o en conjunto con educación presencial (blended education). El desarrollo de las diferentes redes sociales y medios de comunicación ofrecidos por internet, ponen la educación virtual al alcance de todos, ofreciendo la oportunidad de educar y ser educados. Algunas de sus ventajas e inconvenientes son las siguientes:
• Conveniencia: disponible sin necesidad de desplazarse físicamente.
Alto nivel: acceso a profesores e instituciones muy prestigiosas.
Actualización rápida: se recibe información actualizada tan pronto se publica.
Bajo costo: hay muchas publicaciones gratuitas o el costo de registro es bajo.
Interactividad: permite comentar con otros asistentes y con instructores.
También podemos puntualizar varias dificultades:
• Poca disponibilidad: no siempre se encuentra la información que se necesita.
• Calidad: una gran cantidad de la información no es verificable ni se apega a criterios confiables.
• Idioma: todavía hay poco contenido en español.
• Certificación internacional: no siempre se puede aplicar en todos los países.
• Cumplimiento: un significativo porcentaje de asistentes no termina los cursos.
En algunos sentidos la educación virtual ha revolucionado la educación médica. Desde los clásicos libros de hace 50 años a los libros digitales de hace una década, el principal cambio fue que el texto y las figuras pasaron del papel a la pantalla. En los últimos años estamos empezando a aprovechar las ventajas de la conectividad que ofrece el internet 2.0, como es la de brin
dar a todos los oftalmólogos no solamente la capacidad de mantenerse informados, sino también de comentar, cuestionar, discutir y, en último término, orientar la práctica oftalmológica local y global.
Otra ventaja de la educación virtual es la facilidad y rapidez para acceder a la información que se necesita, sea este un caso complejo, dilema diagnóstico u opinión experta. Generalmente es posible encontrar la ayuda requerida en pocos minutos, bien sea por motores de búsqueda o acceso a grupos de discusión virtuales.
Virtualizando la educación médica continua
Hasta hace pocos años el principal recurso para que el oftalmólogo se pudiera mantener actualizado era la lectura de libros o revistas y la asistencia ocasional a conferencias o congresos de especialidad que se presentaban en su ciudad/país de residencia o viajar a congresos regionales, incurriendo en gastos de desplazamiento, además del lucro cesante. Actualmente puede aprovechar la disponibilidad de simposios virtuales (webinars) en la conveniencia de su consultorio u hogar. Si algún conflicto de horario por razones laborales o geográficas le impiden participar en tiempo real, tiene la posibilidad de ver las grabaciones.
campus.oftalmohi.com/ , los Ateneos del Hospital de Clínicas de Buenos Aires https://oftalmouba. com/ateneos , mientras en inglés se puede acceder a las conferencias virtuales de CyberSight https://cybersight.org/lectures/ o los Grand Rounds del Wills Eye http://www.willseyeonline.org/ entre otros.
La Asociación Panamericana de Oftalmología tiene un programa extenso de educación virtual con varios webinars al mes en idioma español y portugués, en formato interactivo, que organiza en forma conjunta con las sociedades de oftalmología de varios países, entre ellos un activo programa con la Sociedad Española de Oftalmología. Se puede registrar sin costo a los próximos webinars en http:// www.campuspaao.org/ y también visualizar el extenso repositorio de webinars grabados que otorga certificados de educación médica continua luego de responder un cuestionario. En la página de la Academia Americana de Oftalmología puede encontrar múltiples recursos educativos en idioma inglés y de acceso gratuito en One Network ingresando a https:// www.aao.org/clinical-education
Educación combinada (Clase invertida)
En realidad, la educación virtual no se contrapone ni compite con la educación presencial. Idealmente se pueden combinar y, aprovechando sus respectivas fortalezas, obtener mejores resultados. Un ejemplo lo encontramos en lo
Varias instituciones ofrecen en tiempo real sus reuniones sobre temas específicos o presentación de casos. En español están disponibles las clases del Hospital Italiano de Buenos Aires http://campus.oftalmohi.com/ , los Ateneos del Hospital de Clínicas de Buenos Aires https://oftalmouba. com/ateneos , mientras en inglés se puede acceder a las conferencias virtuales de CyberSight https://cybersight.org/lectures/ o los Grand Rounds del Wills Eye http://www.willseyeonline.org/ entre otros.
La Asociación Panamericana de Oftalmología tiene un programa extenso de educación virtual con varios webinars al mes en idioma español y portugués, en formato interactivo, que organiza en forma conjunta con las sociedades de oftalmología de varios países, entre ellos un activo programa con la Sociedad Española de Oftalmología. Se puede registrar sin costo a los próximos webinars en http:// www.campuspaao.org/ y también visualizar el extenso repositorio de webinars grabados que otorga certificados de educación médica continua luego de responder un cuestionario. En la página de la Academia Americana de Oftalmología puede encontrar múltiples recursos educativos en idioma inglés y de acceso gratuito en One Network ingresando a https:// www.aao.org/clinical-education
Cursos virtuales asincrónicos tutorados
Estos cursos le dan al estudiante la posibilidad de tomarlos con gran flexibilidad. Pueden conectarse en las horas que tengan disponibles y completarlo en mayor o menor tiempo porque no requiere la presencia simultánea de todos los alumnos y el profesor, ya que las clases están grabadas.
Para tener un resultado óptimo las clases deben seguir un diseño instruccional adecuado, que empieza por objetivos definidos, contenido adecuado, documentación complementaria, extensión suficiente, interacción continua y evaluación planeada para validar que los objetivos fueron cumplidos. Finalmente, la certificación recibida debe tener validez y reconocimiento internacional.
En el campus virtual de la Asociación Panamericana de Oftalmología se puede acceder a cursos asincrónicos sobre diferentes temas sobre aspectos diagnósticos y manejo clínico o quirúrgico de diferentes patologías http:// www.campuspaao.org/ .
Conclusión
Es innegable el impacto que tienen las redes sociales que va mucho más allá de la educación médica. El efecto en la divulgación de conocimiento y su contribución al cierre de la brecha de transferencia de información, proporcionando un medio asequible para la distribución de ideas potencialmente complejas que pueden cuestionar y perfeccionar políticas de salud no puede ser ignorado. El uso inadecuado ha sido evidenciado por el alcance que tiene movimientos similares a los antivacunas, lo cual obliga a los médicos a involucrarse en ellas para ofrecer a la comunidad una información adecuada en un lenguaje comprensible.
La educación virtual ofrece nuevas y positivas oportunidades para la formación de oftalmólogos en todos los niveles. Lejos de competir con la educación presencial tradicional, la complementa. Para obtener los mejores resultados como educadores, se deben seguir los principios básicos de diseño instruccional. Pueden encontrarse valiosos recursos en el sitio del International Council of Ophthalmology ingresando a: http://www.icoph.org/refocusing_education/educational_ programs/e_learning.html
Asimismo, se puede obtener más información en los comentarios que hizo Eduardo Mayorga, uno de los padres de esta nueva modalidad formativa, en https:// oftalmologoaldia.com/por-quee-learning/




 Teñir la cápsula con azul tripano, lo que permite no sólo una mejor visualización, sino que agrega una reducción en la elasticidad de la cápsula anterior. Es recomendable te ñir bajo un colchón de viscoelástico, para evitar la migración del tinte hacia la cavidad vítrea a través del defecto zonular, lo cual nos reduciría el reflejo rojo y haría el procedimiento más difícil.
Teñir la cápsula con azul tripano, lo que permite no sólo una mejor visualización, sino que agrega una reducción en la elasticidad de la cápsula anterior. Es recomendable te ñir bajo un colchón de viscoelástico, para evitar la migración del tinte hacia la cavidad vítrea a través del defecto zonular, lo cual nos reduciría el reflejo rojo y haría el procedimiento más difícil.
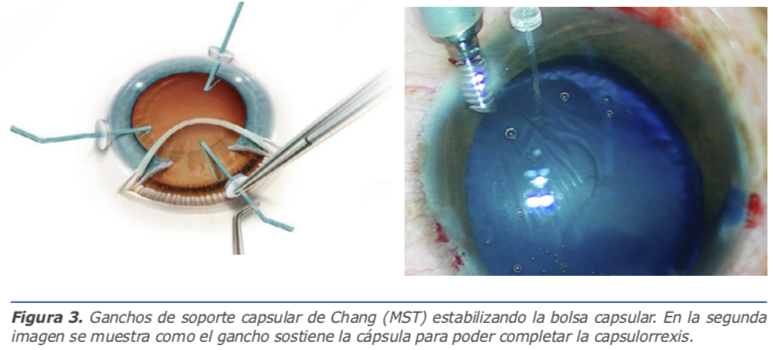
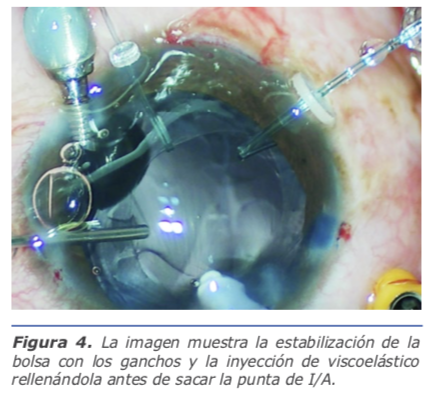 Para aspirar los restos corticales se debe también mantener parámetros bajos y puede ser necesario realizar viscoaspiración si se observa mucha inestabilidad capsular (Figura 4).
Para aspirar los restos corticales se debe también mantener parámetros bajos y puede ser necesario realizar viscoaspiración si se observa mucha inestabilidad capsular (Figura 4).
 En la lámpara de hendidura se debe evaluar funcionalidad palpebral, menisco lagrimal, descartar presencia de blefaritis, disfunción de glándulas de Meibomio, queratitis, tiempo de ruptura de la lágrima (BUT), prueba de Schirmer y, en caso de ser necesario, se puede recurrir a estudio de la osmolaridad lagrimal, detección de metaloproteinasas, niveles de anticuerpos o citología de impresión conjuntival, entre otros.
En la lámpara de hendidura se debe evaluar funcionalidad palpebral, menisco lagrimal, descartar presencia de blefaritis, disfunción de glándulas de Meibomio, queratitis, tiempo de ruptura de la lágrima (BUT), prueba de Schirmer y, en caso de ser necesario, se puede recurrir a estudio de la osmolaridad lagrimal, detección de metaloproteinasas, niveles de anticuerpos o citología de impresión conjuntival, entre otros.









 En los últimos años se ha buscado la posibilidad de manejar ambas patologías en una sola cirugía, pero de una forma efectiva y eficaz. En las últimas dos décadas se introdujo el concepto de cirugía de glaucoma mínimamente invasiva (MIGS, por sus siglas en inglés) que corresponde a un conjunto de procedimientos que han demostrado proporcionar una reducción sostenida de la PIO sin las desventajas de la medicación hipotensiva ocular (por ejemplo, falta de cumplimiento, enfermedad de la superficie ocular, costo) o el riesgo adicional sustancial asociado con las cirugías filtrantes.9 A menudo, los MIGS se pueden combinar con la cirugía de cataratas mediante facoemulsificación usando la misma incisión en córnea clara de la FACO. Hasta la fecha, los procedimientos MIGS disponibles ofrecen resultados más modestos que la cirugía de glaucoma tradicional, pero con el beneficio de un perfil de riesgo más seguro y con otras ventajas como las siguientes: una microincisión interna que ahorra conjuntiva y facilita la cirugía futura de glaucoma, si fuese necesario; traumatismo tisular mínimo; eficacia moderada; y recuperación visual rápida.10
En los últimos años se ha buscado la posibilidad de manejar ambas patologías en una sola cirugía, pero de una forma efectiva y eficaz. En las últimas dos décadas se introdujo el concepto de cirugía de glaucoma mínimamente invasiva (MIGS, por sus siglas en inglés) que corresponde a un conjunto de procedimientos que han demostrado proporcionar una reducción sostenida de la PIO sin las desventajas de la medicación hipotensiva ocular (por ejemplo, falta de cumplimiento, enfermedad de la superficie ocular, costo) o el riesgo adicional sustancial asociado con las cirugías filtrantes.9 A menudo, los MIGS se pueden combinar con la cirugía de cataratas mediante facoemulsificación usando la misma incisión en córnea clara de la FACO. Hasta la fecha, los procedimientos MIGS disponibles ofrecen resultados más modestos que la cirugía de glaucoma tradicional, pero con el beneficio de un perfil de riesgo más seguro y con otras ventajas como las siguientes: una microincisión interna que ahorra conjuntiva y facilita la cirugía futura de glaucoma, si fuese necesario; traumatismo tisular mínimo; eficacia moderada; y recuperación visual rápida.10 Los cuatro enfoques principales de la reducción de la PIO mediante MIGS incluyen el 1) aumento del flujo de salida trabecular mediante la derivación de la malla trabecular yuxtacanalicular, 2) el aumento del flujo uveoescleral a través de vías supracoroidales, 3) la reducción de la producción acuosa del cuerpo ciliar o 4) la creación de una vía de drenaje subconjuntival 8.
Los cuatro enfoques principales de la reducción de la PIO mediante MIGS incluyen el 1) aumento del flujo de salida trabecular mediante la derivación de la malla trabecular yuxtacanalicular, 2) el aumento del flujo uveoescleral a través de vías supracoroidales, 3) la reducción de la producción acuosa del cuerpo ciliar o 4) la creación de una vía de drenaje subconjuntival 8.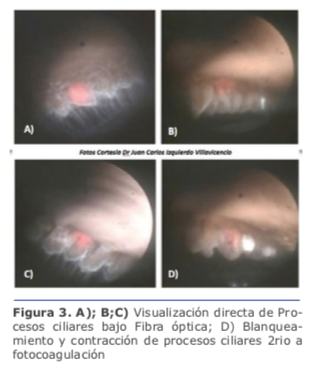 Lindfield et al. encontraron que los ojos que tenían faco-ECP tuvieron una disminución en la PIO media preoperatoria de 21.5 +/1.6 mmHg a 14.4 +/0.8 mmHg después 2 años. Además, el procedimiento produjo menos complicaciones que la facoemulsificación combinada a la trabeculectomía.10
Lindfield et al. encontraron que los ojos que tenían faco-ECP tuvieron una disminución en la PIO media preoperatoria de 21.5 +/1.6 mmHg a 14.4 +/0.8 mmHg después 2 años. Además, el procedimiento produjo menos complicaciones que la facoemulsificación combinada a la trabeculectomía.10

 En casos de queratomileusis o LASIK, mantenga su rutina de cirugía convencional evitando manipular el flap y prevenir así la posible siembra de células epiteliales en la entrecara. Generalmente uso metilcelulosa sobre la córnea, lo que evita el constante goteo de BSS que puede hiperhidratar el epitelio y facilitar una epitelización de la interfase o dentro de las incisiones en las queratotomías refractivas, las cuales ocasionalmente pueden ser mas frágiles y poco compactas. En pacientes con PRK, anticipe la presencia o no de opacidad (haze) que pueda dificultar algunos pasos como la capsulorrexis.
En casos de queratomileusis o LASIK, mantenga su rutina de cirugía convencional evitando manipular el flap y prevenir así la posible siembra de células epiteliales en la entrecara. Generalmente uso metilcelulosa sobre la córnea, lo que evita el constante goteo de BSS que puede hiperhidratar el epitelio y facilitar una epitelización de la interfase o dentro de las incisiones en las queratotomías refractivas, las cuales ocasionalmente pueden ser mas frágiles y poco compactas. En pacientes con PRK, anticipe la presencia o no de opacidad (haze) que pueda dificultar algunos pasos como la capsulorrexis.