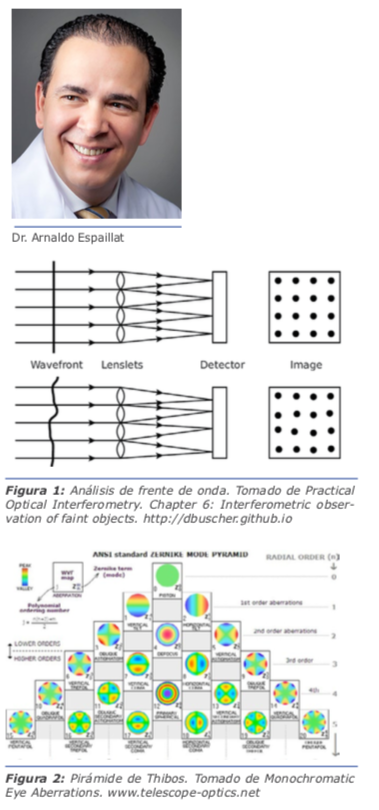
Los aberrómetros se han diseñado para el estudio en la clínica de las alteraciones del frente de onda causadas por las aberraciones. Para estudiar estas aberraciones se emplea el análisis del frente de onda. Este implica la proyección al interior del ojo de finos haces de rayos infrarrojos que son reflectados desde el fondo de ojo y captados con un sensor especular siendo posteriormente sometidos a análisis computarizados (figura 1). Matemáticamente, la información obtenida puede ser analizada de diversos modos (fórmulas de Seydel, Fourier y la más utilizada actualmente, llamada polinomios ortogonales de Zernike, diseñados por el físico holandés Frits Zernike, Premio Nobel de Física de 1953). La denominada pirámide de Thibos, representa los distintos órdenes de estas aberraciones según el análisis de Zernike y su clasificación (figura 2).3
El peso de estas aberraciones en la calidad de la visión es mayor en aquellas localizadas alrededor del eje medial de la pirámide y menor en aquellas periféricas. Esta información es útil para entender el sistema óptico y la calidad de la visión, así como para explicar los síntomas visuales de los pacientes.
Cada aberración puede ser de valor positivo o negativo e induce alteraciones en la calidad de la imagen. La magnitud de estas aberraciones se expresa como un error cuadrático me-
dio (RMS), que es la desviación del frente de onda promediada en todo frente de onda. Cuanto mayor es el valor RMS, mayor es la aberración general para un determinado ojo. La mayoría de los pacientes tienen valores RMS totales inferiores a 0.3 μm. La mayoría de los coeficientes de Zernike de alto orden tienen valores medios cercanos a cero.
Empleando estos polinomios se pueden individualizar las diversas aberraciones:
Aberraciones de bajo orden:
Lasdeordenceroyordenuno no son de utilidad clínica (Pistón y Prisma).
Las de segundo orden son las que tienen mayor peso en la visión:
» Desenfoque esférico (Z20): miopía o hipermetropía
» Astigmatismo oblicuo (Z2 -2)
» Astigmatismo horizontal o ver-
tical (Z2 2)
◊ La sumatoria de estos astigmatismos va a representar el astigmatismo refractivo del paciente.
Aberraciones de alto orden (HOA):
• Tercerorden:
» Coma vertical (Z3 -1) y horizontal (Z3 1)
» Trifolio oblicuo (Z3 -3) y horizontal (Z3 3)
• Cuarto orden:
◊ Cuadrifolio oblicuo (Z4 -4)
◊ Astigmatismo oblicuo de segundo orden (Z4 -2)
◊ Astigmatismo vertical u horizontal de segundo orden (Z4 2)
◊ Cuadrifolio (Z4 4)
◊ Aberración esférica (Z4 0)
Las aberraciones se pueden seguir midiendo en órdenes más elevados, pero el impacto en la calidad visual de estas aberraciones de quinto orden o mayores es mucho menor.
Impacto de las aberraciones ópticas de alto orden en la calidad de visión
Si bien las aberraciones de bajo orden (miopía, hipermetropía y astigmatismo regular) tienen un mayor impacto en la visión, las aberraciones de alto orden también juegan un papel importante, sobre todo en pacientes candidatos a lentes multifocales. Los coeficientes de Zernike que más afectan la calidad visual son coma, aberración esférica y trefoil.
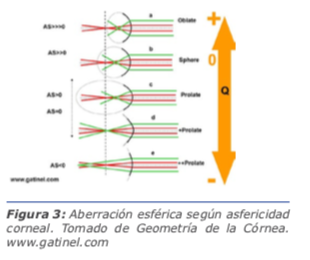
La aberración esférica se genera debido al diferente ángulo de incidencia de los rayos paralelos con respecto a la superficie del lente en la región paracentral y la periférica, llevando entonces a una mayor refracción de los rayos periféricos, con respecto a los paracentrales. En todo lente esférico, los rayos paracentrales se enfocan por detrás de los periféricos, y esto se llama aberración esférica positiva. En los lentes asféricos, dependiendo de si tienden a ser prolatos u oblatos, varía la magnitud de esta aberración. La prolaticidad tiende a disminuir la aberración esférica positiva (siendo este el caso de la córnea humana normal cuya forma es prolata y no esférica). Si se tiende a in-
ducir la oblaticidad (como en una córnea aplanada centralmente por una cirugía refractiva láser para corregir un defecto miópico) la aberración esférica positiva se incrementará. Por el contrario, si un lente asférico tiene mucha prolaticidad, disminuye la aberración esférica positiva y, si la prolaticidad es extrema, puede ocurrir inclusive que los rayos centrales lleguen a enfocarse antes de los periféricos, constituyendo una aberración esférica negativa. Esto sucede en los casos de cirugía corneal refractiva láser para corregir hipermetropía, en donde se aplana la cornea periférica. Esta aberración generalmente reduce el contraste de la imagen retiniana y afecta la calidad visual, especialmente bajo condiciones mesópicas. La aberración esférica es la única aberración de alto orden corregible actualmente en la cirugía de catarata mediante diferentes tipos de lentes intraoculares (Figura 3).4
Los comas (o aberración comática) se deben a descentramientos del sistema óptico y se expresan como una variación en la magnificación en diferentes áreas de la entrada de la pupila, llevando a la aparición de una especie de “cola de cometa” a los puntos de luz. Impactan importantemente la visión. Se ve en córneas ectásicas, tratamientos ablativos descentrados, LIO inclinados o fuera de posición. Producen imágenes dobles, halos y deslumbramientos. Además, afecta el contorno y las esquinas de los objetos. A mayor poder queratométrico de la córnea, mayor será la aberración coma.
El trifolio (en inglés trefoil = trébol) también es conocido como astigmatismo triangular, ya que tiene tres ejes. Producen disminución de la calidad de la visión, halos y deslumbramientos (Figura 3).
Estas aberraciones del frente de onda dependen altamente del tamaño de la pupila y aumentan su valor y, por ende, su impacto visual a medida que la pupi-
Figura 3: Aberración esférica según asfericidad corneal. Tomado de Geometría de la Córnea. www.gatinel.com
la se dilata. Las aberraciones de alto orden también aumentan con la edad, aunque se cree que el efecto clínico se contrarresta con el aumento de la miosis proveniente con la edad. Aunque las aberraciones de bajo orden disminuyen después de una cirugía con propósitos refractivos, si no se toma en cuenta estas aberraciones más silentes y menos llamativas, la calidad de la visión posquirúrgica puede estar en detrimento.
Valores normales de aberraciones oculares totales de alto orden
En un estudio realizado en India se incluyeron 412 ojos (edad promedio de los pacientes 23 años) con defectos refractivos, con agudeza visual mejor corregida 20/20, con pupila natural mayor de 6.0 mm, se determinaron las aberraciones de alto orden con el aberrómetro tipo Hartmann-Shack, el Zywave. El promedio ± desv. estand. de la media cuadrática de las aberraciones de alto orden totales para 6 mm fue de 0.36 ± 0.26 micras.5
Ellos realizaron una tabla comparativa con otros estudios donde también estudiaban los valores normales de las demás aberraciones de alto orden. (Tabla 1):
Lentes intraoculares multifocales
El éxito de las cirugías de cataratas y facorrefractivas para proveer pseudoacomodación está determinado por la ganancia de visión lejana, intermedia y cercana, lo que se traduce en mayor independencia de gafas. Con las técnicas modernas, los fabricantes no solo se preocupan por los focos lejanos y cercanos, sino que también buscan optimizar la calidad de la imagen construyendo lentes intraoculares con superficies más complejas. Los efectos no deseados, como el aumento de los errores de frente de onda, la disminución de la sensibilidad al contraste y la percepción del deslumbramiento y los halos se han reportado con prácticamente todos los modelos de LIO multifocales (bifocales y trifocales). También en los LIO de foco extendido (EDOF, por sus siglas en inglés) se han reportado percepción de deslumbramiento y halos en la visión nocturna.16, 17
Idealmente, las LIO multifocales proporcionarían excelente agudeza visual a distancia y cercana sin comprometer las características inherentes de la función visual normal. El índice de dispersión luminosa intraocular y las aberraciones ópticas de alto orden, provocadas por la óptica refractiva o difractiva, puede conducir a una mala calidad de imagen en la retina. Aun en una cornea perfecta, el contraste de la imagen y, por ende, la calidad de la misma es reducida en cierto grado (Figura 5).6
Los LIO multifocales poseen mayor cantidad de efectos ópticos indeseables que los monofocales, aunque producen multifocalidad. Este intercambio o negociación de una menor calidad visual a cambio de una menor dependencia de gafas debe ser exhaustivamente discutida con el paciente antes de la cirugía.8
Corrección de las aberraciones ópticas con lentes multifocales
El adecuado resultado refractivo en un paciente con implante de LIO multifocal, luego de haber sido seleccionado adecuadamente, se logra corrigiendo las aberraciones. Como fue mencionado anteriormente, las aberraciones más importantes a corregir son las de bajo orden. Esto se logra con un adecuado cálculo del poder dióptrico del lente intraocular, utilizando fórmulas de última generación para la corrección del defecto esférico y, además, corrigiendo el astigmatismo corneal con los distintos métodos existentes (LIO tóricos, incisiones limbares relajantes, etc.). Una vez cubierta esta etapa, se debe plantear la posible corrección de las aberraciones de bajo orden. Actualmente la única aberración de bajo orden corregible es la aberración esférica.
Debido a que no podemos corregir las demás aberraciones, es imperante entonces seleccionar un paciente que naturalmente posea bajas aberraciones de alto orden para lograr un resultado óptimo.
Corrección de aberración esférica
Los lentes intraoculares pueden inducir una aberración esférica positiva, ser neutros o inducir una aberración esférica negativa. Aquellos que inducen aberración esférica positiva son llamados esféricos; estos reducen la calidad de imagen en la retina en la mayoría de los pacientes en condiciones mesópicas, aunque por la naturaleza de su óptica produce mayor profundidad de foco. Solamente están indicados en pacientes con córneas hiperprolatas (pos-LASIK hipermetrópico). Entre los lentes con aberración
Figura 5: Clasificación funcional de los LIOs multifocales. Cedida por el Dr. Joaquín Fernández de España.
esférica positiva tenemos el SA60AT de Alcon con una aberración esférica de +0.14 +/0.09 μm y el lente Sensar de AMO.4
Los lentes que inducen aberración esférica negativa son llamados asféricos. Actualmente son los más utilizados, tanto en los LIO monofocales como multifocales y se desarrollaron con el objetivo de reducir los fenómenos visuales no deseados para proveer un mejor rendimiento del LIO mejorando la calidad de la imagen7. Los LIO asféricos dan mejor sensibilidad al contraste en condiciones mesópicas cuando corrigen la aberración esférica positiva de la córnea, pero generan menor profundidad de foco que los lentes esféricos (Figura 6). Adicionalmente requieren de un mejor centrado, pues un descentramiento de la óptica del lente induce otras aberraciones como el coma. El desempeño del lente es dependiente de la pupila y su4función se deteriora en condiciones mesópicas.
Estudios arrojan que los lentes intraoculares multifocales esféricos y asféricos proveen similares agudezas visuales en visión lejana y próxima, sin embargo, aquellos pacientes en los cuales se le implantó un LIO multifocal asférico tuvieron menos aberración esférica y menos aberraciones de alto orden comparados con los multifocales esféricos,
lo que se traduce en una calidad
de visión superior.7
En pacientes que deseen LIO multifocales, con córneas especiales o con cirugía refractiva previa, la aberración esférica toma mayor importancia. Se sabe que los LIO multifocales distribuyen la luz en varios focos, perdiendo siempre un porcentaje de la transmisión de la luz que puede variar entre un 8 y un 20% de luz. Todos estos lentes presentan una pérdida del contraste en las diferentes distancias 4, por ello no se debe implantar LIO multifocales en casos de córneas con aberraciones de alto orden elevadas como en los casos de cirugía refractiva corneal previa, además del hecho de que son casos de más difícil cálculo del poder del LIO.
¿Qué tanta aberración de alto orden es permitida para implantar un LIO multifocal?
No existe un consenso universal que ayude a determinar qué grado de aberración corneal de alto orden es demasiada para decidir implantar un LIO multifocal, sin embargo, mu-
chos cirujanos han creado valores de corte teóricos que aplican de manera rutinaria en su práctica clínica. Algunos doctores han creado un valor de corte numérico de HOA basado en el diámetro pupilar en conjunto con el HOA. Uno de estos doctores explica que, a 4 mm de diámetro pupilar, 0.3 μm of HOA es similar al desenfoque producido por 0.5 dioptrías de esfera. Este error esférico luego de una cirugía de catarata con propósito refractivo es clínicamente significativo, por lo que valores de HOA mayores de 0.3 μm debe despertar alertas en el cirujano.6
Como la plataforma asférica es la más elegida para los LIO multifocales, es necesario prestar atención a la aberración esférica del paciente. Muchos LIO multifocales utilizan su forma asférica para reducir la aberración esférica. Generalmente la aberración esférica corneal es de +0.27 μm a 6 mm de diámetro pupilar, por lo que un LIO asférico que porta -0.2 o -0.27 de aberración esférica compensa esto, logrando una buena calidad de visión. Existen casos en los cuales la aberración esférica es negativa, población en la cual no se recomienda implantar un LIO multifocal asférico, más bien un esférico. Es por esto que algunos cirujanos toman como punto de corte un valor de 0.1 μm RMS o mayor de aberración esférica para elegir un implante de un LIO multifocal asférico. Si es menor de 0.1 μm RMS, es preferible utilizar un LIO esférico.6
Otras aberraciones de alto orden, como el coma corneal, positivo o negativo, vertical u horizontal, es indicativo de aumento de síntomas visuales desagradables e intolerancia a LIO multifocales, cuando alcanza valores de 0.32 μm o mayores.9
El coma elevado representa un factor determinante en los pacientes insatisfechos luego de una cirugía con un lente multifocal. Autores como Mogamed G. Aly, MD, FRCS, sugiere un punto de corte de Coma <0.25 μm para considerar un LIO multifocal. Pacientes con aberraciones comáticas mayores de 0.33 pueden sufrir síntomas disfotópsicos intolerables, e incluso necesitar un recambio de lente. Estudios que correlacionan las aberraciones de alto orden con síntomas disfotópsicos e insatisfacción en pacientes con LIO multifocal sugieren una relación positiva significativa entre la magnitud del coma y el grado de insatisfacción luego de la cirugía.10
Un estudio realizado en 2012 muestra que pacientes con 0.12 μm de quatrefoil horizontal han tenido problemas para tolerar la multifocalidad, mientras aquellos con valores menores de 0.07 μm podían tolerarlo. En esta misma investigación se encontró que los pacientes insatisfechos con sus LIO multifocales, el valor total de RMS de la tercera y cuarta generación de HOA fue de 0.23 o mayor. Pacientes con estos valores menores de 0.18 fueron más tolerantes a la multifocalidad.9
Las aberraciones de alto orden también tienen impacto en la percepción de fenómenos disfotópsicos en pacientes con LIO multifocales. Estudios demostraron una correlación directa entre el área del halo con el RMS del HOA corneal. Esto sugiere el impacto existente de las aberraciones corneales en la percepción de disfotopsias positivas.11
En cuanto a la aberración cromática y su impacto en la visión es importante anotar aquí que las innumerables longitudes de onda
de un mundo multicolor ocupan diferentes lugares de enfoque en el grosor de la retina. Es así como las longitudes de onda corta en el espectro de los azules se enfocan en la parte anterior de la retina, las longitudes de onda media del espectro del amarillo y naranja se enfocan en la parte media de la retina y, por último, las longitudes de onda larga que corresponden a la gama de colores en el espectro del rojo se enfocan en la parte más posterior de la retina. Las aberraciones y RMS tienden a incrementarse en la medida en que la longitud de onda también aumenta.
Existen LIO de rango de visión extendida (EDOF), cuyo diseño combinado refractivo/difractivo provee profundidad de foco mientras compensa la aberración cromática y la esférica para mejor sensibilidad al contraste. Esta compensación cromática es prácticamente completa en visión lejana y muy relevante en el foco intermedio. Este hecho, acompañado con el diseño asférico del lente, contribuye a la percepción de imágenes más nítidas y mejor rendimiento del lente.12
Los lentes EDOF están demostrando ser una buena elección para pacientes operados de cirugía córneo-refractiva miópica previa, pues ayudan a corregir la aberración esférica positiva, mejoran la aberración cromática, prácticamente no pierden transmisión de luz hacia la retina y son más tolerantes a defectos refractivos residuales. 18
Desde el punto de vista de las aberraciones ópticas, nuestros criterios personales para selección de LIO multifocal en el Instituto
Espaillat Cabral son tomados del OPD scan III (Nidek). Se califica para implantar un LIO multifocal si la pupila mesópica es <6.0 mm, ángulo Kappa <0.55 para lentes trifocales y <0.7 para LIO EDOF (Symfony). Además, debe presentar aberraciones corneales totales de alto orden de RMS <0.5 μm, aberración esférica <0.4 μm, Coma <0.4 μm, trefoil <0.3 μm.
Aberraciones ópticas como medida de calidad visual
Además de la agudeza visual, se han utilizado para evaluar la calidad óptica después de la cirugía de cataratas la sensibilidad al contraste, la función de transferencia de modulación (MTF), la función de dispersión puntual (PSF), el índice de dispersión luminosa (OSI) y las aberraciones oculares. Estudios sugieren que ni los valores de la agudeza visual ni de las aberraciones oculares por sí solos arrojan valores que demuestran la calidad óptica real. En una investigación donde comparaban lentes bifocales asféricos (SN6AD1) comparada con lentes monofocales asféricos, las aberraciones oculares arrojaron valores similares en ambos grupos. Sin embargo, se encontraron valores significativamente más altos del índice de dispersión luminosa (OSI) y valores más bajos de corte MTF, ratio de Steel y sensibilidad al contraste en el grupo de LIO bifocal.13
Otros estudios demuestran correlación negativa importante entre la calidad de la imagen retiniana basado en el Strehl ratio y las aberraciones ópticas totales. Quedó demostrado que las aberraciones ópticas producen degradación de las imágenes en la retina, lo que está relacionado al cociente de Strehl. A diferencia del MTF, el cual arroja información del contraste, el
cociente de Strehl explica la intensidad del brillo de la imagen en la retina. Se puede inferir entonces que las aberraciones ópticas pueden afectar la sensibilidad al contraste y la intensidad del brillo de la imagen de manera diferente y aislada una de otra.14
Esto es posiblemente explicado por el diseño único de un lente multifocal. Los LIO multifocales difractivos están diseñados para permitir la luz visible ser dividida en múltiples puntos de enfoque. Por consiguiente, esta difracción afecta distintamente las diferentes longitudes de onda y esto podría subestimar la entrada correcta de luz a la retina. Esta subestimación podría ser la razón de la poca correlación entre las aberraciones oculares y los parámetros a tomar para determinar la calidad óptica.14
Se recomienda entonces incluir medidas tales como el MTF, PSF, cociente de Strehl (SR), OSI y la normativa de cada uno de estos a la hora de evaluar el rendimiento visual de un paciente con LIO multifocal.11
La razón por la que un diferente nivel de aberraciones ópticas afecta de manera disímil la visión tiene que ver con los múltiples factores que están involucrados en esta función, además de la calidad de la imagen retiniana, específicamente la densidad de los fotorreceptores y el procesamiento cortical. Ya que las aberraciones oculares son sólo una parte del proceso, no son predictores precisos de la función visual.








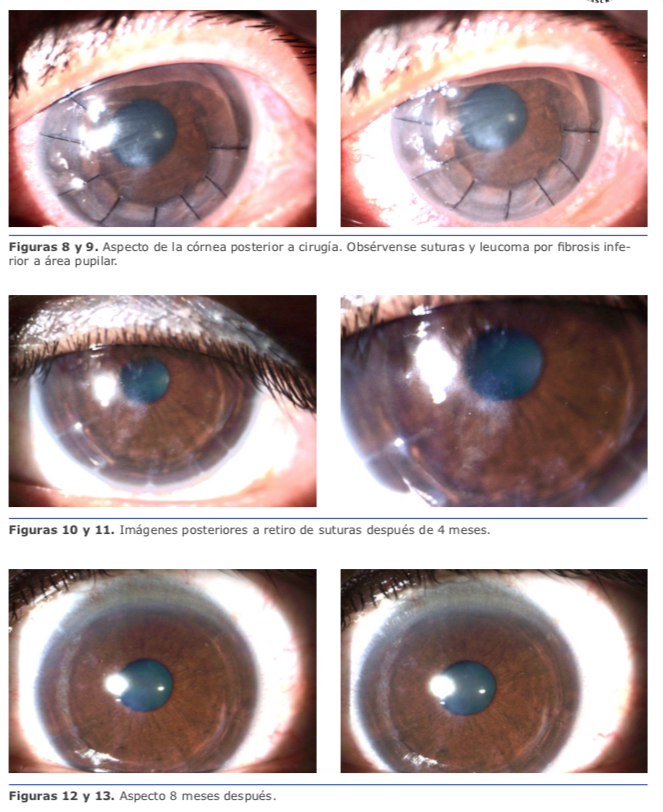
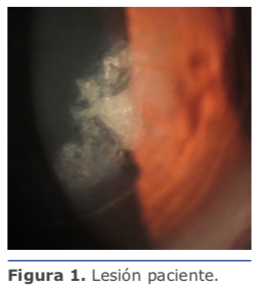 Al momento de la intervención se encuentra, además de material gelatinoso característico de epitelización, áreas de fibrosis con marcada adherencia del colgajo al lecho estromal. Luego de limpieza meticulosa de cara interna del flap y lecho estromal utilizando esponjas Merocel, se aplica MMC 0.02 % por 30 segundos seguido de irrigación profusa de BSS. Se reposiciona el colgajo y se coloca un lente de contacto blando terapéutico.
Al momento de la intervención se encuentra, además de material gelatinoso característico de epitelización, áreas de fibrosis con marcada adherencia del colgajo al lecho estromal. Luego de limpieza meticulosa de cara interna del flap y lecho estromal utilizando esponjas Merocel, se aplica MMC 0.02 % por 30 segundos seguido de irrigación profusa de BSS. Se reposiciona el colgajo y se coloca un lente de contacto blando terapéutico.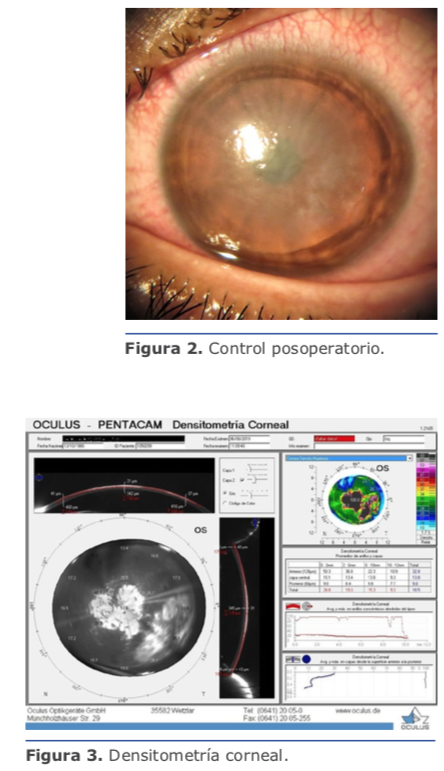



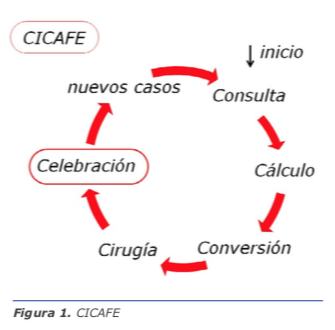 Este método, al alcance de un oftalmólogo enfocado en trabajo de calidad, crea un círculo virtuoso que se autoalimenta (Ver figura 1).
Este método, al alcance de un oftalmólogo enfocado en trabajo de calidad, crea un círculo virtuoso que se autoalimenta (Ver figura 1).


 Bibliografía:
Bibliografía: