Dr. Roberto Velázquez
Costa Rica
La pregunta que nos hacemos es si el aberrómetro transoperatorio realmente nos ayudará en la búsqueda de un resultado perfecto. Pero con tantas variables a considerar y equipos que dan tanta información, cada día es más difícil saber si el resultado va ser reproducible en cada paciente que operamos.
La decisión en mejorar los resultados va de la mano con la corrección del astigmatismo. Desde el año 2015 utilizamos el marcador digital VerionTM y fue una gran sorpresa el poder ver cómo se incrementaban las correcciones del astigmatismo. Después de tener mejores resultados cada día en las refracciones posoperatorias, se consideró iniciar con aberrometrías transoperatorias. Para el año 2017 llegó el ORATM, el aberrómetro transoperatorio.
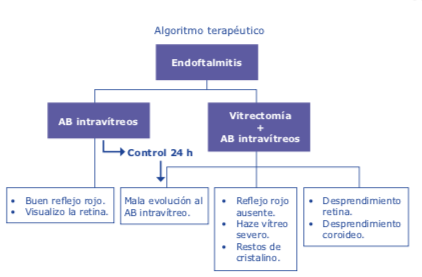
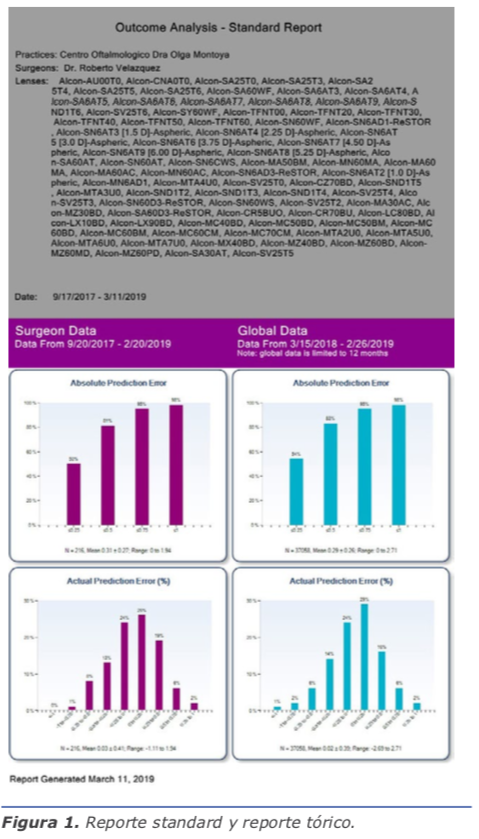 El ORATM cuenta con un programa en línea llamado AnalyzORTM. Este programa es de suma importancia, porque es aquí donde insertamos los datos de los pacientes antes de la cirugía para poder realizar la medida de manera exitosa. También es el que nos va ayudar a personalizar las constantes de nuestros lentes, una vez que llevemos un número de lentes de la misma plataforma. Al inicio, cuando empieza uno, el lente está optimizado de manera global, y en la medida sale un color amarillo a la par de la lente escogida. Hasta que realicemos un número de cirugías y coloquemos la información posquirúrgica iniciando 10 días después de operados, el sistema nos personalizará la constante y el color cambiará a plateado. Es importante realizar la importación de los datos posoperatorios para poder mejorar nuestros resultados. El AnalyzORTM muestra en gráficas, como se aprecia en la figura, el resultado de todas los lentes que utilizamos y, a su vez, nos puede mostrar el manejo del astigmatismo de nuestras cirugías en gráficas. Cuando vemos en la gráfica el error actual predictivo en porcentaje, podemos ver la tendencia si estamos hipocorrigiendo o, al contrario, dejando hipercorregidos a los pacientes. Dentro de las opciones, podemos escoger cada lente por separado y ver los resultados reales. También tenemos la posibilidad de valorar de manera eficaz los resultados de pacientes poscirugía refractiva, como es el LASIK o la queratotomía radiada. Aquí he encontrado una gran ayuda con el ORATM, ya que los resultados han sido muy satisfactorios. (Ver figuras 1 y 2)
El ORATM cuenta con un programa en línea llamado AnalyzORTM. Este programa es de suma importancia, porque es aquí donde insertamos los datos de los pacientes antes de la cirugía para poder realizar la medida de manera exitosa. También es el que nos va ayudar a personalizar las constantes de nuestros lentes, una vez que llevemos un número de lentes de la misma plataforma. Al inicio, cuando empieza uno, el lente está optimizado de manera global, y en la medida sale un color amarillo a la par de la lente escogida. Hasta que realicemos un número de cirugías y coloquemos la información posquirúrgica iniciando 10 días después de operados, el sistema nos personalizará la constante y el color cambiará a plateado. Es importante realizar la importación de los datos posoperatorios para poder mejorar nuestros resultados. El AnalyzORTM muestra en gráficas, como se aprecia en la figura, el resultado de todas los lentes que utilizamos y, a su vez, nos puede mostrar el manejo del astigmatismo de nuestras cirugías en gráficas. Cuando vemos en la gráfica el error actual predictivo en porcentaje, podemos ver la tendencia si estamos hipocorrigiendo o, al contrario, dejando hipercorregidos a los pacientes. Dentro de las opciones, podemos escoger cada lente por separado y ver los resultados reales. También tenemos la posibilidad de valorar de manera eficaz los resultados de pacientes poscirugía refractiva, como es el LASIK o la queratotomía radiada. Aquí he encontrado una gran ayuda con el ORATM, ya que los resultados han sido muy satisfactorios. (Ver figuras 1 y 2)
Lo primero a considerar antes de iniciar con el ORATM es verificar que nuestro paciente coopere y pueda fijar. Una vez pasada la prueba que nos ayudará a minimizar el tiempo en quirófano, valoramos las queratometrías, longitud axial, distancia blanco a blanco y el lente que vamos a colocar. Hay una lista de lentes intraoculares en la plataforma y el utilizarlo de manera continua nos ayudaría a mejorar los resultados.
 Como cirujanos hemos pasado tiempo perfeccionando las técnicas y permitiendo que la tecnología nos ayude con los pasos para poder llegar al gran momento, la implantación de un lente que le va permitir ver a nuestro paciente. ¡Qué gran momento ha llegado! Vemos el entorno, no hay alteración en la bolsa capsular, la córnea está transparente y sin ninguna alteración, y el momento de la confirmación del lente transquirúrgico llegó. Le pedimos a nuestro paciente que enfoque un punto de fijación y en 2 segundos tenemos 40 tomas que nos confirman nuestro plan.
Como cirujanos hemos pasado tiempo perfeccionando las técnicas y permitiendo que la tecnología nos ayude con los pasos para poder llegar al gran momento, la implantación de un lente que le va permitir ver a nuestro paciente. ¡Qué gran momento ha llegado! Vemos el entorno, no hay alteración en la bolsa capsular, la córnea está transparente y sin ninguna alteración, y el momento de la confirmación del lente transquirúrgico llegó. Le pedimos a nuestro paciente que enfoque un punto de fijación y en 2 segundos tenemos 40 tomas que nos confirman nuestro plan.
La medida debe tomar en consideración varios aspectos. El primero será la posición de la cabeza del paciente que esté perpendicular a nuestro microscopio y que no tenga rotación, de lo contrario se va a manifestar un astigmatismo que no es real. Una vez verificada la posición de la cabeza, debemos tener una adecuada tensión intraocular, con la cual usamos el tonómetro que viene con el equipo y verificar que tengamos la presión adecuada. Si nuestras heridas son autoselladas y mantienen la presión intraocular, normalmente son incisiones con láser, podemos usar nuestra solución para la medida, pero mi recomendación seria usar viscoelástico cohesivo. En este paso no podemos mezclar viscoelásticos, por lo que, si estamos usando viscoelástico dispersivo, es de suma importancia removerlo antes de realizar las medidas, de lo contrario la toma puede ser afectada.
Ya el momento llegó y vemos en nuestra pantalla 3 imágenes las cuales nos ayudan a una toma confiable. Tenemos el enfoque que se ve en una columna con un círculo que debe estar en el centro y este a su vez va acompañado de
una imagen de 4 puntos blancos, que astigmatismo y no lo estamos
es el enfoque de la primera imagen de Purkinje. Esta imagen debe ser clara, lo cual nos indica que la córnea está bien hidratada. En la parte superior derecha está la imagen de retroiluminación donde podemos apreciar la capsulorrexis y si aún hay restos en la bolsa capsular. Aquí es de suma importancia que esté lo más limpio posible para que nuestra toma sea confiable y más aún en lentes de alta demanda visual, como puede ser un lente multifocal tórico.
La imagen más grande que se ve es donde nuestro paciente está enfocando y se ve a tiempo real una imagen esferocilíndrica que, cuando está de color verde, la toma está lista para que podamos proceder. Mi recomendación –antes de pedirle a nuestro asistente que inicie la medición, o bien nosotros con el nuevo aberrómetro transoperatorio con el sistema de VerifEyeTM VLynk, que permite controlar con el pie del facoemulsificador en el caso de utilizar plataformas que interactúan entre ellas– es ver la medición a tiempo real del astigmatismo y, cuando este esté en color verde y no tenga muchas fluctuaciones en la medida, iniciar los 2 segundos de confirmación.
Una vez realizada de 1 a 3 tomas (recomiendo 3 tomas como mínimo para los lentes de corrección de astigmatismo), vemos varias informaciones en nuestra pantalla. La primera es ver el poder del lente, y aquí es donde vemos el equivalente esférico posible después de nuestra cirugía.
El ORATM siempre va ayudar con nuestro equivalente esférico, así que, si estamos induciendo mucho corrigiendo con un lente tórico, el cálculo va a dejar una esfera positiva. No es que el cálculo fue erróneo cuando refractamos a nuestro paciente y vemos que quedó hipermétrope; al contrario, valoramos el astigmatismo residual y vemos cómo intento sacar ese equivalente esférico. Aquí es donde recomiendo usar lentes tóricos para poder tener mejores resultados.
Después de valorar la esfera, nos movemos a las recomendaciones de toricidad, si es el caso de colocar un lente tórico. Si no hay lentes tóricos, vemos el resultado de la aberrometría, y la recomendación para lentes monofocales es el equivalente esférico negativo más próximo a cero. Si al contrario es un lente tórico, vemos en nuestra columna derecha M1, M2, M3, que son las medidas a diferentes tiempos un total de 120 medidas, el astigmatismo y el eje que nos están indicando para poder colocar el valor más próximo a nuestro esquema quirúrgico previo.
Aquí es donde el astigmatismo posterior se está midiendo y está modificando en algunos pacientes el eje y algunas veces el cilindro. Ya tenemos el poder del lente y la toricidad, valoramos el equivalente esférico que nos muestra en este momento. Lo ideal sería dejar el poder más positivo próximo al cero en los lentes multifocales y multifocales tóricos y, en los casos de lentes monofocales y monofocales tóricos, dejar el equivalente más próximo negativo a cero.
Colocamos el lente en la bolsa capsular, y hay varias formas para poder confirmar el eje que va a quedar el lente y que nos va dejar el mejor equivalente esférico. Si tenemos un marcador digital, nos facilita la toma porque colocamos el lente y lo rotamos a la posición recomendada y podemos realizar inmediatamente la toma de confirmación del eje. El aberrómetro indicará si hay necesidad de más rotación o si hay que corregirlo. Si no contamos con un marcador digital, lo correcto sería sacar todo nuestro viscoelástico para luego no tener que recolocar el lente y, siempre que tengamos una adecuada presión intraocular, realizamos la medida de confirmación del eje, para de esta forma terminar la cirugía.
Desde que empezamos a utilizar el sistema ORATM con VerifEye+TM, se nos ha facilitado en términos de tiempo de la colocación final del lente porque tenemos la posibilidad de verificar el eje digitalmente. Así siendo, la remoción del viscoelástico es más fácil y si hay necesidad de rotación, sabemos con exactitud dónde queremos dejar el eje.
Satisfacción es el momento en que, al día siguiente, tomamos la visión del paciente y obtenemos el resultado esperado. Aquí es importante recordar el AnalyzORTM o el sistema en el cual de mas resultados posquirúrgicos. Estos se deben colocar después de 10 días, si se colocan antes, no se consideran para la estadística. Dentro del programa del AnalyzORTM se puede observar subfolders donde se encuentran pacientes en preoperatorios, cirugías, posoperatorios, posoperatorios que sobrepasan el tiempo para colocar la información, y reportes. Considero este último muy importante porque es lo que nos va ayudar a personalizar nuestros resultados y, de esta forma, mejorar en el tiempo.
Se va a colocar la agudeza visual sin corrección, la agudeza visual con corrección, la esfera, el cilindro, el eje, las queratometrías, el eje más curvo. Este genera una gráfica en la cual podemos trabajar corrigiendo nuestra tendencia hacia la hipercorrección o la hipocorrección con cada lente específico que colocamos. Hay varias maneras de interpretar la información, dependiendo de nuestra necesidad. Existe la posibilidad de valorar los lentes tóricos, lentes monofocales con incisiones relajantes o bien casos realizados con láser de femtosegundo.
Dentro de los resultados que podemos analizar están el reporte de los resultados generales, que a su vez da la opción de resultados con lentes intraoculares e incisiones relajantes, resultados estándares, resultados posqueratotomía radiada, resultados postLASIK miópico e hipermetrópico. Nuestra experiencia con los pacientes operados con cirugías radiadas y LASIK miópico e hipermetrópico mejoró considerablemente con el aberrómetro. En los cortes radiados, cuenta con hasta 8 cortes en los calculadores con resultados muy confiables. En otra opción está el reporte de manejo de astigma- tismo que nos da 3 opciones: mane- jo de astigmatismo con lente tórico e incisiones relajantes, manejo sólo con lentes tóricos y manejo solo con inci- siones relajantes.
 Toda esta información con la cual con- tamos hoy en día se basa en una base de datos de aproximadamente un mi- llón y medio de lentes ya implantados, pero esto es solo un 37 % de casos completados. Los usuarios del ORATM debemos colocar nuestra información posoperatoria para de esta forma poder obtener resultados más allá de lo que nos pudimos imaginar años atrás. Tomemos ventajas de las plataformas tecno- lógicas para que podamos ayudar más a nuestros pacientes. Si trabajamos en equipo, alimentando el AnalyzORTM, vamos ayudar no solo a nuestros pacientes con los resultados, sino a nuestros cole- gas que están en búsqueda de la emetropía. La optimización de las constantes de los lentes es cada día más confiable y reproducible con toda la información posoperatoria que brindemos.
Toda esta información con la cual con- tamos hoy en día se basa en una base de datos de aproximadamente un mi- llón y medio de lentes ya implantados, pero esto es solo un 37 % de casos completados. Los usuarios del ORATM debemos colocar nuestra información posoperatoria para de esta forma poder obtener resultados más allá de lo que nos pudimos imaginar años atrás. Tomemos ventajas de las plataformas tecno- lógicas para que podamos ayudar más a nuestros pacientes. Si trabajamos en equipo, alimentando el AnalyzORTM, vamos ayudar no solo a nuestros pacientes con los resultados, sino a nuestros cole- gas que están en búsqueda de la emetropía. La optimización de las constantes de los lentes es cada día más confiable y reproducible con toda la información posoperatoria que brindemos.
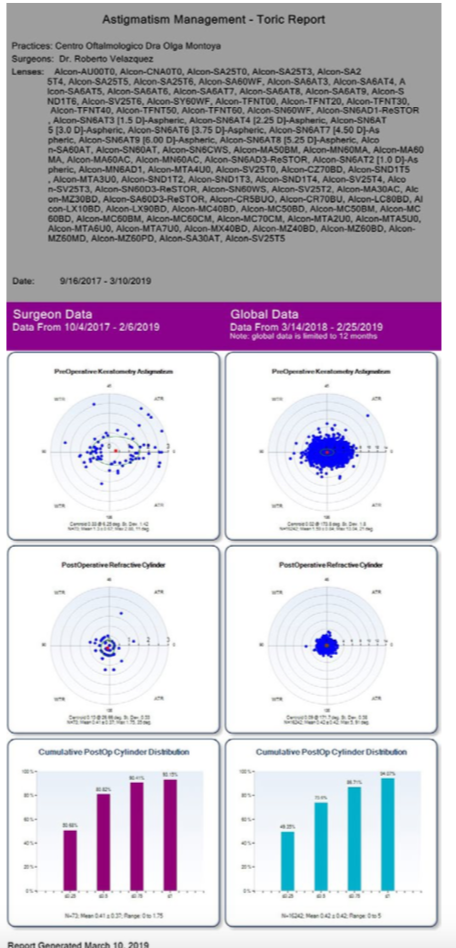
La tecnología avanza cada día más para nuestro uso diario y si trabajamos globalmente en una misma visión, podríamos mejorar aún más nuestros resulta- dos. (Ver figuras 3 y 4)









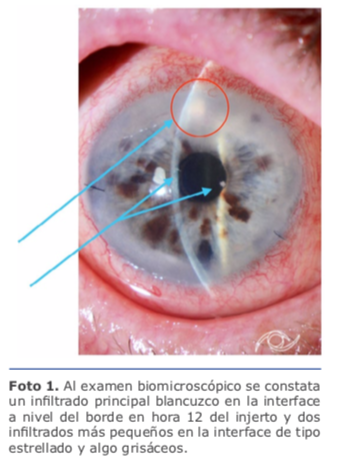
 A partir del 2012, las queratoplastias laminares (DALK, DSAEK/DMEK) han superado juntas en número a las queratoplastias penetrantes en EE. UU. Sin embargo, la incidencia de reportes de infecciones relacionados con los mismos es mucho menor.
A partir del 2012, las queratoplastias laminares (DALK, DSAEK/DMEK) han superado juntas en número a las queratoplastias penetrantes en EE. UU. Sin embargo, la incidencia de reportes de infecciones relacionados con los mismos es mucho menor.

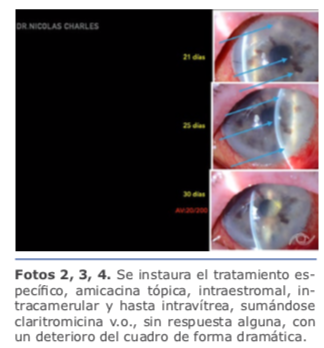
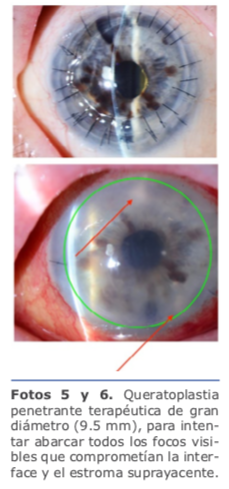
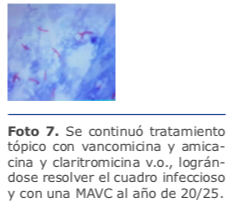
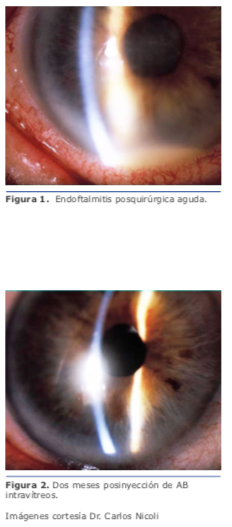 Antibioticoterapia intravítrea empírica
Antibioticoterapia intravítrea empírica