El síndrome de pseudoexfoliación presenta un alto riesgo de complicaciones intra-quirúrgicas y posquirúrgicas que se encuentran relacionadas a las consecuencias que genera la microfibrilopatía sobre las diferentes estructuras oculares, como insuficiente midriasis, presencia de sinequias posteriores, debilidad zonular, entre otras. Se requiere de un exquisito examen preoperatorio y una adecuada y cuidadosa técnica quirúrgica para intentar descender el porcentaje de complicaciones tanto en el proceder del acto quirúrgico como el posoperatorio. En el presente texto se desarrolla una guía de 10 sugerencias para minimizar complicaciones en esta patología.
El síndrome de pseudoexfoliación es una enfermedad sistémica que afecta a diferentes órganos (ojos, sistema vascular, riñones, piel, pulmones, etc.) caracterizado por la producción y depósito de material fibrilar extracelular en la superficie de varios tejidos oculares y extraoculares1. Dentro de las múltiples causas destacan: la edad, factores genéticos, ambientales, inflamatorios y traumáticos. Si bien el origen completo de esta patología aún no está descrito, se sabe que, usualmente, esta patología aparece de forma bilateral, y cuando al momento del diagnóstico no lo es, en general es por su evolución asimétrica, es decir que aún, uno de los dos ojos no muestra los signos clínicos típicos del síndrome al encontrarse en una fase temprana – precoz2,3. Su prevalencia es de 10 a 30% en pacientes de más de 60 años2 sin predominio claro por un sexo4. La prevalencia varía según zonas geográficas. Es más frecuente en países nórdicos y de latitudes bajas dentro del planeta2,4.
A nivel ocular este síndrome es causante de catarata, glaucoma crónico de ángulo abierto, degeneración macular asociada a la edad, subluxación del cristalino, y oclusión de la vena central de la retina2,4,5,6. Además, presenta alta tasa de complicaciones quirúrgicas y posquirúrgicas. Su diagnóstico es siempre clínico. Actualmente existen estudios de imágenes que colaboran en el diagnóstico y otorgan información que ayuda al cirujano a estar más preparado al momento de la cirugía siendo de notable colaboración en la planificación de la misma.
Las cataratas que más frecuentemente se presentan en este síndrome son las nucleares2. El desarrollo y formación de estas, estaría dado como consecuencia de una isquemia ocular, hipoxia del humor acuoso, incremento de los factores de crecimiento y reducción de los factores protectores contra la radiación ultravioleta, debido a niveles bajos de ácido ascórbico en la cámara anterior del ojo2. Además, a nivel genético, se ha detectado una alteración en un gen LOXL1, el cual es el primer contribuyente genético de este síndrome. Dicho gen presenta 3 pleomorfismos de un solo nucleótido (SNP) que se han podido detectar en poblaciones de varios países del mundo7.
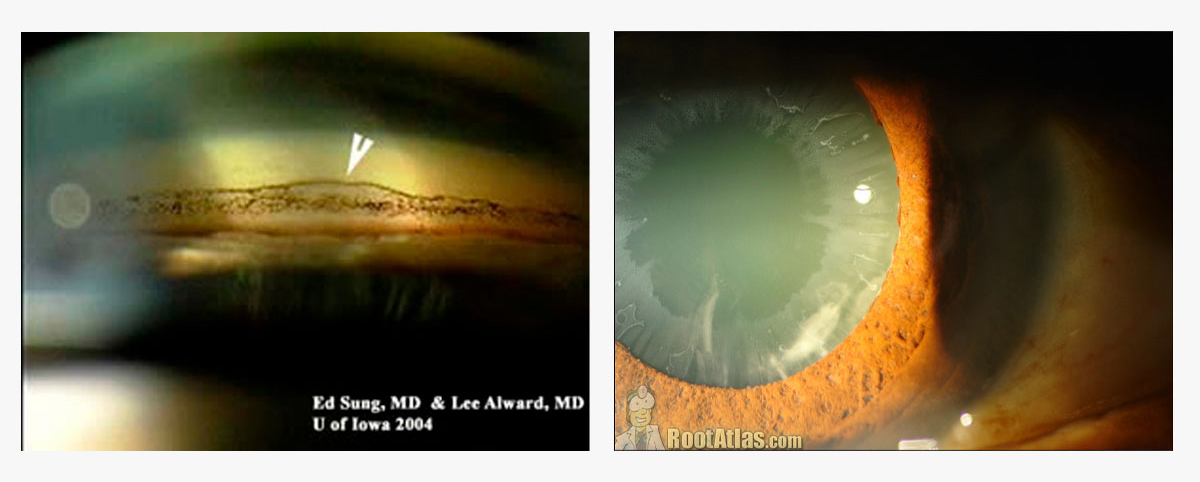
Al examinar un paciente y detectar este síndrome, el cirujano no debería ingresar al quirófano sin antes haber realizado una correcta toma de agudeza visual con la mejor corrección posible, una revisación bajo lámpara de hendidura donde se verifique la presencia de material pseudoexfoliativo a nivel del endotelio, trabeculado, borde del iris, y superficie anterior del cristalino, colocando énfasis en visualizar la presencia de tinciones anormales en el endotelio, controlando el tamaño de cámara anterior8 , verificando a nivel del músculo del iris la presencia de atrofia, así como también se debe buscar pigmento del iris sobre la cápsula anterior del cristalino, incluso presencia de sinequias posteriores. La toma de presión ocular es otro dato fundamental. Se debe realizar bajo midriasis farmacológica un correcto y completo fondo de ojo con evaluación sistemática del nervio óptico, mácula y no olvidar revisar la hialoides anterior donde también se puede encontrar presencia de material pseudoexfoliativo. Sospechar siempre de este síndrome ante la pobre dilatación del iris, la presencia de sinequias posteriores sin otros antecedentes que las pudieran provocar2,9. Al realizar el fondo de ojos (utilizar las mismas gotas que se usarán en el quirófano para conocer la dilatación real que tendrá el paciente el día de la cirugía) es habitual encontrar una imagen sobre la cara anterior del cristalino (cápsula anterior) donde se evidencia material pseudoexfoliativo en forma de halo a la altura de la pupila, posteriormente un espacio “limpio” (sin material pseudoexfoliativo) y a continuación nuevamente otro halo con dicho material el cual es colocado en este lugar con el movimiento de “barrido” que ejecuta el iris según la miosis y midriasis que el ojo realiza en función de la entrada de la luz ambiente (este último halo es percibido solo bajo midriasis). Se debe verificar la presencia de subluxación del cristalino, iridodonesis y facodonesis (resultado de laxitud zonular). Realizar en todos los casos una gonioscopia y buscar la línea de Sampaolesi, casi patognomónica en esta patología2,8, que en ocasiones aparece incluso antes de otras características típicas de este síndrome. El ángulo habitualmente es abierto (salvo en ocasiones donde el síndrome está muy avanzado y puede encontrarse debilidad zonular con luxación del cristalino y cierre angular). Idealmente se sugiere contar con una OCT de segmento anterior o una imagen de UBM, como así también una microscopia especular que ayude a detectar el estado morfológico y la cantidad de células endoteliales. La paquimetría está indicada para ajustar correctamente la toma de presión intraocular2. Lógicamente y como en cualquier cirugía es menester la presencia de una queratometría y biometría para conocer la LIO a implantar. El campo visual y el electrorretinograma de patrón está indicado ante la detección de glaucoma pseudoexfoliativo o hipertensión ocular clara y marcada siempre y cuando la densidad de la catarata lo permita. Una vez el cirujano esté seguro del diagnóstico es recomendable comenzar con antiinflamatorios no esteroides antes de la cirugía4.
Tener presente la edad y comorbilidades del paciente obtenidas en el interrogatorio como así también los hallazgos encontrados en la revisión clínica apoyados por los exámenes complementarios correctos es el primer tip a tener en cuenta para planificar una cirugía cuidadosa y preparada.
El segundo tip a tener presente es que el cirujano sea consciente y honesto consigo mismo para saber si cuenta con la práctica y experiencia suficiente que le permitirá resolver el problema del paciente, o si, por el contrario, debe buscar ayuda en un colega para el momento de la cirugía, o estar listo para derivar mientras crece su práctica; siempre recordar el juramento hipocrático: “primum non nocere”. Hay que hablar con el paciente, explicar los riesgos y las posibles complicaciones en esta cirugía, tanto las intraquirúrgicas como las que pueden aparecer en el posquirúrgico y explicar que la extracción de la catarata no “cura” este síndrome, se debe hablar incluso de la posibilidad de requerir una segunda intervención, en algunos casos con ayuda de un retinólogo, si uno no está suficientemente formado para resolver posibles complicaciones o si no se cuenta en el mismo lugar y horario de la cirugía con dicho profesional. No olvidar dejar en claro, si la catarata lo permite, el estado del nervio óptico para aclarar expectativas y no omitir firmar el consentimiento informado.
Si la decisión es enfrentar la cirugía de esta patología, el tercer tip sería dentro de lo posible, realizar la cirugía con técnica de facoemulsificación (técnica aún no siempre disponible en entornos de bajos recursos). Ingresar al quirófano con todo el material que se pueda requerir (ganchos retractores de iris y de cápsula, anillos de dilatación del iris, así como, la presencia de viscoelásticos cohesivos que mantengan una adecuada dilatación y dispersivos que ayuden a cuidar el endotelio). Saber que si hay presencia de sinequias posteriores se necesitará despegarlas de manera mecánica o farmacológica y lograr, una dilatación cuidadosa, pero optima de unos 6 mm para realizar una rexis circular y continua de entre 5.5 y 6 mm2,4 (utilizando anillos de iris de ser necesario, los ganchos o anillos se suelen usar en dilataciones pobres con pupilas de menos de 5 mm con o sin sinequias). Tener en cuenta que si se estira demasiado el iris con ganchos o anillos se corre el riesgo de lesionar la musculatura del esfínter del iris con el consiguiente resultado de una pupila discórica y una función inadecuada del esfínter iridiano2. La técnica quirúrgica a utilizar debería ser la que el cirujano domine mejor ya que con ella ejercerá menos movimientos y presiones bruscas sobre la cápsula posterior2,4. La cirugía debe ser delicada, con la menor manipulación posible, incluso la hidrodisección debe ser gentil, cuidadosa4 y puede requerir ser sectorizada en diferentes cuadrantes a modo de evitar tensiones extremas sobre la cápsula. Intentar dentro de la comodidad del cirujano si fuera posible, en diálisis zonulares menores a 45 grados iniciar la cirugía colocando el facoemulsificador en dirección opuesta a la desinserción encontrada, de modo de contrarrestar la debilidad zonular y evitar que la misma se acreciente. Idealmente utilizar vacíos elevados y técnicas de enclavamiento (faco chop o quick chop)2.
El cuarto tip es realizar una capsulorrexis curvilínea continua 0.5 mm menor que el tamaño de la óptica de la LIO para tener mejor control de la contracción capsular en el posquirúrgico2.
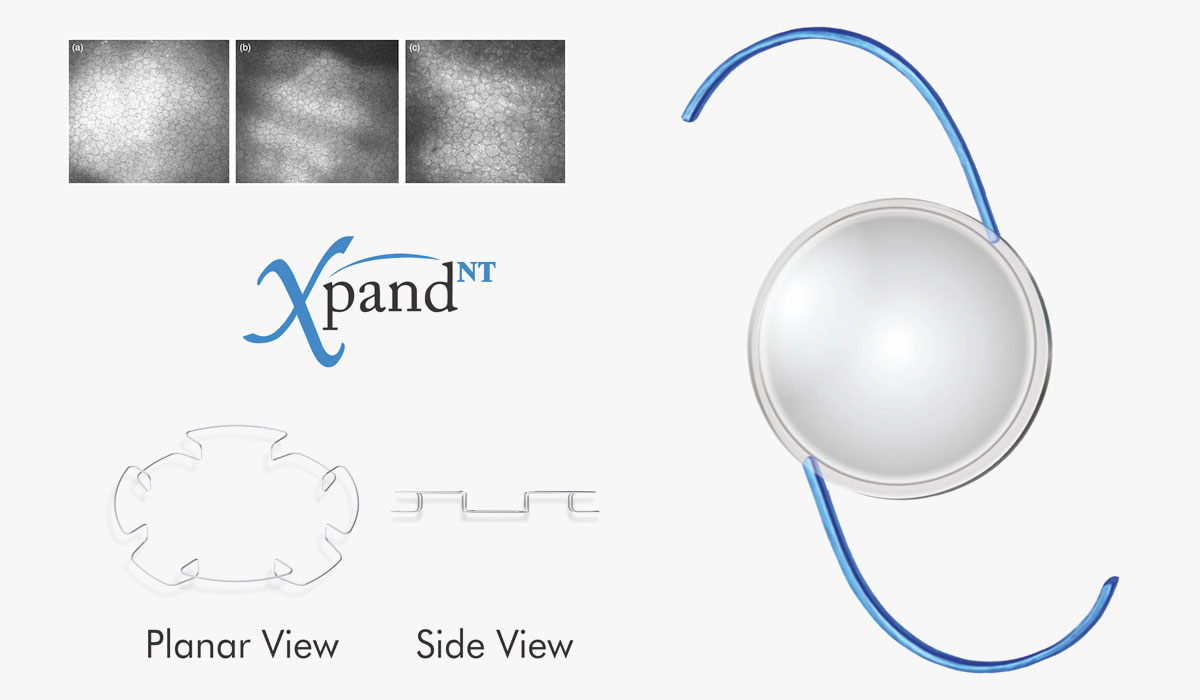
El quinto tip es sobre la elección de la localización y el tipo de LIO. Si el saco está indemne, idealmente colocar la lente dentro de la bolsa, ya que esto le dará más estabilidad, colocando una háptica sobre la zona de desinserción logrando que el saco se distiende y si hay posteriormente retracción capsular no tener colapsos, manteniendo además, la forma y la posición de la bolsa, evitando descentrados indeseados de la lente en el posquirúrgico2. Se prefieren lentes con alta biocompatibilidad (acrílica hidrófoba) con la finalidad de disminuir la inflamación y de bordes cuadrados para disminuir la opacidad de la cápsula posterior)4. Si en cambio hubiera una desinserción zonular superior a 45 grados o está incluso superará los 180 grados y si además el núcleo fuera muy duro es bueno utilizar retractores capsulares, incluso cuando superan los 180 grados se recomienda suturar la lente a la esclera. Dentro de los anillos de tensión capsular uno de los más usados es el de Morcher de 10 mm que tiene como función estabilizar la cápsula, disminuir la tracción hacia la zónula, expandir la cápsula haciéndola más regular, reduciendo el riesgo de luxación, ayudar al centrado de la lente intraocular, disminuir la salida de vítreo, evitar en el posoperatorio la fimosis capsular y prevenir la opacidad capsular posterior10. Si existe ruptura capsular hay que individualizar cada caso, evaluar si hay sostén para colocar la lente en sulcus, y en caso de no contar con suficiente sostén, evaluar lente de tres piezas suturada a esclera, o LIO con fijación en iris.
El sexto tip es tener en cuenta que, una vez retirado el núcleo de la catarata, habitualmente quedan restos corticales adheridos a la cápsula, los cuales al momento de la aspiración ejercen fuerza de tracción sobre la zónula y es por eso que resulta más cauteloso primero colocar la lente dentro del saco aportando estabilidad (aún con la presencia de restos corticales) y luego proceder a retirar los restos con la pieza de mano. Algunos autores incluso mencionan conveniente la colocación de un anillo de tensión capsular y luego proceder a retirar la catarata, o colocarlos luego de la facoemulsificación, previo al implante del LIO4,11 para posteriormente, con la estabilidad que estos aportan proceder al retiro de restos capsulares. Existe controversia sobre cuál es el momento indicado para colocar un anillo de tensión capsular, pues cuanto antes se coloca, más difícil se vuelve la cirugía y si se demora puede ser tarde luego para colocarlo. Es conveniente evaluar caso por caso intentando implantarlo lo más tarde posible, y tan pronto como sea necesario4. Cuando la subluxación supera 4 horas los anillos pierden eficacia y debemos utilizar retractores capsulares para sostener la cápsula durante el proceso de facoemulsificación, y posteriormente suturar el anillo de tensión capsular modificado a esclera4. Las medidas de longitud de blanco a blanco y longitud axial deben guiar la selección del tamaño del anillo de tensión capsular a colocar.
El séptimo tip tiene que ver con el vector de tracción en la aspiración de restos corticales, el mismo idealmente debe ser dirigido hacia la zona de diálisis y no en contra de esta.
El octavo tip es para los casos donde existe ruptura capsular con salida de vítreo a cámara anterior. Lo primero a tener en cuenta es cuando debemos recuperar restos y cuando no, cuando es momento de llamar a un colega retinólogo. Si los restos están accesibles y el cirujano está en condiciones de realizar una vitrectomía anterior para evitar que el vítreo ingrese a la herida principal, debe entonces recuperar todos los restos posibles y realizar la vitrectomía anterior. Si el núcleo es el que se luxo la cámara posterior, de ser posible, se debe intentar recuperar por pars plana, sea con facoemulsificación o de modo manual, teniendo presente el mantenimiento de las presiones del ojo (siempre viscoelástico disponible), si se piensa retirar algún elemento del ojo (como el facoemulsificador) primero colocar viscoelástico a modo de estabilizar la presión del globo ocular y recién después retirar con cuidado el elemento, evitando de este modo, seguir complicando el cuadro. Recordar que si se rompe la cápsula posterior es fundamental disminuir los parámetros del equipo de facoemulsificación, pero no modificar la altura de la botella de irrigación2, colocar viscoelástico cohesivo y realizar vitrectomía anterior siempre.
El noveno tip es no descartar por completo la cirugía extracapsular, ya que la misma en manos expertas, con el uso adecuado de viscoelástico y en cataratas muy duras con un conteo endotelial en límites normales puede ser una opción válida, también lo es en poblaciones de bajos recursos donde no se cuenta con facoemulsificadores, razón por la cual es fundamental conocer la técnica y haber logrado la práctica suficiente de la misma, ya qué hay casos donde se debe recurrir a ella, sea al convertir una faco en EECC o desde el inicio comenzar con ella. En esta técnica tener sumo cuidado al momento de luxar el núcleo a cámara anterior colocando viscoelástico que proteja el endotelio y realizando la incisión lo suficientemente amplia para que el núcleo pueda ser retirado con la mayor facilidad posible, tener cuidado de no “empujar” el núcleo hacia el endotelio mientras intentamos retirarlo ya que esto puede llevar a una descompensación corneal. Se deben realizar incisiones lo más pequeñas posibles para no generar cambios en las presiones del ojo y consecuentemente provocar mayor daño, pero lo suficientemente amplias para que el núcleo sea capaz de salir sin lesionar el endotelio, aquí es importante el arte y la manualidad de cada cirujano al momento de realizar la incisión principal. Muchas veces en casos complejos, como sucede en esta patología, puede servir colocar un trocar con el globo ocular cerrado manteniendo la presión habitual del mismo y ante una eventual complicación contamos con dicho trocar, puesto que es más difícil colocarlo con el ojo ya abierto.
El décimo tip no siempre es posible de ser realizado y tiene que ver con elegir operar a estos pacientes cuando la catarata recién comienza, debido a que cuando las cataratas son más densas, requieren de mayor manipulación, y si las cirugías se realizan sobre ojos con cataratas incipientes se podrá disminuir el trabajo sobre la catarata y congruentemente deberían descender las complicaciones, pero esta situación no siempre es posible y depende de cuando el paciente concurra a control y diagnosticamos esta patología.
Recordar que realizar la cirugía de catarata no logrará suprimir la producción de material exfoliativo en el ojo4. No olvidar los controles posquirúrgicos ya qué hay complicaciones tempranas y tardías que se deben vigilar. Es recomendable dilatar al paciente operado al menos las primeras tres semanas posteriores a la cirugía (durante el primer mes ocurre la contracción capsular) para verificar que no exista una contracción de la cápsula inadvertida y que ello permita una serie de complicaciones indeseadas.
Referencias
Mamani Maquera D J, Valencia Amado G M, Del Carpio Medina F M E. Síndrome de pseudoexfoliación: una aproximación al diagnóstico clínico en oftalmología. Revista Médica Basadrina, 2021; 15 (3): 64-69.
Pérez González H, García Concha Y, Zozaya A B. Síndrome pseudoexfoliativo y cirugía de catarata. Rev Cubana Oftal [Internet]. 10 de mayo de 2012 [citado 18 de abril de 2025];25(2). Disponible en:
https://revoftalmologia.sld.cu/index.php/oftalmologia/article/view/33
Fernández Vigo J I, et al. Evaluación de los signos de la pseudoexfoliación en el segmento anterior mediante tomografía de coherencia óptica y cámara de Scheimpflug. Arch Soc Esp Oftalmol. 2017. http://dx.doi.org/10.1016/j.oftal.2017.06.008
Rodríguez Suárez B, Pérez Candelaria EC, Méndez Duque EAM, et al. Pseudoexfoliación y catarata. Rev Cub Oftal. 2014;27(2):253-263.
Vesti E, Kivelä T. Exfoliation syndrome and exfoliation glaucoma. Prog Retin Eye Res. 2000;19:345-368.
Ritch R. Exfoliation syndrome. Curr Op Ophthalmol. 2001;12(2):124-30.
Hicks PM, Siedlecki A, Haaland B, Owen LA, Au E, Feehan M, et al. A global genetic epidemiological review of pseudoexfoliation syndrome. Explor Med. 2021;2:527 – 43. Https://doi.org/10.37349/emed.2021.00069
Pérez González H, García Concha Y, Gómez Martínez N. Resultados del tratamiento quirúrgico de la catarata en pacientes con síndrome pseudoexfoliativo. Panorama Cuba y Salud [Internet]. 2012;7(3):9-13. Recuperado de:
https://www.redalyc.org/articulo.oa?id=477348949003
Meza de Regil A, Retchkiman-Bret M, Velasco Barona C, Cervantes Coste G. Síndrome de pseudoexfoliación y catarata: resultados visuales postoperatorios. Rev Mex Oftalmol. 2003 [citado 27 ene 2011];77(4). Disponible en:
http://www.medigraphic.com/pdfs/revmexoft/rmo-2003/rmo034c.pdf
Tinoco Ortega R, Guerrero Berger O, Arroyo Muñoz L. Posición efectiva del lente en pacientes con síndrome de pseudoexfoliación. Rev. Mex. de Oftalmol. 2011;85(3):136-141.
López García JS, García Lozano I, Bové Guri M, Martínez Garchitorena J. Cirugía de Catarata en el Síndrome Pseudoexfoliativo. Microcirugía Ocular. 1998;30(6):25.
 Coordinador:
Coordinador: 












 Dr. Sofia Antonela Ambrosetto
Dr. Sofia Antonela Ambrosetto
 Dr. Alejandro J. Aguilar MD, pHD
Dr. Alejandro J. Aguilar MD, pHD









 Dr. Facundo Rodríguez – Argentina
Dr. Facundo Rodríguez – Argentina