Nos complace contar con la participación de destacados especialistas en cirugía de córnea: el Prof. Dr. Guillermo Amescua (EE.UU.) y el Prof. Dr. Juan Carlos Ginés (Paraguay), quienes han sido invitados a debatir tres casos clínicos desafiantes. Cada caso plantea una situación concreta en la práctica quirúrgica diaria, y se invita a los expertos a elegir la opción terapéutica que consideren más adecuada, justificando su elección con base en su experiencia y evidencia clínica.
Caso 1:
Paciente de 55 años con catarata nuclear incipiente, córnea guttata, espesor corneal central de 540 micras y un recuento endotelial de 1000 células/mm². El paciente no presenta sintomatología de descompensación corneal.
Dr. Guillermo Amescua
¿Cuál sería su conducta terapéutica?
- Esperar la aparición de sintomatología y realizar cirugía combinada de catarata y córnea.
- Proceder con cirugía de catarata y observar la evolución de la córnea.
- Realizar cirugía combinada de catarata y córnea de manera simultánea, sin esperar signos de descompensación.
Respuesta: Esta es una situación clínicamente común en nuestro servicio de córnea. Los datos importantes son que no hay sintomatología de disfunción endotelial, el espesor corneal está dentro de límites normales y la catarata es incipiente. Ante una situación como esta, yo optaría por observar al paciente. Si el paciente presentara una catarata ya formada, que se correlaciona con la agudeza visual, y no tuviera síntomas de falla endotelial, y/o si el espesor corneal es menor a 640–650 micras, mi conducta sería ofrecer cirugía de catarata sin combinarla con DMEK/DSAEK. Sin embargo, todo esto varía mucho de paciente a paciente, así como por la logística alrededor de la situación clínica. Es fundamental realizar un buen examen del segmento posterior para valorar la presencia de desprendimiento de vítreo. El riesgo de desgarros retinianos periféricos a esa edad es un factor importante a considerar y siempre debe tenerse en cuenta.
Dr. Juan Carlos Ginés
¿Cuál sería su conducta terapéutica?
- Esperar la aparición de sintomatología y realizar cirugía combinada de catarata y córnea.
- Proceder con cirugía de catarata y observar la evolución de la córnea.
- Realizar cirugía combinada de catarata y córnea de manera simultánea, sin esperar signos de descompensación.
Respuesta: En este caso, considerando la catarata nuclear incipiente y la ausencia de síntomas de descompensación corneal, mi enfoque sería abordar la catarata en primer lugar y luego evaluar la evolución de la salud corneal del paciente post operatoriamente. La presencia de córnea guttata y un recuento endotelial de 1000 células/mm² sugiere la necesidad de un monitoreo estrecho de la salud corneal.
En cuanto a la técnica quirúrgica, consideraría la dureza de la catarata para determinar el enfoque más adecuado. Si se trata de una catarata blanda, podría optar por facoaspiración, mientras que en casos de cataratas más duras, podría ser más apropiado realizar una cirugía de catarata por incisión pequeña manual (MSICS). En ambos casos, utilizaría una combinación de viscoelásticos cohesivos y dispersivos para minimizar el trauma corneal.
Dada la ausencia de síntomas de descompensación corneal, no considero indicada una cirugía corneal simultánea en este momento. El cálculo preciso del poder de la lente intraocular y la limitación de tejido disponible en nuestra región son factores importantes a considerar. Sin embargo, con una estrategia adecuada y un seguimiento estrecho, es probable que la córnea del paciente se mantenga funcional durante un período prolongado, a pesar de la pérdida esperada de células endoteliales asociada a la cirugía.
Caso 2:
Paciente de 30 años con astigmatismo residual mayor a 6 dioptrías tras la retirada de suturas, luego de una queratoplastia lamelar anterior.
Dr. Guillermo Amescua
¿Qué alternativa terapéutica consideraría más adecuada para corregir el defecto refractivo?
- Colocación de anillos intraestromales.
- Cirugía incisional relajante combinada con suturas compresivas.
- Implante de lente fáquico.
Respuesta: Es una situación clínica interesante y relativamente frecuente. Mi decisión varía mucho dependiendo de cuál fue la patología que llevó al paciente a una cirugía de DALK. En general, en nuestra práctica tenemos la ventaja de contar con un excelente servicio de lentes de contacto (rígidos, híbridos, esclerales, etc.), por lo que siempre prefiero comenzar con una opción no quirúrgica. No tengo mucha experiencia con anillos intraestromales debido a las limitaciones impuestas por la FDA para su uso en Estados Unidos. Si el uso de lentes de contacto no es efectivo y/o posible, y el paciente presenta un astigmatismo alto regular o relativamente regular, le ofrezco incisiones relajantes asistidas con láser de femtosegundo para reducir el astigmatismo. Reservo el uso de suturas compresivas para pacientes en los que tengo certeza de que podrán tener un seguimiento adecuado, a fin de evitar complicaciones relacionadas con las suturas. La opción de un lente fáquico también es válida, siempre y cuando el paciente tenga las características anatómicas necesarias para su implantación.
Dr. Juan Carlos Ginés
¿Qué alternativa terapéutica consideraría más adecuada para corregir el defecto refractivo?
- Colocación de anillos intraestromales.
- Cirugía incisional relajante combinada con suturas compresivas.
- Implante de lente fáquico.
Respuesta: En el caso de un paciente con astigmatismo residual mayor a 6 dioptrías después de una queratoplastia lamelar anterior, considero que la opción más adecuada sería la cirugía incisional relajante combinada con suturas compresivas. Esta técnica ha demostrado ser efectiva en la reducción del astigmatismo postoperatorio significativo al ajustar la tensión en la córnea. Sin embargo, es importante destacar que la magnitud de los ajustes es subjetiva y depende en gran medida de la experiencia y habilidad del cirujano.
Es fundamental informar al paciente sobre la posibilidad de requerir correcciones adicionales en el futuro, ya que la cirugía incisional relajante no siempre logra la corrección completa del astigmatismo. En cuanto al implante de lente fáquico, podría ser considerado como una opción secundaria para la corrección de errores refractivos más amplios, pero no sería mi primera elección para abordar específicamente el astigmatismo residual post-queratoplastia.
Caso 3:
Paciente con catarata y córnea opaca e irregular, en quién está indicada una queratoplastia penetrante.
Dr. Guillermo Amescua
¿Cuál sería su enfoque quirúrgico preferido en este contexto?
- Realizar un procedimiento triple (queratoplastia + cirugía de cataratas + lente intraocular) calculado con queratometría teórica.
- Realizar cirugía combinada de catarata y córnea, dejando el implante del lente intraocular para un segundo tiempo quirúrgico.
- Realizar primero la queratoplastia y posponer la cirugía de catarata e implante del LIO hasta la retirada de las suturas corneales.
Respuesta: En general, trato al máximo de evitar la necesidad de un trasplante corneal penetrante. Mi práctica clínica tiene un volumen alto de pacientes con problemas moderados a severos de superficie ocular. Es muy común que atienda pacientes con deficiencia limbar moderada a severa por múltiples causas (quemaduras, pénfigoide, rosácea, etc.) que presentan vascularización corneal superficial secundaria a disfunción de las células limbares, lo que genera opacidad corneal y astigmatismo irregular. Si estos pacientes tienen una catarata significativa, mi conducta es evaluar si toleran bien un lente escleral. Si lo toleran, prefiero evitar una cirugía corneal y realizar únicamente la cirugía de catarata. Si la córnea está opaca e irregular pero tiene buena función endotelial, prefiero intentar un DALK, que en algunos casos se combina con cirugía de catarata en el mismo tiempo quirúrgico. Lo ideal es poder realizar la cirugía de catarata una vez que el trasplante esté estable, tras la retirada de los puntos o cuando la córnea haya alcanzado estabilidad refractiva.
Dr. Juan Carlos Ginés
¿Cuál sería su enfoque quirúrgico preferido en este contexto?
- Realizar un procedimiento triple (queratoplastia + cirugía de cataratas + lente intraocular) calculado con queratometría teórica.
- Realizar cirugía combinada de catarata y córnea, dejando el implante del lente intraocular para un segundo tiempo quirúrgico.
- Realizar primero la queratoplastia y posponer la cirugía de catarata e implante del LIO hasta la retirada de las suturas corneales.
Respuesta: En el caso de un paciente con catarata y córnea opaca e irregular que requiere queratoplastia penetrante, consideraría el enfoque quirúrgico en base a varios aspectos de cada paciente que muchas veces no tiene que ver tanto con el aspecto técnico sino con la opción más factible de acuerdo a la realidad social, económica, geográfica, y del estado de salud físico y mental del paciente.
En el aspecto técnico es crucial sopesar las ventajas y desventajas de un procedimiento único versus secuencial y analizarlo con los aspectos previamente comentados en el párrafo anterior para obtener el mejor plan quirúrgico para el paciente,
El procedimiento triple puede ser beneficioso en pacientes con dificultades en el seguimiento, falta de oportunidades quirúrgicas adicionales, o riesgos quirúrgicos elevados. No obstante, plantea desafíos significativos, como la predicción del astigmatismo residual y la selección precisa del poder del lente intraocular.
Por otro lado, realizar la queratoplastia en primer lugar permite obtener queratometrías estables después de varios meses, lo que facilita un cálculo más preciso del lente intraocular. Además, este enfoque se asocia con una menor inflamación, lo que puede resultar en una recuperación visual más rápida y un menor riesgo de rechazo. Sin embargo, la cirugía de catarata subsiguiente conlleva el riesgo de pérdida de células endoteliales y trauma quirúrgico endotelial, aunque este riesgo es relativamente bajo.
En última instancia, la decisión entre un procedimiento triple y secuencial dependerá de las características individuales del paciente y de la experiencia del cirujano.





 Dr. Facundo Rodríguez – Argentina
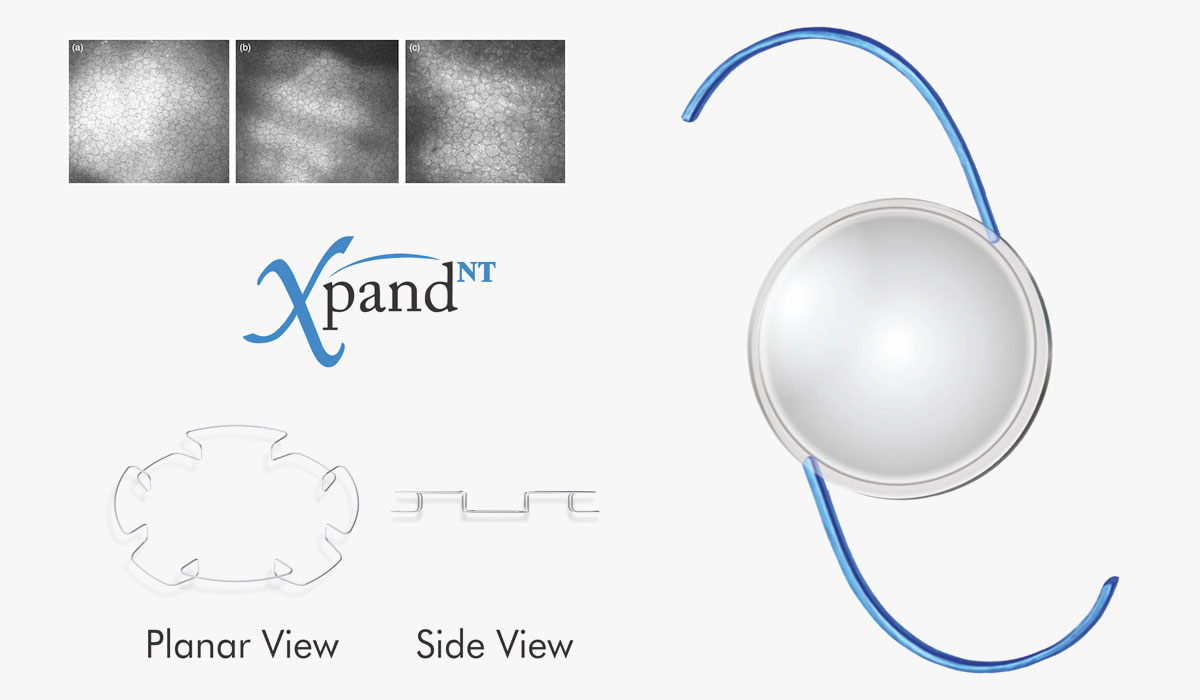
Dr. Facundo Rodríguez – Argentina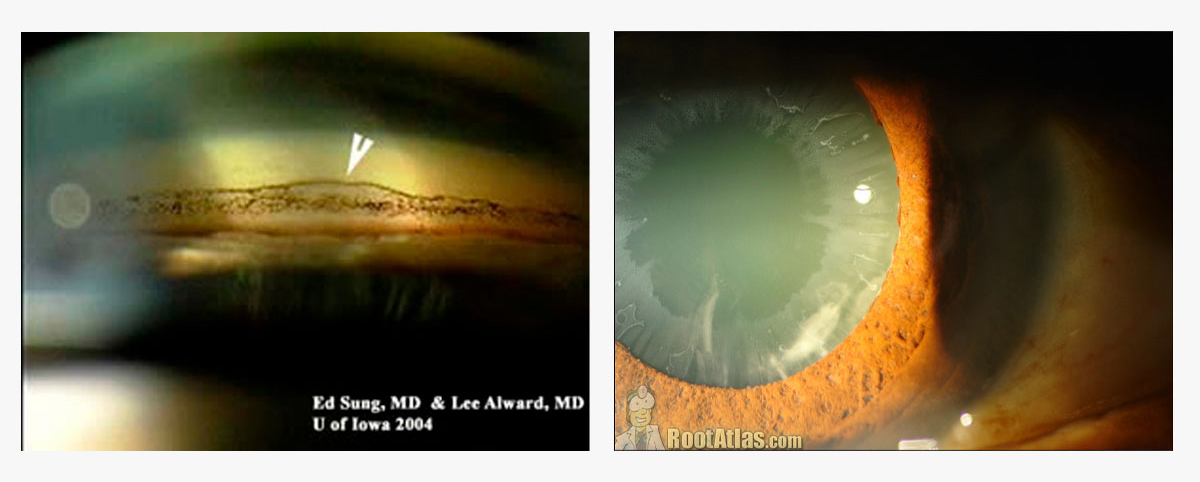

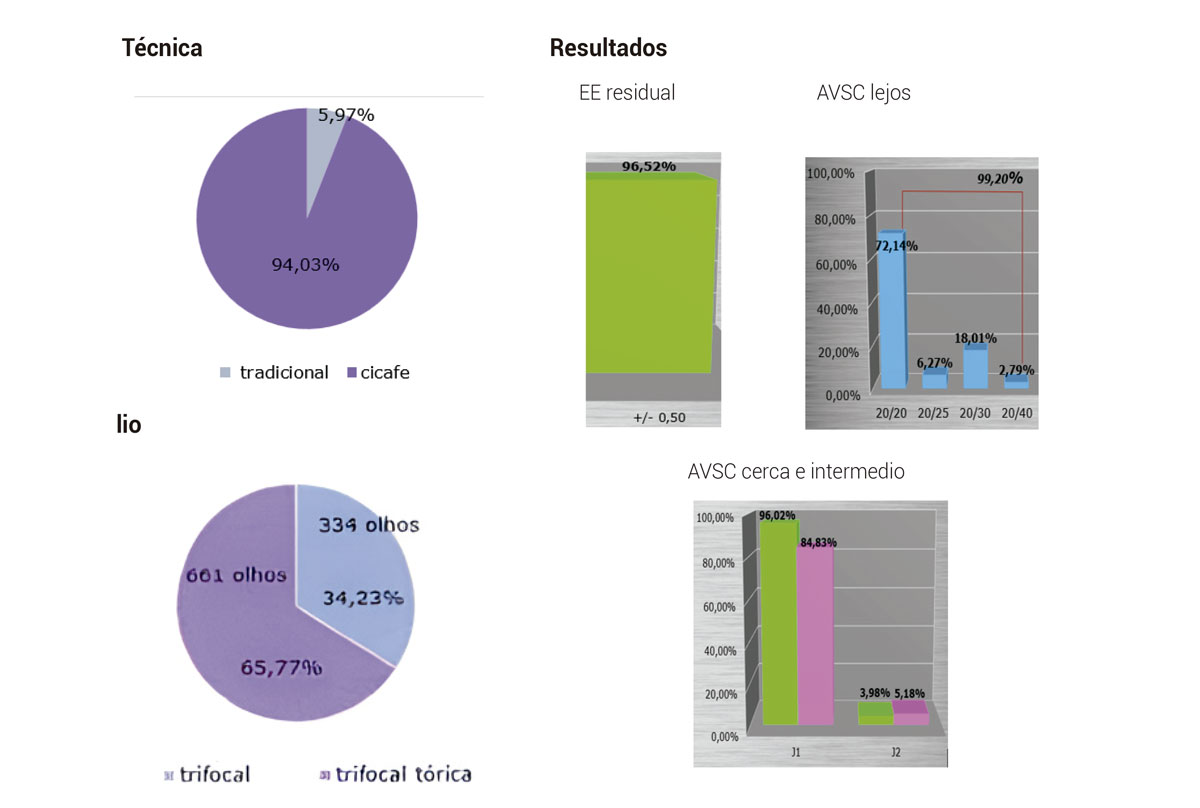
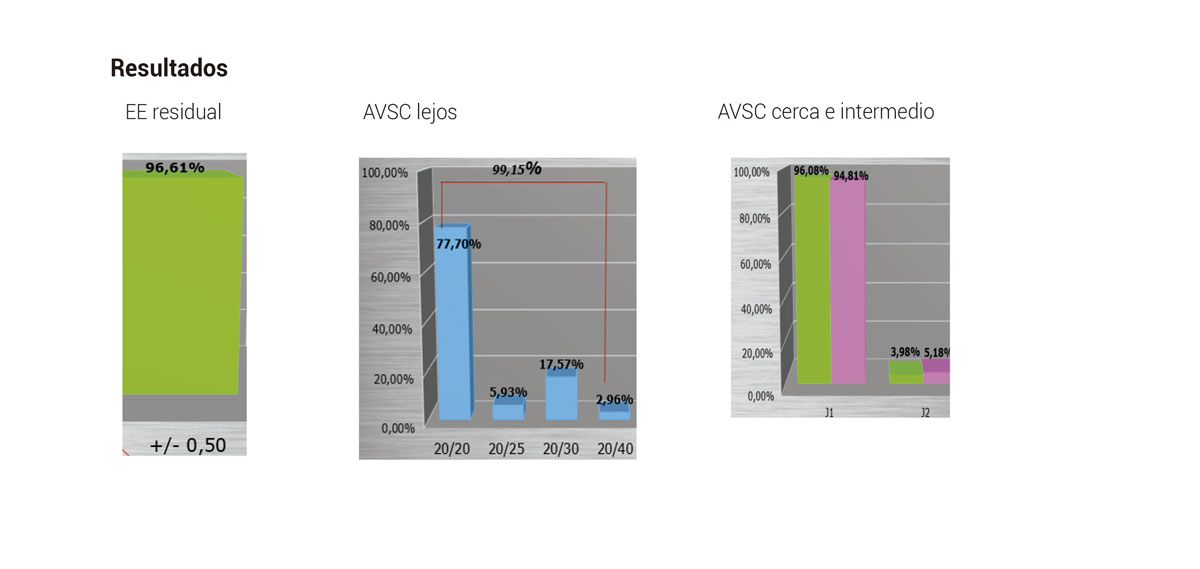
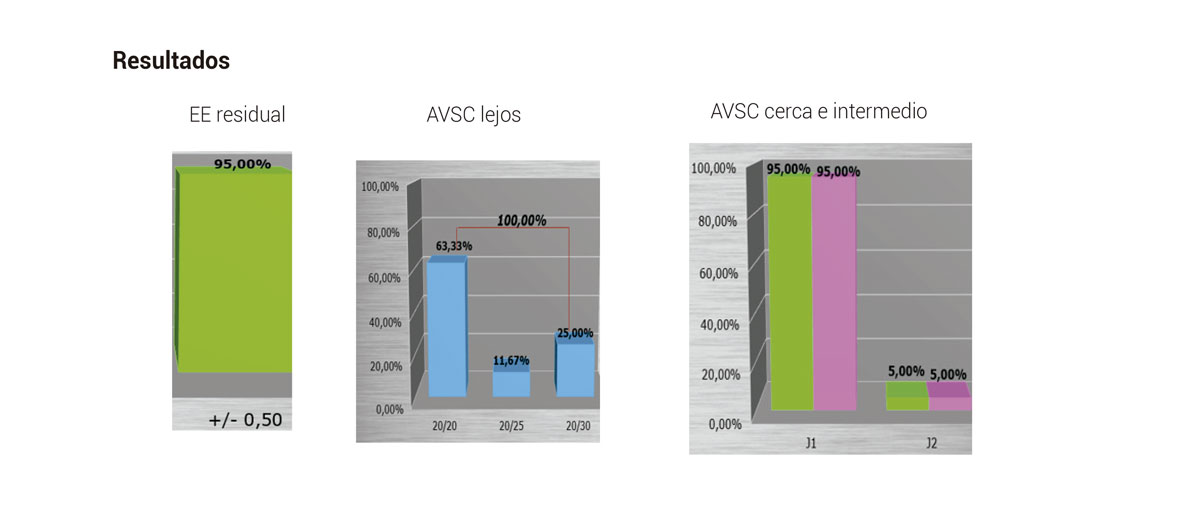 Conclusión:
Conclusión: Dr. Patricio Grayeb – Argentina
Dr. Patricio Grayeb – Argentina Dr. Guillermo Amescua – EE.UU
Dr. Guillermo Amescua – EE.UU Dr. Juan Carlos Ginés – Paraguay
Dr. Juan Carlos Ginés – Paraguay Dr. Jorge E. Valdez García
Dr. Jorge E. Valdez García







 Dra. Florencia Germanetti
Dra. Florencia Germanetti

 Dr. Carlos Palomino Bautista
Dr. Carlos Palomino Bautista