Top Ten:
Expectativa Refractiva tras la Cirugía de Catarata y Precisión Biométrica
 Dr. Mauro Campos
Dr. Mauro Campos
Dra. Eliana Domingues Gonçalves
La cirugía de catarata por Facoemulsificación (CCF) es la principal cirugía electiva realizada en todo el mundo, con expectativa de crecimiento debido al envejecimiento poblacional. La técnica quirúrgica y las opciones de lentes intraoculares (LIOs) más elaboradas tienen el objetivo de restaurar la visión con independencia de lentes correctivos. (1,2)
Los principales factores que interfieren en la estabilidad refractiva tras la CCF son la posición relativa de la LIO, la profundidad de la cámara anterior, la longitud axial del ojo y la curvatura corneal. En un estudio con seguimiento posoperatorio de 3 años, se observó que el parámetro de mayor variabilidad fue el aumento de la cámara anterior, resultando en hipermetropización en la mayoría de los casos y sugiriendo un objetivo refractivo ligeramente miópico. (1)
A continuación, seleccionamos diez temas relevantes para optimizar resultados:
- Superficie Ocular
Las alteraciones palpebrales (malposiciones, blefaritis y meibomitis) y las irregularidades corneales por alteraciones de la película lagrimal (ojo seco y pterigion) interfieren en la medida de la curvatura corneal. El tratamiento busca permitir lecturas de curvatura corneal estables y regulares. Los métodos de control incluyen biomicroscopía y colorantes vitales, fluoresceína, T-BUT y aplicación de cuestionarios. (3,4)
- Cirugía Refractiva Previa
Tras la RK, PRK y LASIK, la relación entre la curvatura corneal anterior y posterior sufre alteraciones, que en el caso de las correcciones miópicas, pueden generar sobrestimación del poder corneal en fórmulas convencionales y error secundario en la estimación de la posición de la LIO. Los pacientes sometidos a RK presentan fluctuación refractiva a lo largo del día. La tendencia hipermetrópica persiste en el posoperatorio. (5)
Se prefiere la biometría óptica. La fórmula Barrett True-K se mostró igual o mejor que la Haigis L en ojos miopes. (6,7,8)
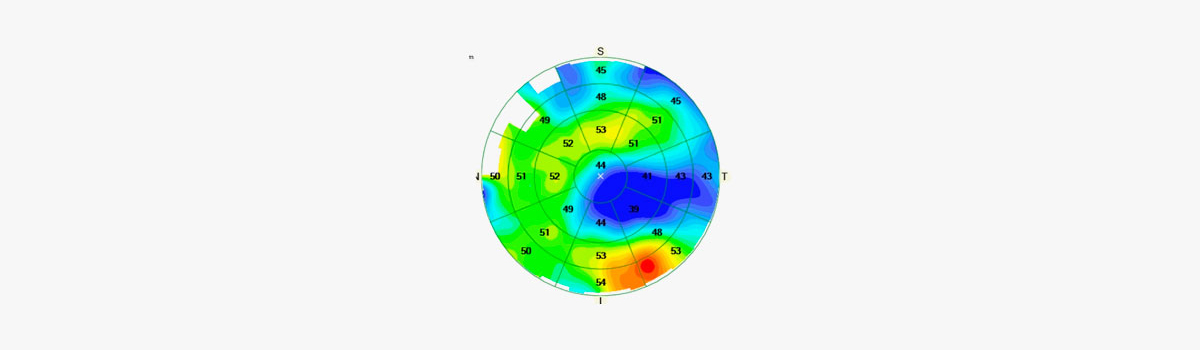
- Queratocono
Se debe evaluar la gravedad y la estabilidad de la enfermedad. En usuarios de lentes rígidas, se calcula un período de suspensión de 30 días por década de uso; en lentes blandas, 3 semanas. La biometría óptica es la técnica de elección, salvo en casos muy avanzados. La fórmula más precisa fue la Barrett True-K. El objetivo refractivo para K muy alto debe ser miopizado. (9)
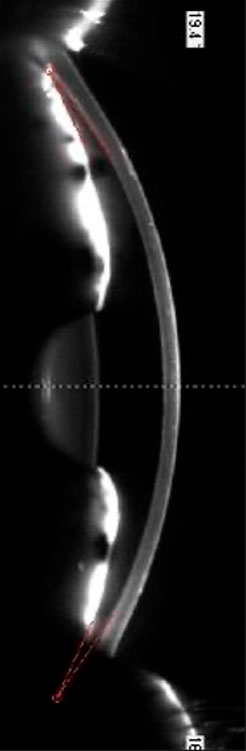
- Alta Miopía
La biometría óptica y LIOs de dioptrías bajas/negativas son recomendadas en ojos largos (>26 mm). (10)
Las fórmulas Barrett True (BTAL) y EVO mostraron tendencia a hipermetropía en ojos ultra largos (>28 mm). (10,11)
Fórmulas de nueva generación (Kane, EVO, LSF, BU-II y Hill-RBF) tienen mejor desempeño que fórmulas tradicionales. (10)
- Alta Hipermetropía
Los errores principales son la medida de la longitud axial y la estimación de la posición efectiva de la LIO. Resultados aceptables con biómetros ópticos y fórmulas de 4ª/5ª generación (Haigis, Holladay II). (12)
Las fórmulas BTAL y EVO presentaron mejores resultados en ojos cortos. (11)
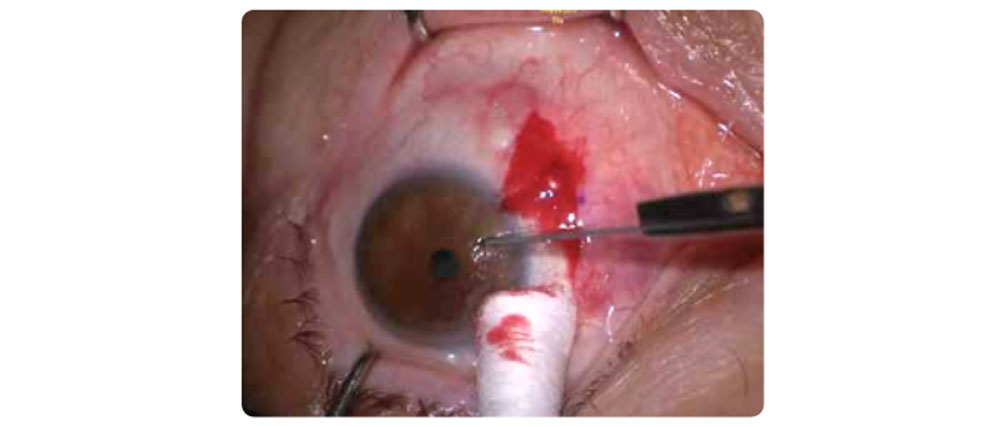
- Endoteliopatías
Las enfermedades endoteliales como la Distrofia de Fuchs cursan con subestimación de curvatura corneal por edema y astigmatismos irregulares. La cirugía combinada (FacoDMEK, FacoDSEK, FacoDSAEK) altera la K media y debe ser monitoreada con topografía, tomografía y paquimetría. Se sugiere LIO +1 D con fórmulas Barrett UII, Pearl DGS y EVO. (13,14)
- Flotadores
Son condensaciones de colágeno que flotan en el vítreo. No alteran refracción, pero interfieren en fijación durante biometría óptica. Tras cirugía, pueden volverse más evidentes; la mayoría mejora en 6 meses. (15)
- Glaucoma
La predicción de la posición efectiva de la LIO puede verse perjudicada por variaciones de la cámara anterior. En FacoTREC (Facoemulsificación y vitrectomía) ocurre un sesgo miópico; fórmulas nuevas no superan a la SRK/T. (16)
- Maculopatías
Las maculopatías afectan la confiabilidad de la biometría por inestabilidad de fijación. El pronóstico visual debe analizarse con OCT macular. En Facovitrectomía se recomienda sesgo miópico. En ojos con silicona se ajusta –0,7 a –0,8. En gas intraocular, ultrasonido modo A. (17)
- Diabetes
Atención a oscilaciones refractivas según el estado glucémico. Tratar irregularidades corneales y edemas. Se recomienda biometría óptica. (18)
Conclusión
El objetivo ligeramente miópico, la estabilidad refractiva, la biometría óptica, el tratamiento de enfermedades preexistentes y la orientación sobre posibles problemas en la recuperación posoperatoria son determinantes para el éxito refractivo tras la CCF.
Referencias
Lee N S, Ong K. Changes in refraction after phacoemulsification surgery. Int Ophthalmol (2023) 43:1545-1551.
Khoramnia K, et al. Refractive Outcomes after Cataract Surgery. Diagnostics (2022), 12, 243. https://doi.org/10.3390/diagnostics12020243.
Venkateswaran N, Luna RD, Gupta PK. Ocular surface optimization before cataract surgery. Saudi Journal of Ophthalmology (2022), 36(2):142-8.
Hida RY, et al. Métodos Diagnósticos da Superfície Ocular. In: Superfície Ocular. 3ª Ed., Rio de Janeiro: Cultura Médica.
Helaly HA, et al. Accuracy of Traditional and Modern Formulas for IOL Calculation After Radial Keratotomy. Clinical Ophthalmology 2023:17, 2589-2597.
Caballero JCS, Centurion V. Como eu faço o cálculo da LIO em olhos submetidos a LASIK ou PRK. In: O essencial em Biometria. 2ª Ed., Cultura Médica, 2012.
Gettinger K, et al. Accuracy of recent intraocular lens power calculation methods in post-myopic LASIK eyes. Nature Sci Reports (2024) 14:26560.
Adi A, et al. Accuracy of the Barrett True-K formula after LASIK or PRK. J Cataract Refract Surg (2016), 42(3):363-369.
Gershoni A, Barret GD, Sella R. Advances in IOL calculations in keratoconus. Ther Adv Ophthalmol, 2025, Vol.17:1-13.
Li H, et al. Comparing the accuracy of new-generation IOL formulas in axial myopic eyes: meta-analysis. Int Ophthalmol (2023) 43:619-633.
Kato Y, et al. Accuracy of new IOL formula for short/long eyes using segmental indices. ASCRS/ESCRS, Jan 2024, 810-815.
Caballero JCS, Centurion V. Como eu faço o cálculo da LIO em alta hipermetropia. In: O essencial em Biometria. 2ª Ed., Cultura Médica, 2012.
Sapoki E, et al. Comparison of 11 IOL Formulas in Cataract + DMEK. Am J Ophthalmol, Sept 2025, 295-304.
Borasio E. IOL Power Calculation in Keratoplasty. In: Intraocular Lens Calculation. Essentials in Ophthalmology. 2024, 963-972.
Hillman L. Floaters and postop patient happiness. EyeWorld. https://www.eyeworld.org/floaters.
Geada S, et al. Prediction Accuracy of IOL Formulas in Cataract + Trabeculectomy. Rev Soc Port Oftalmol 49(2):2025.
Mieli A, et al. Biometric refractive error after cataract/retina surgery: systematic review. Eye (2021) 35:3049-3055.
. Morya AK, et al. IOL selection in diabetic patients. World J Diabetes, 2024, 15(6):1199-1211.


 Dr. Sofia Antonela Ambrosetto
Dr. Sofia Antonela Ambrosetto
 Dr. Facundo Rodríguez – Argentina
Dr. Facundo Rodríguez – Argentina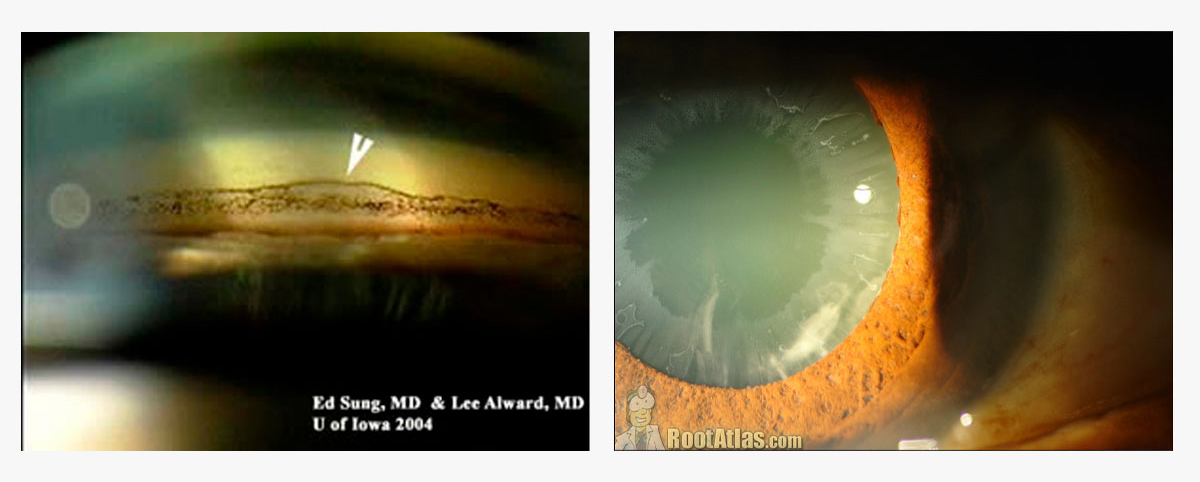

 Dra. Florencia Germanetti
Dra. Florencia Germanetti

 Luis Fernando Mejia
Luis Fernando Mejia Luisa Fernanda Anaya
Luisa Fernanda Anaya Paulo Dantas
Paulo Dantas José Miguel Vargas
José Miguel Vargas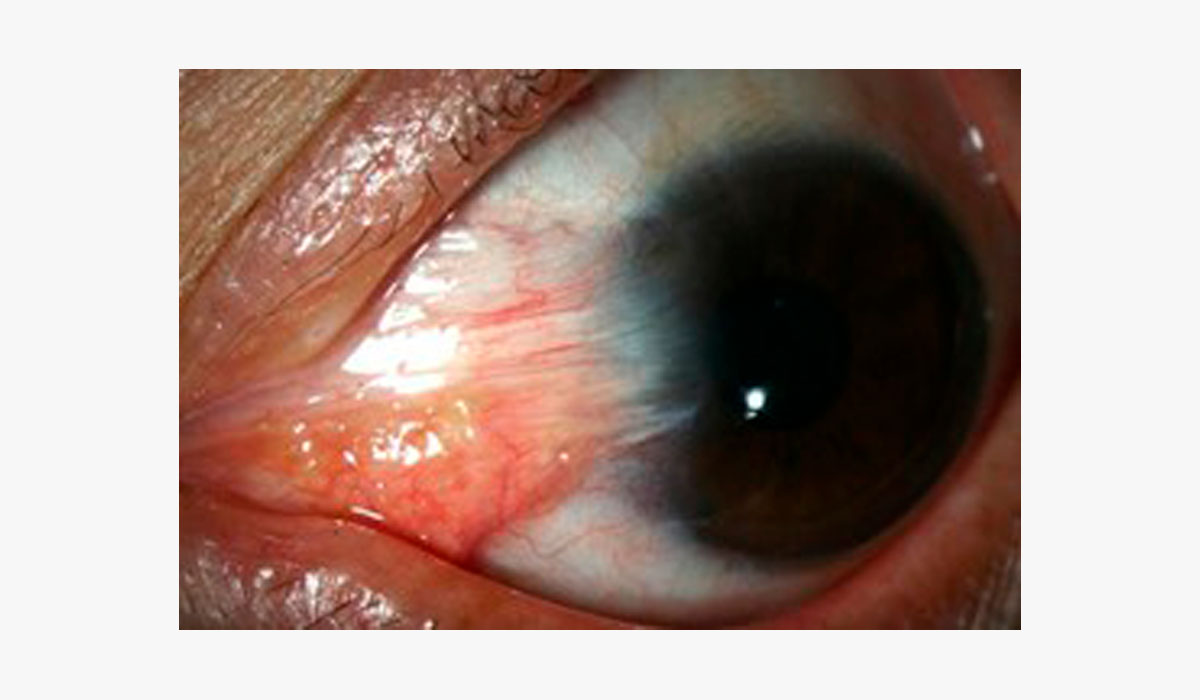

 Dr. Bernardo Kaplan Moscovicil
Dr. Bernardo Kaplan Moscovicil







 Dra. Palavecino Mariana
Dra. Palavecino Mariana


 Dr. Julio Fernández
Dr. Julio Fernández
 Dr. Leopoldo Garduño Vieyra
Dr. Leopoldo Garduño Vieyra


 Milton Yogi, Brasil
Milton Yogi, Brasil