
Dr. Cecilio Velasco
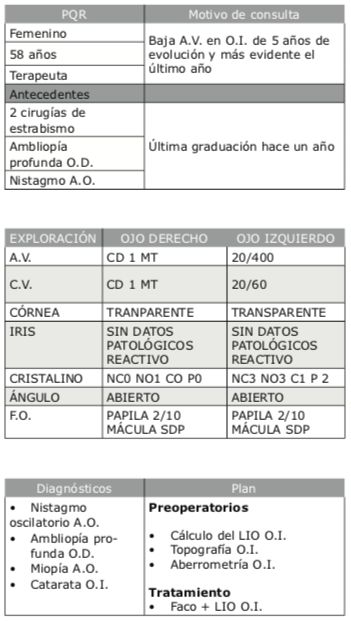
Preguntas del caso
1. ¿Qué queratometrías to- marían para realizar el cál- culo del poder del LIO y por qué?
Dr. Daniel Elies I. Amat: Si me lo permiten, me gustaría hacer unas consideraciones previas a contestar de forma concisa las preguntas que se nos formulan:
Se trata de una paciente relativamen- te joven, en edad laboral, con nistag- mo, que ha desarrollado una catarata en su ojo único funcional. Me gusta- ría conocer la refracción previa a la catarata, pues siendo miope, me sor- prende la refracción que muestra el Ray Tracey ( -10.00 D), consideran- do unas queratometrías (Ks) dentro de un rango normal y una longitud axial no muy acentuada (muy proba- blemente exista una miopización por la catarata). Y, sobre todo, a la hora de plantear la corrección intraocular, me falta saber si la paciente corregía su defecto refractivo con gafa o con lente de contacto. Me explico: la pa- ciente tiene un astigmatismo irregu- lar importante. Si la paciente utiliza lentes de contacto (LC), su calidad vi- sual será muy superior a la que con- sigamos con una corrección intraocu- lar y/o con unas gafas. Si la paciente pretende mantener esa calidad vi- sual, deberá seguir utilizando LC en el posoperatorio y por tanto NO de- bemos plantear corregir el astigma- tismo con la lente intraocular. Si, por el contrario, siempre ha utilizado ga- fas, podríamos valorarlo, aunque en mi caso, intentaría adaptárselas en el posoperatorio aun cuando nunca las hubiera utilizado.
Como respuesta a la pregunta, se trata de un caso con un astig- matismo irregular importante, con queratometrías “normales”, una amplitud de cámara ante- rior (ACD) muy amplia y un blan- co-blanco (B-B) muy pequeño. Con estos parámetros, el cálcu- lo de la lente intraocular va a ser muy complejo y con un alto ries- go de error refractivo residual. Con todo ello, lo primero es expli- car a la paciente la situación y ha- cer que entienda y asuma su rea- lidad. Yo utilizaría las SIM K en los 2.5 milímetros centrales y la fór- mula de Barrett, porque otras fór- mulas con esas ACD y B-B discor- dantes, según mi experiencia, dan peores resultados refractivos.
Dr. Daniel Badoza: Tomaría en cuenta los valores de las au- to-K, la biometría óptica, y los 3 mm centrales de la topografía cor- neal, dándole prioridad a este últi- mo resultado.
Dr. Gerardo Valvecchia:
Utilizaría todos los equipos a mi disposición. En el centro donde tra- bajo tenemos Pentacam, Lenstar, topografía Plácido-Tomey y OCT Avanti. Utilizaría todos estos equi- pos para comparar las medidas en- tre sí. Daría una especial impor- tancia a tener la información de la cara posterior de la córnea que, en nuestro centro, es medida median- te OCT y/o Pentacam. Es impor- tante destacar que dichos pacien- tes suelen ser usuarios de lentes de contacto, por lo cual se solicita la suspensión de las mismas al me- nos por tres semanas para evitar el efecto warpage que ocasionan.
2. ¿Pondrían un LIO monofocal?
Dr. Daniel Elies I. Amat: Sí, sin duda.
Dr. Daniel Badoza: Recomendaría el implante monofocal, en especial si el paciente es tolerante y recuerda haber tenido muy buena visión con LC gas- permeables, puesto que de esta forma corregirá de la mejor manera posible el astigmatismo irregular residual. En caso de que el paciente esté lo suficien- temente motivado, corregiría la refrac- ción residual con lente tórica Add-on.
Dr. Gerardo Valvecchia: En este caso colocaría una LIO monofocal, no tórica.
3. ¿Usarían un LIO tórico y por qué?
Daniel Elies I. Amat
Dr. Gerardo Valvecchia: No elegiría una LIO tórica, ya que, en este caso, la toma de las imáge- nes se vuelve dificultosa debido al nistagmo que el paciente presen- ta. Por ese motivo, al tener imáge- nes descentradas y un patrón topo- gráfico poco frecuente, el cálculo de la LIO se vuelve un desafío. Los da- tos queratométricos que tomamos en cuenta son en base al poder cor- neal de los 3 mm centrales, los cua- les no son confiables en los estudios de esta paciente.
El queratocono es una patología no inflamatoria degenerativa de la cór- nea que se asocia con astigmatismo asimétrico elevado. Dicha patología suele darse en ojos miopes con lar- go axial elevado. En estos casos se plantea un desafío cuando se debe realizar facoemulsificación, ya que, en muchas ocasiones posteriores a la cirugía, queda un defecto refracti- vo residual.
Si se da prioridad a corregir el com- ponente miópico, quedaría el astig- matismo residual a ser corregido
a Dr. Daniel Elies I. Amat: Siendo – un devoto defensor de las lentes tóri- 3 cas, en este caso NO pondría una lente
- – tórica. El eje refractivo y el topográfico
- – difieren y los distintos queratómetros (el del biómetro que no se nos facili- ta) y el del Ray Tracing probablemente también difieran. Y como he menciona- do al principio, en el posoperatorio in- tentaría adaptar una LC para mejorar la visión final de la paciente. Se trata de un ojo único, y hay que primar la cali- dad de la visión por encima del defectorefractivo final.Dr. Daniel Badoza: Las LIO tóricas no son mi primera opción en casos con queratocono. Las utilizo especialmente cuando el paciente es intolerante a len- tes de contacto en los que la refracción subjetiva es medible (en especial si lle- ga a niveles altos de AVCC y no difieren de la AV con estenopeico), y la tomo- grafía no muestra una gran irregulari- dad en los 3 mm centrales.
con lentes aéreos, lente de con- tacto o evaluar la posibilidad de realizar piggyback. Una vez operada, la corrección del astig- matismo se realiza mediante la refracción subjetiva, con lo cual la queratometría y sus medidas cobran una menor importancia.
4. ¿En qué estudio basa- rían el poder y eje del astigmatismo?
Dr. Daniel Elies I. Amat:
En mi caso, valoraría el Cassini (topógrafo que me muestra me- diciones de cara anterior y pos- terior y, por tanto, nos da un poder corneal total) y lo compa- raría con el K total del IOLMaster 700. Si tengo solo los datos que nos muestran, utilizaría los va- lores de Ray Tracing.
Dr. Daniel Badoza: El poder del astigmatismo generalmente lo tomo de la biometría y la au- to-K, mientras que considero el eje más curvo del tomógrafo.
Dr. Gerardo Valvecchia: Utilizaría to- dos los equipos a mi disposición para tener distintas medidas de queratometría. Hay que tener en cuenta que las medidas quera- tométricas de distintos equipos con distinto índice de refracción no son comparables di- rectamente entre sí. De todas maneras, in- tentaría tener datos de un equipo con cá- mara Scheimpflug, una OCT, un Plácido. Si las queratometrías son similares o distintas, nos pueden ayudar a tomar una mejor de- cisión sobre la lente a implantar y el target refractivo propuesto.
En el caso de un paciente con nistagmo osci- latorio, es recomendable realizar topografía con métodos estáticos, en la que los resul- tados puedan ser confiables y las imágenes estén centradas. La falta de alineamiento puede afectar la exactitud de los mapas to- pográficos, de modo que se pueden produ- cir errores significativos si existe un descen- tramiento del ápex corneal en el momento de realizar la medida.
5. La paciente tiene nistagmo os- cilatorio. ¿Tendría algún consejo para la cirugía?
Dr. Daniel Elies I. Amat: No creo que esto constituya un problema quirúrgico. No tendrá mucho nistagmo por las AVcc que al- canza (2/6 con catarata y una córnea irre- gular) y, con una leve sedación, la amplitud del mismo suele disminuir o incluso desapa- recer. Yo plantearía una anestesia tópica con sedación leve y no asumiría el riesgo de una anestesia locorregional (peri-retrobulbar).
Dr. Daniel Badoza: Si bien he realiza- do en muchas ocasiones la cirugía del nis- tagmo bajo anestesia tópica e intracameral, si el nistagmo dificultase la realización de la capsulorrexis, le daría anestesia subteno- niana. En caso de haber decidido implantar LIO tórica, marcaría el eje horizontal de la córnea en la lámpara de hendidura.
Dr. Gerardo Valvecchia: En mi práctica habitual, realizo solamente anestesia tópica en los nistagmos. Sin embargo, puede ser recomendable rea- lizar anestesia peribulbar en estos ca- sos ya que se necesita la acinesia del globo ocular.
6. ¿Con qué página calcularían el LIO tórico y cuáles quera- tometrías usarían (SIM K del topógrafo, K de autorrefracto- queratómetro, poder refracti- vo corneal) y por qué?
Dr. Daniel Elies I. Amat: Como ya he comentado, usaría el K del topógrafo (K total) y fórmula de Barrett (yo suelo usar Barrett y Haigis, pero en este caso, con las variantes del B-B y la ACD, me fío más de Barrett).
Dr. Daniel Badoza: En caso de im- plantar una lente tórica, la calcularía usando la fórmula Panacea en compa- ración con el cálculo obtenido en el cal- culador del fabricante de la lente. El effective power a 3 mm parece ser la más precisa de las fuentes para obte- ner las K.
Dr. Gerardo Valvecchia: Utilizaría de modo preferencial las queratome- trías de OCT de cara anterior y pos- terior. Dejaría en un segundo lugar el Pentacam, ya que es un estudio más di- námico que el de OCT y, por ende, el nistagmo de la paciente puede arrojar datos poco confiables. Dichas medidas de cara anterior y posterior de la córnea no se pueden usar en cualquier fórmu- la de cálculo, ya que la mayoría de las fórmulas necesitan una medida de que- ratometría, por ejemplo, al estilo SIM K o autoqueratometrías de un interfe- rómetro convencional. En estos casos
Dr. Daniel Badoza.
puntuales, usamos Panacea, que permite cargar los datos topomé- tricos (radios de curvatura ante- rior y posterior) para calcular el lente intraocular. Utilizaría un tar- get levemente miópico (−0.50), dado que en los queratoconos los resultados refractivos posquirúr- gicos suelen tender a la hiperme- tropía por una sobrestimación de la queratometría.
Si colocara una lente tórica, po- dría usar Panacea y también po- dría usar el calculador de Barrett para lentes tóricas. Dicho calcu- lador también permite usar da- tos de queratometría de cara anterior y posterior. El calcula- dor de Barrett, además, permite usar la Median K, que se calcula utilizando distintas medidas que- ratométricas de distintos equipos para crear una única medición de queratometría. Podría ser de uti- lidad en este caso donde eje y poder pueden mostrar variacio- nes según el equipo con que se lo mida.











 Años después me presentaron Ngenuity. Sin volver a saber del tema, Alcon había comprado la compañía que había evolucionado en el desarrollo de la plataforma y decidió lanzarla para cirugía de vítreo y retina.
Años después me presentaron Ngenuity. Sin volver a saber del tema, Alcon había comprado la compañía que había evolucionado en el desarrollo de la plataforma y decidió lanzarla para cirugía de vítreo y retina.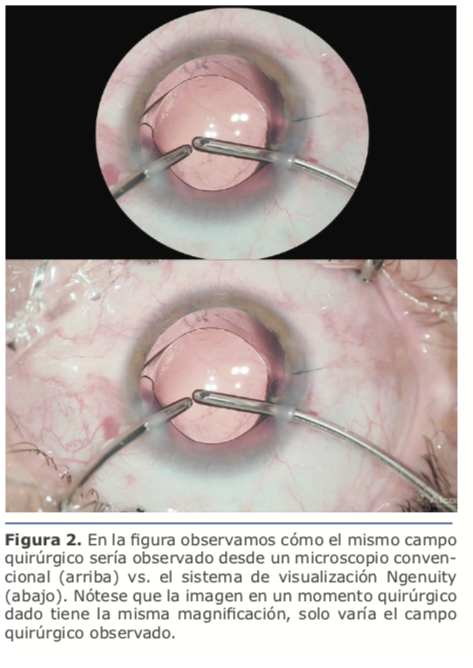
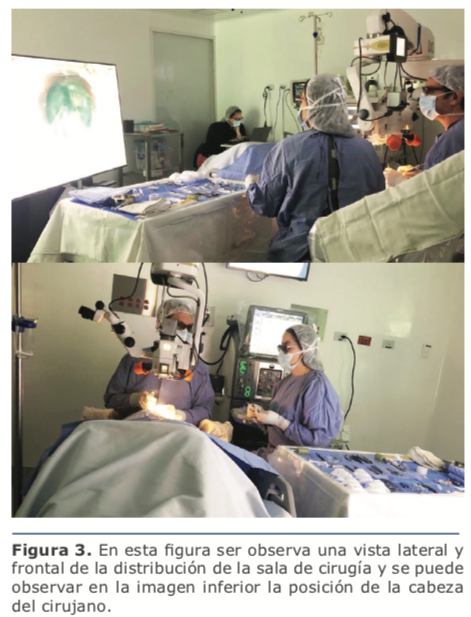 Con respecto a la configuración elegida pienso que siempre es preferible cambiar la posición de la cabeza del cirujano manteniendo la posición de la cabeza del paciente en la misma relación con mis manos y mis hombros, dado que esto mantiene mis movimientos de la forma habitual. Al hacer esto me encuentro fluyendo más al entrar y salir de las paracentesis, al hacer la capsulorrexis, y en general en toda maniobra intraocular. Cuando intento cambiar la posición, como lo hice en los primeros casos, los movimientos de mis manos en relación al ojo del paciente cambiaron y me observé haciendo movimientos imprecisos en los que me sentí fuera de equilibrio.
Con respecto a la configuración elegida pienso que siempre es preferible cambiar la posición de la cabeza del cirujano manteniendo la posición de la cabeza del paciente en la misma relación con mis manos y mis hombros, dado que esto mantiene mis movimientos de la forma habitual. Al hacer esto me encuentro fluyendo más al entrar y salir de las paracentesis, al hacer la capsulorrexis, y en general en toda maniobra intraocular. Cuando intento cambiar la posición, como lo hice en los primeros casos, los movimientos de mis manos en relación al ojo del paciente cambiaron y me observé haciendo movimientos imprecisos en los que me sentí fuera de equilibrio.
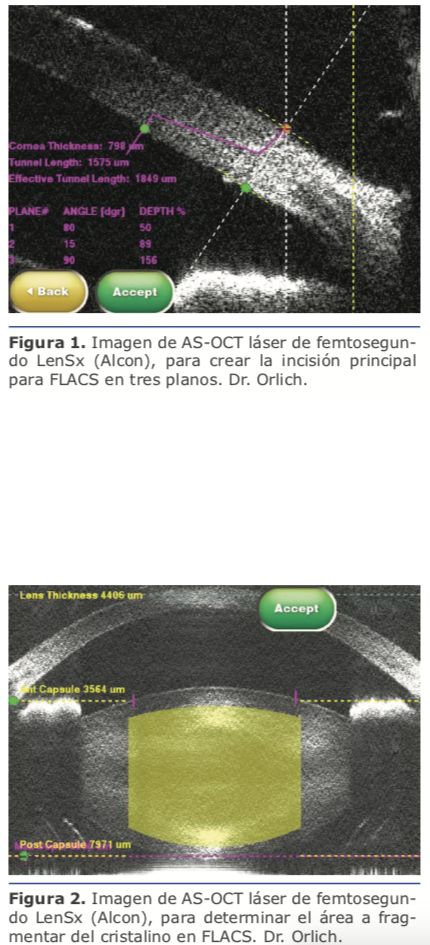 4. AS-OCT vs UBM: En ocasiones el OCT puede ser análogo del UBM y utilizarse con fines diagnósticos en patología del segmento anterior. El OCT-SA tiene como ventajas sobre el UBM que no requiere de contacto con el ojo del paciente, lo cual toma mayor relevancia en casos de cuerpos extraños corneales los cuales hay duda de su profundidad para un retiro seguro, además el OCT presenta una resolución de 15 micras a comparación de las 50 micras del UBM y permite valorar un mayor diámetro del ojo (16 x 6 mm vs 5 x 5 mm), sin embargo, tiene como desventaja que no permite estudiar lesiones por detrás del iris. El OCT tiene además ventaja sobre el UBM en algunas neoplasias de superficie ocular en el diagnostico y seguimiento, además de casos de adelgazamientos corneal o esclerales.
4. AS-OCT vs UBM: En ocasiones el OCT puede ser análogo del UBM y utilizarse con fines diagnósticos en patología del segmento anterior. El OCT-SA tiene como ventajas sobre el UBM que no requiere de contacto con el ojo del paciente, lo cual toma mayor relevancia en casos de cuerpos extraños corneales los cuales hay duda de su profundidad para un retiro seguro, además el OCT presenta una resolución de 15 micras a comparación de las 50 micras del UBM y permite valorar un mayor diámetro del ojo (16 x 6 mm vs 5 x 5 mm), sin embargo, tiene como desventaja que no permite estudiar lesiones por detrás del iris. El OCT tiene además ventaja sobre el UBM en algunas neoplasias de superficie ocular en el diagnostico y seguimiento, además de casos de adelgazamientos corneal o esclerales.


 Los materiales de los lentes intraoculares que se implantan en el mundo son diversos y con propiedades físicas específicas. Algunos de estos materiales pueden sufrir una pérdida de su transparencia secundaria a estímulos diversos.
Los materiales de los lentes intraoculares que se implantan en el mundo son diversos y con propiedades físicas específicas. Algunos de estos materiales pueden sufrir una pérdida de su transparencia secundaria a estímulos diversos.
