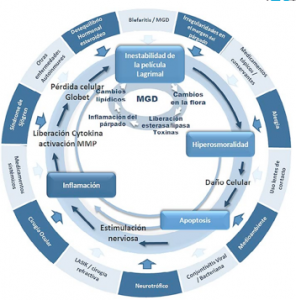
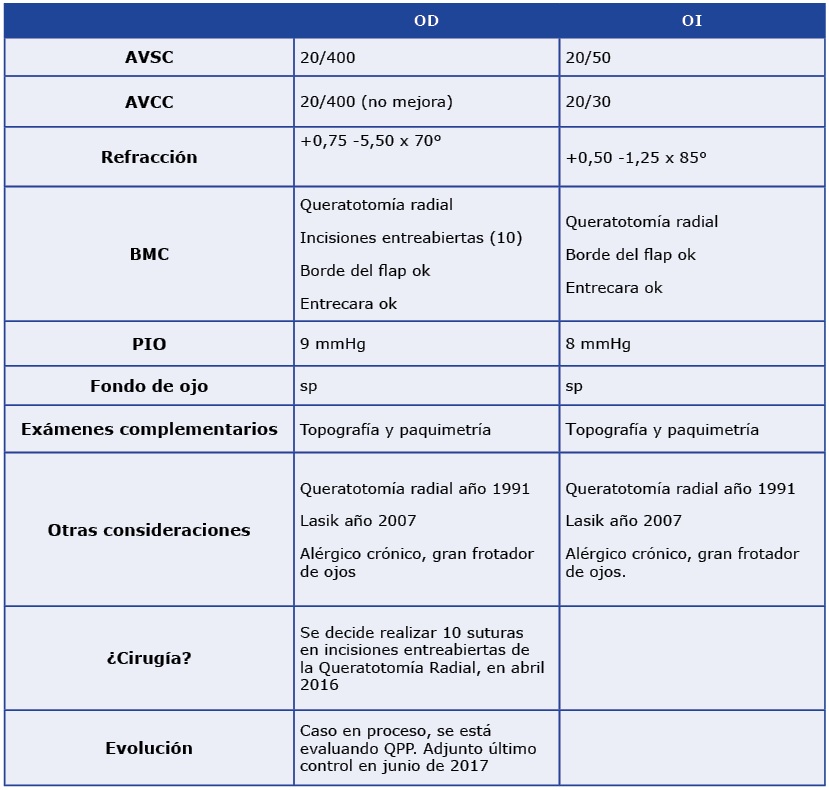
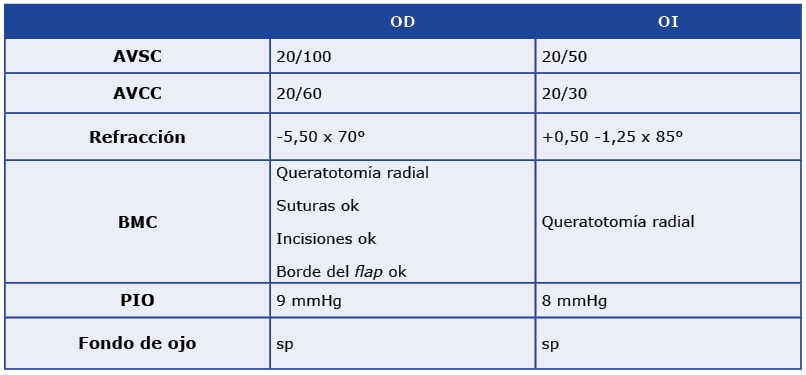
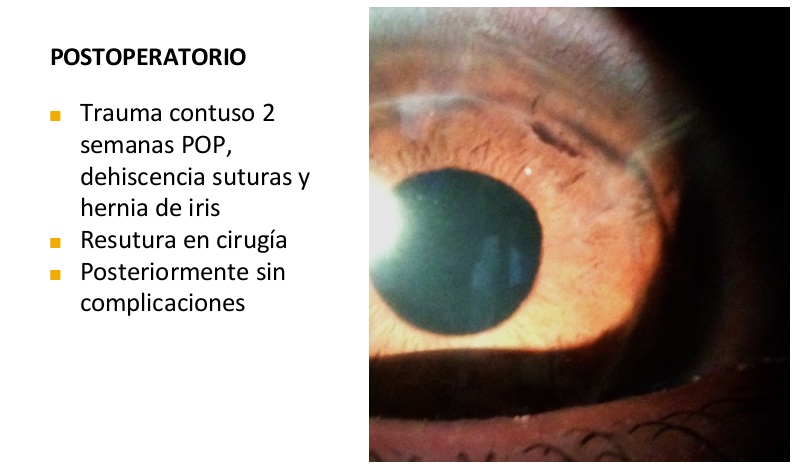
¿Tiene un departamento específico para el tratamiento de ojo seco en su práctica cotidiana? ¿Por qué?
Dr. Alejandro Aguilar: Nuestro servicio cuenta desde hace años con un departamento destinado al estudio, diagnóstico y tratamiento de enfermedades de superficie ocular en donde el tratamiento del ojo seco primario y secundario ocupa un lugar preponderante.
Las enfermedades de la superficie ocular son cada vez más frecuentes y constituyen un riesgo potencial para la salud visual, por eso se hace necesario y agregaría «indispensable» un departamento de superficie ocular para el manejo del ojo seco.
Dr. Marcelo Sterzovsky: Efectivamente, tenemos un departamento para diagnóstico y tratamiento del ojo seco. Esto es debido a que desde la introducción de la aberrometría óptica en nuestra práctica cotidiana, en el año 2002, nos dimos cuenta de que el ojo seco es un factor importantísimo en la calidad visual posoperatoria, y que si no lo tenemos en cuenta, la satisfacción de los pacientes disminuye dramáticamente. Además, no solo es importante el 20/20, sino la calidad visual en las diferentes actividades cotidianas, desde conducir hasta el uso de ordenadores.
Dr. José Álvaro Pereira Gomes: Sí, yo soy especialista en enfermedades de la superficie ocular y tengo una estructura específica para diagnóstico y tratamiento de ojo seco.
Dr. Luis Izquierdo: Sí, nuestro Instituto Oftalmosalud cuenta con un servicio de superficie ocular dedicado especialmente al ojo seco, que atiende todos los días de la semana. Creemos que es un sector muy importante y realizamos la encuesta DWES.
De diez pacientes ¿a cuántos le indica algún tipo de tratamiento para ojo seco?
Dr. Alejandro Aguilar: Mi práctica se centraliza específicamente en las enfermedades de ojo externo, de 10 pacientes que consultan, 8 tienen ojo seco certeramente diagnosticado y los otros dos tienen algún signo o síntoma de ojo seco.
Esta proporción varía en los meses de cambios de estación, donde la patología alérgica se hace presente. En esos momentos, podríamos hablar de 7 a 3, con la misma consideración anteriormente expuesta sobre la presencia de algún tipo de signo o síntoma.
Dr. Marcelo Sterzovsky: De 10 pacientes que superen los 50 años, en poblaciones urbanas de alta densidad, aproximadamente el 70 % tendrá algún hallazgo de ojo seco, pero solo el 30 % manifestara alguna molestia relacionada con la patología, eso incluye pruebas rutinarias, como medición del menisco lagrimal, BUT, tinción con rosa de Bengala y Schirmer.
Esto tiene fundamental importancia en aquellos pacientes en los que indicamos cirugía refractiva corneal, lentes fáquicas o facorrefractiva, ya que las mediciones queratométricas, el grado y eje del astigmatismo y hasta la longitud axial sufren modificaciones cuando la superficie no es satisfactoria. Incluso la humedad del ambiente donde efectuamos las mediciones pueden hacerlas poco constantes.
Es por ello, que cuando realizamos topografías, tomografías e interferometrías para medir la longitud axial, apagamos el aire acondicionado del ambiente. Además de personal altamente calificado para comprender cuando una toma debe ser descartada, en la mayoría de los ojos instilamos una gota de lubricante de baja densidad 5 minutos antes de efectuarla.
Dr. Luis Izquierdo: Alrededor del 80 %.
Dr. José Álvaro Pereira Gomes: Mi práctica tiene un viés porque tengo muchos casos de ojo seco por indicación de otros colegas. Es posible que de cada 10 pacientes, indique tratamiento de ojo seco en 6.
¿Qué relevancia le otorga al laboratorio para ojo seco?
Dr. Alejandro Aguilar: El laboratorio de ojo seco es un auxiliar diagnóstico de excelencia. Cuando tenemos certeza clínica de la presencia de ojo seco, el laboratorio nos permite estadificar con celeridad el cuadro de ojo seco, al mismo tiempo que nos orienta en el tipo de ojo seco, es decir si es lacrimodeficiente o evaporativo.
Permite, además, hacer una correcta evaluación evolutiva del tratamiento implementado, por lo que tiene entonces valor diagnóstico y pronóstico. También, permite establecer si el cuadro de ojo seco se debe a fallas cuantitativas o cualitativas del film lagrimal. Además, contribuye a sospechar si el ojo seco obedece a causas sistémicas. En los casos en que existe duda con otras patologías que involucran a la superficie ocular, nos permite obtener datos de enorme valor para el diagnóstico diferencial.
Dr. Marcelo Sterzovsky: El laboratorio es importante para comprender si estamos ante un cuadro de ojo seco por déficit lagrimal o evaporativo, así que realizamos medición de osmolaridad, lisozima, IgA y citología de impresión. Sin embargo, resultados laboratoriales alterados no significan necesariamente una sintomatología. Por eso también realizamos una profunda anamnesis relacionando la historia de medicamentos orales, tales como antidepresivos o ansiolíticos de uso masivo en nuestra región, trastornos hormonales, antecedentes de enfermedades reumáticas o autoinmunes y la calidad del medio ambiente en que desarrolla su vida laboral o recreativa.
Dr. José Álvaro Pereira Gomes: Para mi práctica, es extremamente útil, principalmente para diferenciar el tipo de ojo seco y definir mejor abordaje terapéutico.
Dr. Luis Izquierdo: La relevancia es fundamental, pues es ahí mismo donde producimos terapia de suero autólogo, plasma enriquecido, membrana amniótica, etc.
¿Qué parámetros de laboratorio considera clínicamente más representativos? ¿Por qué?
Dr. Alejandro Aguilar: La evaluación de la osmolaridad de la película lagrimal es gold standar en el diagnóstico, ya que se encuentra elevada en todos los tipos y es directamente proporcional al grado de ojo seco.
La citología de impresión conjuntival permite estadificar en gravedad a la sequedad ocular. La correcta evaluación de las células mucosecretantes es un pilar diagnóstico y de control evolutivo por excelencia.
La presencia de metaplasia escamosa ayuda a sospechar la posibilidad de enfermedades orgánicas que causan ojo seco. Es un indiscutido aliado en la evaluación de deficiencias límbicas. Permite, además, realizar el diagnóstico diferencial con fenómenos alérgicos y alteraciones de la superficie ocular secundarias a la contaminación ambiental.
La evaluación del contenido proteico del film y específicamente la concentración de lisozima es otra prueba fundamental, ya que la disminución de la concentración de esta enzima en la película lagrimal expone al paciente a infecciones y es indicador de la posibilidad de patologías sistémicas.
Dr. Marcelo Sterzovsky: Es fundamental la búsqueda sistemática del ojo seco en el preparatorio, especialmente en quienes no tienen síntomas, ya que si los van a desarrollar después de una cirugía refractiva hay que comenzar con tratamiento tópico cuatro semanas antes con lubricantes y ciclosporina A, continuándolos a posteriori e incluso en algunos casos la colocación de puntum plugs.
Dr. José Álvaro Pereira Gomes: El examen detallado biomicroscópico sin y con tinción (fluoresceina y lisamina verde) y determinación del BUT son sencillos y muy útiles en la práctica cotidiana. También utilizo cuestionarios como el OSDI.
Para casos más graves y desafiadores, ahí si utilizo examen por imagen con Keratograph (medida del menisco lagrimal, de la hiperemia, meibomiografía), test de Schirmer, determinación de la osmolaridad, citología de impresión y otros test más específicos, como el Inflammdry MMP-9.
Dr. Luis Izquierdo: Utilizamos citología de impresión conjuntival, test de osmolaridad y test computarizado de ojo seco (topógrafo con software de ojo seco). Además, visualizamos las glándulas de Meibomio, realizamos break up time no invasivo, medición del menisco lagrimal y evaluación de la capa lipídica.
¿Qué tipo de tratamientos sistémicos o alternativos indica en casos severos?
Dr. Alejandro Aguilar: En casos severos están indicados los estimulantes de la secreción lagrimal, y si el ojo seco es secundario a inmunopatías, el control de estas enfermedades por inmunomodulación o inmunosupresión es fundamental.
Es importante considerar la administración de suplementos alimenticios.
Dr. Marcelo Sterzovsky: En cuanto a la administración de tratamientos sistémicos, indicamos suplementos dietarios ricos en omega-3 o aceite de pescado y comprimidos de ácido hialurónico, la mayoría de las veces con un impacto positivo en cuanto a los síntomas no solo oculares, especialmente en la población femenina, que refiere cambios en la turgencia de la piel y la humectación corporal en general
Dr. José Álvaro Pereira Gomes: Para ojo seco evaporativo/MGD: doxiciclina oral por 2-3 meses, seguido por omega-3; para ojo seco por deficiencia acuosa grave y síndrome Sjögren: pilocarpina oral o similar e interconsulta con reumatólogo.
Dr. Luis Izquierdo Entre los tratamientos sistémicos, utilizamos desde inmunomoduladores hasta pulsos EV de corticoides de rápida acción, trabajando en concordancia con reumatología. Respecto a los alternativos, en pacientes con insuficiencia o disfunción glandular, utilizamos IPL (Intensive Pulse Light), cuya traducción más cercana sería «luz intensa pulsada». Esta luz es absorbida por los vasos sanguíneos, genera calor en la capa dérmica de la piel que realiza una licuefacción de las secreciones y abre las glándulas. Inmediatamente exprimimos estas glándulas, para ayudar a liberarlas, lo cual permite que los pacientes sientan una sensación rápida de alivio.
¿Cuáles considera que son los casos más rebeldes o desafiantes?
Dr. Alejandro Aguilar: Los secundarios a inmunopatías sistémicas severas, quemaduras fisicoquímicas y ojo seco posradioterapia por patología neoplásica craneofacial.
Dr. Marcelo Sterzovsky: Los casos más desafiantes son en los que indicamos cirugía facorrefractiva con implante de lentes MF, porque en estos ojos es donde más incide una mala calidad en la superficie. No es suficiente una excelente cirugía y la exactitud en las mediciones previas. Si la superficie está alterada, generará alto grado de molestia e insatisfacción.
Dr. José Álvaro Pereira Gomes: Los casos de GVHD, Stevens-Johnson y penfigoide cicatricial.
Dr. Luis Izquierdo: Definitivamente los síndromes óculo-cicatrizantes crónicos: penfigoide cicatricial ocular, síndrome Stevens-Johnson, síndrome de Lyell, rosácea y síndrome de Sjögren.
Mencione su peor caso y relátelo brevemente, por favor.
Dr. Alejandro Aguilar: Un paciente con neoplasia linfomatosa que tras injerto medular desarrolla un cuadro severo de «enfermedad trasplante vs. huésped». El mismo cursó con deficiencia límbica severa.
El tratamiento sistémico que combinó inmunosupresores con corticosteroides desencadenó un glaucoma cortisónico y cataratas. Su tratamiento incluyó injerto límbico y amniótico y cirugía combinada de catarata-glaucoma.
Dr. Marcelo Sterzovsky: Mi peor caso relacionado con ojo seco ocurrió hace aproximadamente 20 años: en la misma sesión quirúrgica se intervenían padre e hijo, ambos con astigmatismo mixto, bajo LASIK con utilización de microqueratomo de Baush & Lomb y con bisagra superior, bilateral simultánea.
Primero se operó el hijo sin ninguna complicación. Luego el padre, y en el primer ojo ocurrió una desepitelización moderada, luego de la creación del flap, que interpreté que había sucedido por una mala lubricación antes del pasaje del microqueratomo. Pero en el segundo ojo, a pesar de lubricar profusamente (en esa época lo hacía con proparacaína) la desepitelización fue total. Como resultado en paciente tuvo un posoperatorio tormentoso con uso de lente de contacto durante casi 60 días.
El problema fue no haber diagnosticado la patología previa, que consistía en una alteración de la membrana basal bilateral, patología no del todo infrecuente y a investigar en el preparatorio. Hoy el hijo sigue altamente satisfecho con su cirugía, y hace poco más de 30 días intervine también de astigmatismo mixto a su hija, pero esta vez con femtosegundo y sin problemas. Eso sí del padre no me olvido, mas aprendí la lección, y es otra de las patologías que investigo en los candidatos a cirugía refractiva.
Dr. José Álvaro Pereira Gomes: Mi peor caso fue de un paciente joven portador de ojo seco grave secundario a síndrome de Stevens-Johnson sometido a trasplante de limbo que presentó complicaciones en los dos ojos por infección e inflamación.
Dr. Luis Izquierdo: Fue una paciente derivada el 24 de diciembre, recién dada a luz (1 mes posparto), con presentación de perforación bilateral corneal, en atalamia con uno de los ojos con queratitis bacteriana, con antecedente de 3 semanas de haber sufrido un episodio de Steven-Johnson. Brevemente terminó con ceguera bilateral a pesar de múltiples terapias inmunes y repetidos tratamientos, desde parches corneales hasta trasplantes corneales.