Ametropía extrema: miopía magna
Coordinador:
Dr. David Flikier – Costa Rica
Panelistas
Dr. Noé Rivero – Argentina
Dr. Juan Guillermo Ortega – Colombia Dr. Pablo Suárez – Ecuador
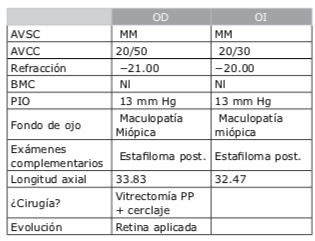
Historia clínica
• Femenina,50años.
• Antecedentes, desprendimiento de retina a la edad de 20 años del ojo derecho, afectó retina inferior, tratado exitosamente con vitrectomía PP + aire + exoimplante + endolaser.
• Recupera agudezas visuales con lente de contacto gas permeables con poderes de −17.00 D aprox. de 20/50 OD y 20/30 OI.
• Refracciones subjetivas que oscilan alrededor de las −21.00 y −20.00 D, con pérdida progresiva de la agudeza visual por catarata, maculopatía miópica.
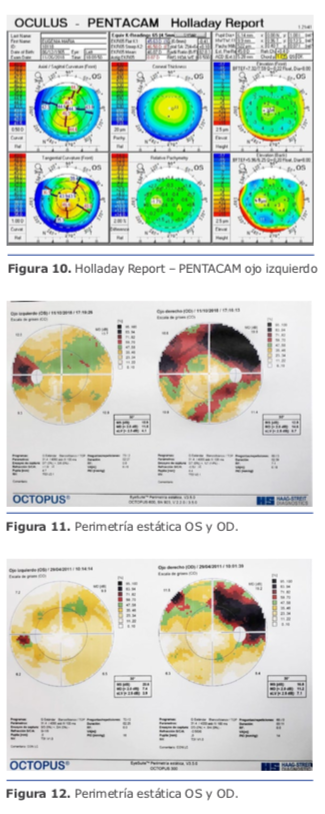
• Se adjuntan estudios de progresión de cambios en campimetrías computarizadas, OCT de mácula y nervio óptico.
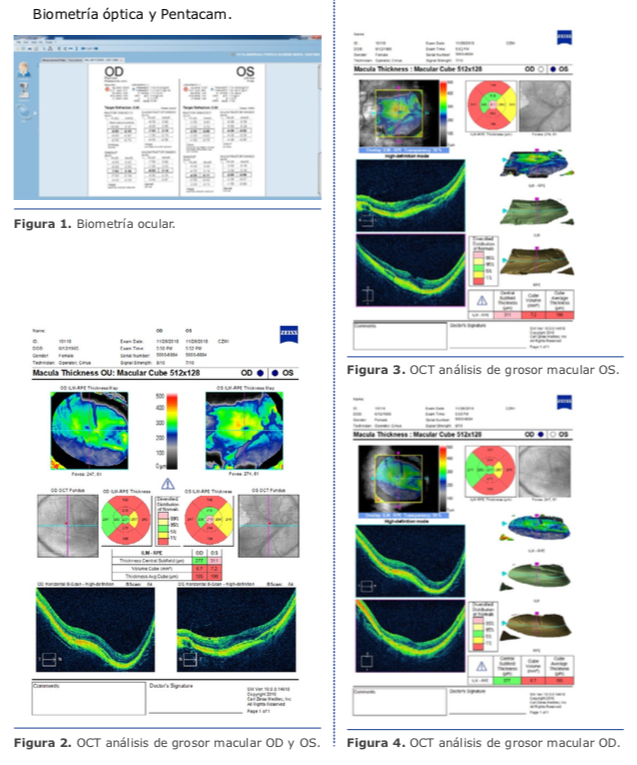
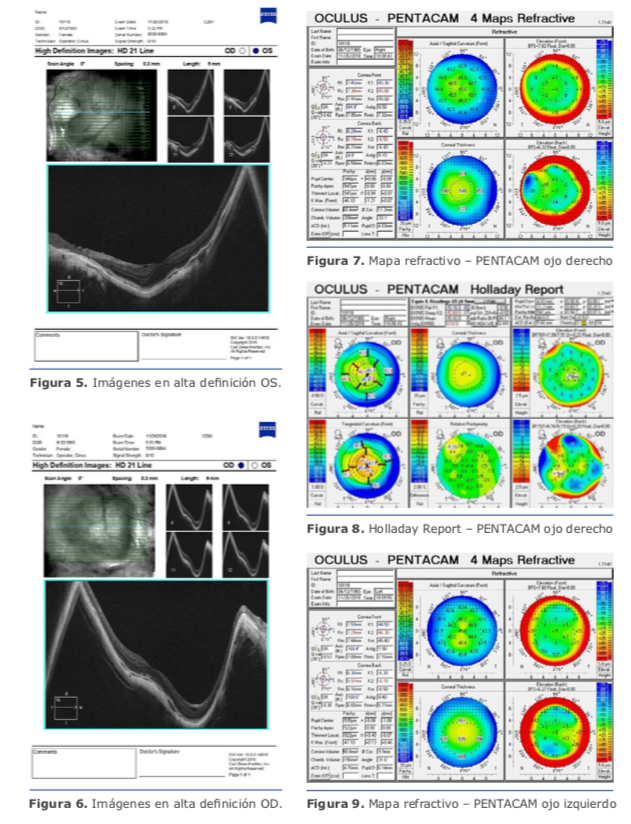
Exámenes complementarios del caso
Preguntas del caso
1. ¿Cómo procede para el cálculo del lente intraocular?
Dr. Noé Rivero: En casos de miopía extrema, como en el presente caso, busco fórmulas que me puedan dar mayor certeza en la posición final de la lente a implantar con fórmulas tipo BARRETT II, o la de mi preferencia en la actualidad, que es PANACEA con resultados muy previsibles y mejores de cuando utilizaba las formulas SRK-T o HAIGIS aun aplicándoles la corrección de Wang-Koch, y puede deberse a que estas fórmulas de tercera generación no están diseñadas para el uso en dioptrías negativas.
Trato siempre de que el cálculo esté del lado de la miopía residual y no de la emetropía absoluta, ya que, si el resultado se va hacia la hipermetropía, puede ser muy molesto para estos tipos de pacientes.
Dr. Juan Guillermo Ortega: En miopías extremas conviene hacer biometrías ópticas por definición, pero es importante hacer ecografías para evaluar la presencia de estafilomas posteriores, su morfología y de ser posible, ubicar la mácula dentro de ese espacio. Me parece importante comparar longitudes axiales de ambos métodos para establecer una correspondencia. Pero los cálculos se hacen a partir de las medidas de la regla biométrica óptica en lo posible.
Conviene tener medidas queratométricas consistentes con al menos dos sistemas ópticos independientes, y en estos casos es útil (no definitivo) tener una medida del espesor del cristalino, para hacer más preciso el cálculo. En ciertos casos el incremento del diámetro del cristalino explica buena parte de la miopía extrema de ciertos pacientes. Adicionalmente, programas como PANACEA, piden esa medida en sus cálculos.
 Dr. Pablo Suárez: Para el cálculo de la lente debemos tener varios puntos claros en cuanto a la medición de los diferentes compartimentos del ojo. Para ello, creo que se deben valorar los siguientes tipos de ojos miopes:
Dr. Pablo Suárez: Para el cálculo de la lente debemos tener varios puntos claros en cuanto a la medición de los diferentes compartimentos del ojo. Para ello, creo que se deben valorar los siguientes tipos de ojos miopes:
1. Dependiente de la longitud axial del globo ocular.
2. Miope dependiente del crecimiento del segmento anterior como, por ejemplo, un queratocono.
Esto es muy importante para tener en cuenta puesto que la posición efectiva del lente (PEL) será diferente en cada uno de estos tipos que he mencionado. Por ello, las fórmulas de última generación que toman en cuenta la profundidad de la cámara anterior son muy importantes para ello.
2.¿Cuáles cuidados se deben tomar en la toma de la biometría? ¿Prefiere el ultrasonido o la biometría óptica? Si tiene un estafiloma posterior, ¿qué hace?
Dr. Noé Rivero: Para la medida correcta, se debe tener un especial cuidado en que el paciente fije y esté alineado correctamente al punto de fijación del equipo con el que vayamos a realizar la medición (ya sea ecometría manual, Pentacam, IOLMaster, GALILEI, etc.) y en lo posible soy yo quien realiza las tomas personalmente, y trato de conseguir una repetibilidad de al menos 3 tomas con altos índices de confiabilidad y congruencia.
Además, trato de realizar dentro de lo posible tomas adicionales con otro equipo para corroborar no solo el largo axial (que en general puede ser complejo porque los estafilomas están en el polo posterior y área macular), sino también el valor del poder real corneal (cara anterior y posterior), ejes del astigmatismo, asfericidad Q, ACD, lens thickness y WtoW.
Prefiero siempre biometría óptica, utilizo IOLMaster y GALILEI en mi práctica diaria, de mi preferencia Galilei ya que me aporta todos los datos antes descritos. Pero es mandatorio realizar una ecografía modo B que nos va a dar información muy importante del estado de la retina, cavidad vítrea, hialoides posterior y localización del estafiloma miópico con respecto a la mácula. La utilización del modo B complementario con el modo A puede ayudar a determinar el valor real del largo axial y posición macular en casos complejos. (Ver figura 13)
Dr. Juan Guillermo Ortega: La medida debe ser realizada por alguien con experiencia, pero parte del problema radica en que, si el cristalino es muy opaco, los pacientes no fijan correctamente; si además tienen un estafiloma posterior, las medidas pueden ser erráticas. Adicionalmente, si hay alteraciones maculares, el tema de la fijación se vuelve crítico. Por lo mismo, la ecografía servirá para comparar medidas.
Dr. Pablo Suárez: Hoy en día el uso de la tecnología nos ayuda a tener mayor información y poder comparar con diferentes plataformas. Si hablamos de estafiloma posterior creo que la biomicroscopía por inmersión es la opción más adecuada ya que se puede maniobrar hacia el polo posterior. Recordemos que el estafiloma no siempre es central y la mácula o el punto focal no se encuentra en la cúspide del estafiloma. Para ello, la confirmación de la localización del estafiloma siempre será muy buena con el apoyo del US SCAN A. Sin embargo, en mi práctica también utilizamos equipos como Lenstar®, ya que la medición del segmento anterior es muy confiable y así, con la unión y verificación de todos estos datos, el cálculo será más acertado.
3. ¿Cuáles fórmulas utiliza en estos casos o qué cambios hace?
Dr. Noé Rivero: Utilizo las fórmulas BARRETT II o PANACEA que son gratuitas y están disponibles para MAC, PC o IPAD y uno puede llevarse los datos del paciente y realizar el cálculo con tranquilidad en la oficina al terminar el día o en el hogar. Se pueden acceder gratuitamente tanto a BARRETT o PANACEA desde la página de utilidades de Facoelche en www.facoelche.com/utilidades/barrett-universal-ii-formula-iol-calculator/ O www.facoelche.comhttps://www.facoelche.com/utilidades/descarga-panacea/ (Ver figura 14)
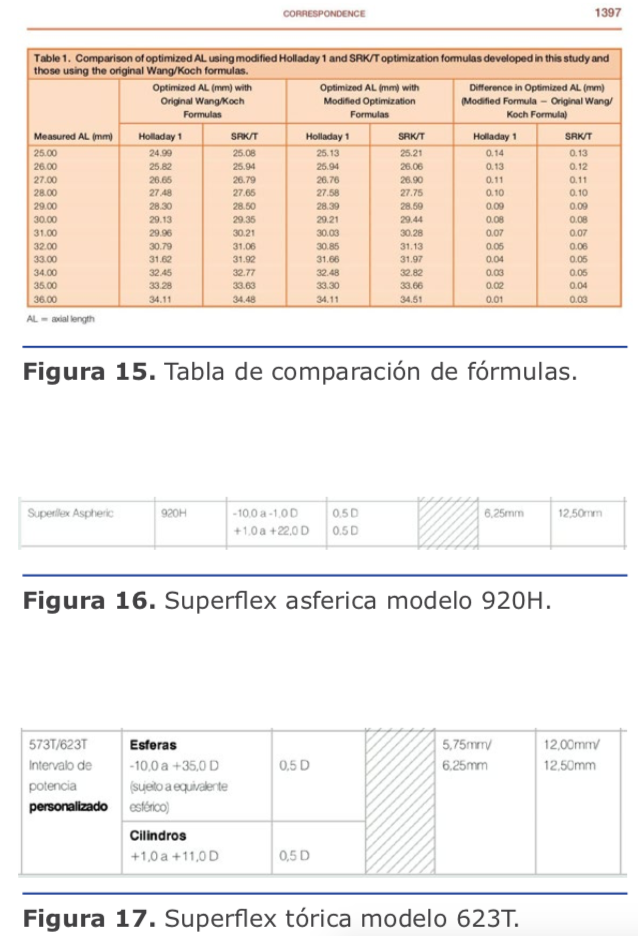
 Dr. Juan Guillermo Ortega: Los cálculos de miopías extremas suelen producir hipermetropía posoperatoria porque magnifican el poder del lente a implantar. Este hallazgo produjo lo que se denomina el ajuste de Wang-Koch, que es particularmente útil en fórmulas antiguas como Holladay 1, y que originalmente se proponía para longitudes axiales superiores a 25,2 mm. SRK/T se comporta mejor, y Haigis todavía más, porque es menos sensible a esta aberración de medida óptica. Las fórmulas más recientes como Barrett Universal, Hill RBF y PANACEA se comportan mucho mejor en estos casos. (Ver figura 15)
Dr. Juan Guillermo Ortega: Los cálculos de miopías extremas suelen producir hipermetropía posoperatoria porque magnifican el poder del lente a implantar. Este hallazgo produjo lo que se denomina el ajuste de Wang-Koch, que es particularmente útil en fórmulas antiguas como Holladay 1, y que originalmente se proponía para longitudes axiales superiores a 25,2 mm. SRK/T se comporta mejor, y Haigis todavía más, porque es menos sensible a esta aberración de medida óptica. Las fórmulas más recientes como Barrett Universal, Hill RBF y PANACEA se comportan mucho mejor en estos casos. (Ver figura 15)
Hay otra corriente de cálculo del lente intraocular a partir de la longitud axial y medidas de cada espacio “óptico” del globo ocular, que propone que en ojos por encima de 27 mm (este caso en particular), se convierte la queratometría a milímetros (por ejemplo 42.25 D = 8 mm, o 48.25 D = 7), se multiplican por 4 estos valores, y se restan del valor de la longitud axial. Por ejemplo, digamos 30 mm de longitud axial, y la queratometría es de 42.25 (8 mm x 4 = 32). Entonces 30 − 32= −2. Como cada milímetro de longitud axial produce un efecto de 3 dioptrías, ese −2 x 3= −6. Esto es algo más extraño, pero puede perfectamente ensayarse.
Dr. Pablo Suárez: Como mencioné anteriormente, la posibilidad de obtener varios datos en diferentes equipos ha hecho que varias fórmulas inteligentes sean de gran ayuda para estos casos. Actualmente, formulas gratuitas como PANACEA® y VARAS CALCULATOR® han hecho que nuestros cálculos sean más exactos y con mejores resultados. He tenido la oportunidad de realizar cálculos de medidas extremas con PANACEA y la verdad es que los resultados han sido muy buenos y que los hemos presentados en varios foros de ALACCSA-R. Sin embargo, la incorporación en el VARAS CALCULATOR de datos de varios topógrafos y autorrefractores, ha sido de gran ayuda para este tipo de pacientes y ametropías.
4. Si el lente es negativo, ¿realiza algún cambio?
Dr. Noé Rivero: Para los casos como el descripto o implante de lentes negativas utilizo de preferencia la lente Superflex de Rayner modelos 920H asférica, 620H esférica o si necesitamos un tórico para corregir un astigmatismo, se puede pedir a la fábrica el modelo 623T que tienen un amplio rango desde −10 DP de esfera en pasos de 0.50 DP y una toricidad de +1 DP hasta +11 DP en pasos de 0.50 DP, y presenta un calculador amigable en línea que se puede conseguir en www.raytrace.rayner.com/. (Ver figura 16 y 17)
 Esta lente es de una sola pieza de acrílico (Rayacril) de borde cuadrado en 360 grados con una baja incidencia de opacidad capsular muy importante para evitar o retrasar lo más posible la apertura de la cápsula posterior con YAG en estos tipos de pacientes, y una óptica grande de 6,25 mm que permite realizar un examen minucioso de la retina periférica para el control o posibles tratamientos a futuro, por 12.50 mm de longitud ideal para estos pacientes que presentan un bag grande. (Ver figura 18)
Esta lente es de una sola pieza de acrílico (Rayacril) de borde cuadrado en 360 grados con una baja incidencia de opacidad capsular muy importante para evitar o retrasar lo más posible la apertura de la cápsula posterior con YAG en estos tipos de pacientes, y una óptica grande de 6,25 mm que permite realizar un examen minucioso de la retina periférica para el control o posibles tratamientos a futuro, por 12.50 mm de longitud ideal para estos pacientes que presentan un bag grande. (Ver figura 18)
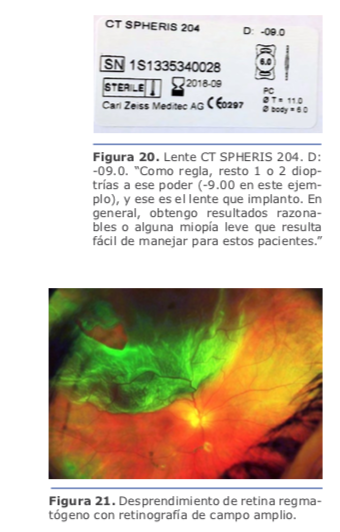
Dr. Juan Guillermo Ortega: Estos lentes son habitualmente negativos (adjunto un caso personal con −12.00). Como regla, resto 1 o 2 dioptrías a ese poder (−9.00 en este ejemplo), y ese es el lente que implanto. En general, obtengo resultados razonables o alguna miopía leve que resulta fácil de manejar para estos pacientes. (Ver figuras 19 y 20)
Dr. Pablo Suárez: En realidad con las fórmulas que he mencionado no realizado ningún cambio.
5. Durante la cirugía, ¿cuáles son sus estrategias que cambia con respecto a un caso normal?
Dr. Noé Rivero: Como cirujano de segmento anterior y posterior le doy muchísima importancia al estudio de la retina en estos tipos de pacientes que van a ser intervenidos de cataratas ya que tienen un mayor índice de desprendimiento de retina por ser miopes y se les suma el factor de la cirugía de catarata, y más si tiene antecedente de un desprendimiento de retina en uno de los ojos, como es el paciente del caso que estamos evaluando.
Debemos estudiar a conciencia la retina periférica en busca de desgarros o degeneración periférica predisponente de un posible desprendimiento retinal como degeneración lattice, en baba de caracol o empalizada, adherencias vitreorretinianas patológicas perivasculares o blanco sin presión. Además, debemos completar con ecografía modo B, retinografía de campo amplio y OCT, que son de gran ayuda.
Tendremos que evaluar el área macular ya que como en el caso, estos pacientes son propensos a tener maculopatía degenerativa o neovascular miópica y una angiogra-fía o angio-OCT nos puede servir de mucha ayuda para evaluar al detalle este tipo de pacientes.
También realizo un examen retinal en el posquirúrgico inmediato, al mes, a los 3 meses y al año de la cirugía. Si detectamos justo antes o luego de la cirugía alguna lesión predisponente de posible desprendimiento de retina, realizo láser de argón rodeando la zona problemática con una triple corona de disparos.

 Durante la cirugía trato de evitar cambios bruscos o descompresiones excesivas de la cámara anterior al retirar el faco o la aspiración, siempre colocando viscoelástico o manteniendo la irrigación constante para evitar mayores movimientos del vítreo hacia adelante. En general, realizo un túnel corneal un poco más corto y utilizo una pinza de rexis recta, no curva, para mejor acceso a la cápsula posterior y no abrir el labio de la córnea ni que se deforme el túnel, ya que tenemos que trabajar mucho más abajo por la amplia cámara anterior que tienen este tipo de pacientes. Luego el resto de la cirugía sigue de forma habitual. (Ver figura 21)
Durante la cirugía trato de evitar cambios bruscos o descompresiones excesivas de la cámara anterior al retirar el faco o la aspiración, siempre colocando viscoelástico o manteniendo la irrigación constante para evitar mayores movimientos del vítreo hacia adelante. En general, realizo un túnel corneal un poco más corto y utilizo una pinza de rexis recta, no curva, para mejor acceso a la cápsula posterior y no abrir el labio de la córnea ni que se deforme el túnel, ya que tenemos que trabajar mucho más abajo por la amplia cámara anterior que tienen este tipo de pacientes. Luego el resto de la cirugía sigue de forma habitual. (Ver figura 21)
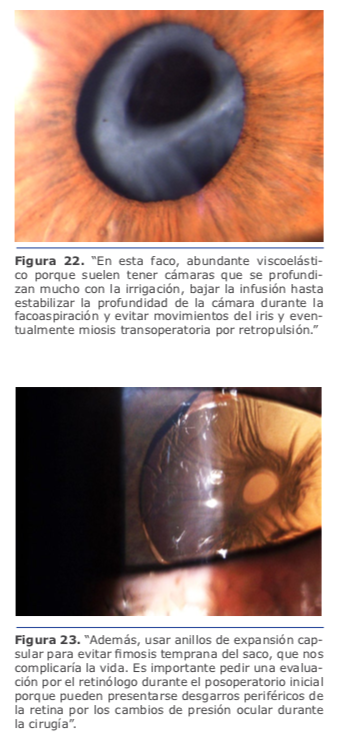
Dr. Juan Guillermo Ortega: En esta faco, abundante viscoelástico porque suelen tener cámaras que se profundizan mucho con la irrigación, bajar la infusión hasta estabilizar la profundidad de la cámara durante la facoaspiración y evitar movimientos del iris y eventualmente miosis transoperatoria por retropulsión. Además, usar anillos de expansión capsular para evitar fimosis temprana del saco, que nos complicaría la vida. (Ver figura 22 y 23)
Es importante pedir una evaluación por el retinólogo durante el posoperatorio inicial porque pueden presentarse desgarros periféricos de la retina por los cambios de presión ocular durante la cirugía.
Dr. Pablo Suárez: El punto clave antes de empezar el procedimiento debería ser el tipo de anestesia que vamos a utilizar. Debemos recordar a quien infiltre, en el caso de ser con anestesia local peri o retrobulbar, que es un paciente con una órbita especial y globo ocular grande. Personalmente, para evitar cualquier tipo de complicación, opero a estos pacientes con anestesia tópica como la mayoría de mis casos, pero si existe algún inconveniente que deba ser con otro tipo de anestesia, deberán tenerse en cuenta estas consideraciones.
Creo que es importante tomar en cuenta que mientras más rápido se opere a una catarata en paciente miope con estas características, mejor será. Esto nos ayudará a no tener que usar parámetros muy altos que puedan descompensar el polo posterior. Lo más recomendable es mantener los fluidos constantes durante el procedimiento y no tener cambios bruscos de presión.
Aunque varios estudios refieren que el uso de anillos de tensión capsular no genera ningún tipo de seguridad futura ante un posible desprendimiento de retina, lo uso de manera rutinaria como parte de un protocolo de mucho tiempo de la clínica.
POSOPERATORIO DEL CASO
• Se intenta dejar con monovisión: OD: −2.50
OI: −0.50 (Ver figuras 24 y 25).






 En la evaluación del paciente con glauco- ma y catarata encontramos que la agudeza visual, el campo visual, la percepción del color y la sensibilidad al contraste pueden estar alteradas, siendo reversibles sólo los defectos asociados a la catarata, por lo que el compromiso en el campo visual y en la sensibilidad al contraste permanecerán afectados aún después de una cirugía de catarata exitosa, y el resultado refractivo puede no ser el deseado en los pacientes que desean menor dependencia de gafas. Por tal motivo, el oftalmólogo debe ser muy claro con las expectativas del paciente y debe conocer los benecios
En la evaluación del paciente con glauco- ma y catarata encontramos que la agudeza visual, el campo visual, la percepción del color y la sensibilidad al contraste pueden estar alteradas, siendo reversibles sólo los defectos asociados a la catarata, por lo que el compromiso en el campo visual y en la sensibilidad al contraste permanecerán afectados aún después de una cirugía de catarata exitosa, y el resultado refractivo puede no ser el deseado en los pacientes que desean menor dependencia de gafas. Por tal motivo, el oftalmólogo debe ser muy claro con las expectativas del paciente y debe conocer los benecios CAMBIOS FUNCIONALES
CAMBIOS FUNCIONALES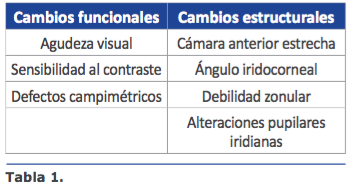 Pupila e iris:
Pupila e iris: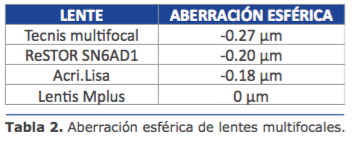 La primera LIO asférica fue comercializada en el año 2002. En la actualidad las hay con per l de asfericidad nulo y con per l asférico negativo, en aras de lograr mejoría signi cativa en la sensibilidad al contraste y disminuir los fenómenos disfotópsicos, como glare y halos. Adicionalmente se les han añadido cualidades de multifocalidad y/o toricidad.
La primera LIO asférica fue comercializada en el año 2002. En la actualidad las hay con per l de asfericidad nulo y con per l asférico negativo, en aras de lograr mejoría signi cativa en la sensibilidad al contraste y disminuir los fenómenos disfotópsicos, como glare y halos. Adicionalmente se les han añadido cualidades de multifocalidad y/o toricidad.

 3. La ablación guiada por topografía no solo tiene la ventaja de contar
3. La ablación guiada por topografía no solo tiene la ventaja de contar
 En SMILE hacemos un procedimiento realmente intraestromal, mínimamente invasivo, no hay duda de que se res- peta de una mejor manera la biomecánica corneal2, comparada con los otros procedimientos y haciendo tratamientos por debajo de 140 micras, respetamos mucho más el plexo nervioso de la córnea. Se logra el menor daño posible utilizando un solo equipo alta- mente preciso, que requiere mucho me- nos mantenimiento o condiciones ambientales menos estrictas de sala que el láser excimer. Con SMILE, además, podemos corregir miopía y astigmatismo muy por arriba del rango que frecuentemente vemos, con la posibilidad de corregir hasta 10 dioptrías de miopía y 5 dioptrías de astigmatismo.
En SMILE hacemos un procedimiento realmente intraestromal, mínimamente invasivo, no hay duda de que se res- peta de una mejor manera la biomecánica corneal2, comparada con los otros procedimientos y haciendo tratamientos por debajo de 140 micras, respetamos mucho más el plexo nervioso de la córnea. Se logra el menor daño posible utilizando un solo equipo alta- mente preciso, que requiere mucho me- nos mantenimiento o condiciones ambientales menos estrictas de sala que el láser excimer. Con SMILE, además, podemos corregir miopía y astigmatismo muy por arriba del rango que frecuentemente vemos, con la posibilidad de corregir hasta 10 dioptrías de miopía y 5 dioptrías de astigmatismo. Dr. Claudio Orlich: Existe una tendencia a hipocorregir el cilindro en la mayoría de los estudios9, esto asociado a varios factores. Para mí, el más importante es la ciclo- torsión. A todos los casos con astigmatismo de 0.75 D o más los marco en la lámpara de hendidura con una aguja con tinta a las III y IX, y una vez realizada la succión, roto la interfase para que la retícula del equipo coincida con las marcas de la córnea. Esta compensación me ha permitido mejorar mucho la corrección del cilindro y alcanzar resultados similares al LASIK. En general los mejores resultados los obtengo en miopías con astigmatismos menores que la esfera. En cilindros irregulares, astigmatismos mixtos o cilindros muy altos con poca miopía, prefiero realizar un LASIK guiado por topografía.
Dr. Claudio Orlich: Existe una tendencia a hipocorregir el cilindro en la mayoría de los estudios9, esto asociado a varios factores. Para mí, el más importante es la ciclo- torsión. A todos los casos con astigmatismo de 0.75 D o más los marco en la lámpara de hendidura con una aguja con tinta a las III y IX, y una vez realizada la succión, roto la interfase para que la retícula del equipo coincida con las marcas de la córnea. Esta compensación me ha permitido mejorar mucho la corrección del cilindro y alcanzar resultados similares al LASIK. En general los mejores resultados los obtengo en miopías con astigmatismos menores que la esfera. En cilindros irregulares, astigmatismos mixtos o cilindros muy altos con poca miopía, prefiero realizar un LASIK guiado por topografía.
 Los parámetros de seguridad son los mismos que para LASIK, en cuanto a regularidad topográfica y limitaciones paquimétricas.
Los parámetros de seguridad son los mismos que para LASIK, en cuanto a regularidad topográfica y limitaciones paquimétricas.
 Caso clínico
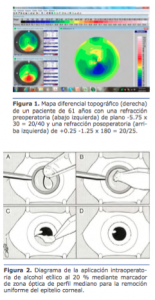
Caso clínico Dr. Nicolás Fernández Meijide: La tomografía muestra un encurvamiento inferior símil «pelúcida» (sin serlo) con astigmatismo central en contra de la regla que coincide con su refracción. Para poder dar más objetividad al análisis refractivo, sería bueno contar con dos topografías separadas en el tiempo, lo que descartaría o confirmaría la participación corneal en el cambio refractivo (recordar que a veces el cambio refractivo se relaciona con cambios cristalinianos, de tipo esclerosis o catarata nuclear, aunque esto más frecuentemente vira hacia la miopía pura que hacia al astigmatismo).
Dr. Nicolás Fernández Meijide: La tomografía muestra un encurvamiento inferior símil «pelúcida» (sin serlo) con astigmatismo central en contra de la regla que coincide con su refracción. Para poder dar más objetividad al análisis refractivo, sería bueno contar con dos topografías separadas en el tiempo, lo que descartaría o confirmaría la participación corneal en el cambio refractivo (recordar que a veces el cambio refractivo se relaciona con cambios cristalinianos, de tipo esclerosis o catarata nuclear, aunque esto más frecuentemente vira hacia la miopía pura que hacia al astigmatismo).