Corrección del astigmatismo en cirugía de catarata
Dra. Ximena Núñez
Colombia
Contacto
Dra. Ximena Núñez – ximena@visionsana.com
Comencemos el tema dando un orden armónico, hablando de la catarata, que pese a los esfuerzos globales como es el Plan Visión 20/20 de la OMS, llamado «El derecho a la visión», la catarata es uno de los principales focos a tratar. El número anual de cirugías necesarias para eliminar la ceguera por catarata se estima entre 2000 y 4000 cirugías por millón de habitantes, de acuerdo con la región. Sin embargo, se encuentran diversos factores que contribuyen a no alcanzar el número de cirugías requeridas, como son las dificultades económicas, culturales y no menos importante, el desconocimiento del tratamiento quirúrgico. Esto finalmente repercute en no poder disminuir la ceguera y tener centenares de pacientes con baja visión por catarata.
Siendo así, desde el punto de vista de salud pública, la catarata hay que operarla y a pesar de los intentos de modernización, no se ha podido superar aún su clasificación con el LOCS III, ni su tratamiento electivo con facoemulsificación y sin establecerse el procedimiento como una cirugía refractiva, concepto moderno cuyas expectativas van más allá de prevenir la ceguera.
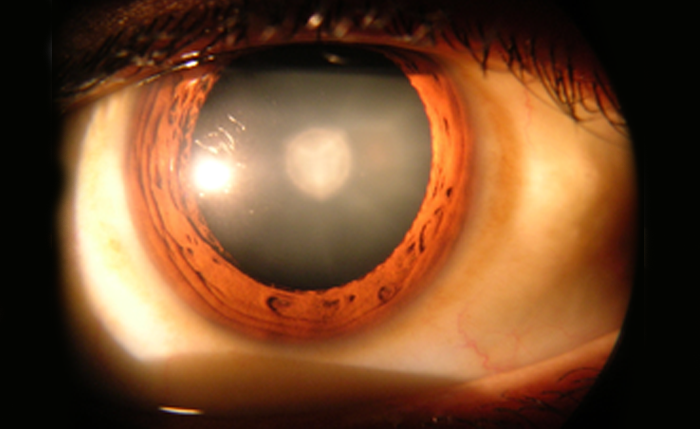
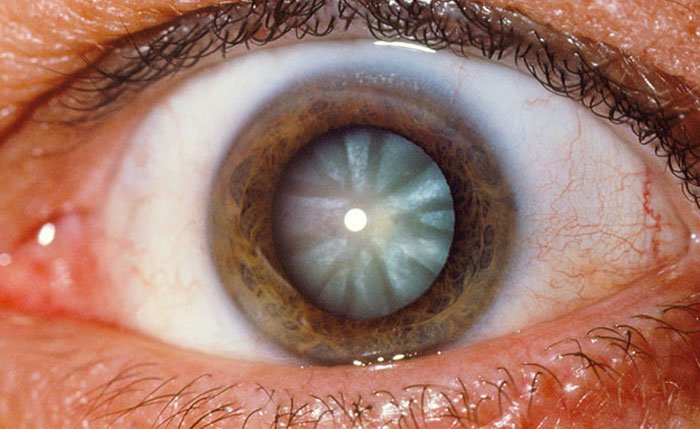
Entonces cuando hablamos de astigmatismo en pacientes con catarata extendemos el concepto básico de la diferencia entre curvaturas corneales. Aquí estamos pensando en optimizar un resultado y, más importante aún, en resaltar el hecho de que aproximadamente el 40 % de los pacientes con catarata presentan astigmatismo superior a 1 dioptría1, y que en pacientes pseudofáquicos, astigmatismos residuales superiores a 0,75 D disminuyen la agudeza visual y deterioran la calidad de vida, principalmente si el implante fue con un lente multifocal, trifocal o de visión extendida. Estos pacientes pueden referir síntomas como visión borrosa, glare, halos, fotofobia y diplopía2.
Con este preámbulo, para los pacientes que además de la Facoemusificación esencial buscan una solución refractiva definitiva, podríamos pensar que antes de tener la multifocalidad en nuestra mente, se debe evaluar la curvatura, y después decidir el lente a implantar. Solo hago referencia a este aspecto porque es el tema que nos ocupa, pero no debemos olvidar otros tantos como la película lagrimal, el nervio óptico y la mácula. Estos requisitos implican que se requiere un manejo personalizado para cada paciente y que lo premium no son los lentes, sino el análisis y la decisión correcta para cada caso.
Existen diferentes formas de corregir el astigmatismo en cirugía de catarata, como son: la incisión en el meridiano curvo, las incisiones pareadas, las incisiones corneales relajantes y los lentes tóricos. Cada uno de estos métodos tiene distintas aplicaciones, límites y predictibilidad en los resultados, lo que implica que cada cirujano está en la obligación de conocer hasta adónde se puede llegar con cada corrección.
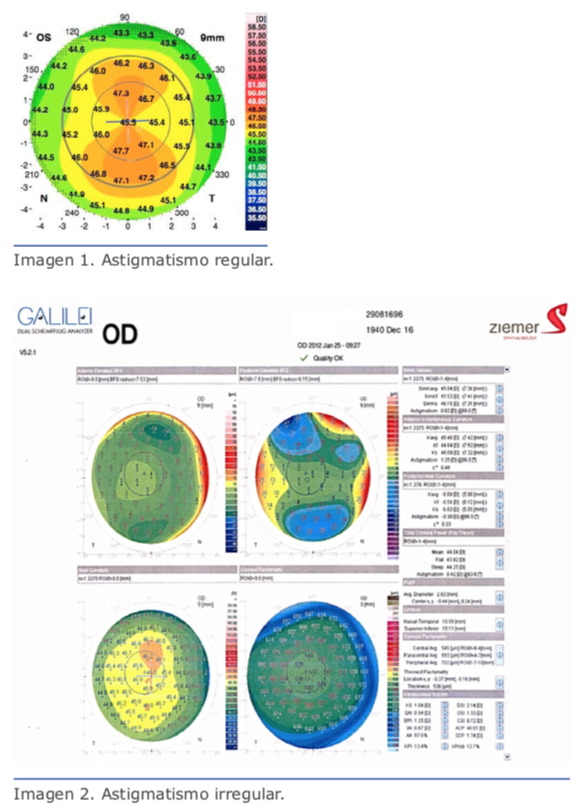
La evaluación de la curvatura y la búsqueda de la toricidad implican que debemos tener, como mínimo, una tomografía y una biometría óptica, evaluar la superficie corneal anterior y posterior y usar los calculadores tóricos alimentando la información adecuadamente. Si el astigmatismo es regular (imagen 1) y el paciente tiene una fijación adecuada, no tendremos mayor problema en el cálculo del lente; pero cuando el astigmatismo es irregular (imagen 2) esto requiere un mayor conocimiento, y aquí es imperativo salirse de la rutina básica y acudir a la experiencia y el juicio razonable.
 El uso de los calculadores tóricos deberíamos adoptarlo de rutina, con un SIA personalizado, y en todos los pacientes. Con sorpresa a veces pensamos que un caso es para colocación de un lente tórico y no lo es, o por el contrario, no lo consideramos, y el calculador nos presenta un lente tórico como lo más adecuado para el paciente.
El uso de los calculadores tóricos deberíamos adoptarlo de rutina, con un SIA personalizado, y en todos los pacientes. Con sorpresa a veces pensamos que un caso es para colocación de un lente tórico y no lo es, o por el contrario, no lo consideramos, y el calculador nos presenta un lente tórico como lo más adecuado para el paciente.
El lente tórico es la opción que ofrece la mejor predictabilidad en la correción de astigmatismo en pacientes que presentan catarata, y aunque no hay reportes que muestren el 100 % de eficacia en la corrección, si se controlan factores pre-, intray posquirúrgicos, se puede mejorar la exactitud de los resultados.
Este editorial es un preámbulo que muestra que este tema es amplio, llegando a ser extenso. Es importante tener un consenso con acuerdos y recomendaciones a través de los cuales se pueda ayudar a los oftalmólogos latinoamericanos a adoptar mejores prácticas durante la cirugía de catarata en pacientes con astigmatismo y mejorar sus resultados, y estoy hablando del COLASC, Consenso Latinoamericano de Astigmatismo en Cirugía de Catarata, del cual muy pronto publicaremos los resultados.
Bibliografía
1. Ferrer-BlascoT,Montes-MicoR,Peixoto-de-Matos SC, Gonzalez-Meijome JM, Cervino A. Prevalence
of corneal astigmatism before cataract surgery. J Cataract Refract Surg 2009; 35:70-75. 2. Alio JL, Ab- delghany AA, Fernandez-Buenaga R. Enhancements after cataract surgery. Curr Opin Ophthalmol 2015; 26:50-55.