El manejo de cristalino subluxado es una de las situaciones más complejas, desafiantes y gratificantes con que suele enfrentarse el cirujano de segmento anterior. Hasta hace pocos años, el tratamiento de esta patología se solía limitar a la cirugía de extracción intracapsular del cristalino. Actualmente la disponibilidad de técnicas quirúrgicas y dispositivos innovadores nos han dado la habilidad de brindar un mejor manejo y resultado a los pacientes con cataratas asociadas a compromiso zonular.
Mencionaremos diez tips que consideramos importantes para alcanzar el éxito en el tratamiento de estos casos.
1.Identificar la causa: Es muy importante clasificar si se trata de un cristalino subluxado de origen en patologías congénitas y del desarrollo (síndrome de Marfán, por ejemplo), adquirida (traumático, pseudoexfoliación). Las patologías asociadas a daño zonular progresivo deben manejarse más agresivamente para evitar pseudofacodonesis posquirúrgica y subluxación del lente intraocular.
2. Determinar el grado de subluxación: En la evaluación en midriasis podemos dividir estos cristalinos con pobre soporte zonular en tres grados:
1. Leve: el borde del cristalino cubre menos del 25 % del área de la pupila.
2. Moderada: el borde del cristalino cubre entre 25 % y 50 % del área de la pupila.
3. Severa: el borde del cristalino cubre más del 50 % del área de la pupila.
3. Evaluar la estabilidad zonular: Se infiere con el grado de facodonesis y evaluando la forma del borde subluxado del cristalino. En diferentes patologías el compromiso zonular es diferente, pudiendo tenerse defectos localizados y focales (trauma, síndrome de Marfán) o debilidad difusa (pseudoexfoliación). También se utiliza como parámetro de inestabilidad la pérdida de zónula en horas de reloj, clasificando como leve menos de 3 horas de pérdida zonular, moderada entre 3 y 6 horas y severa la ausencia de más de 6 horas del reloj de la zónula.
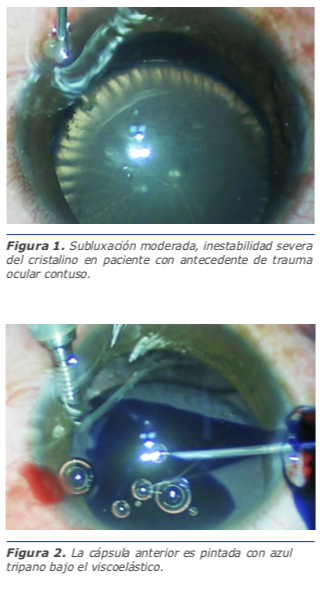
Tanto la facodonesis muy marcada, como el aplanamiento en el borde del cristalino y los casos con ausencia zonular moderada y severa nos deben preparar a enfrentarnos a un cristalino con fibras zonulares remanentes con poca fuerza y mucha inestabilidad. Esto le permite al cirujano anticipar el uso de retractores de cápsula y posteriormente dispositivos para fijar la bolsa del cristalino a la esclera (Figura 1).
4. Estar preparado en el quirófano con todo lo necesario para solucionar un caso complejo y que potencialmente presentaría complicaciones serias en el transoperatorio. Es conveniente tener la capacidad de realizar vitrectomía anterior por pars plana, tener acceso a retractores que permitan fijar la cápsula, anillos de tensión capsular, segmentos para fijación escleral, lentes intraoculares para fijación en caso de pérdida de la cápsula.
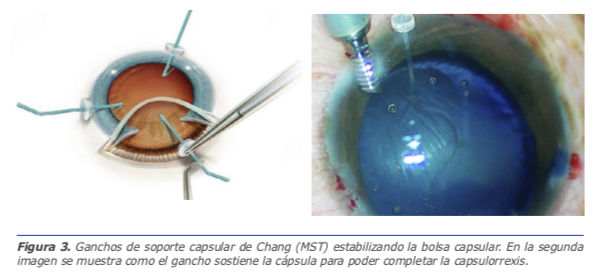
5. Para poder culminar con éxito la capsulorrexis debe ser completa y debemos preservar la bolsa capsular. Uno de los pasos más complejos de la cirugía del cristalino subluxado es precisamente la capsulorrexis. A continuación, algunas recomendaciones para evitar problemas.
Teñir la cápsula con azul tripano, lo que permite no sólo una mejor visualización, sino que agrega una reducción en la elasticidad de la cápsula anterior. Es recomendable te-
ñir bajo un colchón de viscoelástico, para evitar la migración del tinte hacia la cavidad vítrea a través del defecto zonular, lo cual nos reduciría el reflejo rojo y haría el procedimiento más difícil.
La capsulorrexis es recomendable realizarla bajo viscoelástico cohesivo y es mejor iniciar con un cistótomo, no con la pinza, para disminuir la tensión en la zónula. Además, la apertura de la cápsula anterior en estos casos es mucho más complicada y suele encontrase cápsulas muy elásticas en jóvenes o fibrosas en traumas antiguos. Si la apertura de la cápsula resulta muy difícil incluso con el cistótomo, podemos utilizar dos agujas de 30G como “espadas cruzadas” para romper la cápsula anterior y tener un punto de inicio desde el cual continuar con la pinza de capsulorrexis. Durante la apertura circular de la cápsula anterior, en casos de gran inestabili-
dad zonular, suele requerirse el uso de pinzas de microcirugía y/o ganchos de fijación para poder sostener la cápsula y completar la rexis.
El tamaño de la capsulotomía debe ser grande, especialmente si nos enfrentamos a cataratas duras. Cuanto mayor la rexis, menos complicada será la extracción de los fragmentos de núcleo del saco capsular. Sin embargo, debe respetarse un espacio de al menos dos milímetros entre el borde de la capsulorrexis y el ecuador.
Si la cápsula anterior es muy fibrosa, inestable o se complica desplazándose la apertura muy periféricamente, el uso de tijeras microquirúrgicas es de gran utilidad para lograr completar este paso fundamental y tener éxito en estos casos complicados (Figura 2).
6. Estabilizar la bolsa capsular: En casos leves, de menos de 3 horas de pérdida zonular, generalmente se
puede realizar la facoemulsificación sin requerir dispositivos para fijar el saco capsular. Para pérdidas mayores de la zónula es recomendable sostener la bolsa durante la cirugía. Esto lo podemos conseguir con retractores de iris, aunque suele ser más estable la fijación mediante ganchos especiales diseñados para este propósito, especialmente porque estos sostienen la bolsa por el ecuador y no por el borde de la capsulorrexis, reduciendo el riesgo de desgarros en la cápsula anterior. Está descrito el uso de segmentos de Ahmed para estabilizar la cápsula previo a la facoemulsificación; sin embargo, en nuestra experiencia, esto resulta bastante complicado y genera una dificultad más a cirugías ya de por sí retadoras.
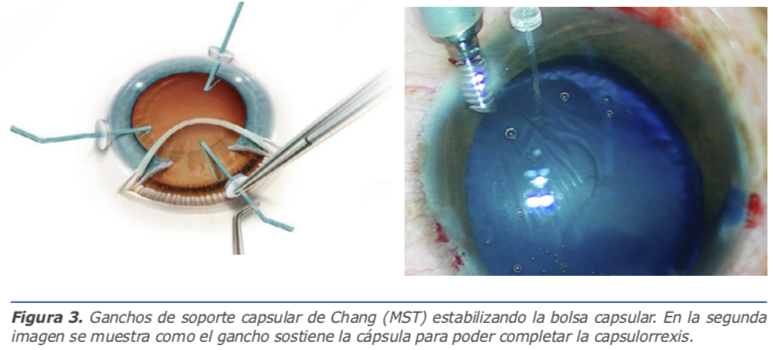
El uso temprano de anillos de tensión capsular (CTR) agrega bastante estabilidad a las bolsas muy sueltas, especialmente cuando faltan más de 6 horas de zónula, y se vuelve muchas veces obligatorio para poder llevar adelante estos casos. No obstante, esto puede luego dificultar un poco la aspiración de la corteza más avanzada en el procedimiento. Usualmente preferimos diferir el uso de los anillos de tensión capsular hasta etapas finales de la cirugía, antes de inyectar el lente intraocular. Sin embargo, si la situación lo amerita, lo hemos de implantar justo después de completada la capsulorrexis, lo importante es siempre dar la estabilidad necesaria al saco para poder completar la facoemulsificación y aspiración sin contratiempos (Figura 3).
7. La hidrodisección, viscodisección e hidrodelaminación son fundamentales en estos casos para disminuir la tracción sobre las zónulas remanentes durante la facoemulsificación.
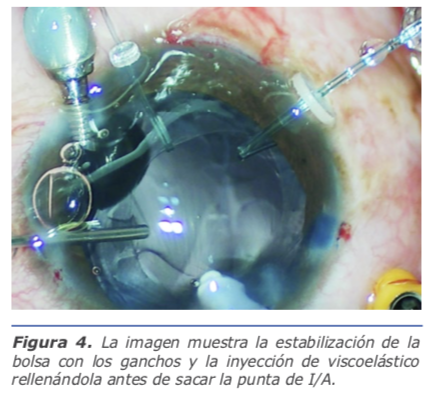
Figura 4. La imagen muestra la estabilización de la bolsa con los ganchos y la inyección de viscoelástico rellenándola antes de sacar la punta de I/A.
8.La facoemulsificación se recomienda con parámetros de “slow motion phaco” tratando de reducir los movimientos de desplazamiento anterior y posterior del cristalino, y evitar el prolapso de vítreo hacia el segmento anterior. Durante este paso, es muy útil la inyección repetida de viscoelástico dispersivo, que también puede ayudar a evitar la salida de vítreo y protegerá el endotelio del trauma por el ultrasonido. Es muy importante que antes de sacar las puntas de faco y de I/A de la cámara anterior, se llene esta con viscoelástico para evitar su colapso que podría permitir la salida de vítreo y hasta la pérdida de la bolsa capsular. Para aspirar los restos corticales se debe también mantener parámetros bajos y puede ser necesario realizar viscoaspiración si se ob-
serva mucha inestabilidad capsular (Figura 4).
9. En caso de evidencia de vítreo en el segmento anterior, este debe removerse completamente antes de proseguir con la facoemulsificación, para evitar la tracción retiniana y permitir la remoción de los fragmentos del cristalino. El abordaje por pars plana y el uso de trocares para vitrectomía facilitan muchísimo la vitrectomía, lo mismo que el uso de triamcinolona para teñir el vítreo. Una vez limpio el segmento anterior
de vítreo, se aplica la inyección de viscoelástico dispersivo a través del trocar formando un colchón por debajo del cristalino. Esto permite continuar con la cirugía más fácilmente, pues estabiliza aún más el cristalino y evita temporalmente el prolapso del vítreo hacia adelante nuevamente.
10. Uso de dispositivos de fijación permanente de la cápsula y lentes intraoculares. Como mencionamos previamente, en estos casos debemos colocar un anillo de tensión capsular para brindar estabilidad al saco. Cuando la diálisis zonular es pequeña, un
CTR simple suele ser suficiente. En casos con pérdida zonular moderada o severa, generalmente se requerirá un dispositivo especial para fijar la cápsula a la esclera. Se puede usar la combinación de un CTR y un segmento de fijación como el de Ahmed, lo cual técnicamente es menos complejo que la opción de colocar un CTR de Cionni. El anillo de Cionni permite una mejor fijación en casos en que la debilidad zonular es mayor. Además, el doble permite fijar en 2 puntos diferentes aumentando la estabilidad de la bolsa capsular. Recientemente tenemos la opción del CTR de Malyugin/Cionni que se inyecta y fija de forma más simple y permite una adecuada fijación y estabilización de la bolsa capsular. Estos dispositivos los podemos fijar a esclera con suturas no absorbibles, y nuestra preferencia es el uso de polipropileno 9-0 o politetrafluoroetileno 8-0 (Gore-Tex® CV-8).
Si logramos completar la cirugía sin complicaciones y manteniendo un saco estable, en teoría podríamos colocar cualquier tipo de lente intraocular, incluidos LIO multifocales y tóricos. Sin embargo, nuestra recomendación es utilizar lentes monofocales, e utilizar idealmente lentes esféricos y de 3 piezas, que permitan solucionar complicaciones posoperatorias de manera menos compleja. El lente intraocular debe colocarse endocapsular, no en el sulcus, a no ser que este se fije de alguna manera, pues es muy probable que el LIO migre a través del defecto zonular, pudiendo luxarse a la cavidad vítrea (Figura 5).
Si completamos la extracción del cristalino, pero se considera que no será posible estabilizar la misma, se puede corregir la
afaquia con un LIO de cámara anterior de soporte angular –opción que ha caído en desuso–, un lente de fijación iridiana (Artisan o Artiflex), un lente de 3 piezas de cámara posterior para fijación a iris, o esclera.
Es importante recordar que para casos de cataratas con pérdida zonular casi completa, en los que no será posible estabilizar la cápsula para completar la facoemulsificación, y especialmente cuando se trata de cristalinos de una dureza extrema, el uso de la extracción intracapsular y vitrectomía anterior siempre es una buena opción; y en el mismo tiempo podríamos realizar el implante del LIO y su fijación escleral. La técnica de fijación intraescleral de las hápticas (Yamane) permite de forma simple completar estos casos, pero esto es otro tema.





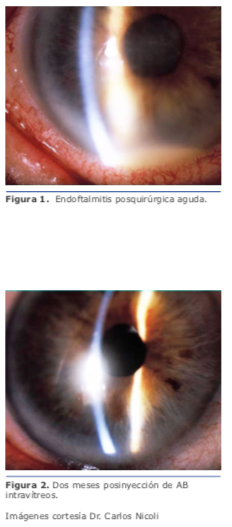 Antibioticoterapia intravítrea empírica
Antibioticoterapia intravítrea empírica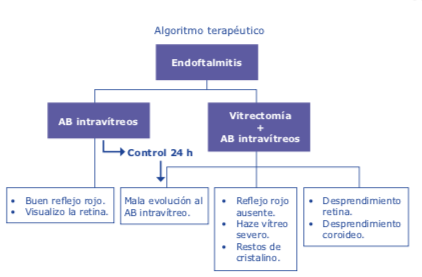

 Este método, al alcance de un oftalmólogo enfocado en trabajo de calidad, crea un círculo virtuoso que se autoalimenta (Ver figura 1).
Este método, al alcance de un oftalmólogo enfocado en trabajo de calidad, crea un círculo virtuoso que se autoalimenta (Ver figura 1).

 Bibliografía:
Bibliografía:

 Teñir la cápsula con azul tripano, lo que permite no sólo una mejor visualización, sino que agrega una reducción en la elasticidad de la cápsula anterior. Es recomendable te ñir bajo un colchón de viscoelástico, para evitar la migración del tinte hacia la cavidad vítrea a través del defecto zonular, lo cual nos reduciría el reflejo rojo y haría el procedimiento más difícil.
Teñir la cápsula con azul tripano, lo que permite no sólo una mejor visualización, sino que agrega una reducción en la elasticidad de la cápsula anterior. Es recomendable te ñir bajo un colchón de viscoelástico, para evitar la migración del tinte hacia la cavidad vítrea a través del defecto zonular, lo cual nos reduciría el reflejo rojo y haría el procedimiento más difícil.
 Para aspirar los restos corticales se debe también mantener parámetros bajos y puede ser necesario realizar viscoaspiración si se observa mucha inestabilidad capsular (Figura 4).
Para aspirar los restos corticales se debe también mantener parámetros bajos y puede ser necesario realizar viscoaspiración si se observa mucha inestabilidad capsular (Figura 4).
 En la lámpara de hendidura se debe evaluar funcionalidad palpebral, menisco lagrimal, descartar presencia de blefaritis, disfunción de glándulas de Meibomio, queratitis, tiempo de ruptura de la lágrima (BUT), prueba de Schirmer y, en caso de ser necesario, se puede recurrir a estudio de la osmolaridad lagrimal, detección de metaloproteinasas, niveles de anticuerpos o citología de impresión conjuntival, entre otros.
En la lámpara de hendidura se debe evaluar funcionalidad palpebral, menisco lagrimal, descartar presencia de blefaritis, disfunción de glándulas de Meibomio, queratitis, tiempo de ruptura de la lágrima (BUT), prueba de Schirmer y, en caso de ser necesario, se puede recurrir a estudio de la osmolaridad lagrimal, detección de metaloproteinasas, niveles de anticuerpos o citología de impresión conjuntival, entre otros.


 En los últimos años se ha buscado la posibilidad de manejar ambas patologías en una sola cirugía, pero de una forma efectiva y eficaz. En las últimas dos décadas se introdujo el concepto de cirugía de glaucoma mínimamente invasiva (MIGS, por sus siglas en inglés) que corresponde a un conjunto de procedimientos que han demostrado proporcionar una reducción sostenida de la PIO sin las desventajas de la medicación hipotensiva ocular (por ejemplo, falta de cumplimiento, enfermedad de la superficie ocular, costo) o el riesgo adicional sustancial asociado con las cirugías filtrantes.9 A menudo, los MIGS se pueden combinar con la cirugía de cataratas mediante facoemulsificación usando la misma incisión en córnea clara de la FACO. Hasta la fecha, los procedimientos MIGS disponibles ofrecen resultados más modestos que la cirugía de glaucoma tradicional, pero con el beneficio de un perfil de riesgo más seguro y con otras ventajas como las siguientes: una microincisión interna que ahorra conjuntiva y facilita la cirugía futura de glaucoma, si fuese necesario; traumatismo tisular mínimo; eficacia moderada; y recuperación visual rápida.10
En los últimos años se ha buscado la posibilidad de manejar ambas patologías en una sola cirugía, pero de una forma efectiva y eficaz. En las últimas dos décadas se introdujo el concepto de cirugía de glaucoma mínimamente invasiva (MIGS, por sus siglas en inglés) que corresponde a un conjunto de procedimientos que han demostrado proporcionar una reducción sostenida de la PIO sin las desventajas de la medicación hipotensiva ocular (por ejemplo, falta de cumplimiento, enfermedad de la superficie ocular, costo) o el riesgo adicional sustancial asociado con las cirugías filtrantes.9 A menudo, los MIGS se pueden combinar con la cirugía de cataratas mediante facoemulsificación usando la misma incisión en córnea clara de la FACO. Hasta la fecha, los procedimientos MIGS disponibles ofrecen resultados más modestos que la cirugía de glaucoma tradicional, pero con el beneficio de un perfil de riesgo más seguro y con otras ventajas como las siguientes: una microincisión interna que ahorra conjuntiva y facilita la cirugía futura de glaucoma, si fuese necesario; traumatismo tisular mínimo; eficacia moderada; y recuperación visual rápida.10 Los cuatro enfoques principales de la reducción de la PIO mediante MIGS incluyen el 1) aumento del flujo de salida trabecular mediante la derivación de la malla trabecular yuxtacanalicular, 2) el aumento del flujo uveoescleral a través de vías supracoroidales, 3) la reducción de la producción acuosa del cuerpo ciliar o 4) la creación de una vía de drenaje subconjuntival 8.
Los cuatro enfoques principales de la reducción de la PIO mediante MIGS incluyen el 1) aumento del flujo de salida trabecular mediante la derivación de la malla trabecular yuxtacanalicular, 2) el aumento del flujo uveoescleral a través de vías supracoroidales, 3) la reducción de la producción acuosa del cuerpo ciliar o 4) la creación de una vía de drenaje subconjuntival 8.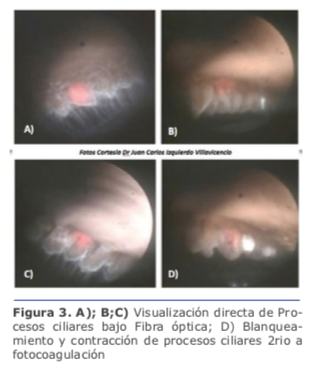 Lindfield et al. encontraron que los ojos que tenían faco-ECP tuvieron una disminución en la PIO media preoperatoria de 21.5 +/1.6 mmHg a 14.4 +/0.8 mmHg después 2 años. Además, el procedimiento produjo menos complicaciones que la facoemulsificación combinada a la trabeculectomía.10
Lindfield et al. encontraron que los ojos que tenían faco-ECP tuvieron una disminución en la PIO media preoperatoria de 21.5 +/1.6 mmHg a 14.4 +/0.8 mmHg después 2 años. Además, el procedimiento produjo menos complicaciones que la facoemulsificación combinada a la trabeculectomía.10

 En casos de queratomileusis o LASIK, mantenga su rutina de cirugía convencional evitando manipular el flap y prevenir así la posible siembra de células epiteliales en la entrecara. Generalmente uso metilcelulosa sobre la córnea, lo que evita el constante goteo de BSS que puede hiperhidratar el epitelio y facilitar una epitelización de la interfase o dentro de las incisiones en las queratotomías refractivas, las cuales ocasionalmente pueden ser mas frágiles y poco compactas. En pacientes con PRK, anticipe la presencia o no de opacidad (haze) que pueda dificultar algunos pasos como la capsulorrexis.
En casos de queratomileusis o LASIK, mantenga su rutina de cirugía convencional evitando manipular el flap y prevenir así la posible siembra de células epiteliales en la entrecara. Generalmente uso metilcelulosa sobre la córnea, lo que evita el constante goteo de BSS que puede hiperhidratar el epitelio y facilitar una epitelización de la interfase o dentro de las incisiones en las queratotomías refractivas, las cuales ocasionalmente pueden ser mas frágiles y poco compactas. En pacientes con PRK, anticipe la presencia o no de opacidad (haze) que pueda dificultar algunos pasos como la capsulorrexis.