La oftalmología está creciendo en gran parte gracias a la tecnología aplicada. El láser de femtosegundos es una herramienta altamente sofisticada, que desde su aparición hasta el presente aparentemente no ha encontrado un lugar dónde volverse imprescindible y popularizarse, ¿o sí?.
En principio para la implantación de segmentos intracorneales el femtosegundos parece haber ganado la batalla. Es indiscutible que es preferible la exactitud asistida por aparatología antes que la construcción de túneles corneales artesanales que son únicos, pero a las vez no tan reproducibles. Pero no sucede lo mismo frente a la cirugía refractiva corneal, dónde los nuevos microquerátomos siguen siendo una buena opción para asistir a la mano del cirujano. Es cierto que el femto también es un buen bisturí para crear colgajos corneales, pero al considerar la función del dispositivo, su efecto y su real necesidad médica, el microquerátomo sigue estando un paso adelante y mucho más pensando en costo-beneficio.
Pero esta editorial se centra en la aplicación del femtosegundos en la realización de la ciruía de cataratas, en procedimiento denominado FLACS (por sus siglas en inglés). ¿Es esta tecnología un aporte que permite reducir el factor de la variabilidad humana, al facilitar la realización de pasos quirúrgicos, de manera más segura y exacta? Asimismo, algo que sucede con este tipo de tecnologías es que agregan un costo a la medicina que debe justificarse mediante evidencias. Al día de hoy, FLACS en realidad se planeta como opcional, aunque en realidad, para algunos casos podría ser la técnica quirúrgica de elección. Sin embargo en la comunidad médica existe cierta resistencia a incorporar estos conceptos. Plantear estas cuestiones es lo que motiva la presente editorial, dónde muy brevemente se comentará los siquiente: ¿FLACS, es necesario, equivalente o superior la cirugía de cataratas convencional con faco? Bien, en realidad esa pregunta depende el contexto y de la comunidad en la que se aplique. Lo cierto es que en una parte el mundo, se hace más FLACS que faco convencional, pero en otra parte del mundo se hace más la extracapsultar. La técnica debe estar a disposición del médico, en contexto de las necesidades del ámbito donde se practique la medicina. Por lo tanto, creo que la pregunta actual sobre FLACS debería ser ¿en qué casos FLACS resulta una técnica más apropiada que las otras disponibles para resolver cataratas?
Comprendamos primero la esencia de funcionamiento del femto y su función en FLACS, para de esta forma plantear sus posibilidades y limitaciones. El femto trabaja por fotodisrupción a través de la emisión de pulsos infrarrojos, ultra-cortos y secciona vaporizando, generando burbujas de micro-cavitación que al colapsar separa el tejido1-3. Sus potenciales cualidades en FLACS son la creación de incisiones y cortes muy precisos, de utilidad en la creación de una capsulorrexis cercana a la perfección y altamente reproducible, pero también permite crear incisiones corneales que son diseñadas con la asistencia de tecnología de imágenes en vivo por tomografía de coherencia óptica (OCT), lo que asimismo permite manejar estas incisiones para lograr un mejor control del astigmatismo. En resumen El femto se encarga de la capsulorrexis y la incisión corneal, guiada por OCT. Ni más ni menos. Son sólo dos etapas de toda la cirugía de cataratas, pero dos etapas fundamentales, que pueden hacer la gran diferencia en eficacia y seguridad, principalmente en los casos vamos a discutir de forma breve y conceptual, en los ítems a, b y c, que siguen a continuación
a. FLACS y lentes premium.
Las nuevas lentes intraoculares multifocales requieren de un centrado apropiado, para poder aprovechar todos sus recursos de diseño óptico. De esta forma se logra tanto calidad como cantidad visual, a diferentes distancias. FLACS facilita esto mediante capsulotomías que si se diseñan bien antes de ser ejecutadas, garantizarán el éxito de posicionar la lente en su punto justo.4 Además, el manejo del astigmatismo mediante la creación de la incisión corneal de la forma más apropiada, serán un valor extra a la hora de evitar agregar un factor de error.
b. FLACS y Fuchs
El manejo quirúrgico del paciente con Fuchs y cataratas no es simple, existiendo el riesgo principal de la descompensación corneal irreversible. Desde la introducción del láser de femtosegundos en la cirugía de cataratas en 20095 se han realizado comparaciones entre las técnicas con la facoemulsificación convencional (manual) que demuestran la menor energía y tiempo de faco a la cual se expone el ojo, menor inflamación en cámara anterior y a su vez mayor precisión y reproducibilidad que otorga el láser de femtosegundos.6-9 Esta combinación de datos pareciera ser ideal para realizar casos complejos como en la Distrofia corneal de Fuchs. 6-10
c. FLACS y más casos especiales.
Cataratas blancas, intumescentes: en estos casos existe fibrosis y aumento de la tensión capsular, por lo que sin FLACS hay mayor riesgo de tener complicaciones con la capsulorrexis, entrada de vítreo en cámara anterior y caída del núcleo al vítreo, mientras que con FLACS se logra una capsulotomía precisa y rápida..11-14
Hipermetropía elevada y cierre angular: el bloqueo pupilar, es una complicación posible en casos con cataratas y cámara estrecha, donde FLACS, es una buena opción en ojos donde hay menos espacio de trabajo en la cámara anterior, por lo que sin FLACS hay mayor riesgo de sufrimiento endotelial.15 Con FLACS, el endotelio está más cuidado y hay menos riesgo de rotura capsular.14, 15 A su vez, si fuera necesario, FLACS permitirá la creación de incisiones arcuatas, siendo esta una herramienta más sobre todo para el manejo de astigmatismos complejos.16
A modo de conceptos finales, podemos mencionar como ventajas de FLACS: predictibilidad, proporciona visualización en directo mediante OCT y otorga cierta reducción del factor humano como fuente de error en los pasos quirúrgicos. Asimismo, como desventajas encontramos el costo del equipo y los tratamientos por un lado y la necesidad de movilizar equipamiento/paciente durante el procedimiento, algo que con algunos equipos ha ido mejorando en el tiempo. Pero lo más relevante, es conocer que estos recursos existen y están disponibles para ser utilizados en los casos indicados.
Referencias
Pajic B, Vastardis I, Gatzioufas Z et al. First experience with the new high-frequency femtosecond laser system (LDV Z8) for cataract surgery. Clinical Ophthalmology. 2014;8:2485-2489.
Alió JL, Abdou AA, Puente AA et al. Femtosecond laser cataract surgery: updates on technologies and outcomes. J Refract Surg. 2014 Jun;30(6):420-7.
Wu BM, Williams GP, Tan A et al.. A Comparison of Different Operating Systems for Femtosecond Lasers in Cataract Surgery. Journal of Ophthalmology. 2015;2015:616478.
Levitz LM, Dick HB, Scott W, Hodge C, Reich JA. The Latest Evidence with Regards to Femtosecond Laser-Assisted Cataract Surgery and Its Use Post 2020. Clin Ophthalmol. 2021;15:1357-1363.
Nagy Z, Takacs A, Filkorn T et al. Initial clinical evaluation of intraocular femtosecond laser in cataract surgery. J Refract Surg. 2009;25:1053–60.
Ang RET, Quinto MMS, Cruz EM et al. Comparison of clinical outcomes between femtosecond laser-assisted versus conventional phacoemulsification. Eye and Vision. 2018;5:8.
Yamazoe K., Yamaguchi T., Hotta K., Satake Y., Konomi K., Den S., Shimazaki J. – Outcomes of cataract surgery in eyes with a low corneal endothelial cell density. Journal of Cataract and Refractive Surgery 37(12): 2130-2136, 2011.
Hayashi K., Yoshida M., Manabe S., Hirata A. Cataract surgery in eyes with low corneal endothelial cell density. J Cataract Refract Surg; 37(8):1419-25, 2011.
Seitzman G.D., Gottsch J.D., Stark W.J. Cataract surgery in patients with Fuchs’ corneal dystrophy: expanding recommendations for cataract surgery without simultaneous keratoplasty. Ophthalmology, 112(3):441-446, 2005.
.Gavriş M, Horge I, Avram E et al. FUCHS ENDOTHELIAL CORNEAL DYSTROPHY: IS FEMTOSECOND LASER – ASSISTED CATARACT SURGERY THE RIGHT APPROACH? . Romanian Journal of Ophthalmology. 2015;59(3):159-163.
Chee SP, Chan NS, Yang Y, Ti SE. Femtosecond laser-assisted cataract surgery for the white cataract. Br J Ophthalmol. 2019;103(4):544-550. doi:10.1136/bjophthalmol-2018-312289
Zhu Y, Chen X, Chen P, et al. Lens capsule-related complications of femtosecond laser-assisted capsulotomy versus manual capsulorhexis for white cataracts. J Cataract Refract Surg. 2019;45(3):337-342. doi:10.1016/j.jcrs.2018.10.037
Larco P, Larco C, Borroni D, et al. Efficacy of femtosecond laser for anterior capsulotomy in complex white cataracts. J Fr Ophtalmol. 2023;46(5):501-509. doi:10.1016/j.jfo.2022.10.010
Lee YW, Cho KS, Hyon JY, Han SB. Application of Femtosecond Laser in Challenging Cataract Cases. Asia Pac J Ophthalmol (Phila). 2023;12(5):477-485.
Bissen-Miyajima H, Hirasawa M, Nakamura K, Ota Y, Minami K. Safety and reliability of femtosecond laser-assisted cataract surgery for Japanese eyes. Jpn J Ophthalmol. 2018;62(2):226-230.
Kwon HJ, Lee H, Lee JA, Kim JY, Tchah H. Astigmatic correction of simultaneous femtosecond laser-assisted cataract surgery (FLACS) with intrastromal arcuate keratotomy (ISAK) versus Toric intraocular Lens Impantation with conventional phacoemulsification. BMC Ophthalmol. 2021;21(1):298.
 Dr. Ticiano Gobellina
Dr. Ticiano Gobellina Dr. Alfonso Sabater – España
Dr. Alfonso Sabater – España Dr. Neto Rosatelli – Brasil
Dr. Neto Rosatelli – Brasil





 Dr. Gerardo Valvecchia
Dr. Gerardo Valvecchia  Dr. Ramiro Medina Boiko.
Dr. Ramiro Medina Boiko. Dr. David Flicker
Dr. David Flicker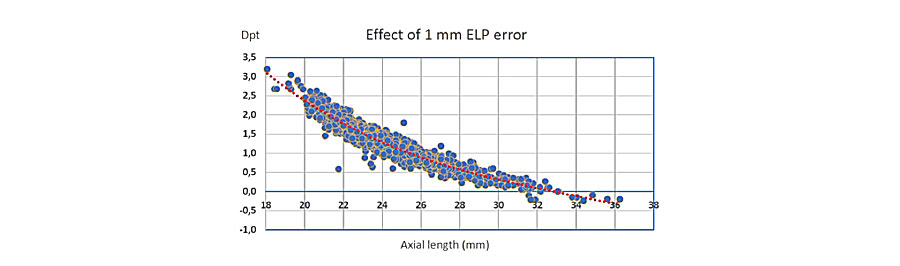
 2.¿Cuál de las siguientes no es causa de descentración de la lente intraocular?
2.¿Cuál de las siguientes no es causa de descentración de la lente intraocular? 3. ¿Cuál considera que es la fórmula para el cálculo de lente intraocular que predice con mayor precisión la posición efectiva de la lente?
3. ¿Cuál considera que es la fórmula para el cálculo de lente intraocular que predice con mayor precisión la posición efectiva de la lente?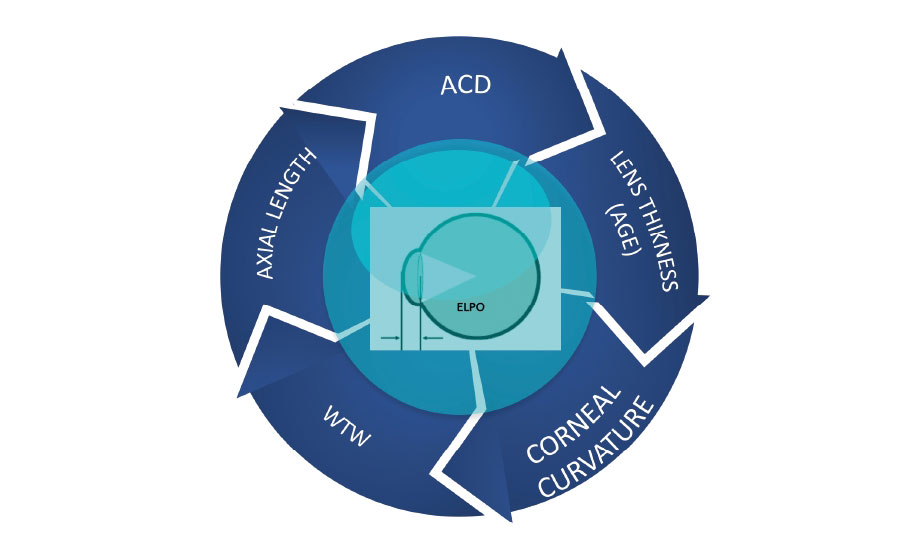

 Dra. Rachel Gómez
Dra. Rachel Gómez Dr. Luis Brenner – Noruega
Dr. Luis Brenner – Noruega Dra. Leila Gouvea – Brasil
Dra. Leila Gouvea – Brasil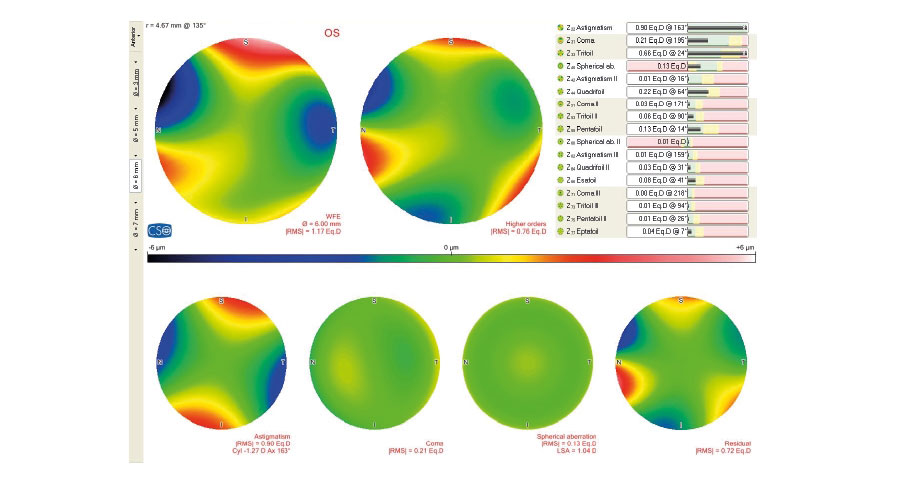
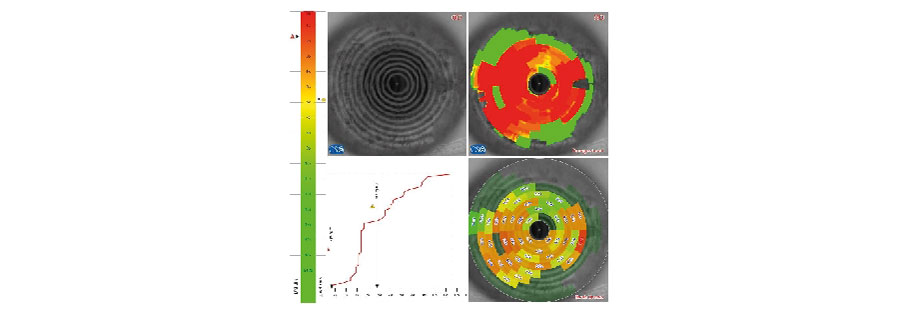
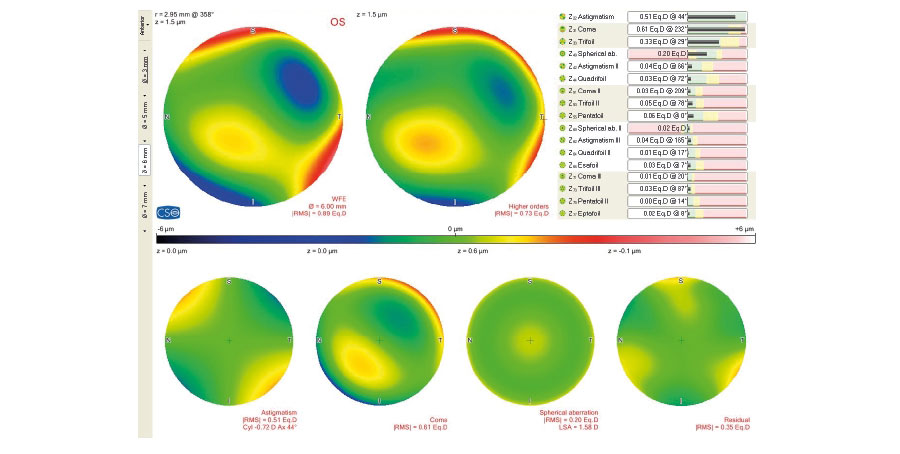 2. ¿Cuál examen preoperatorio es más importante para definir si el implante de lentes trifocales es adecuado o no?
2. ¿Cuál examen preoperatorio es más importante para definir si el implante de lentes trifocales es adecuado o no?


 Dr. Arturo Kantor, MD
Dr. Arturo Kantor, MD  Dr. Felipe Mellado, MD
Dr. Felipe Mellado, MD Dr. Juan José Mura, MD
Dr. Juan José Mura, MD 


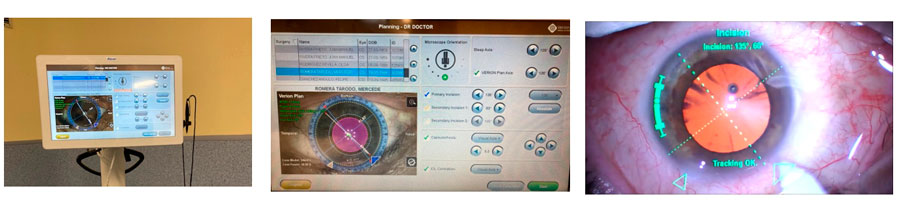




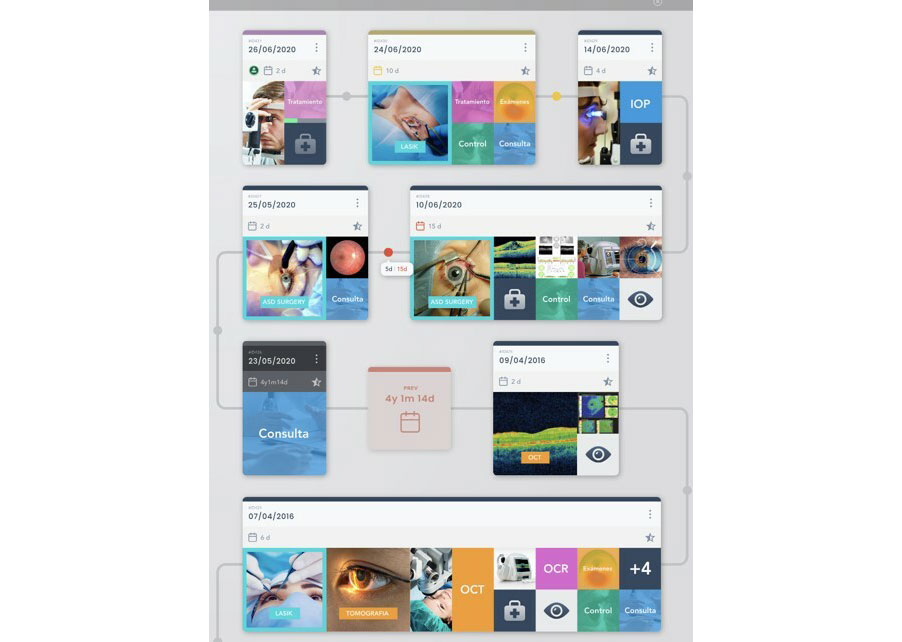 Figura 1: Imagen de vista telegráfica para optimizar tiempos de estudio de paciente en solución Revai.
Figura 1: Imagen de vista telegráfica para optimizar tiempos de estudio de paciente en solución Revai.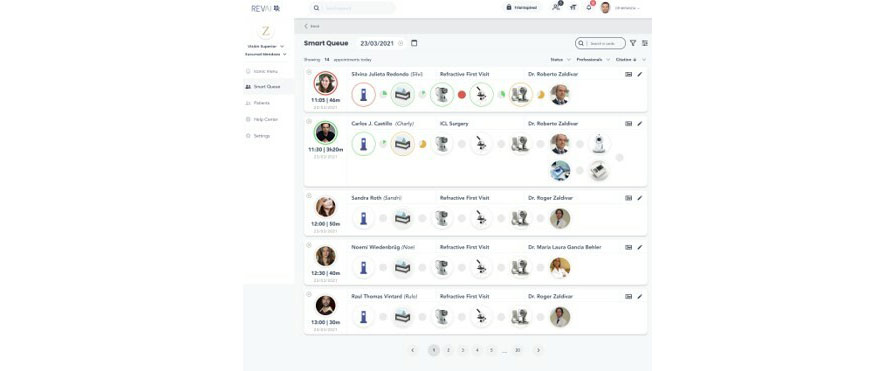 Fig 2: Smart Queue para observar flujos de pacientes y objetivar tiempos de espera en el proceso de atención.
Fig 2: Smart Queue para observar flujos de pacientes y objetivar tiempos de espera en el proceso de atención.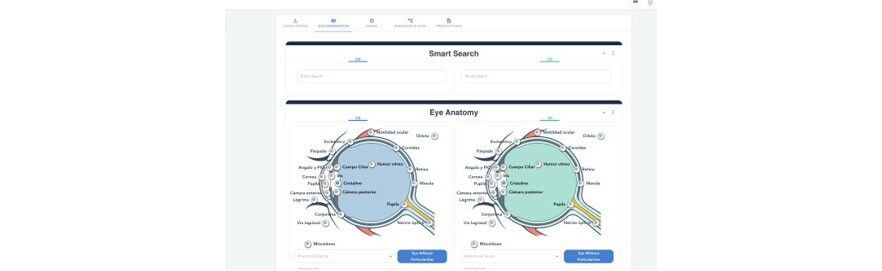 Fig 3: Biomicroscopia
Fig 3: Biomicroscopia