Dr. Eduardo Chávez Mondragón México
Panelistas
Dr. Miguel Srur – Chile
Dr. Carlos Palomino – España
¿Qué clasificación de ojos cortos prefiere y por qué?
Dr. Miguel Srur: Desde el punto de vista anatómico, en ojos cortos tenemos aque- llos que tienen una cámara anterior estre- cha con un eje axial corto (nanoftalmos o microftalmos) o con un eje axial normal. Por otro lado, tenemos los ojos con una CA dentro de límites normales, pero que tienen un eje axial corto, como son la ma- yoría de las hipermetropías.
Casos más raros son las microcórneas, que tienen un segmento anterior peque- ño, pero con una longitud axial normal y, por otro lado, están las megalocórneas, con una hipermetropía axial, pero que
tienen una cámara anterior corta.
Thomas Neumann hace años estableció el nombre “microftalmos anterior relati- vo”, que son aquellos ojos que tienen un diámetro corneal menor de 11 mm, una CA menor de 2.2 mm y una longitud axial mayor de 20 mm. Estos ojos tienen un mayor riesgo de glaucoma, exfoliación capsular de Vogt y córnea guttata.
Existe también el microftalmos posterior, en que hay un segmento posterior corto, pero con una apariencia externa normal. Estos son habitualmente pacientes altos hipermétropes que pueden tener pliegues corio-retinales en el polo posterior y efu- siones coroideas.
Los nanoftalmos son una forma de mi- croftalmos sin otras anomalías del de- sarrollo, lo que los diferencia de los mi- croftalmos complejos, que pueden tener
distintas anomalías congénitas como son los colobomas. Tienen longitu- des axiales cortas, escleróticas más gruesas, CA estrechas y cristalino normal o engrosado.
En general se define también como ojo corto todos aquellos con un eje axial menor de 22,5 mm, y como na- noftalmos, aquellos con un eje axial menor de 20,5 mm.
Dr. Carlos Palomino: La clasifica- ción que prefiero es la publicada por Javier Mendicute en la ponencia de la Sociedad Española de Oftalmolo- gía bajo el título: «Cirugía del cris- talino», porque es una clasificación anatomoclínica que divide los ojos cortos en:
- Microftalmos
- Microftalmos
- Microftalmos anterior
- Microftalmos
Esta clasificación nos indica las características de cada grupo, así como las anomalías oculares que las acompañan.
2. Consejos pre-, trans- y posopera- torios con estos casos.
Dr. Miguel Srur: En el preoperatorio se debe ser muy cuidadoso en el manejo del glaucoma si lo hubiera, con control médi- co o quirúrgico de ser necesario.
Mediciones obligatorias son las quera- tometrías, diámetro corneal y blanco a blanco. Paquimetrías, mediciones de CA, grosor del cristalino y de la cavidad vítrea. Todo esto para introducir valores más exactos en las reglas biométricas para la determinación del lente intraocular, lo que no siempre es fácil en estos ojos. Ideal- mente determinar el grosor esclero-coroi- deo mediante ecografía, ya que de estar engrosado (>1,7 mm) sabremos que nos enfrentamos a un nanoftalmos y se debe asumir que se pueden producir otro tipo de complicaciones intraoperatorias. En lo posible, es de gran ayuda una OCT de segmento anterior.
En el intraoperatorio, preferir el abordaje temporal, ya que muchas veces son ojos pequeños y hundidos. Extremar cuidado con la paracentesis inicial para no pasar a llevar la raíz del iris, que no sea grande ni muy cercana a la esclerótica para evitar el prolapso del mismo, sino más bien peque- ña para introducir el viscoelástico (debe ser dispersivo en esta etapa) suficiente que nos permita hacer la incisión principal con menos riesgo de lesionar el iris.
La paracentesis se puede ampliar poste- riormente para introducir las espátulas o instrumental necesario para la faco.
No usar mucho viscoelástico que impli- que mayor riesgo de protrusión iridiana, pero sí lo suficiente que permita hacer una capsulorrexis segura y nos evite tocar el endotelio en una cámara estrecha. Es ideal usar instrumentos delgados para la confección de la capsulorrexis, como sonlos fórceps tipo Ikeda o Kawai (MST- Geuder- Duckworth & Kent, etc.) por sobre las pinzas como la Utrata. En esta etapa es cuando se demuestra una de las principales ventajas de la faco femtosegundo, la que sin duda nos facilita este paso en la cirugía
La faco tiene que ser hecha con microtip tipo Kelman de angulación inferior para alejarnos del endotelio. Tener cuidado de irrigar siem- pre la incisión principal, ya que estos pacien- tes tienen más riesgo de quemadura incisio- nal. Con relación a la CA, puede ser más fácil
en estos casos la técnica bimanual.
Dr. Carlos Palomino
Tener cuidado en la implantación del LIO en el saco, que debe ser llevada a cabo de ma- nera lenta y segura para evitar aperturas bruscas del mismo, que pasen a llevar el en- dotelio que está más cerca.
La capsulorrexis debe ser de 5 mm, pero si fue- ra más grande y tenemos riesgo de protrusión del LIO hacia CA, se deben colocar mióticos.
Al término, si las incisiones no están bien selladas, asegurarlas con una sutura por el riesgo de prolapso iridiano.
Por último, en cámaras muy estrechas, lo que nos puede facilitar el procedimiento al inicio de la cirugía es el uso de manitol al 20 % (2 ml/kg), si tenemos PIO >25 mmHg, o una vitrectomía posterior que nos ayuda a ampliar la CA.
Dr. Carlos Palomino: Preoperatorio:
La biometría debe realizarse con técnicas de interferometría óptica con la que podemos medir queratometrías, longitud axial, ACD, blanco-blanco y grosor del cristalino.
En cuanto a las fórmulas, en este tipo de ojos, usamos preferentemente Hoffer Q y Holladay II.
En ojos menores de 20 mm se debe realizar ecografía para medir el espesor esclero-coroideo.
Se deben valorar:
- Los cambios anatomomorfológicos.
- El objetivo refractivo bilateral
Si hay hipertensión ocular debemos buscar la causa y normalizar el ojo an- tes de la cirugía.
Si en la ecografía hemos diagnosticado un engrosamiento esclero-coroideo de- beremos realizar esclerectomías profi- lácticas anteriores.
Cirugía:
La anestesia como primera elección debe ser tópica.
Las incisiones deben tener una ar- quitectura exquisita. La complicada capsulotomía debe ser perfecta y de un tamaño adecuado y el tratamien- to del núcleo debe ser el adecuado. Todo esto lo conseguimos usando un femtofaco.
Posoperatorio:
El edema corneal transitorio es fre- cuente por la cercanía del endotelio.
En caso de desprendimiento exuda- tivo de coroides o de retina, nues- tros retinólogos lo tratarán, llevan- do un estricto control ecográfico.
En cuanto al edema macular quístico,
será tratado como habitualmente.
- ¿Cómo calcula el LIO en ojos cortos, sobre todo en nanoftalmos?
Dr. Miguel Srur: El cálculo de es- tos lentes es fundamental, ya que pequeños errores nos pueden de- terminar grandes errores refracti- vos en el posoperatorio.
La fórmula Hoffer Q es bastante ade- cuada para ojos con LA <22 mm, ya que considera la ELP en función del ojo y no como una constante, con una medición de CA personalizada, así como factores de moderación de la ACD en ojos cortos. También son útiles las fórmulas de Haigis y Ho- lladay II.
El nuevo Calculador PANACEA, de David Flikier, es un nuevo aporte para el cálculo de estos casos.
Dr. Carlos Palomino: La respues- ta a esta pregunta ha sido incluida en la respuesta del segundo punto
- ¿Recomienda doble LIO en la bolsa?
Dr. Miguel Srur: El piggyback es una técnica difícil de hacer en ojos pequeños, y cada vez se está ha-ciendo menos en la medida que han apa- recido en el mercado diseños de nuevos lentes que permiten corregir altas diop- trías. Uno de ello es el LIO de Morcher, modelo 27 D, especial para microftalmos. Se hace a pedido y permite corregir hasta 75 D. Lo mismo sucede con los modelos ASPIRA de Human Optics que pueden co- rregir hasta 60 D.
Si estos lentes no están disponibles, la op- ción entonces es un piggyback. En este caso se debe hacer con un lente de una pieza de acrílico hidrofóbico en el saco y un LIO de tres piezas en el surco. Hay que tener cui- dado, eso sí, a pesar de que actualmente el riesgo es bajo, a diferencia de cuando se usaban LIO de silicona o materiales simila- res, con la opacificación de las ópticas que entran en contacto o con la formación de membranas entre ambos.
Otro punto que se debe considerar, es que a veces en ojos muy chicos el piggyback nos puede estrechar más aun la cámara anterior, con riesgo serio de glaucoma o su descompensación si lo hubiera.
Dr. Carlos Palomino: Nosotros no so- mos partidarios del piggyback, ya que ac- tualmente podemos conseguir, por encar- go, lentes de hasta 60 dioptrías, aunque se pueden producir problemas de aberra- ciones y trastornos visuales por encima de las 40 D. En caso de implantar dos lentes, somos partidarios de implantar el de mayor potencia en el saco, y en el sur- co, el complementario.
- Algunas formas de estos casos de- sarrollan con cierta facilidad efusio- nes coroideas, glaucoma, DR y cua- dros inflamatorios ¿Cómo evitarlos y cómo manejarlos?
Dr. Miguel Srur: Sin duda, estos ojos tienen
riesgo de presentar complicaciones graves.
En los casos de efusión coroidea previa o intraoperatoria, las esclerotomías pre- o in- traoperatorias, son obligatorias, haciendo un adecuado drenaje coroideo como lo des- cribió Mendicute, mediante dos triángulos equiláteros de 4 mm por lado a 3,5 mm del limbo, pasando luego una espátula por de- bajo de la coroides. Con esto aminoramos la posibilidad de una hemorragia expulsi- va y de DR. Este riesgo disminuye también evitando hacer descompresiones bruscas al entrar al ojo en el momento de la faco.
En casos de glaucoma, como comenté al co- mienzo, el cuadro clínico debe estar contro- lado antes de la cirugía, ya sea con medica- mentos o mediante cirugías, que van desde iridotomías láser hasta trabeculectomías.
Dr. Carlos Palomino: Estas complicacio- nes son más frecuentes en microftalmos posteriores y en nanoftalmos. En los ojos en cuya ecografía se observa un aumento del grosor esclero-coroideo se pueden reali- zar esclerectomías profilácticas anteriores. En caso de glaucoma debemos buscar la causa y solucionarlo. Los cuadros inflama- torios deben ser controlados médicamente y haciendo una cirugía lo más cuidadosa y lo menos traumática posible.





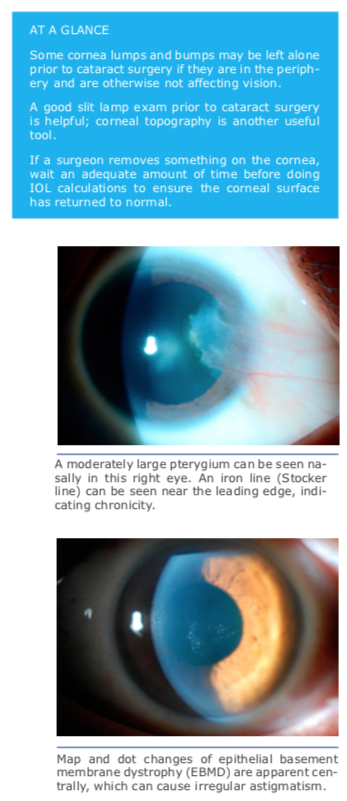 Dr. Rapuano stressed the importance of a good slit lamp exam. He added that corneal topography is also key, and you want to have a normal corneal topogra- phy map. It’s important to look at not just the colors on the corneal topogra- phy map, he said, but also the rings. If
Dr. Rapuano stressed the importance of a good slit lamp exam. He added that corneal topography is also key, and you want to have a normal corneal topogra- phy map. It’s important to look at not just the colors on the corneal topogra- phy map, he said, but also the rings. If