Topógrafos y tomógrafos
Dr. Carlos Palomino Bautista
España
Contacto
Dr. Carlos Palomino Bautista – CPALOMINO@oftalmos.es
En la última década han evolucionado las tecnologías tomográficas y topográficas para el análisis del segmento anterior. Se han implementado nuevos conceptos mejorando la caracterización matemática, la precisión en la toma de datos y consiguiendo optimizar nuestros resultados quirúrgicos. No obstante, sigue siendo fundamental nuestra interpretación de la medición y sobre todo nuestro aporte subjetivo para una correcta realización de la medida.
1. Comprobación del índice queratométrico con el que trabaja la máquina, habitualmente 1,3375, como hace por ejemplo
Pentacam (Oculus, Wetzlar, Alemania) y IOLMaster 700 (Carl Zeiss Meditec, Gena, Alemania). En caso de utilizar otro índice distinto, debemos tener en cuenta este hecho para la utilización de la queratometría simulada (simK) en fórmulas de cálculo biométrico1. No obstante, la mayoría de los aparatos permite configurar este parámetro que además viene fijado en 1,3375.

2.
Conocimiento de la metodología empleada por la máquina para la estimación de la potencia corneal central a efectos de cálculos biométri- cos y de comparación. No es lo mismo que se mida la queratometría en los 3 mm centrales mediante reflexión por anillos de Plácido, que se haga en los 4 mm centrales con imágenes de Scheimpflug. Cuando tenemos distintas fuentes queratométricas y queremos compa- rarlas, estas deben ser al menos de la misma zona para que sea fiable e intercambiable di- cha comparación2,3,4,5.
No6 podemos olvidarnos de la superficie ocu- lar . La queratometría es la fuente de error primaria en los cálculos biométricos y poten- cialmente productora de sorpresa refractiva7. De modo que la observación previa de la su- perficie ocular y su estado para una correcta medida queratométrica es capital. En muchos casos será necesario lubricar artificialmen- te la superficie ocular de nuestros pacientes para llevar a cabo una medida satisfactoria. Así como no debemos olvidarnos de recordar al paciente que parpadee durante las medidas para una correcta distribución lagrimal. Siem- pre es aconsejable realizar varias queratome- trías/topografías/tomografías separadas en el tiempo con el mismo aparato para promediar sus valores.
Fundamental distinguir entre queratometría simulada (simK) y potencia real corneal8. La primera, es una estimación de la potencia real corneal a través de la asunción de una ratio constante entre cara anterior y posterior de la córnea de 0,822. Cualquier topógrafo/tomó- grafo corneal, independientemente de la tec- nología en la que esté basado, mide la simK. Sin embargo, la potencia real corneal solo se puede medir por aquellos sistemas que “lean” la cara posterior de la córnea, ya que a través de un algoritmo por trazado de rayos e índices tisulares reales obtienen la potencia refractiva real de la córnea como dioptrio.
Los topógrafos/tomógrafos9 de última gene- ración nos permiten tomar medidas más rea- les del poder total corneal para poder ajustar así de manera más eficaz nuestras cirugías premium, ya que no tomamos medidas simu- ladas, sino medidas reales del poder total de la córnea.

- Mucho cuidado con la anatomía palpebral y del segmento anterior en general de nuestros pacientes10. Lagoftalmos, laxitudes, hipotoni- cidades o hipertonicidades, repliegues de los párpados, o simplemente hendiduras palpe- brales pequeñas dificultarán las mediciones. Tendremos que tener especial precaución en la sujeción de los párpados de nuestros pacien- tes evitando presiones que pudieran alterar los resultados topográficos. Del mismo modo que prestaremos atención a las acumulaciones de lágrima en el párpado inferior.
-
- Pterigium, leucomas corneales, depósitos sube- 7 piteliales postadenovíricos, etc., podrían influir negativamente en nuestras medidas topográ- ficas, arrojando valores queratométricos erró- neos. En estos casos, deberíamos, en la medidade lo posible, eliminar el agente causante para evitar arrastrar esas medidas erróneas a nues- tros cálculos de implantación. No obstante, si la situación corneal del paciente obliga a basarnos en un dato queratométrico irregular en la zona central, no despreciaremos emplear un quera- tómetro Javal11 en dichas circunstancias.
-
- Debemos hacer especial hincapié en los pa- cientes intervenidos con procedimientos qui- rúrgicos corneales12,13: queratotomías radiales
o láser excímer, ya que exigen un tratamiento diferenciado para obtener los mejores resul- tados en el cálculo de la potencia de la lente intraocular. En dichos casos y en relación con 8 posibles cálculos biométricos es crucial explorarla zona central a través de herramientas como el EKR14 (Equivalent K Readings) de Pentacam (Oculus, Wetzlar, Alemania), que teniendo en cuenta la ratio posterior/anterior arroja un va- lor queratométrico equivalente para poder em- plearlo en ciertas fórmulas de cálculo biométri- co. La fórmula de Potvin-Hill15 con el mapa de distribución de potencias en 4 mm obtenido con Pentacam (Oculus, Wetzlar, Alemania) es otra herramienta muy útil para la resolución del cál- culo de lente intraocular en operados de cirugía refractiva previa.
- Debemos hacer especial hincapié en los pa- cientes intervenidos con procedimientos qui- rúrgicos corneales12,13: queratotomías radiales

No es baladí en estos casos utilizar el clásico queratómetro de Javal en ápex, para cotejarlo con otras medidas topográficas. Por supuesto, en el caso de cálculos tóricos se hace impres- cindible la práctica de varias medidas querato- métricas para buscar coincidencias.
9. Ponerespecialatenciónenlosusuariosdelen- tes de contacto, ya que los moldeos cornea- les anteriores, incluso con lentes de contacto blandas desechables, se pueden producir16. En este sentido se hace necesario discriminar entre un “corneal warpage” y una ectasia cor- neal haciendo diagnóstico diferencial, tenien- do en cuenta la cara posterior de la córnea y el tiempo suficiente sin el uso de lentes de contacto para repetir las medidas topográfi- cas. En este sentido, los mapas topográficos epiteliales obtenidos, por ejemplo, con RTVue OCT system (Optovue, Inc.) son una buena alternativa en estos casos17.
10.Ante patologías deformadoras de la córnea como los queratoconos18, se hacen muy úti- les las aplicaciones de la industria en sus sis- temas para discriminar estas patologías. Por ejemplo, el primer módulo de software imple- mentado en los sistemas topográficos tenien- do en cuenta la geometría de la cara poste- rior corneal fue el Belin-Ambrosio Enhanced Ectasia19,20 de Pentacam (Oculus,Wetzlar, Alemania), que permite hacer un despistaje del riesgo de patología ectásica corneal.
Bibliografía
- SaviniG,HofferKJ,LomorielloDS,DucoliP.Simulated Keratometry Versus Total Corneal Power by Ray Tracing: A Comparison in Prediction Accuracy of Intraocular Lens Power. Cornea. 2017 Nov;36(11):1368-1372.
- DelaParra-ColínP,Garza-LeónM,Barrientos-GutierrezT. Repeatability and comparability of anterior segment biome- try obtained by the Sirius and the Pentacam analyzers. Int Ophthalmol. 2014 Feb;34(1):27-33.
- BaoF,SaviniG,ShuB,ZhuS,GaoR,DangG,YuA,Wang Q, Huang J. Repeatability, Reproducibility, and Agreement
of Two Scheimpflug-Placido Anterior Corneal Analyzers for Posterior Corneal Surface Measurement. J Refract Surg. 2017 Aug 1;33(8):524-530. - Ruiz-MesaR,Abengózar-VelaA,Ruiz-SantosM.Compari- son of a new Scheimpflug imaging combined with partial coherence interferometry biometer and a low-coherence reflectometry biometer. J Cataract Refract Surg. 2017 Nov;43(11):1406-1412.
- HamerCAetal.Comparisonofreliabilityandrepeatabilityof corneal curvature assessment with six keratometers.Clin Exp Optom. 2016 Nov;99(6):583-589.
- AsenaLetal.EffectofdryeyeonScheimpflugimaging of the cornea and elevation data. Can J Ophthalmol. 2017 Jun;52(3):313-317.
- CampsVJ1,PiñeroDP,deFezD,MateoV.MinimizingtheIOL power error induced by keratometric power. Optom Vis Sci. 2013 Jul;90(7):639-49.
- NæserK1,SaviniG2,BregnhøjJF1.Cornealpowersmea- sured with a rotating Scheimpflug camera. Br J Ophthalmol. 2016 Sep;100(9):1196-200.
- FanRetal.Applicationsofcornealtopographyandtomogra- phy: a review. Clin Exp Ophthalmol. 2017 Dec 20.
- Savino G et al. Corneal Topographic Changes After Eyelid Ptosis Surgery. Cornea. 2016 Apr;35(4):501-5
- Visser N et al. Comparability and repeatability of corneal as- tigmatism measurements using different measurement tech- nologies. J Cataract Refract Surg. 2012 Oct;38(10):1764-70.
- Randleman JB, Foster JB, Loupe DN, Song CD, Stulting RD. Intraocular lens power calculations after refractive surgery: Consensus-K technique. J Cataract Refract Surg. 2007;33:1892–8.
-
- Helaly HA et al. Accuracy of Corneal Power Measurements for Intraocular Lens Power Calculation after Myopic Laser In situ Keratomileusis. Middle East Afr J Ophthalmol. 2016 Jan- Mar;23(1):122-8.
- Holladay JT, Hill WE, Steinmueller A. Corneal power measu- rements using scheimpflug imaging in eyes with prior corneal refractive surgery.J Refract Surg. 2009 Oct;25(10):862-8.
- Potvin R, Hill W. New algorithm for intraocular lens power calculations after myopic laser in situ keratomileusis based on rotating Scheimpflug camera data.J Cataract Refract Surg. 2015 Feb;41(2):339-47.
- Patrão LF et al. Differentiation of mild keratoconus from corneal warpage according to topographic inferior steepening based on corneal tomography data. Arq Bras Oftalmol. 2016 Jul-Aug;79(4):264-7.
- Schallhorn JM et al. Distinguishing between contact lens war- page and ectasia: Usefulness of optical coherence tomography epithelial thickness mapping. J Cataract Refract Surg. 2017 Jan;43(1):60-66.
- De Luis Eguileor B et al. Evaluation of the Reliability and Re- peatability of Scheimpflug System Measurement in Keratoco- nus. Cornea. 2018 Feb;37(2):177-181.
- Hashemi H et al. Pentacam top indices for diagnosing subcli- nical and definite keratoconus. J Curr Ophthalmol. 2016 Mar 29;28(1):21-6.
- R. Ambrósio Jr. et al. Enhanced screening for ectasia suscepti- bility among refractive candidates: the role of corneal tomo- graphy and biomechanics. Curr Ophthalmol Rep, 1 (2013), pp. 28-38.








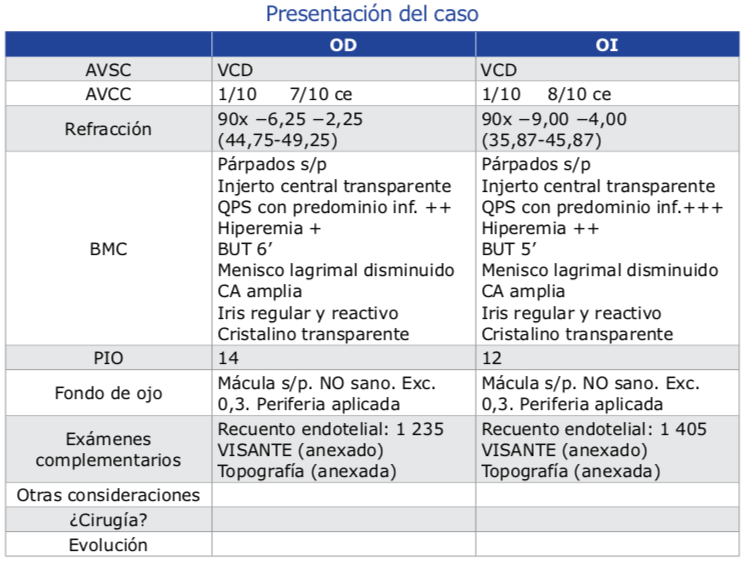
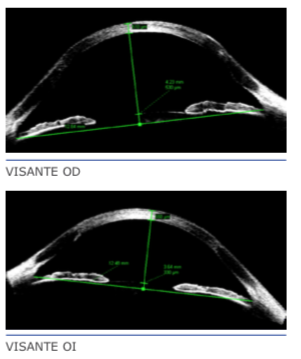
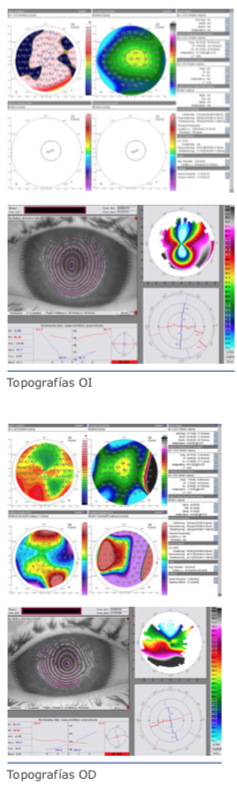
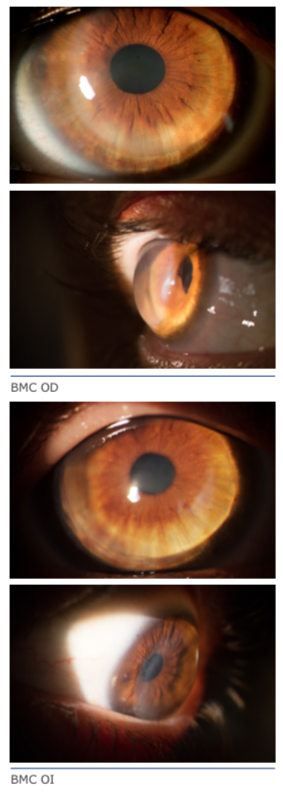
 Al ser los resultados quirúrgicos de las diferen- tes técnicas (arcuatas, puntos de tracción so- bre el meridiano plano, ICRS, resecciones en cuña, queratoplastias lamelares tectónicas sectoriales, etc.) bastante poco predecibles y estables en el tiempo, preferimos ser conser- vadores en un principio y tratar el defecto re- fractivo mediante diferentes tipos de lentes de contacto (rígidas, gas permeables, piggyback, híbridas, apoyo escleral), así como mejorar la superficie ocular con los tratamientos anterior- mente descritos.
Al ser los resultados quirúrgicos de las diferen- tes técnicas (arcuatas, puntos de tracción so- bre el meridiano plano, ICRS, resecciones en cuña, queratoplastias lamelares tectónicas sectoriales, etc.) bastante poco predecibles y estables en el tiempo, preferimos ser conser- vadores en un principio y tratar el defecto re- fractivo mediante diferentes tipos de lentes de contacto (rígidas, gas permeables, piggyback, híbridas, apoyo escleral), así como mejorar la superficie ocular con los tratamientos anterior- mente descritos.
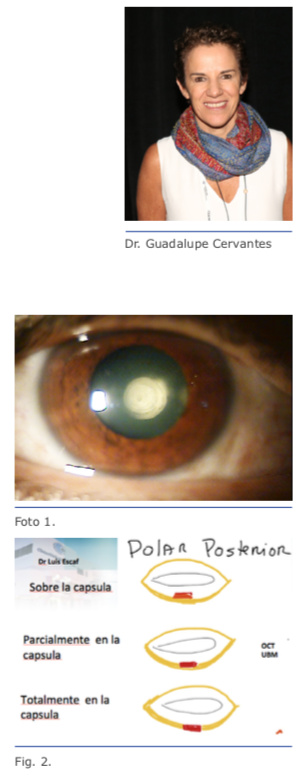 1. Catarata polar posterior por encima de la cápsula posterior (Fig. 2).
1. Catarata polar posterior por encima de la cápsula posterior (Fig. 2).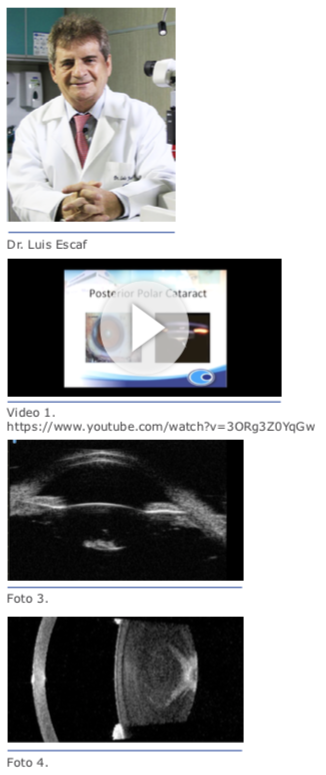 Si definitivamente es una catarata polar posterior dura, como se supone en este caso, por la edad del paciente, me voy limitar a describir como no- sotros abordamos este tipo de cataratas.
Si definitivamente es una catarata polar posterior dura, como se supone en este caso, por la edad del paciente, me voy limitar a describir como no- sotros abordamos este tipo de cataratas.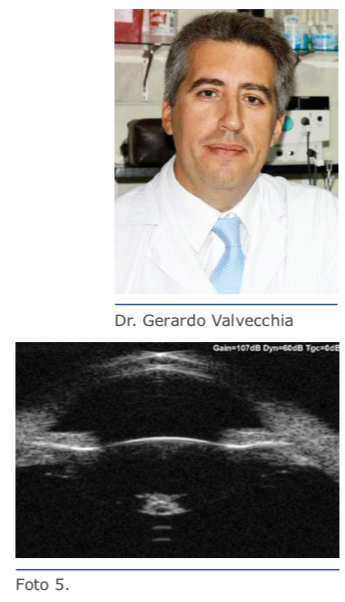 Dr. Luis Escaf: De antemano a la cirugía uno debe planear qué tipo de LIO va implantar. Puede ser un multifocal, un monofocal o un tórico, pero tener a la mano un monofocal de tres piezas o de una sola pieza. En caso de que no se pueda implantar el LIO premium, se decide por monofocal y, dependiendo de la RCP, se implanta en sulcus o saco, pudiéndose abotonar ya sea por delante o por detrás de la rexis o, en algunos casos, en la capsulorrexis posterior (ver video de Ike Ahmed).
Dr. Luis Escaf: De antemano a la cirugía uno debe planear qué tipo de LIO va implantar. Puede ser un multifocal, un monofocal o un tórico, pero tener a la mano un monofocal de tres piezas o de una sola pieza. En caso de que no se pueda implantar el LIO premium, se decide por monofocal y, dependiendo de la RCP, se implanta en sulcus o saco, pudiéndose abotonar ya sea por delante o por detrás de la rexis o, en algunos casos, en la capsulorrexis posterior (ver video de Ike Ahmed). Cualquier vitréctomo neumático que trai- ga el equipo de facoemulsificación de más de 1.200 cortes sirve. A todos los facoemul- sificadores se les pueden adaptar piezas de mano de vitréctomos 23 G, solo debemos asesorarnos a cuantos PSI trabaja nuestro equipo para comprar las piezas adecuadas.
Cualquier vitréctomo neumático que trai- ga el equipo de facoemulsificación de más de 1.200 cortes sirve. A todos los facoemul- sificadores se les pueden adaptar piezas de mano de vitréctomos 23 G, solo debemos asesorarnos a cuantos PSI trabaja nuestro equipo para comprar las piezas adecuadas.
 El párpado es una estructura anexa que nos puede dar más de un dolor de cabeza en el pre y posoperatorio sino le damos la importancia que se merece. Los párpados deben estar completamente sanos para proceder a una eventual cirugía intraocular y para ello su análisis debe ser minucioso y obligatorio. Foto 3.
El párpado es una estructura anexa que nos puede dar más de un dolor de cabeza en el pre y posoperatorio sino le damos la importancia que se merece. Los párpados deben estar completamente sanos para proceder a una eventual cirugía intraocular y para ello su análisis debe ser minucioso y obligatorio. Foto 3.
 En la figura 10 podemos ver la in- tegridad de los anillos mientras que en la figura 11 se aprecia ya un des- vanecimiento de los anillos.
En la figura 10 podemos ver la in- tegridad de los anillos mientras que en la figura 11 se aprecia ya un des- vanecimiento de los anillos.
 La biometría óptica o interferometría de coherencia parcial utiliza una fuente de luz con coherencia parcial que funciona como un interferómetro de Michelson (Figura 1). Los biómetros ópticos miden de la córnea al EPR, en cambio los biómetros ultrasónicos miden de la córnea a la membrana limitante interna. Los primeros permiten realizar mediciones de no contacto, rápidas y precisas, a diferencia de la biometría ultrasónica.
La biometría óptica o interferometría de coherencia parcial utiliza una fuente de luz con coherencia parcial que funciona como un interferómetro de Michelson (Figura 1). Los biómetros ópticos miden de la córnea al EPR, en cambio los biómetros ultrasónicos miden de la córnea a la membrana limitante interna. Los primeros permiten realizar mediciones de no contacto, rápidas y precisas, a diferencia de la biometría ultrasónica. El biómetro OA-2000 (Tomey), utiliza una tomografía de coherencia de fuente de barrido o espectral, que permite una mayor penetración a los tejidos (Fig. 5):
El biómetro OA-2000 (Tomey), utiliza una tomografía de coherencia de fuente de barrido o espectral, que permite una mayor penetración a los tejidos (Fig. 5):

